Sterilitätstests sind entscheidend für die Produktion von kultiviertem Fleisch, da selbst geringfügige Kontaminationen zu kostspieligen Chargenausfällen führen können. Dieser Prozess stellt sicher, dass keine schädlichen Mikroorganismen die Bioreaktoroperationen stören, wodurch sowohl die Produktqualität als auch die finanzielle Rentabilität geschützt werden. Mit Kontaminationsraten von durchschnittlich 11,2 % - und bis zu 19,5 % bei der Großproduktion - stehen Produzenten vor erheblichen Herausforderungen bei der Aufrechterhaltung steriler Umgebungen.
Wichtige Punkte umfassen:
- Hauptkontaminationsquellen: Personal, Rohmaterialien und Bioreaktoroperationen sind häufige Eintrittspunkte für Mikroben.
- Testmethoden: Membranfiltration für große Volumina, direkte Inokulation für kleinere Proben und Bioburden-Tests während der Produktion sind weit verbreitet.
- Echtzeitüberwachung: Werkzeuge wie gelöste Sauerstoffsensoren und Abgasanalysen ermöglichen die frühzeitige Erkennung mikrobieller Aktivitäten.
- Neue Technologien: KI-gesteuertes Monitoring, Kaltplasma-Sterilisation und automatisierte Bildgebungssysteme bieten schnellere und präzisere Kontaminationsmanagementlösungen.
Für Produzenten von kultiviertem Fleisch ist die Kombination traditioneller Sterilitätstests mit fortschrittlichen Überwachungslösungen unerlässlich, um Risiken zu reduzieren und die Produktionseffizienz zu verbessern.
Rocker Discover - Wie führt man einen Sterilitätstest durch?
sbb-itb-ffee270
Kontaminationsquellen in Bioreaktorsystemen
Um Chargenausfälle in Bioreaktorsystemen zu verhindern, ist es entscheidend, die Herkunft der Kontamination zu identifizieren. Kontaminanten fallen typischerweise in drei Hauptkategorien: mikrobiell, partikulär und Endotoxin. Jede Art stellt einzigartige Herausforderungen für die Produktion von kultiviertem Fleisch dar, weshalb es unerlässlich ist, spezifische Präventionsstrategien zu entwickeln.
Personal sind die Hauptquelle der Kontamination, oft durch Hautabschuppung, unsachgemäße Kleidung oder schlechte Handhygiene [4][7]. Selbst bei strengen Protokollen können einfache Bewegungen den Luftstrom stören, was zu Turbulenzen oder stagnierenden Bereichen führt, in denen sich Verunreinigungen ansammeln können [4][9]. Die U.S. Die Food and Drug Administration hebt die damit verbundenen Risiken hervor und erklärt: "Jegliche manuelle oder mechanische Manipulation des sterilen Arzneimittels, der Komponenten, Behälter oder Verschlüsse vor oder während der aseptischen Montage birgt das Risiko einer Kontamination und erfordert daher eine sorgfältige Kontrolle" [4].
Umweltfaktoren spielen ebenfalls eine bedeutende Rolle.Zum Beispiel kann das Versäumnis, einen positiven Druck von 10–15 Pascal aufrechtzuerhalten, dazu führen, dass ungefilterte Luft in sterile Zonen eindringt [3][4]. Darüber hinaus können Probleme wie Ineffizienzen von HEPA-Filtern - bei denen die Partikelrückhaltung unter 99,97 % fällt - oder beeinträchtigte Druckgasfilter die Sterilität schnell gefährden [4].
Kontamination von Rohstoffen und Zelllinien
Rohstoffe, die in das Bioreaktorsystem gelangen, stellen ein großes Kontaminationsrisiko dar. Ungeprüfte Zutaten, Komponenten von Wachstumsmedien und Zelllinien (verfügbar über spezialisierte B2B-Marktplätze) können opportunistische Krankheitserreger einführen [2]. Die nährstoffreiche Umgebung von Zellkulturmedien ist besonders anfällig für Kontaminationen, was die Prozesse der kultivierten Fleischproduktion im Vergleich zu mikrobiellen Bioprozessen anfälliger macht [8].
Wärmeempfindliche Zutaten, die nicht autoklaviert werden können, sind besonders riskant, da sie alternative Sterilisationsmethoden wie Filtration erfordern [1][8]. Darüber hinaus birgt der Inokulationsprozess selbst inhärente Risiken. Selbst wenn Membranen mit Alkohol desinfiziert oder Verfahren in der Nähe einer offenen Flamme durchgeführt werden, gibt es keine absolute Garantie gegen Kontamination während der Einführung von Zelllinien [8]. Diese Risiken unterstreichen die Bedeutung einer gründlichen Überprüfung der Rohstoffe, bevor sie in das System eingeführt werden.
Betriebsrisiken von Bioreaktoren
Tägliche Operationen in Bioreaktoren bieten zahlreiche Kontaminationsmöglichkeiten. Manuelle Probenahme ist besonders risikoreich, da jeder Zugangspunkt die Chance erhöht, Verunreinigungen einzuführen [1].Probleme wie beschädigte Dichtungen, defekte O-Ringe oder unsterilisierte Verschlüsse erhöhen das Risiko weiter [4][8]. Darüber hinaus stellt der Transfer von Materialien aus niedriger klassifizierten Bereichen in höher klassifizierte Zonen ohne ordnungsgemäße Dekontamination eine weitere kritische Schwachstelle dar [7].
Die Aufrechterhaltung strenger Umweltkontrollen ist nicht verhandelbar. Druckdifferenzen zwischen Reinraumbereichen sollten kontinuierlich überwacht werden, und ungewöhnliche Veränderungen müssen sofort untersucht werden [4]. In kritischen Bereichen der Klasse 100 (ISO 5) müssen die Partikelzahlen für Größen ≥0,5 μm während des Betriebs unter 3.520 Partikel pro Kubikmeter bleiben [4].Darüber hinaus können das Versprühen von Desinfektionsmitteln oder 70% Isopropylalkohol in der Nähe von Luftprobenahmegeräten die Partikelmessungen erhöhen, während Kondensat auf Gasfiltern Blockaden verursachen oder das mikrobielle Wachstum fördern kann [4][7].
Diese betrieblichen Risiken unterstreichen die Bedeutung der Implementierung rigoroser Sterilitätstestmethoden zum Schutz von Bioreaktorprozessen.
Sterilitätstestmethoden für Bioreaktoren
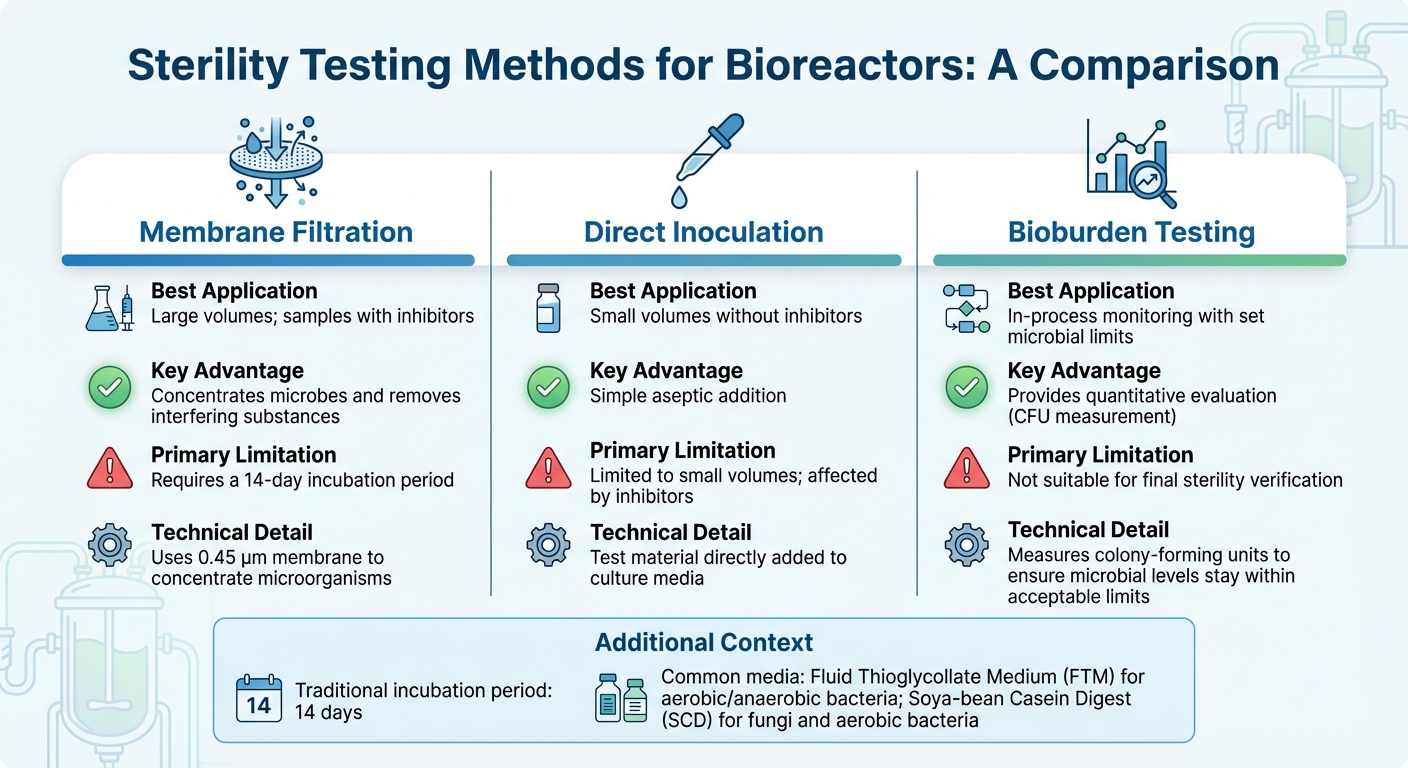
Vergleich von Sterilitätstestmethoden für Bioreaktoren
Die Auswahl des richtigen Sterilitätstests für Bioreaktoren hängt von Faktoren wie der Größe des Bioreaktors, dem Produktionsstadium und den Skalierungsherausforderungen sowie der Zusammensetzung der Probe ab - insbesondere wenn Inhibitoren vorhanden sind. Für die meisten industriellen Anwendungen ist Membranfiltration die bevorzugte Methode [3].In der Zwischenzeit bieten molekulare Techniken wie PCR eine schnellere Erkennung spezifischer Kontaminanten. Im Folgenden werden wir Methoden untersuchen, die auf die Produktion von kultiviertem Fleisch zugeschnitten sind und die einzigartigen Herausforderungen sowohl bei großen als auch kleinen Proben testen.
Für Proben mit großem Volumen, die in industriellen Bioreaktoren üblich sind, verwendet die Membranfiltration eine 0,45 µm Membran, um Mikroorganismen zu konzentrieren und die Empfindlichkeit der Erkennung zu verbessern [10]. Diese Methode ist besonders effektiv für Proben, die Antibiotika enthalten, da das Spülen Inhibitoren vor der Inkubation eliminieren kann. Andererseits funktioniert die direkte Inokulation, bei der das Testmaterial direkt dem Kulturmedium hinzugefügt wird, besser für kleinere Probenvolumina, hat jedoch Schwierigkeiten mit hemmenden Substanzen umzugehen. Nach der Konzentration der Proben und der Entfernung von Inhibitoren sorgen Inkubation und Validierung für die Genauigkeit der Ergebnisse.
Traditionelle Sterilitätstests basieren auf einer 14-tägigen Inkubationszeit, um das mikrobielle Wachstum visuell zu bestätigen [3]. Häufig verwendete Medien sind Flüssig-Thioglykolat-Medium (FTM) für aerobe und anaerobe Bakterien und Soya-Casein-Digest (SCD) für Pilze und aerobe Bakterien. Vor der Durchführung eines Sterilitätstests ist es wichtig zu validieren, dass das Produkt das mikrobielle Wachstum nicht durch Bakteriostase- und Fungistase-Tests hemmt.
Für die laufende Prozessüberwachung bietet quantitative Keimbelastungstests eine praktischere Lösung als binäre Sterilitätstests, insbesondere in der Produktion von kultiviertem Fleisch. Im Gegensatz zu Sterilitätstests, die ein einfaches Bestehen/Nichtbestehen-Ergebnis liefern, messen Keimbelastungstests koloniebildende Einheiten (KBE), um sicherzustellen, dass die mikrobiellen Werte innerhalb akzeptabler Grenzen bleiben. Diese Methode entspricht den aufkommenden lebensmitteltauglichen Standards und findet ein Gleichgewicht zwischen strengen pharmazeutischen Kontrollen und den wirtschaftlichen Realitäten der großflächigen Lebensmittelproduktion.
Für Sterilitätstestmaterialien und Bioreaktorlösungen können Fachleute für kultiviertes Fleisch auf vertrauenswürdige Anbieter wie
| Methode | Beste Anwendung | Hauptvorteil | Primäre Einschränkung |
|---|---|---|---|
| Membranfiltration | Große Volumina; Proben mit Inhibitoren | Konzentriert Mikroben und entfernt störende Substanzen[3] | Erfordert eine 14-tägige Inkubationszeit[3] |
| Direkte Inokulation | Kleine Volumina ohne Inhibitoren | Einfache aseptische Zugabe | Begrenzt auf kleine Volumina; beeinflusst durch Inhibitoren[3] |
| Bioburden-Test | In-Prozess-Überwachung mit festgelegten mikrobiellen Grenzwerten | Bietet eine quantitative Bewertung | Nicht geeignet für die endgültige Sterilitätsüberprüfung [3] |
Echtzeitüberwachung und Sterilitätssicherung
Die Abhängigkeit von traditionellen 14-tägigen Sterilitätstests birgt das Risiko, ganze Chargen zu verlieren, wenn eine Kontamination zu spät entdeckt wird.Echtzeitüberwachung bietet eine proaktive Lösung, indem sie kritische Prozessparameter im Auge behält, während sie auftreten. Dies ermöglicht sofortiges Handeln, wenn etwas schiefgeht. In der Produktion von kultiviertem Fleisch, bei der Bioreaktorläufe Wochen dauern und teure Wachstumsmedien verwendet werden, kann die frühzeitige Erkennung von Kontaminationen Tausende von Pfund sparen und Produktionsverzögerungen vermeiden. Durch die Kombination von Echtzeitdaten mit herkömmlichen Sterilitätstests können Produzenten die Lücke zwischen verzögerter Bestätigung und schneller Intervention schließen.
Sensorgestützte Überwachung
Schlüsselindikatoren wie gelöster Sauerstoff (DO) und pH-Werte können frühzeitig auf Kontamination hinweisen. Wenn Bakterien oder Pilze in einen Bioreaktor eindringen, verbrauchen sie schnell Sauerstoff - was zu einem Abfall der DO-Werte führt - und setzen Stoffwechselprodukte frei, die den pH-Wert erheblich senken [12]. Diese Veränderungen können Stunden erkannt werden, bevor die Kontamination visuell erkennbar wird. Während traditionelle Sterilitätstests Ergebnisse nach dem Prozess bestätigen, fungiert die Echtzeitüberwachung als Schutzmaßnahme, um sicherzustellen, dass der Prozess auf Kurs bleibt und Kontaminationsrisiken früher angegangen werden.
Abgasanalyse, unter Verwendung der magnetischen Sektormassenspektrometrie, misst kontinuierlich die Sauerstoff- und Kohlendioxidwerte im Abgas eines Bioreaktors. In kontrollierten Kontaminationsstudien identifizierte diese Methode mikrobielles Wachstum innerhalb von 22,4 Stunden durch Sauerstoffveränderungen, während die pH-basierte Erkennung mit 25,8 Stunden hinterherhinkte [13]. Magnetische Sektorsysteme liefern präzise Sauerstoffmessungen mit einer Genauigkeit von bis zu 0,003 % (v/v) über sieben Tage und übertreffen damit traditionelle paramagnetische Detektoren, die nur eine Genauigkeit von ±0,2 % (v/v) erreichen [13].
Spektroskopische Sensoren bieten eine nicht-invasive Überwachung durch die Wände von Einweg-Bioreaktoren, was entscheidend für die Aufrechterhaltung der Sterilität ist.UV-vis-Spektroskopie kann Membranschäden durch Messung der Lichtabsorption bei 350–400 nm erkennen, während ausgetretene intrazelluläre Materialien bei 800–900 nm erscheinen [14]. Kapazitätssonden, die einzigen kommerziell erhältlichen Sensoren zur Messung der lebensfähigen Zelldichte, erreichen dies durch Erkennung von Änderungen in der Membranpolarisation [14]. Für Einrichtungen, die mehrere Bioreaktoren verwalten, können Werkzeuge wie der Rapid Multi-Stream Sampler bis zu 16 Gasströme gleichzeitig überwachen [13].
Diese sensorbasierten Systeme, kombiniert mit Umweltkontrollen wie HVAC-Kontaminationsprävention, schaffen eine robuste Verteidigung gegen Kontamination.
Umwelt- und Druckkontrollen
Die Aufrechterhaltung eines positiven Drucks zwischen Reinraumbereichen ist entscheidend, um das Eindringen von Verunreinigungen zu verhindern [3].Positive-Pressure-Systeme, die mit HEPA-Filtration kombiniert werden, wirken als physische Barrieren gegen mikrobielle Eindringung. Hörbare oder visuelle Alarme an HEPA-Filtern können das Personal sofort benachrichtigen, wenn der Druck unter akzeptable Werte fällt [3].
Die Zählung nicht-lebensfähiger Partikel ist eine weitere Verteidigungsschicht. Laserpartikelzähler überprüfen kontinuierlich, ob die Umgebung während des Betriebs den ISO-Luftreinheitsstandards entspricht. Durch die Überwachung von sowohl 0,5 µm als auch 5,0 µm Partikeln stellen diese Geräte sicher, dass die Luftqualität innerhalb der erforderlichen Grenzen bleibt [7]. Wenn unerwartete Abweichungen auftreten - wie ein plötzlicher Abfall des DO oder eine pH-Schwankung - kann die sofortige Isolierung des betroffenen Bioreaktors und das Stoppen der Futterzugaben verhindern, dass sich die Kontamination ausbreitet [12].
Für die Beschaffung spezialisierter Sensoren und Ausrüstungen, die auf den Betrieb von kultiviertem Fleisch zugeschnitten sind, verbinden Unternehmen wie
Neue Technologien in der Sterilitätstestung
Traditionelle Methoden der Sterilitätstestung sind oft unzureichend aufgrund ihrer langen 14-tägigen Inkubationszeiten und der Abhängigkeit von manuellen Probenahmen, die Raum für Erkennungslücken lassen können. Neuere Technologien treten in den Vordergrund, um diese Herausforderungen zu bewältigen, und bieten schnellere und präzisere Kontaminationsdetektion. Dies ist besonders wichtig in der Produktion von kultiviertem Fleisch, wo die hohen Kosten für Wachstumsmedien und verlängerte Kultivierungszeiten eine Kontamination in der Spätphase zu einem finanziellen Albtraum machen.
KI-gesteuerte Überwachungssysteme
Künstliche Intelligenz verändert die Kontaminationsdetektion, indem sie Echtzeitdaten analysiert, um mikrobielle Eindringlinge zu identifizieren.Wenn Bakterien in einen Bioreaktor eindringen, verbrauchen sie Sauerstoff und produzieren Stoffwechsel-Säuren, was zu merklichen Abnahmen des gelösten Sauerstoffs und der pH-Werte führt. KI-Systeme können diese Abweichungen im Sauerstoff- und Nährstoffverbrauch erkennen und potenzielle Kontaminationen weit früher kennzeichnen, als traditionelle Bioburden-Tests und Sterilitätsprotokolle Ergebnisse liefern können [12].
Diese KI-Plattformen integrieren auch mathematische Modelle, um den genauen Zeitpunkt der Kontamination zu bestimmen und zu simulieren, wie sich mikrobielle Populationen im Laufe der Zeit entwickeln. Dies hilft den Betreibern, die Kontamination auf ihre Quelle zurückzuführen, sei es eine fehlerhafte Futterquelle, ein betrieblicher Fehler oder ein Geräteproblem. Techniken wie die Poisson-Wahrscheinlichkeitsanalyse verbessern die Genauigkeit der Bioburden-Tests weiter und verringern die Wahrscheinlichkeit von falsch-negativen Ergebnissen [12].
"Mathematische Modelle helfen bei der Schätzung der Kontaminationseinführungszeit und der mikrobiellen Wachstumsdynamik, was die Rückverfolgbarkeit von Kontaminationen verbessert." - Naveenganesh Muralidharan, Senior Manager, MSAT, AGC Biologics [12]
Wenn Anomalien erkannt werden, können sofortige Maßnahmen - wie die Isolierung des Bioreaktors und das Stoppen aller Futterzugaben - verhindern, dass sich das Problem ausbreitet [12]. Ein systematischer Ansatz, der Bioburden-Tests, molekulare Identifikation und Wachstumsratenanalyse umfasst, ist entscheidend, um die Ursache zu identifizieren und Korrekturmaßnahmen zu ergreifen. Diese KI-Tools überbrücken die Lücke zwischen traditionellen Methoden und proaktivem Kontaminationsmanagement.
Kaltplasma-Sterilisation
Kaltplasmatechnologie bietet eine nicht-thermische Sterilisationsoption, die besonders gut für die Produktion von kultiviertem Fleisch geeignet ist.Der Betrieb bei oder nahe Raumtemperatur ist ideal zum Sterilisieren empfindlicher Komponenten wie Bioreaktor-Teile, Sensoren und Kunststoffe, die die Hitze der traditionellen Autoklavierung nicht aushalten können [15][16][17]. Diese Methode verwendet reaktive Sauerstoff- und Stickstoffspezies sowie UV-Licht, um mikrobielle Membranen und DNA zu zerstören. Sie ist wirksam gegen eine Vielzahl von Verunreinigungen, einschließlich bakterieller Sporen (Bacillus, Clostridium), Pilze, Viren und sogar Prionen [15][17].
Eines der herausragenden Merkmale von Kaltplasma ist, dass es keine toxischen Rückstände hinterlässt. Sobald die Stromversorgung abgeschaltet wird, wandeln sich die reaktiven Spezies schnell in Sauerstoff zurück, wodurch die Notwendigkeit einer Desorptionsphase entfällt [16][18].Es ist auch energieeffizient und benötigt nur eine Standardsteckdose anstelle von fossilen Brennstoffen basierten Wärmequellen [15][16]. Studien zeigen beispielsweise, dass kaltes Plasma eine >5 log Reduktion von Bacillus cereus Sporen innerhalb von 25 Minuten bei 300W Leistung erreichen kann [15].
Allerdings ist die Technologie nicht ohne Einschränkungen. Ihre Sterilisationseffekte sind hauptsächlich oberflächlich, was bedeutet, dass sie Schwierigkeiten hat, komplexe Geometrien zu durchdringen, in denen sich Mikroben in Rissen oder Rillen verstecken können [15][16]. Ein hoher Protein- oder Fettgehalt in Bioreaktor-Umgebungen kann Mikroben auch schützen, indem reaktive Spezies abgefangen werden, was die Effizienz der Sterilisation verringert [15][18].
| Merkmal | Kaltplasma |
|---|---|
| Vorteile | Nicht-thermisch, ungiftig, energieeffizient, keine Rückstände, schnell [16] |
| Einschränkungen | Begrenzte Eindringtiefe, verringerte Wirksamkeit in komplexen Geometrien [15][16] |
Automatisierte bildbasierte Erkennungssysteme
Zusätzlich bieten automatisierte Bildgebungssysteme ein leistungsstarkes Werkzeug zur Echtzeit-Erkennung von Kontaminationen. Diese Systeme bieten detaillierte morphologische Einblicke in das Zellwachstum, was entscheidend ist, um Kontaminationsmuster zu erkennen, sobald sie auftreten [19].Im Gegensatz zur traditionellen Offline-Mikroskopie - die manuelle Probenahme und Färbung erfordert - integriert sich die automatisierte Bildgebung nahtlos in Online- oder At-Line-Überwachungssetups. Dies ermöglicht es den Bedienern, Biomasse und Zellgesundheit zu überwachen, ohne die Sterilität zu beeinträchtigen [19].
Durch die Reduzierung manueller Eingriffe verringern diese Systeme menschliche Fehler und verbessern die Reproduzierbarkeit in den Kultivierungsprozessen [19]. Fortschrittliche Bildverarbeitungsalgorithmen können den Fermentationsfortschritt verfolgen, die Metabolitproduktion optimieren und Konsistenz gewährleisten - ein kritischer Faktor beim Hochskalieren von Bioprozessen [19].
"Die Verfügbarkeit fortschrittlicher Probenahmetechniken in Verbindung mit automatisierten Messwerkzeugen...kann die für die Stammauswahl, die Prozessentwicklung und die Prozesskontrolle erforderliche Zeit erheblich verkürzen, indem die Anzahl der Schritte im Produktions-/Kultivierungsprozess, insbesondere manuelle Schritte, verringert und die Fehlerfortpflanzung reduziert wird." - A.C. Veloso und E.C. Ferreira, Universität Minho [19]
Trotz ihrer Vorteile ist die Integration dieser Systeme nicht immer einfach. Zellkulturen sind komplex, Rohstoffe variieren und Sensoren müssen harten Sterilisationsmethoden wie Dampf oder Gammastrahlung standhalten [19]. Für Unternehmen, die diese Technologien übernehmen möchten, können Plattformen wie
Fazit
Die Sicherstellung der Sterilität von Bioreaktoren in der Produktion von kultiviertem Fleisch ist keine leichte Aufgabe, aber eine integrierte Sterilitätsteststrategie kann dies erreichbar machen.Diese Strategie kombiniert traditionelle Methoden, wie Membranfiltration für größere Probenvolumina und direkte Inokulation für kleinere, mit modernen molekularen Werkzeugen wie PCR und qPCR für eine schnelle Erregerüberprüfung. Zusätzlich bietet die Umweltüberwachung - durch Luftprobenahme und Oberflächenabstriche - einen zusätzlichen Schutz, indem sie Kontaminationsrisiken in HVAC-Systemen anspricht und potenzielle Kontaminationen erkennt, bevor sie die Produktionsgefäße beeinträchtigen können [11].
Die Wahl des Testansatzes hängt von Faktoren wie der Probengröße, dem Vorhandensein von Substanzen, die die Ergebnisse beeinträchtigen könnten, und davon ab, ob der Fokus auf der vollständigen Sterilitätsvalidierung oder einfach auf der Überwachung der Keimbelastung liegt. Probenahme von mehreren Punkten im Bioreaktor - oben, in der Mitte und unten - hilft, ein umfassendes mikrobielles Profil zu erstellen und verringert die Chance, lokalisierte Kontaminationen zu übersehen [1].Dies ist besonders kritisch, da die Kontaminationsrisiken bei der Produktion von kultiviertem Fleisch deutlich höher sind als in der biopharmazeutischen Herstellung, was die Notwendigkeit strenger Sterilitätsprotokolle unterstreicht [6].
Der Schlüssel zur Aufrechterhaltung der Mediensterilität in Bioreaktoren ist die Beschaffung der richtigen Ausrüstung. Werkzeuge wie aseptische Probennahmesysteme mit vorsterilisierten Septen und HEPA-Filter, die 99,97 % der Partikel größer als 0,3 μm erfassen können, sind unerlässlich [4]. Plattformen wie
Mit dem Wachstum der Branche werden hybride Sterilitätsansätze zunehmend wichtiger.Anwendung von pharmazeutischen Kontrollen in den frühen Phasen der Saatgutproduktion, während Lebensmittelstandards für die großtechnische Produktion übernommen werden, stellt ein Gleichgewicht zwischen Sicherheit und Kosteneffizienz dar [5][6]. Diese integrierten Maßnahmen werden der Grundstein für eine sichere und effiziente Produktion von kultiviertem Fleisch sein, während das Feld weiterhin Fortschritte macht.
FAQs
Was sind die Hauptursachen für Kontaminationen in Bioreaktorsystemen, die für die Produktion von kultiviertem Fleisch verwendet werden?
Kontaminationen in Bioreaktorsystemen treten auf, wenn die sterile Umgebung gestört wird oder wenn nährstoffreiche Medien einen idealen Nährboden für Mikroben bieten. Dies kann durch mehrere Faktoren verursacht werden, wie z.B. Verletzungen während der Probenahme, Wartung oder Zellernte; beschädigte oder verstopfte Gasfilter; bereits im Wachstumsmedium vorhandene Kontaminationen; oder temporäre Öffnungen, die bei der Installation oder Wartung von Sensoren entstehen.Zusätzlich können abgenutzte Geräte Mikroplastikpartikel freisetzen, die als Lebensraum für Mikroorganismen dienen können.
In der Produktion von kultiviertem Fleisch kann selbst die kleinste Verunreinigung sowohl die Sicherheit als auch den Ertrag einer Charge beeinträchtigen. Um diese Risiken zu minimieren, ist es entscheidend, in hochwertiges Equipment wie sterile Filter, Bioreaktoren und Sensorkits zu investieren, die strengen aseptischen Standards entsprechen. Plattformen wie
Wie verbessert künstliche Intelligenz die Sterilitätstests in Bioreaktoren?
KI-gestützte Systeme transformieren die Sterilitätstests in kultivierten Fleisch-Bioreaktoren, indem sie Echtzeiteinblicke durch kontinuierliche Überwachung bieten. Mithilfe fortschrittlicher Biosensoren überwachen diese Systeme kritische Faktoren wie pH, gelöster Sauerstoff und essentielle Metaboliten wie Glukose und Aminosäuren. All dies geschieht ohne manuelle Kontrollen, was das Risiko einer Kontamination erheblich reduziert.
Was diese Systeme auszeichnet, ist ihre Fähigkeit, Daten mithilfe von Algorithmen zu analysieren, die Messwerte mit etablierten Sterilitätsstandards vergleichen. Das bedeutet, dass sie selbst die kleinsten Anzeichen von mikrobiellen Wachstum weit früher als herkömmliche Methoden erkennen können. Über die reine Erkennung hinaus kommen prädiktive Analysen ins Spiel, die potenzielle Risiken wie Probleme bei der Sensorinstallation oder den Eintritt durch Ports identifizieren. Diese Systeme schlagen sogar Korrekturmaßnahmen vor, um Produzenten zu helfen, kostspielige Chargenverluste zu vermeiden.
KI-gestützte Mikroskopie fügt eine weitere Effizienzschicht hinzu, indem sie sofort zwischen gesunden Zellen und Verunreinigungen unterscheidet und die Prozesse der Sterilitätsüberprüfung beschleunigt.Für Produzenten erleichtern Plattformen wie
Welche Herausforderungen schränken die Nutzung der Kaltplasma-Sterilisation in Bioreaktoren für die Produktion von kultiviertem Fleisch ein?
Kaltplasma-Sterilisation ist effektiv bei der Neutralisierung von Mikroben, bringt jedoch eine Reihe von Herausforderungen mit sich, wenn sie auf Bioreaktoren in der Produktion von kultiviertem Fleisch angewendet wird. Ein Hauptproblem ist die begrenzte Eindringtiefe der durch Plasma erzeugten reaktiven Spezies. Dies erschwert die gründliche Sterilisation großer Volumina oder dicht gepackter Medien. Darüber hinaus wird es zunehmend schwierig, eine gleichmäßige Plasmabedeckung über einen gesamten Reaktor zu erreichen, je größer das System wird.
Die Skalierung von Kaltplasma-Systemen von Laboreinstellungen auf kommerzielle Bioreaktoren bringt zusätzliche Hürden mit sich.Größere Reaktoren erfordern höhere Leistungs-zu-Volumen-Verhältnisse, was zu Sterilisationszeiten führen kann, die alles andere als praktisch sind. Viele Kaltplasmasysteme arbeiten auch unter Vakuumbedingungen oder sind auf reaktive Gase angewiesen, was zusätzliche Komplexität in Bezug auf Sicherheit, regulatorische Compliance und Gerätekonstruktion mit sich bringt. Diese Faktoren machen die Methode weniger ideal für die groß angelegten Bioreaktoren, die typischerweise in der kommerziellen Produktion von kultiviertem Fleisch erforderlich sind.
Ein weiteres Anliegen ist das Potenzial für Schäden, die durch reaktive Sauerstoff- und Stickstoffspezies (RONS) verursacht werden, die entscheidend für die mikrobielle Inaktivierung sind. Diese reaktiven Spezies können empfindliche Säugetierzellen schädigen oder Medienkomponenten abbauen, was eine sorgfältige Optimierung erfordert, um die Zellviabilität aufrechtzuerhalten. Infolgedessen wird Kaltplasma oft in Kombination mit anderen Sterilisationstechniken verwendet, anstatt als eigenständige Lösung.











