Kryokonservierung ist der Prozess des Einfrierens und Lagerns lebender Zellen bei ultraniedrigen Temperaturen, um ihre Lebensfähigkeit über die Zeit zu erhalten. Diese Methode ist entscheidend für die Produktion von kultiviertem Fleisch, da sie konsistente, stabile Zelllinien gewährleistet und Verluste durch Kontamination oder Ausfall von Geräten schützt. Wichtige Schritte umfassen:
- Vorbereitung: Zellen während ihrer Wachstumsphase ernten, die Lebensfähigkeit überprüfen (Ziel ≥90%) und sie in Gefriermedium mit Kryoprotektoren wie DMSO oder Glycerin vorbereiten.
- Einfrieren: Eine kontrollierte Abkühlrate (-1°C bis -3°C pro Minute) verwenden, um Schäden durch Eiskristalle zu vermeiden. Zellen in flüssigem Stickstoffdampf (-135°C bis -190°C) für die langfristige Lagerung aufbewahren.
- Auftauen: Zellen schnell in einem Wasserbad bei 37°C auftauen, um die Toxizität der Kryoprotektoren zu minimieren, und sie dann in Wachstumsmedium zur Erholung überführen.
- Qualitätskontrolle: Etikettieren Sie die Vials genau, überwachen Sie die Lagerbedingungen und testen Sie die Lebensfähigkeit nach dem Auftauen, um eine erfolgreiche Konservierung sicherzustellen.
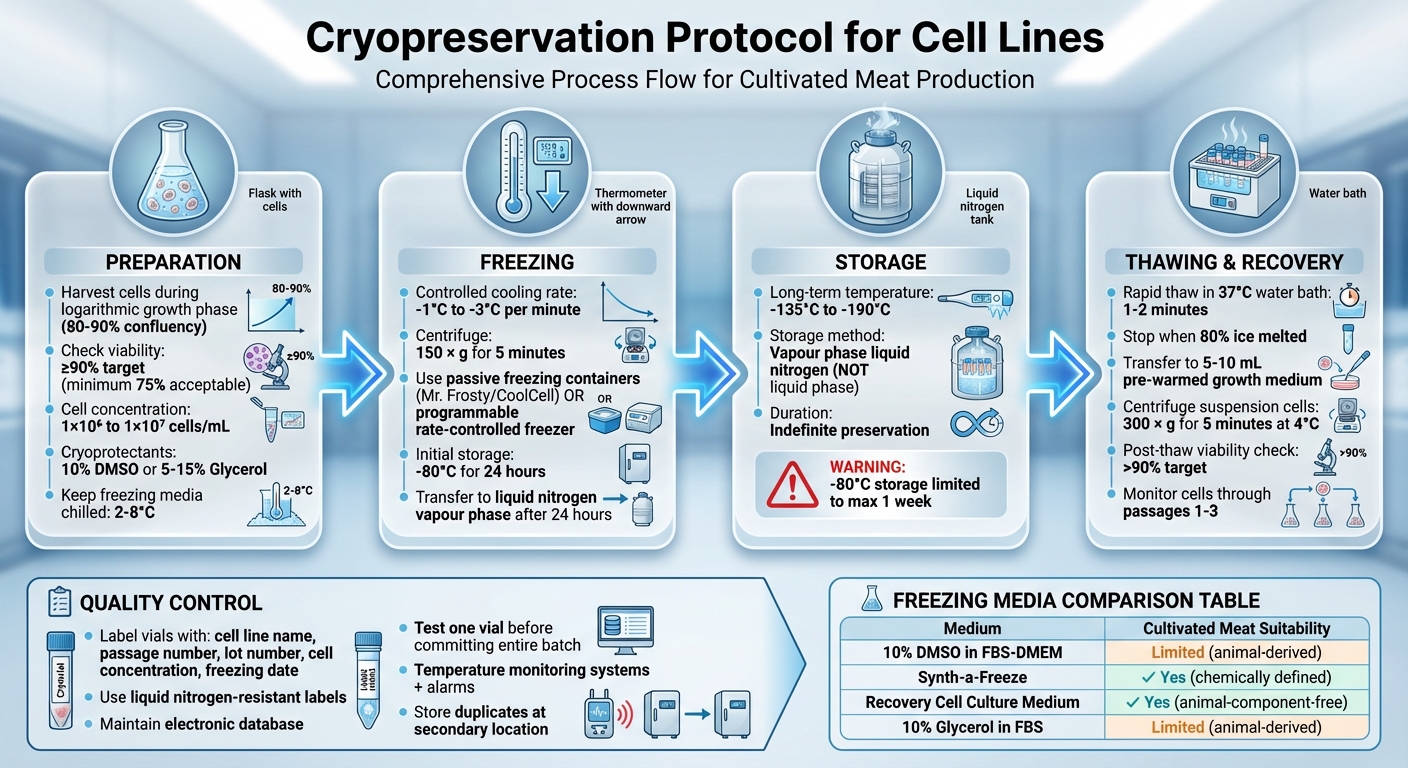
Vollständiges Kryokonservierungsprotokoll für Zelllinien: 4-Schritte-Prozess von der Vorbereitung bis zur Lagerung
Zellen für die Kryokonservierung vorbereiten
Zellernte und Lebensfähigkeitsprüfungen
Um die beste Erholung nach dem Auftauen sicherzustellen, ernten Sie die Zellen während ihrer logarithmischen (log) Wachstumsphase. Bei adhärenten Zelllinien ist dies typischerweise der Fall, wenn sie 80–90% Konfluenz erreichen [2][3][6].
Überprüfen Sie die Lebensfähigkeit der Zellen mit der Trypanblau-Ausschlussmethode. Mischen Sie gleiche Teile (1:1) von 0,4% Trypanblau mit der Zellaufhängung und zählen Sie dann die Zellen mit einem Hämozytometer.Lebensfähige Zellen schließen den Farbstoff aus und erscheinen unter dem Mikroskop hell, während nicht lebensfähige Zellen blau gefärbt werden [4]. Idealerweise streben Sie eine Lebensfähigkeit von mindestens 90% für die besten Erholungsraten an, obwohl einige Protokolle ein Minimum von 75% akzeptieren können [1][2][3][5].
Überprüfen Sie vor der Ernte mit einem Mikroskop auf bakterielle oder pilzliche Kontamination. Gesunde Suspensionszellen sollten unter einem invertierten Phasenkontrastmikroskop hell, rund und refraktär erscheinen [2][3].
Sobald die Zellen die erforderlichen Lebensfähigkeitsstandards erfüllen, fahren Sie mit den Schritten vor dem Einfrieren fort.
Vorbereitungen zum Vorfrost
Für adhärente Zellen verwenden Sie sanfte Dissoziationsmethoden, wie Trypsin oder TrypLE Express, und begrenzen Sie die Inkubationszeit, um Schäden an den Zellmembranen zu vermeiden [5]. Bereiten Sie die Zellen in einer Konzentration von 1 × 10⁶ bis 1 × 10⁷ Zellen/mL vor, abhängig von der Zelllinie [1][6]. Achten Sie beim Aliquotieren darauf, dass die Zellaufhängung häufig gemischt wird, um eine gleichmäßige Verteilung in den Kryovials zu gewährleisten [5].
Halten Sie das Gefriermedium während der Resuspension zwischen 2°C und 8°C gekühlt, um die Toxizität des Kryoprotektants vor Beginn des Gefrierprozesses zu reduzieren [5]. Sobald die Zellen im Gefriermedium resuspendiert sind, fahren Sie schnell mit dem Gefrierprotokoll fort [1].Zellen immer bei der niedrigstmöglichen Passagezahl kryokonservieren, um das Risiko genetischer Drift oder morphologischer Veränderungen zu verringern [5][7].
Auswahl von Kryoprotektoren und Gefriermedien
Kryoprotektor-Optionen und deren Funktionen
Dimethylsulfoxid (DMSO) wird häufig als Kryoprotektor verwendet, typischerweise in einer Konzentration von 10% [2]. Es wirkt, indem es in Zellmembranen eindringt und die Eisbildung während des Gefrierens reduziert. DMSO kann jedoch bei Raumtemperatur toxisch für Zellen sein, daher ist ein schnelles Auftauen entscheidend, um die Exposition zu minimieren und es schnell zu verdünnen [1].
Glycerin dient als nützliche Alternative für Zelllinien, die empfindlich auf DMSO reagieren, und wird in der Regel in Konzentrationen von 5% bis 15% verwendet [8].Es ist besonders effektiv für Zelltypen, bei denen DMSO unerwünschte Differenzierung verursachen könnte [3], und es hat tendenziell eine geringere Toxizität im Vergleich zu DMSO.
In Anwendungen für kultiviertes Fleisch verwenden traditionelle Gefrierprotokolle oft eine Mischung aus 90% Fötales Rinderserum (FBS) und 10% DMSO [1]. Allerdings schränkt die Abhängigkeit von tierischen Komponenten diese Methoden hinsichtlich Skalierbarkeit und behördlicher Genehmigung ein [9]. Um diese Probleme anzugehen, chemisch definierte Medien - wie Synth-a-Freeze oder Recovery Cell Culture Medium - bieten eine tierkomponentenfreie Alternative. Diese Medien erhalten eine hohe Zellviabilität nach dem Auftauen und überwinden die Herausforderungen, die mit tierischen Komponenten verbunden sind [9].
Vergleich von Gefriermedien
Hier ist eine Übersicht über die Vorteile und Einschränkungen verschiedener Gefriermedien, die in der Produktion von kultiviertem Fleisch verwendet werden:
| Medium | Vorteile | Nachteile | Eignung für kultiviertes Fleisch |
|---|---|---|---|
| 10% DMSO in FBS-DMEM | Etablierte Protokolle [1] | Enthält tierische Bestandteile; Batch-Variabilität [9] | Begrenzte Skalierbarkeit |
| Synth-a-Freeze | Chemisch definiert; konsistente Qualität; frei von tierischen Bestandteilen [9] | Höhere Anfangskosten [9] | Ja |
| Recovery Zellkulturmedium | Einfach zu bedienen; entwickelt für eine schnelle Erholung [9] | Kann für spezifische Zelllinien optimiert werden | Ja |
| 10% Glycerin in FBS | Alternative für DMSO-empfindliche Zellen [1] | Beruht auf Serum tierischen Ursprungs [9] | Begrenzte Skalierbarkeit |
Im Februar 2023 zeigten Forscher an der Tokyo Women's Medical University, geleitet von Hironobu Takahashi, die Bedeutung der Wahl des richtigen Einfriermediums.Durch die Verwendung kommerzieller Optionen wie CELLBANKER 1 und 2 konnten sie erfolgreich primäre bovine myogene Zellen bei –80°C bis zu einem Jahr kryokonservieren. Bemerkenswerterweise behielten diese Zellen ihre Fähigkeit zur Proliferation und Differenzierung in kontraktiles Muskelgewebe mit intakten Sarkomerstrukturen nach dem Auftauen [10].
Für die Produktion von kultiviertem Fleisch werden zunehmend chemisch definierte und GMP-konforme Medien bevorzugt. Wie STEMCELL Technologies hervorhebt:
In stark regulierten Bereichen wie der Zell- und Gentherapie wird empfohlen, ein GMP-gefertigtes, vollständig definiertes Kryokonservierungsmedium zu verwenden, um sicherzustellen, dass die Produkte konsistent nach Qualitätsstandards hergestellt und kontrolliert werden [9].
Plattformen wie
Cryokonservierungsverfahren und Kühlraten
Schritt-für-Schritt-Gefrierprotokoll
Der Schlüssel zum erfolgreichen Kryokonservierungsprozess liegt in der Aufrechterhaltung einer konstanten Kühlrate von -1°C bis -3°C pro Minute[2]. Dieser schrittweise Prozess ermöglicht es, dass Wasser langsam die Zellen verlässt, wodurch die Bildung schädlicher intrazellulärer Eiskristalle verhindert wird, die Zellmembranen rupturieren könnten[1].
Beginnen Sie mit der Zentrifugation der Zellen bei 150 x g für 5 Minuten[3]. Nach der Zentrifugation resuspendieren Sie das Zellpellet in einem kalten Gefriermedium, das 10% DMSO bei einer Konzentration von 2–4×10⁶ Zellen/mL[3] enthält.Um die DMSO-Exposition zu reduzieren, gehen Sie schnell zum nächsten Schritt - Einfrieren.
Verteilen Sie die Zellensuspension in vorbeschriftete kryogene Vials. Jedes Vial sollte wichtige Details wie den Zellliniennamen, die Passage-Nummer, die Chargen-Nummer, die Zellkonzentration und das Datum des Einfrierens deutlich angeben[3]. Nachdem die Vials vorbereitet sind, ist es an der Zeit, die geeignete Kühltechnik auszuwählen und zu nutzen.
Kühlgeräte und Techniken
Platzieren Sie die Vials sofort in ein kontrolliertes Kühlgerät. Passive Gefrierbehälter, wie der Nalgene "Mr Frosty" (der Isopropanol verwendet) oder der Corning "CoolCell", sind beliebte Optionen. Diese Werkzeuge können eine Kühlrate von etwa 1°C pro Minute erreichen, wenn sie in einem -80°C Gefrierschrank platziert werden[2].
Für großangelegte Operationen, bei denen Konsistenz entscheidend ist, ist ein programmierbarer, ratenkontrollierter Gefrierschrank die beste Option. Wie von Sigma-Aldrich angegeben:
ECACC verwendet routinemäßig einen programmierbaren, ratenkontrollierten Gefrierschrank. Dies ist die zuverlässigste und reproduzierbarste Methode, um Zellen einzufrieren[3].
Nach etwa 24 Stunden bei -80°C die Vials in die Dampfphase von flüssigem Stickstoff überführen, wo die Temperaturen zwischen -135°C und -190°C liegen, für die Langzeitlagerung[4]. Vermeiden Sie es, Zellen länger als eine Woche bei -80°C zu lagern, da dies ihre Lebensfähigkeit beeinträchtigen kann. Temperaturen unter -135°C sind entscheidend für die unbegrenzte Erhaltung[2]. Die Verwendung der Dampfphase anstelle der Flüssigphase verringert das Risiko einer Kreuzkontamination, während ausreichend niedrige Temperaturen aufrechterhalten werden.
Auftau- und Wiederherstellungsprotokolle
Auftauprozess
Das schnelle Auftauen von Zellen ist entscheidend, um die Exposition gegenüber toxischen Kryoprotektoren zu begrenzen und zu verhindern, dass Eiskristalle Schäden verursachen. Stellen Sie sicher, dass Sie eine Vollgesichtsvisier und isolierte Handschuhe zum Schutz tragen. Beginnen Sie damit, die Kryovial aus flüssigem Stickstoff zu entfernen und den Deckel leicht zu lockern, um den aufgebauten Druck abzulassen. Ziehen Sie dann den Deckel wieder fest.
Platzieren Sie die Vial in einem Wasserbad bei 37 °C, wobei der Deckel über der Wasserlinie bleibt. Lassen Sie es 1–2 Minuten auftauen, oder bis nur noch wenige Eiskristalle verbleiben. Nach dem Auftauen wischen Sie die Außenseite der Vial mit 70% Alkohol ab, um die Sterilität aufrechtzuerhalten.
Übertragen Sie den Inhalt der Vial in ein Röhrchen mit 5–10 mL vorgewärmtem Wachstumsmedium. Fügen Sie das Medium langsam hinzu, um osmotischen Schock zu reduzieren. Wenn Sie mit Suspensionzelllinien arbeiten, zentrifugieren Sie die Zellensuspension sofort bei 300 × g für 5 Minuten bei 4 °C.Dieser Schritt hilft, die Zellen zu pelletieren und entfernt das Kryoprotektivmittel. Nach der Zentrifugation die Zellen in frischem Medium resuspendieren. Bei adhärenten Zellen ist die Zentrifugation in der Regel nicht erforderlich. Stattdessen die Zellen direkt in ein geeignetes Kulturgefäß einbringen und während des ersten Medienwechsels, typischerweise nach 24 Stunden, verbleibendes DMSO entfernen.
Nach dem Auftauen Bewertungen
Unmittelbar nach dem Auftauen die Zellviabilität überprüfen, um sicherzustellen, dass die Wiederherstellung erfolgreich war. Verwenden Sie die Trypanblau-Ausschlussmethode für diese Bewertung. Idealerweise sollte die Zellviabilität 90 % übersteigen [11], aber ein Minimum von 75 % ist akzeptabel. Nach 24 Stunden die Zellen unter einem Phasenkontrastmikroskop inspizieren, um die Adhärenz zu bestätigen, die Zellendichte zu bewerten und nach Anzeichen von Kontamination zu suchen.
Die Zellen durch die Passagen 1–3 weiterhin überwachen, um eine normale Proliferation sicherzustellen und dass sie ihre erwarteten Eigenschaften beibehalten.Für Zelllinien, die sich langsamer erholen, können Sie die Überlebensrate verbessern, indem Sie die anfängliche Konzentration von Fötus-Rinderserum auf etwa 20% v/v erhöhen.
sbb-itb-ffee270
Aufbewahrung und Langzeitlebensfähigkeit
Aufbewahrungsbedingungen und -dauer
Um die Lebensfähigkeit von Zelllinien langfristig zu erhalten, ist es wichtig, sie bei Temperaturen unter -135°C zu lagern [7][2]. Dies stellt sicher, dass sie unbegrenzt erhalten bleiben.Die bevorzugte Methode zur Lagerung von kultivierten Fleischzelllinien ist flüssiger Stickstoff in Dampfphase. Diese Technik hält die Temperaturen zwischen -135°C und -190°C, was sie ideal für die langfristige Konservierung macht und im Vergleich zur Lagerung in flüssiger Phase eine verbesserte Sicherheit bietet.
Wenn Sie Zellen bei -80°C lagern müssen, beschränken Sie dies auf einen Zeitraum von 24 Stunden bis zu einer Woche. Darüber hinaus kann die Zelllebensfähigkeit abnehmen.Für die vorübergehende Lagerung bei dieser Temperatur die Zellen so schnell wie möglich in flüssigen Stickstofflagern transferieren.
Verwenden Sie standardmäßige sterile kryogene Vials (1–2 mL) mit Innengewinde und einem O-Ring für eine sichere Lagerung [4][5]. Platzieren Sie immer versiegelte Kryovials in der Gasphase und nicht in der Flüssigphase von Stickstoff, um das Risiko von Vial-Explosionen während des Auftauens zu verringern [5]. Stellen Sie außerdem sicher, dass die Behälter mit flüssigem Stickstoff mindestens halb voll sind, um einen Sicherheitsbuffer aufrechtzuerhalten.
Schließlich sind strenge Qualitätskontrollmaßnahmen entscheidend, um die langfristige Lebensfähigkeit der Zellen sicherzustellen.
Qualitätskontrollprüfungen
Um die Zuverlässigkeit der gelagerten Zelllinien sicherzustellen, befolgen Sie strenge Protokolle für die Qualitätskontrolle. Beginnen Sie damit, jedes Vial mit flüssigkeitsstickstoffbeständigen Etiketten genau zu kennzeichnen.Fügen Sie wesentliche Details wie die Identität der Zelllinie, die Chargennummer, die Passage-Nummer und das Einfrierdatum hinzu. Führen Sie eine elektronische Datenbank, um den genauen Standort jeder Ampulle aufzuzeichnen, was die Zeit reduziert, die Lagerbehälter offen bleiben müssen [7][2].
Bevor Sie gesamte Chargen zur Langzeitlagerung verpflichten, testen Sie die Lebensfähigkeit einer Ampulle nach kurzfristiger Gasphasenlagerung. Dieser Schritt hilft zu bestätigen, dass der Einfrierprozess erfolgreich war und identifiziert mögliche Probleme [4][7][2]. Für hochpreisige Zellbestände ist es ratsam, Duplikate an einem sekundären Standort zu lagern, um sich gegen Geräteausfälle oder lokale Katastrophen abzusichern [7][2].
Statten Sie alle Lagerbehälter mit Temperaturüberwachungssystemen und Alarmen aus, um niedrige Flüssigstickstoffstände zu erkennen [7]. Installieren Sie zusätzlich Sauerstoffalarme in den Lagerbereichen, die bei 18% Sauerstoff (v/v) ausgelöst werden, um das Risiko der Erstickung für das Personal, das mit Flüssigstickstoff arbeitet, zu minimieren [7][2].
Kryokonservierung von Säugetierzelllinien Video-Protokoll
Fazit und wichtige Erkenntnisse
Hier ist eine kurze Zusammenfassung der wesentlichen Schritte und Empfehlungen für eine effektive Kryokonservierung in der Produktion von kultiviertem Fleisch:
- Zellernte: Sammeln Sie Zellen während ihrer logarithmischen Wachstumsphase, wobei die Lebensfähigkeit über 90% liegen sollte. Verwenden Sie 10% DMSO als Kryoprotektant, obwohl Glycerin eine Alternative für empfindlichere Zelllinien sein kann [11][1].
- Kühlung und Lagerung: Halten Sie eine kontrollierte Kühlrate ein und übertragen Sie die Vials schnell in die Dampfphase von flüssigem Stickstoff, um die Zellintegrität zu schützen [11]
Eine Studie von Roka Kakehi et al. hebt die Bedeutung von Präzision in der Kryokonservierung hervor [10]:
"Die Gewährleistung einer zuverlässigen und konsistenten Quelle von Zellen durch die Verwendung von Kryokonservierung wird es uns ermöglichen, die stabile Versorgung mit vielversprechenden Zellen für die Produktion von kultiviertem Fleisch zu erhöhen." - Roka Kakehi et al., Tokyo Women's Medical University
- Auftauprozess: Tauchen Sie die Zellen in ein Wasserbad bei 37°C für etwa zwei Minuten, und stoppen Sie, wenn 80% des Eises geschmolzen sind. Dies reduziert die DMSO-Toxizität und verbessert die Zellwiederherstellung [1]. Führen Sie anschließend Nachuntersuchungen zur Lebensfähigkeit nach dem Auftauen durch, um den Erfolg sicherzustellen und zukünftige Verfahren zu optimieren.
Diese Methoden arbeiten Hand in Hand mit strengen Qualitätskontrollpraktiken. Beschriften Sie immer die Vials genau, führen Sie organisierte Aufzeichnungen und implementieren Sie gründliche Kontrollen vor der Langzeitlagerung [11]. Für spezialisierte Kryokonservierungsbedürfnisse verbinden Plattformen wie
Häufig gestellte Fragen
Was sind die Vorteile der Verwendung von chemisch definierten Medien zur Kryokonservierung von Zelllinien in der Produktion von kultiviertem Fleisch?
Chemisch definierte Medien bieten mehrere Vorteile, wenn es um die Kryokonservierung von Zelllinien für die Produktion von kultiviertem Fleisch geht. Durch die Entfernung undefinierter Komponenten, wie tierischem Serum, gewährleisten sie konstante und vorhersehbare Ergebnisse - ein entscheidender Faktor für die langfristige Zuverlässigkeit von Zelllinien.
Ein weiterer wichtiger Vorteil ist das reduzierte Risiko von Kontamination und Variabilität. Dies unterstützt nicht nur höhere Qualitäts- und Sicherheitsstandards, sondern passt auch perfekt zu der Präzision und Skalierbarkeit, die erforderlich sind, um sowohl regulatorischen Anforderungen als auch den Erwartungen der Verbraucher in der kultivierten Fleischindustrie gerecht zu werden.
Wie beeinflusst die Wahl des Kryoprotektants das Überleben der Zellen während des Einfrierens und Auftauens?
Die Wahl des Kryoprotektants ist ein entscheidender Faktor für die Erhaltung der Zellgesundheit während des Einfrierens und Auftauens. Zwei weit verbreitete Optionen sind Dimethylsulfoxid (DMSO) und Glycerin, die jeweils unterschiedliche Eigenschaften aufweisen. DMSO ist bekannt für seine Fähigkeit, schnell in Zellen einzudringen und starken Schutz zu bieten. Es hat jedoch einen Nachteil: In hohen Konzentrationen oder bei längerer Exposition kann es toxisch werden, was die Zellviabilität potenziell verringert.
Glycerin hingegen ist weniger toxisch und kann direkt angewendet werden.Sein Nachteil liegt in seiner langsameren Zellpenetrationsrate, was zu weniger sofortigem Schutz im Vergleich zu DMSO führen kann.
Das Erreichen des richtigen Gleichgewichts ist entscheidend. Eine ordnungsgemäße Anpassung der Konzentration und der Expositionszeit des Kryoprotektants hilft, die Zellen zu schützen und gleichzeitig das Risiko von Toxizität zu minimieren. Darüber hinaus ist es wichtig, die besten Praktiken für Kühlraten und Lagerbedingungen einzuhalten, um die höchstmöglichen Wiederherstellungsraten nach dem Auftauen zu gewährleisten.
Warum ist es wichtig, die Kühlrate während der Kryokonservierung zu kontrollieren?
Die Aufrechterhaltung einer konstanten Kühlrate, normalerweise zwischen –1°C und –3°C pro Minute, ist entscheidend, um die Zellen lebensfähig zu halten. Ein allmähliches Abkühlen ermöglicht es den Zellen, kontrolliert zu dehydrieren, wodurch die Wahrscheinlichkeit schädlicher Eiskristalle verringert wird, die Zellmembranen reißen oder beschädigen können.
Dieser maßvolle Ansatz schützt die Struktur der Zellen und erhöht deren Überlebensfähigkeit und Funktionalität nach dem Auftauen.Die Einhaltung präziser Kühlprotokolle ist entscheidend, um eine erfolgreiche langfristige Lagerung und Wiederherstellung von Zelllinien zu gewährleisten.











