Steriliteitstesten zijn cruciaal voor de productie van gekweekt vlees, waar zelfs een kleine besmetting kan leiden tot kostbare batchfouten. Dit proces zorgt ervoor dat geen schadelijke micro-organismen de bioreactoroperaties verstoren, waardoor zowel de productkwaliteit als de financiële levensvatbaarheid worden beschermd. Met besmettingspercentages die gemiddeld 11,2% bedragen - en oplopen tot 19,5% voor grootschalige productie - staan producenten voor aanzienlijke uitdagingen bij het handhaven van steriele omgevingen.
Belangrijke punten zijn onder andere:
- Belangrijkste Besmettingsbronnen: Personeel, grondstoffen en bioreactoroperaties zijn veelvoorkomende toegangspunten voor microben.
- Testmethoden: Membraanfiltratie voor grote volumes, directe inoculatie voor kleinere monsters, en bioburden testen tijdens de productie worden veel gebruikt.
- Realtime Monitoring: Hulpmiddelen zoals opgeloste zuurstofsensoren en off-gas analyse maken vroege detectie van microbiële activiteit mogelijk.
- Opkomende Technologieën: AI-gestuurde monitoring, koude plasma sterilisatie en geautomatiseerde beeldsystemen bieden snellere en nauwkeurigere contaminatiebeheer.
Voor producenten van gekweekt vlees is het essentieel om traditionele steriliteitstests te combineren met geavanceerde monitoringsoplossingen om risico's te verminderen en de productiviteit te verbeteren.
Rocker Discover - Hoe voer je een steriliteitstest uit?
sbb-itb-ffee270
Contaminatiebronnen in Bioreactorsystemen
Om batchfouten in bioreactorsystemen te voorkomen, is het cruciaal om te identificeren waar de contaminatie vandaan komt. Verontreinigingen vallen doorgaans in drie hoofdcategorieën: microbiologisch, deeltjes en endotoxine. Elk type vormt unieke uitdagingen voor de productie van gekweekt vlees, waardoor het essentieel is om specifieke preventieve strategieën te ontwikkelen.
Personeel is de primaire bron van besmetting, vaak door het introduceren van verontreinigingen via huidschilfers, onjuiste kleding of slechte handhygiëne [4][7]. Zelfs met strikte protocollen kunnen eenvoudige bewegingen de luchtstroom verstoren, wat leidt tot turbulentie of stilstaande gebieden waar verontreinigingen zich kunnen ophopen [4][9]. De U.S. De Food and Drug Administration benadrukt de betrokken risico's en stelt: "elke handmatige of mechanische manipulatie van het gesteriliseerde geneesmiddel, componenten, containers of sluitingen vóór of tijdens aseptische assemblage brengt het risico van besmetting met zich mee en vereist daarom zorgvuldige controle" [4].
Omgevingsfactoren spelen ook een belangrijke rol.Bijvoorbeeld, het niet handhaven van een positieve druk van 10–15 Pascal kan ervoor zorgen dat ongefilterde lucht steriele zones binnendringt [3][4]. Bovendien kunnen problemen zoals inefficiënties van HEPA-filters - waarbij de deeltjesretentie onder de 99,97% daalt - of aangetaste filters voor samengeperste gassen snel de steriliteit in gevaar brengen [4].
Grondstof- en Cellijnbesmetting
Grondstoffen die het bioreactorsysteem binnenkomen vormen een groot besmettingsrisico. Niet-geverifieerde ingrediënten, componenten van groeimedia en cellijnen (beschikbaar via gespecialiseerde B2B-marktplaatsen) kunnen opportunistische pathogenen introduceren [2]. De voedingsrijke omgeving van celkweekmedia is bijzonder vatbaar voor besmetting, waardoor processen voor gekweekt vlees kwetsbaarder zijn in vergelijking met microbiële bioprocessen [8].
Warmtegevoelige ingrediënten die niet kunnen worden gesteriliseerd door middel van autoclaveren zijn bijzonder risicovol, omdat ze alternatieve sterilisatiemethoden zoals filtratie vereisen [1][8]. Bovendien brengt het inoculatieproces zelf inherente risico's met zich mee. Zelfs wanneer membranen worden gedesinfecteerd met alcohol of procedures worden uitgevoerd nabij een open vlam, is er geen absolute garantie tegen besmetting tijdens de introductie van cellijnen [8]. Deze risico's onderstrepen het belang van grondige verificatie van grondstoffen voordat ze in het systeem worden geïntroduceerd.
Operationele Risico's van de Bioreactor
Dagelijkse operaties binnen bioreactoren bieden talrijke mogelijkheden voor besmetting. Handmatige bemonstering is bijzonder risicovol, aangezien elk toegangspunt de kans op het introduceren van verontreinigingen vergroot [1].Problemen zoals aangetaste afdichtingen, beschadigde O-ringen of niet-gesteriliseerde sluitingen verhogen het risico verder [4][8]. Bovendien is het overbrengen van materialen van lager geclassificeerde gebieden naar hoger geclassificeerde zones zonder juiste decontaminatie een andere kritieke kwetsbaarheid [7].
Het handhaven van strikte omgevingscontroles is niet-onderhandelbaar. Drukverschillen tussen cleanroomgebieden moeten continu worden gecontroleerd, en eventuele ongebruikelijke veranderingen moeten onmiddellijk worden onderzocht [4]. In Klasse 100 (ISO 5) kritieke gebieden moeten deeltjesaantallen voor maten ≥0,5 μm onder de 3.520 deeltjes per kubieke meter blijven tijdens operaties [4].Bovendien kunnen het aerosoliseren van desinfectiemiddelen of 70% isopropylalcohol in de buurt van luchtmonsters de deeltjesmetingen verhogen, terwijl condensaat op gasfilters verstoppingen kan veroorzaken of microbiële groei kan bevorderen [4][7].
Deze operationele risico's benadrukken het belang van het implementeren van rigoureuze steriliteitstestmethoden om bioreactorprocessen te beschermen.
Steriliteitstestmethoden voor Bioreactoren
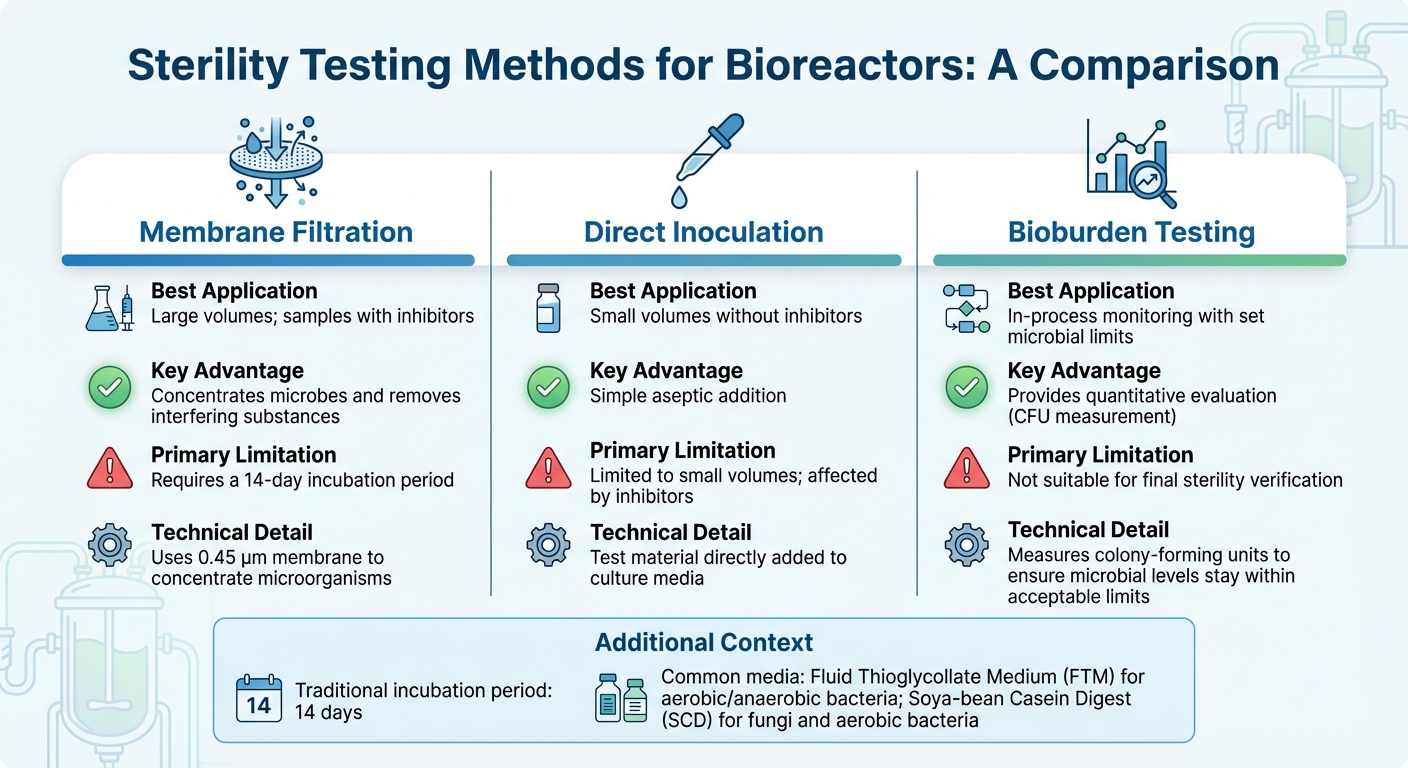
Vergelijking van Steriliteitstestmethoden voor Bioreactoren
Het selecteren van de juiste steriliteitstest voor bioreactoren hangt af van factoren zoals de grootte van de bioreactor, productiefase en opschalingsuitdagingen, en de samenstelling van het monster - vooral wanneer er remmers aanwezig zijn. Voor de meeste industriële toepassingen is membraanfiltratie de voorkeursmethode [3].Ondertussen bieden moleculaire technieken zoals PCR snellere detectie voor specifieke verontreinigingen. Hieronder verkennen we methoden die zijn afgestemd op de productie van gekweekt vlees, waarbij de unieke uitdagingen van zowel grote als kleine monstertests worden aangepakt.
Voor monsters met een groot volume, gebruikelijk in industriële bioreactoren, maakt membraanfiltratie gebruik van een 0,45 µm membraan om micro-organismen te concentreren, waardoor de detectiegevoeligheid wordt verbeterd [10]. Deze methode is bijzonder effectief voor monsters die antibiotica bevatten, aangezien spoelen remmers kan elimineren voordat incubatie plaatsvindt. Aan de andere kant werkt directe inoculatie, waarbij het testmateriaal direct aan het kweekmedium wordt toegevoegd, beter voor kleinere monstervolumes, maar heeft moeite met het verwerken van remmende stoffen. Na het concentreren van monsters en het verwijderen van remmers zorgen incubatie en validatie voor de nauwkeurigheid van de resultaten.
Traditionele steriliteitstests vertrouwen op een incubatieperiode van 14 dagen om visueel microbiële groei te bevestigen [3]. Veelgebruikte media zijn onder andere Fluid Thioglycollate Medium (FTM) voor aerobe en anaerobe bacteriën, en Soya-bean Casein Digest (SCD) voor schimmels en aerobe bacteriën. Voordat een steriliteitstest wordt uitgevoerd, is het cruciaal om te valideren dat het product de microbiële groei niet remt door middel van bacteriostase- en fungistasetests.
Voor voortdurende procesbewaking biedt kwantitatieve bioburden testing een praktischere oplossing dan binaire steriliteitstests, vooral in de productie van gekweekt vlees. In tegenstelling tot steriliteitstests die een eenvoudig pass/fail-resultaat geven, meet bioburden testing het aantal kolonievormende eenheden (CFU) om ervoor te zorgen dat microbiële niveaus binnen acceptabele grenzen blijven.Deze methode sluit aan bij opkomende voedselveiligheidsnormen en vindt een balans tussen strenge farmaceutische controles en de economische realiteit van grootschalige voedselproductie.
Voor benodigdheden voor steriliteitstesten en bioreactoroplossingen kunnen professionals in gekweekt vlees terecht bij vertrouwde leveranciers zoals
| Methode | Beste Toepassing | Belangrijkste Voordeel | Primaire Beperking |
|---|---|---|---|
| Membraanfiltratie | Grote volumes; monsters met remmers | Concentreert microben en verwijdert storende stoffen [3] | Vereist een incubatieperiode van 14 dagen [3] |
| Directe Inoculatie | Kleine volumes zonder remmers | Eenvoudige aseptische toevoeging | Beperkt tot kleine volumes; beïnvloed door remmers [3] |
| Bioburden Testen | In-proces monitoring met vastgestelde microbiële limieten | Biedt een kwantitatieve evaluatie | Niet geschikt voor definitieve steriliteitsverificatie [3] |
Realtime monitoring en steriliteitsgarantie
Vertrouwen op traditionele 14-daagse steriliteitstests brengt het risico met zich mee dat hele batches verloren gaan als besmetting te laat wordt ontdekt.Realtime monitoring biedt een proactieve oplossing door kritieke procesparameters in de gaten te houden terwijl ze zich voordoen. Dit maakt onmiddellijke actie mogelijk als er iets misgaat. In de productie van gekweekt vlees, waar bioreactorruns weken duren en dure groeimedia worden gebruikt, kan vroege detectie van besmetting duizenden ponden besparen en productievertragingen voorkomen. Door realtime gegevens te combineren met conventionele steriliteitstests, kunnen producenten de kloof overbruggen tussen vertraagde bevestiging en snelle interventie.
Sensorgebaseerde monitoring
Belangrijke indicatoren zoals opgeloste zuurstof (DO) en pH-niveaus kunnen vroegtijdig besmetting signaleren. Wanneer bacteriën of schimmels een bioreactor binnendringen, verbruiken ze snel zuurstof - waardoor DO-niveaus dalen - en geven ze metabolische zuren af die de pH aanzienlijk verlagen [12]. Deze veranderingen kunnen uren voordat besmetting visueel zichtbaar wordt, worden gedetecteerd. Terwijl traditionele steriliteitstests resultaten bevestigen na het proces, fungeert real-time monitoring als een vangnet, waardoor het proces op koers blijft en besmettingsrisico's eerder worden aangepakt.
Afgasanalyse, met behulp van magnetische sector massaspectrometrie, meet continu de zuurstof- en kooldioxidegehaltes in het uitlaatgas van een bioreactor. In gecontroleerde besmettingsstudies identificeerde deze methode microbiële groei binnen 22,4 uur door veranderingen in zuurstof, terwijl pH-gebaseerde detectie achterbleef met 25,8 uur [13]. Magnetische sectorsystemen leveren nauwkeurige zuurstofmetingen met een nauwkeurigheid tot 0,003% (v/v) over zeven dagen, wat beter presteert dan traditionele paramagnetische detectoren, die slechts nauwkeurig zijn tot ±0,2% (v/v) [13].
Spectroscopische sensoren bieden niet-invasieve monitoring door de wanden van single-use bioreactoren, wat essentieel is voor het handhaven van steriliteit.UV-vis spectroscopie kan membraanschade detecteren door lichtabsorptie te meten bij 350–400 nm, terwijl gelekte intracellulaire materialen verschijnen bij 800–900 nm [14]. Capacitantieprobes, de enige commercieel beschikbare sensoren die zijn ontworpen om de levensvatbare celdichtheid te meten, bereiken dit door veranderingen in membraanpolarisatie te detecteren [14]. Voor faciliteiten die meerdere bioreactoren beheren, kunnen tools zoals de Rapid Multi-Stream Sampler tot 16 gasstromen tegelijkertijd monitoren [13].
Deze op sensoren gebaseerde systemen, gecombineerd met omgevingscontroles, zoals HVAC-contaminatiepreventie, creëren een robuuste verdediging tegen besmetting.
Omgevings- en Drukcontroles
Het handhaven van positieve druk tussen cleanroomzones is cruciaal om te voorkomen dat verontreinigingen binnendringen [3].Positieve druksystemen, in combinatie met HEPA-filtratie, fungeren als fysieke barrières tegen microbiële indringing. Hoorbare of visuele alarmen op HEPA-filters kunnen het personeel onmiddellijk waarschuwen als de druk onder acceptabele niveaus daalt [3].
Niet-levensvatbare deeltjes telling is een andere verdedigingslaag. Laser deeltjes tellers verifiëren continu dat de omgeving voldoet aan de ISO luchtzuiverheidsnormen tijdens de werking. Door zowel 0,5 µm als 5,0 µm deeltjes te monitoren, zorgen deze apparaten ervoor dat de luchtkwaliteit binnen de vereiste limieten blijft [7]. Als er onverwachte afwijkingen optreden - zoals een plotselinge daling in DO of een pH-schommeling - kan onmiddellijke isolatie van de getroffen bioreactor en het stoppen van toevoegingen van voeding voorkomen dat besmetting zich verspreidt [12].
Voor het inkopen van gespecialiseerde sensoren en apparatuur die zijn afgestemd op kweekvleesoperaties, verbinden bedrijven zoals
Nieuwe Technologieën in Steriliteitstesten
Traditionele methoden voor steriliteitstesten schieten vaak tekort vanwege hun lange incubatieperiodes van 14 dagen en de afhankelijkheid van handmatige bemonstering, wat ruimte kan laten voor detectiehiaten. Nieuwere technologieën komen in actie om deze uitdagingen aan te pakken, door snellere en nauwkeurigere detectie van besmetting te bieden. Dit is vooral cruciaal in de productie van kweekvlees, waar de hoge kosten van groeimedia en verlengde kweekperiodes late besmetting tot een financiële nachtmerrie maken.
AI-gestuurde Monitoringsystemen
Kunstmatige intelligentie hervormt de detectie van besmetting door realtime gegevens te analyseren om microbiële indringingen te identificeren.Wanneer bacteriën een bioreactor binnendringen, verbruiken ze zuurstof en produceren ze metabolische zuren, wat leidt tot merkbare dalingen in opgeloste zuurstof- en pH-niveaus. AI-systemen kunnen deze afwijkingen in zuurstof- en voedingsstoffenverbruik detecteren, waardoor mogelijke besmetting veel eerder wordt gemeld dan traditionele bioburden-testen en steriliteitsprotocollen resultaten kunnen leveren [12].
Deze AI-platforms bevatten ook wiskundige modellen om het exacte tijdstip van besmetting te bepalen en te simuleren hoe microbiële populaties in de loop van de tijd groeien. Dit helpt operators om de besmetting terug te traceren naar de bron, of het nu een defecte voedingsbron, een operationele fout of een probleem met de apparatuur is. Technieken zoals Poisson-probabiliteitsanalyse verbeteren verder de nauwkeurigheid van bioburden-testen, waardoor de kans op vals-negatieven wordt verminderd [12].
"Wiskundige modellen helpen bij het schatten van de introductietijd van besmetting en de dynamiek van microbiële groei, waardoor de traceerbaarheid van besmetting wordt verbeterd." - Naveenganesh Muralidharan, Senior Manager, MSAT, AGC Biologics [12]
Wanneer er anomalieën worden gesignaleerd, kan onmiddellijke actie - zoals het isoleren van de bioreactor en het stoppen van alle toevoer - voorkomen dat het probleem zich verspreidt [12]. Een systematische aanpak met bioburden testen, moleculaire identificatie en groeisnelheidsanalyse is essentieel voor het identificeren van de oorzaak en het implementeren van corrigerende maatregelen. Deze AI-tools overbruggen de kloof tussen traditionele methoden en proactief besmettingsbeheer.
Koude Plasma Sterilisatie
Koude plasmatechnologie biedt een niet-thermische sterilisatieoptie die bijzonder geschikt is voor de productie van gekweekt vlees.Werken bij of nabij kamertemperatuur, het is ideaal voor het steriliseren van gevoelige componenten zoals bioreactoronderdelen, sensoren en kunststoffen die de hitte van traditionele autoclavering niet kunnen weerstaan [15][16][17]. Deze methode gebruikt reactieve zuurstof- en stikstofsoorten, samen met UV-licht, om microbiële membranen en DNA te verstoren. Het is effectief tegen een breed scala aan verontreinigingen, waaronder bacteriële sporen (Bacillus, Clostridium), schimmels, virussen en zelfs prionen [15][17].
Een van de opvallende kenmerken van koude plasma is dat het geen toxische residuen achterlaat. Zodra de stroom is uitgeschakeld, keren reactieve soorten snel terug naar zuurstof, waardoor de noodzaak voor een desorptiefase wordt geëlimineerd [16][18].Het is ook energiezuinig en vereist slechts een standaard stopcontact in plaats van op fossiele brandstoffen gebaseerde warmtebronnen [15][16]. Uit studies blijkt bijvoorbeeld dat koude plasma een >5 log reductie kan bereiken in Bacillus cereus sporen binnen 25 minuten bij 300W vermogen [15].
Echter, de technologie heeft ook zijn beperkingen. De sterilisatie-effecten zijn voornamelijk oppervlakte-niveau, wat betekent dat het moeite heeft om complexe geometrieën te penetreren waar microben zich kunnen verbergen in scheuren of groeven [15][16]. Een hoog eiwit- of vetgehalte in bioreactoromgevingen kan microben ook beschermen door reactieve soorten te onderscheppen, waardoor de efficiëntie van de sterilisatie wordt verminderd [15][18].
| Kenmerk | Koud Plasma |
|---|---|
| Voordelen | Niet-thermisch, niet-toxisch, energie-efficiënt, geen residuen, snel [16] |
| Beperkingen | Beperkte penetratie, verminderde effectiviteit in complexe geometrieën [15][16] |
Geautomatiseerde Beeldgebaseerde Detectiesystemen
Als aanvulling bieden geautomatiseerde beeldsystemen een krachtig hulpmiddel voor realtime detectie van besmetting. Deze systemen bieden gedetailleerde morfologische inzichten in celgroei, wat cruciaal is voor het opsporen van besmettingspatronen zodra ze zich voordoen [19].In tegenstelling tot traditionele offline microscopie - die handmatige bemonstering en kleuring vereist - integreert geautomatiseerde beeldvorming naadloos in online of at-line monitoringopstellingen. Dit stelt operators in staat om biomassa en celgezondheid te monitoren zonder de steriliteit in gevaar te brengen [19].
Door handmatige interventies te verminderen, verminderen deze systemen menselijke fouten en verbeteren ze de reproduceerbaarheid in kweekprocessen [19]. Geavanceerde beeldverwerkingsalgoritmen kunnen de voortgang van fermentatie volgen, de productie van metabolieten optimaliseren en consistentie waarborgen - een cruciale factor bij het opschalen van bioprocessen [19].
"De beschikbaarheid van geavanceerde bemonsteringstechnieken in combinatie met geautomatiseerde meetinstrumenten...kan de tijd die nodig is voor stamselectie, procesontwikkeling en procescontrole aanzienlijk verkorten door het aantal stappen in het productie-/kweekproces te verminderen, vooral handmatige stappen, en het verminderen van foutpropagatie." - A.C. Veloso en E.C. Ferreira, Universiteit van Minho [19]
Ondanks hun voordelen is het integreren van deze systemen niet altijd eenvoudig. Celculturen zijn complex, grondstoffen variëren, en sensoren moeten bestand zijn tegen zware sterilisatiemethoden zoals stoom of gamma-bestraling [19]. Voor bedrijven die deze technologieën willen adopteren, kunnen platforms zoals
Conclusie
Het waarborgen van de steriliteit van bioreactoren in de productie van gekweekt vlees is geen gemakkelijke taak, maar een geïntegreerde strategie voor sterilisatietesten kan het haalbaar maken.Deze strategie combineert traditionele methoden, zoals membraanfiltratie voor grotere monstervolumes en directe inoculatie voor kleinere, met moderne moleculaire hulpmiddelen zoals PCR en qPCR voor snelle pathogeenscreening. Bovendien voegt milieubewaking - via luchtmonsters en oppervlakteafname - een extra beveiliging toe, waarmee verontreinigingsrisico's in HVAC systemen worden aangepakt, en potentiële verontreiniging wordt opgevangen voordat deze de productievaartuigen kan beïnvloeden [11].
De keuze van de testbenadering hangt af van factoren zoals de monsteromvang, de aanwezigheid van stoffen die de resultaten kunnen beïnvloeden, en of de focus ligt op volledige steriliteitsvalidatie of simpelweg op het monitoren van de bioburden. Monsterneming van meerdere punten in de bioreactor - boven, midden en onder - helpt bij het creëren van een grondig microbiologisch profiel en vermindert de kans op het missen van lokale verontreiniging [1].Dit is bijzonder cruciaal gezien het feit dat de risico's op besmetting bij de productie van gekweekt vlees aanzienlijk hoger zijn dan bij de productie van biofarmaceutica, wat de noodzaak van rigoureuze steriliteitsprotocollen benadrukt [6].
Sleutel tot het handhaven van media-steriliteit in bioreactoren is het verkrijgen van de juiste apparatuur. Hulpmiddelen zoals aseptische bemonsteringssystemen met voor-gesteriliseerde septa en HEPA-filters die 99,97% van de deeltjes groter dan 0,3 μm kunnen opvangen, zijn essentieel [4]. Platforms zoals
Naarmate de industrie groeit, worden hybride steriliteitsbenaderingen steeds belangrijker.Het toepassen van farmaceutische kwaliteitscontroles tijdens de vroege zaadtreinfasen, terwijl voedselveiligheidsnormen worden gehanteerd voor grootschalige productie, biedt een balans tussen veiligheid en kosteneffectiviteit [5][6]. Deze geïntegreerde maatregelen zullen de hoeksteen zijn van veilige en efficiënte productie van gekweekt vlees naarmate het veld zich verder ontwikkelt.
Veelgestelde vragen
Wat zijn de belangrijkste oorzaken van besmetting in bioreactorsystemen die worden gebruikt voor de productie van gekweekt vlees?
Besmetting in bioreactorsystemen treedt op wanneer de steriele omgeving wordt verstoord of wanneer voedingsrijke media een ideale omgeving bieden voor microben om te gedijen. Dit kan worden veroorzaakt door verschillende factoren, zoals schendingen tijdens bemonstering, onderhoud of celoogst; beschadigde of geblokkeerde gasfilters; besmetting die al aanwezig is in het groeimedium; of tijdelijke openingen die ontstaan bij het installeren of onderhouden van sensoren.Bovendien kan versleten apparatuur microplastic deeltjes afgeven, die als een thuis voor micro-organismen kunnen dienen.
Bij de productie van gekweekt vlees kan zelfs de kleinste besmetting zowel de veiligheid als de opbrengst van een batch in gevaar brengen. Om deze risico's te verminderen, is het cruciaal om te investeren in hoogwaardige apparatuur zoals steriele filters, bioreactoren en sensorkits die voldoen aan strikte aseptische normen. Platforms zoals
Hoe verbetert kunstmatige intelligentie de steriliteitstesten in bioreactoren?
Door AI aangedreven systemen transformeren de steriliteitstesten in bioreactoren voor gekweekt vlees door real-time inzichten te bieden via continue monitoring. Met behulp van geavanceerde biosensoren houden deze systemen kritische factoren bij zoals pH, opgeloste zuurstof, en essentiële metabolieten zoals glucose en aminozuren. Dit alles gebeurt zonder de noodzaak van handmatige controles, wat het risico op besmetting aanzienlijk vermindert.
Wat deze systemen onderscheidt, is hun vermogen om gegevens te analyseren met behulp van algoritmen die metingen vergelijken met vastgestelde steriliteitsnormen. Dit betekent dat ze zelfs de kleinste tekenen van microbiële groei veel eerder kunnen detecteren dan traditionele methoden. Naast detectie komt voorspellende analyse in het spel, waarbij potentiële risico's worden geïdentificeerd, zoals problemen tijdens de installatie van sensoren of toegang via poorten. Deze systemen suggereren zelfs corrigerende maatregelen om producenten te helpen kostbare batchverliezen te voorkomen.
AI-gestuurde microscopie voegt een extra laag efficiëntie toe door onmiddellijk onderscheid te maken tussen gezonde cellen en verontreinigingen, waardoor de processen voor sterilisatieverificatie worden versneld.Voor producenten maken platforms zoals
Welke uitdagingen beperken het gebruik van koude plasma sterilisatie in bioreactoren voor de productie van gekweekt vlees?
Koude plasma sterilisatie is effectief in het neutraliseren van microben, maar het brengt een reeks uitdagingen met zich mee wanneer het wordt toegepast op bioreactoren in de productie van gekweekt vlees. Een belangrijk probleem is de beperkte penetratiediepte van de reactieve soorten die door plasma worden geproduceerd. Dit maakt het moeilijk om grote volumes of dicht opeengepakte media grondig te steriliseren. Bovendien wordt het steeds moeilijker om een gelijkmatige plasmabedekking over een hele reactor te bereiken naarmate de systeemgrootte toeneemt.
Het opschalen van koude plasmasystemen van laboratoriumomgevingen naar commerciële bioreactoren introduceert extra obstakels.Grotere reactoren vereisen hogere vermogen-tot-volume verhoudingen, wat kan resulteren in sterilisatietijden die verre van praktisch zijn. Veel koude plasmasystemen werken ook onder vacuümomstandigheden of zijn afhankelijk van reactieve gassen, wat lagen van complexiteit toevoegt op het gebied van veiligheid, naleving van regelgeving en ontwerp van apparatuur. Deze factoren maken de methode minder ideaal voor de grootschalige bioreactoren die typisch vereist zijn in de commerciële productie van gekweekt vlees.
Een andere zorg is het potentieel voor schade veroorzaakt door reactieve zuurstof- en stikstofsoorten (RONS), die essentieel zijn voor microbiële inactivatie. Deze reactieve soorten kunnen gevoelige zoogdiercellen beschadigen of mediacomponenten afbreken, waardoor zorgvuldige optimalisatie nodig is om de levensvatbaarheid van cellen te behouden. Als gevolg hiervan wordt koude plasma vaak gebruikt in combinatie met andere sterilisatietechnieken in plaats van als een op zichzelf staande oplossing.











