Cryopreservatie is het proces van het invriezen en opslaan van levende cellen bij ultra-lage temperaturen om hun levensvatbaarheid in de loop van de tijd te behouden. Deze methode is cruciaal voor de productie van gekweekt vlees, omdat het zorgt voor consistente, stabiele cellijnen en bescherming biedt tegen verliezen door besmetting of uitval van apparatuur. Belangrijke stappen zijn:
- Voorbereiding: Oogst cellen tijdens hun groeifase, controleer de levensvatbaarheid (streef naar ≥90%), en bereid ze voor in vriesmedia met cryoprotectanten zoals DMSO of glycerol.
- Invriezen: Gebruik een gecontroleerde koelsnelheid (-1°C tot -3°C per minuut) om schade door ijskristallen te voorkomen. Bewaar cellen in vloeibare stikstofdamp (-135°C tot -190°C) voor langdurige bewaring.
- Ontdooien: Ontdooi cellen snel in een waterbad van 37°C om de toxiciteit van cryoprotectanten te minimaliseren, en breng ze vervolgens over naar groeimedia voor herstel.
- Kwaliteitscontrole: Label vials nauwkeurig, monitor opslagomstandigheden en test levensvatbaarheid na ontdooiing om succesvolle conservering te waarborgen.
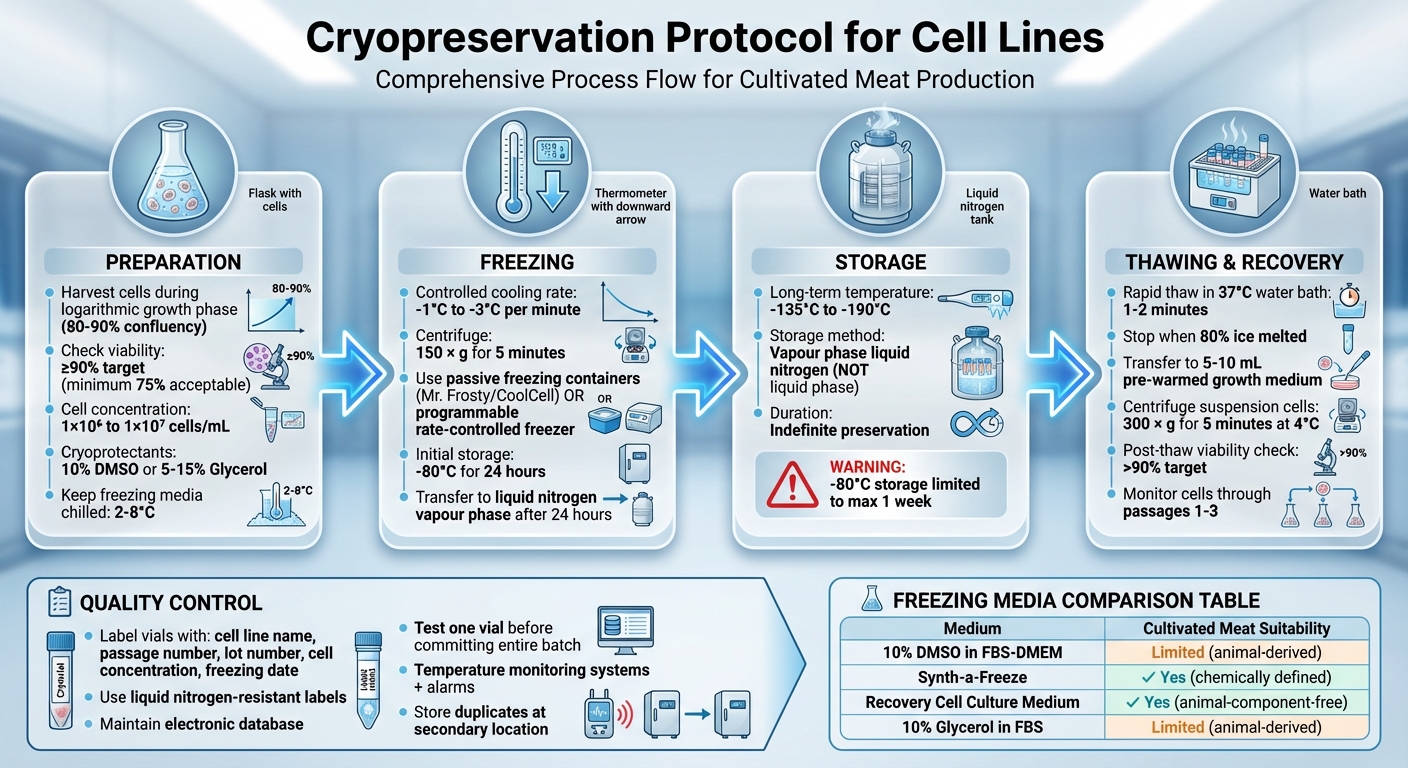
Volledige Cryopreservatieprotocol voor Cellijnen: 4-stappenproces van Voorbereiding tot Opslag
Cellen Voorbereiden voor Cryopreservatie
Cel Oogst en Levensvatbaarheidscontroles
Om de beste herstel na ontdooiing te waarborgen, oogst cellen tijdens hun logaritmische (log) groeifase. Voor adherente cel lijnen is dit meestal wanneer ze 80–90% confluente zijn [2][3][6].
Controleer de levensvatbaarheid van de cellen met de Trypan Blue uitsluitingsmethode. Meng gelijke delen (1:1) van 0,4% Trypan Blue met de cel suspensie, tel vervolgens de cellen met een hemocytometer.Levende cellen zullen de kleurstof uitsluiten en helder onder de microscoop verschijnen, terwijl niet-levende cellen blauw zullen kleuren [4]. Idealiter streeft u naar een levensvatbaarheid van ten minste 90% voor de beste herstelpercentages, hoewel sommige protocollen een minimum van 75% kunnen accepteren [1][2][3][5].
Controleer voor de oogst met een microscoop op bacteriële of schimmelcontaminatie. Gezonde suspensiecelllen zouden helder, rond en refractiel moeten verschijnen onder een omgekeerde fasecontrastmicroscoop [2][3].
Wanneer de cellen voldoen aan de vereiste levensvatbaarheidsnormen, gaat u verder met de stappen voor het voorbevriezen.
Voorbereidingen voor het Voorbevriezen
Voor hechtende cellen, gebruik milde dissociatiemethoden, zoals trypsine of TrypLE Express, en beperk de incubatietijd om schade aan de celmembranen te voorkomen [5]. Bereid de cellen voor in een concentratie van 1 × 10⁶ tot 1 × 10⁷ cellen/mL, afhankelijk van de cellijn [1][6]. Zorg ervoor dat de cellen tijdens het aliquoteren regelmatig worden gemengd om een uniforme verdeling over de cryovials te behouden [5].
Houd de bevriezingsmedia gekoeld tussen 2°C en 8°C tijdens het resuspenden om de toxiciteit van het cryoprotectivum te verminderen voordat het bevriezingsproces begint [5]. Zodra de cellen zijn gesuspendeerd in de bevriezingsmedia, ga dan snel verder met het bevriezingsprotocol [1].Bewaar altijd cellen bij de laagst mogelijke passage nummer om het risico op genetische drift of morfologische veranderingen te verminderen [5][7].
Selecteren van Cryoprotectanten en Vriesmedia
Opties voor Cryoprotectanten en Hun Functies
Dimethylsulfoxide (DMSO) wordt veel gebruikt als cryoprotectant, meestal bij een concentratie van 10% [2]. Het werkt door celmembranen binnen te dringen en de ijsvorming tijdens het invriezen te verminderen. DMSO kan echter toxisch zijn voor cellen bij kamertemperatuur, dus snelle ontdooiing is essentieel om de blootstelling te minimaliseren en het snel te verdunnen [1].
Glycerol dient als een nuttig alternatief voor cellijnen die gevoelig zijn voor DMSO, doorgaans gebruikt in concentraties variërend van 5% tot 15% [8].Het is bijzonder effectief voor celtypes waarbij DMSO ongewenste differentiatie kan veroorzaken [3], en het heeft doorgaans een lagere toxiciteit in vergelijking met DMSO.
In toepassingen voor gekweekt vlees gebruiken traditionele vriesprotocollen vaak een mengsel van 90% Fetaal Rundserum (FBS) en 10% DMSO [1]. Echter, de afhankelijkheid van dierlijke componenten beperkt deze methoden qua schaalbaarheid en goedkeuring door regelgevende instanties [9]. Om deze problemen aan te pakken, chemisch gedefinieerde media - zoals Synth-a-Freeze of Recovery Cell Culture Medium - bieden een alternatief zonder dierlijke componenten. Deze media behouden een hoge levensvatbaarheid van cellen na ontdooiing, terwijl ze de uitdagingen die gepaard gaan met dierlijke oorsprong componenten overwinnen [9].
Vergelijking van Vriesmedia
Hier is een overzicht van de voordelen en beperkingen van verschillende vriesmedia die worden gebruikt in de productie van gekweekt vlees:
| Medium | Voordelen | Nadelen | Geschiktheid voor Gekweekt Vlees |
|---|---|---|---|
| 10% DMSO in FBS-DMEM | Gevestigde protocollen [1] | Bevat dierlijke componenten; batchvariabiliteit [9] | Beperkte schaalbaarheid |
| Synth-a-Freeze | Chemisch gedefinieerd; consistente kwaliteit; vrij van dierlijke componenten [9] | Hogere initiële kosten [9] | Ja |
| Herstel Celcultuur Medium | Gemakkelijk te gebruiken; ontworpen voor snelle herstel [9] | Moet mogelijk geoptimaliseerd worden voor specifieke cellijnen | Ja |
| 10% Glycerol in FBS | Alternatief voor DMSO-gevoelige cellen [1] | Afhankelijk van serum van dierlijke oorsprong [9] | Beperkte schaalbaarheid |
In februari 2023 toonden onderzoekers aan de Tokyo Women's Medical University, onder leiding van Hironobu Takahashi, het belang aan van het kiezen van het juiste vriesmedium.Met commerciële opties zoals CELLBANKER 1 en 2, hebben ze met succes primaire rundermyogene cellen cryopreserveerd bij –80°C gedurende maximaal een jaar. Opmerkelijk is dat deze cellen hun vermogen behielden om te prolifereren en te differentiëren in contractiel spierweefsel met intacte sarcomeerstructuren na ontdooiing [10].
Voor de productie van gekweekt vlees worden chemisch gedefinieerde en GMP-conforme media steeds meer geprefereerd. Zoals STEMCELL Technologies benadrukt:
In sterk gereguleerde gebieden zoals cel- en gentherapie wordt aanbevolen om een GMP-geproduceerd, volledig gedefinieerd cryopreservatiemedium te gebruiken om ervoor te zorgen dat de producten consistent worden geproduceerd en gecontroleerd volgens kwaliteitsnormen [9].
Platforms zoals
Cryopreservatieprocedure en koelsnelheden
Stapsgewijs vriesprotocol
De sleutel tot succesvolle cryopreservatie ligt in het handhaven van een constante koelsnelheid van -1°C tot -3°C per minuut[2]. Dit geleidelijke proces stelt water in staat om langzaam de cellen te verlaten, waardoor de vorming van schadelijke intracellulaire ijskristallen wordt voorkomen die celmembranen kunnen beschadigen[1].
Begin met het centrifugeren van de cellen bij 150 x g gedurende 5 minuten[3]. Zodra de cellen zijn gecentrifugeerd, resuspend de celpellet in een koud vriesmedium dat 10% DMSO bevat met een concentratie van 2–4×10⁶ cellen/mL[3].Om de blootstelling aan DMSO te verminderen, ga snel door naar de volgende stap - invriezen.
Verdeel de cellen suspensie in vooraf gelabelde cryogene vials. Elke vial moet duidelijk essentiële details aangeven, zoals de naam van de cellijn, passage nummer, lotnummer, celconcentratie en de datum van invriezen[3]. Met de vials voorbereid, is het tijd om de juiste koelapparatuur te selecteren en te gebruiken.
Koelapparatuur en technieken
Plaats de vials onmiddellijk in een gecontroleerd-snelheid koelapparaat. Passieve vriescontainers, zoals de Nalgene "Mr Frosty" (die isopropanol gebruikt) of de Corning "CoolCell", zijn populaire keuzes. Deze hulpmiddelen kunnen een koelsnelheid van ongeveer 1°C per minuut bereiken wanneer ze in een -80°C vriezer worden geplaatst[2].
Voor grootschalige operaties waarbij consistentie cruciaal is, is een programmeerbare temperatuurgecontroleerde vriezer de beste optie. Zoals vermeld door Sigma-Aldrich:
ECACC maakt routinematig gebruik van een programmeerbare temperatuurgecontroleerde vriezer. Dit is de meest betrouwbare en reproduceerbare manier om cellen in te vriezen[3].
Na ongeveer 24 uur bij -80°C, verplaats de vials naar de dampfase van vloeibare stikstof, waar de temperaturen variëren tussen -135°C en -190°C, voor langdurige opslag[4]. Vermijd het opslaan van cellen bij -80°C langer dan een week, aangezien dit hun levensvatbaarheid kan compromitteren. Temperaturen onder -135°C zijn essentieel voor onbepaalde bewaring[2]. Het gebruik van de dampfase in plaats van de vloeibare fase vermindert het risico op kruisbesmetting terwijl voldoende lage temperaturen worden gehandhaafd.
Onthaal- en Herstelprotocollen
Onthaalproces
Het snel ontdooien van cellen is cruciaal om de blootstelling aan toxische cryoprotectanten te beperken en te voorkomen dat ijskristallen schade veroorzaken. Zorg ervoor dat je een volledig gezichtsscherm en geïsoleerde handschoenen draagt voor de veiligheid. Begin met het verwijderen van de cryovial uit vloeibare stikstof en draai de dop iets los om opgebouwde druk vrij te laten. Draai de dop vervolgens weer vast.
Plaats de vial in een waterbad van 37°C, zorg ervoor dat de dop boven de waterlijn blijft. Laat het 1–2 minuten ontdooien, of totdat er nog maar een paar ijskristallen overblijven. Zodra het ontdooid is, veeg je de buitenkant van de vial af met 70% alcohol om de sterielheid te behouden.
Breng de inhoud van de vial over in een buis met 5–10 mL van voorverwarmd groeimedium. Voeg het medium langzaam toe om osmotische schok te helpen verminderen. Als je werkt met suspensiecellijnen, centrifugeer dan de cellen onmiddellijk bij 300 × g gedurende 5 minuten bij 4°C.Deze stap helpt bij het pelletiseren van de cellen en verwijdert de cryoprotectant. Na centrifugatie, resuspendeer de cellen in vers medium. Voor adherente cellen is centrifugatie meestal niet nodig. Zaai de cellen in plaats daarvan direct in een geschikt kweekvat en verwijder eventuele resterende DMSO tijdens de eerste mediawisseling, meestal na 24 uur.
Post-Thaw Beoordelingen
Direct na ontdooiing, controleer de celviabiliteit om te zorgen dat het herstel succesvol is geweest. Gebruik de Trypan Blue uitsluitingsmethode voor deze beoordeling. Idealiter zou de celviabiliteit meer dan 90% moeten zijn [11], maar een minimum van 75% is acceptabel. Na 24 uur, inspecteer de cellen onder een fase-contrastmicroscoop om de hechting te bevestigen, de cel dichtheid te evalueren en te controleren op tekenen van contaminatie.
Blijf de cellen monitoren door passages 1–3 om ervoor te zorgen dat de normale proliferatie plaatsvindt en dat ze hun verwachte kenmerken behouden. Voor cellijnen die langzamer herstellen, kunt u de overleving verbeteren door de initiële concentratie van foetaal runderserum te verhogen tot ongeveer 20% v/v.
sbb-itb-ffee270
Opslag en Langdurige Levensvatbaarheid
Opslagomstandigheden en Duur
Om de levensvatbaarheid van cellijnen op lange termijn te behouden, is het essentieel om ze op temperaturen onder -135°C te bewaren [7][2]. Dit zorgt ervoor dat ze onbeperkt bewaard blijven.
De voorkeurmethode voor het opslaan van gekweekte vlees cellijnen is dampfase vloeibare stikstof. Deze techniek houdt de temperaturen tussen -135°C en -190°C, waardoor het ideaal is voor langdurige bewaring en een verbeterde veiligheid biedt in vergelijking met opslag in vloeibare fase.
Als u cellen bij -80°C moet opslaan, beperk dit dan tot een periode van 24 uur tot een week. Daarbuiten kan de levensvatbaarheid van de cellen afnemen.Voor tijdelijke opslag bij deze temperatuur, verplaats de cellen zo snel mogelijk naar opslag in vloeibare stikstof.
Gebruik standaard steriele cryogene vials (1–2 mL) met interne schroefdraad en een O-ring voor veilige opslag [4][5]. Plaats altijd afgesloten cryovials in de gasfase in plaats van de vloeistoffase van stikstof om het risico op explosies van vials tijdens het ontdooien te verminderen [5]. Zorg er bovendien voor dat bulk vloeibare stikstofvaten ten minste halfvol zijn om een veiligheidsbuffer te behouden.
Ten slotte zijn strenge kwaliteitscontrolemaatregelen cruciaal om de langetermijnlevensvatbaarheid van de cellen te waarborgen.
Kwaliteitscontrolecontroles
Om de betrouwbaarheid van opgeslagen cellijnen te waarborgen, volg strikte protocollen voor kwaliteitscontrole. Begin met het nauwkeurig labelen van elke vial met vloeibare stikstofbestendige labels.Neem essentiële details op, zoals de identiteit van de cellijn, het lotnummer, het passage nummer en de bewaar datum. Houd een elektronische database bij om de exacte locatie van elke vial vast te leggen, wat de tijd vermindert dat opslagvaten open moeten blijven [7][2].
Voordat u volledige batches aan langdurige opslag toewijst, test de levensvatbaarheid van één vial na korte termijn gasfase opslag. Deze stap helpt bevestigen dat het vriesproces succesvol was en identificeert eventuele potentiële problemen [4][7][2]. Voor zeer waardevolle cellen is het verstandig om duplicaten op een secundaire locatie op te slaan om te beschermen tegen uitval van apparatuur of lokale rampen [7][2].
Voorzie alle opslagvaten van temperatuurmonitoringssystemen en alarmen om lage niveaus van vloeibare stikstof te detecteren [7]. Installeer daarnaast zuurstofalarmen in opslagruimtes, ingesteld om te activeren bij 18% zuurstof (v/v), om de risico's van verstikking voor personeel dat met vloeibare stikstof werkt te minimaliseren [7][2].
Cryopreservatie van zoogdiercellijnen video protocol
Conclusie en Belangrijkste Inzichten
Hier is een snelle samenvatting van de essentiële stappen en aanbevelingen voor effectieve cryopreservatie in de productie van gekweekt vlees:
- Cel Oogsten: Verzamel cellen tijdens hun logaritmische groeifase, waarbij de levensvatbaarheid meer dan 90% moet zijn. Gebruik 10% DMSO als cryoprotectant, hoewel glycerol een alternatief kan zijn voor meer delicate cellijnen [11][1].
- Koeling en Opslag: Handhaaf een gecontroleerde koelsnelheid en verplaats vials snel naar opslag in vloeibare stikstof in dampfase om de celintegriteit te waarborgen [11]
Een studie van Roka Kakehi et al. benadrukt het belang van precisie in cryopreservatie [10]:
"Het waarborgen van een betrouwbare en consistente bron van cellen door gebruik te maken van cryopreservatie stelt ons in staat om de stabiele aanvoer van veelbelovende cellen voor de productie van gekweekt vlees te vergroten." - Roka Kakehi et al., Tokyo Women's Medical University
- Ontdooi Proces: Ontdooi cellen in een waterbad van 37°C gedurende ongeveer twee minuten, stop wanneer 80% van het ijs is gesmolten. Dit vermindert de toxiciteit van DMSO en verbetert de celherstel [1]. Volg op met levensvatbaarheidscontroles na het ontdooien om succes te waarborgen en toekomstige procedures te verfijnen.
Deze methoden werken hand in hand met strikte kwaliteitscontrolepraktijken. Label altijd vials nauwkeurig, houd georganiseerde records bij en implementeer grondige controles voordat u ze voor lange termijn opslaat [11]. Voor gespecialiseerde cryopreservatiebehoeften verbinden platforms zoals
Veelgestelde vragen
Wat zijn de voordelen van het gebruik van chemisch gedefinieerde media voor het cryopreserveren van cellijnen in de productie van gekweekt vlees?
Chemisch gedefinieerde media bieden meerdere voordelen als het gaat om het cryopreserveren van cellijnen voor de productie van gekweekt vlees. Door ongedefinieerde componenten, zoals dierlijk serum, te verwijderen, zorgen ze voor consistente en voorspelbare resultaten - een cruciale factor voor het behoud van de lange termijn betrouwbaarheid van cellijnen.
Een ander belangrijk voordeel is het verminderde risico op contaminatie en variabiliteit. Dit ondersteunt niet alleen hogere kwaliteits- en veiligheidsnormen, maar sluit ook perfect aan bij de precisie en schaalbaarheid die nodig zijn om zowel te voldoen aan de regelgeving als aan de verwachtingen van consumenten in de gekweekte vleesindustrie.
Hoe beïnvloedt de keuze van cryoprotectant de celoverleving tijdens het invriezen en ontdooien?
De keuze van cryoprotectant is een belangrijke factor bij het behouden van de celgezondheid tijdens het invriezen en ontdooien. Twee veelgebruikte opties zijn dimethylsulfoxide (DMSO) en glycerol, elk met verschillende kenmerken. DMSO staat bekend om zijn vermogen om snel cellen binnen te dringen en sterke bescherming te bieden. Het heeft echter een kanttekening: bij hoge concentraties of bij langdurige blootstelling kan het toxisch worden, wat de celviabiliteit kan verlagen.
Glycerol daarentegen is minder toxisch en kan direct worden toegepast.Het nadeel ligt in de langzamere snelheid van celpenetratie, wat kan resulteren in minder onmiddellijke bescherming in vergelijking met DMSO.
Het bereiken van de juiste balans is cruciaal. Het correct aanpassen van de concentratie en blootstellingstijd van de cryoprotectant helpt cellen te beschermen terwijl het risico op toxiciteit wordt geminimaliseerd. Bovendien is het naleven van de beste praktijken voor koelsnelheden en opslagomstandigheden essentieel om de hoogste mogelijke herstelpercentages na ontdooiing te waarborgen.
Waarom is het belangrijk om de koelsnelheid tijdens cryopreservatie te beheersen?
Het handhaven van een constante koelsnelheid, meestal tussen –1°C en –3°C per minuut, is de sleutel tot het behouden van de levensvatbaarheid van cellen. Geleidelijk koelen stelt cellen in staat om op een gecontroleerd tempo te dehydrateren, waardoor de kans op schadelijke ijskristallen die celmembranen kunnen scheuren of beschadigen, wordt verminderd.
Deze gemeten aanpak beschermt de structuur van de cellen, waardoor hun overleving en functionaliteit na ontdooiing worden verbeterd.Het volgen van nauwkeurige koelprotocollen is essentieel om een succesvolle langdurige opslag en herstel van cellijnen te waarborgen.











