การทดสอบความปลอดเชื้อเป็นสิ่งสำคัญสำหรับการผลิตเนื้อสัตว์ที่เพาะเลี้ยง ซึ่งแม้แต่การปนเปื้อนเล็กน้อยก็อาจนำไปสู่ความล้มเหลวของชุดการผลิตที่มีค่าใช้จ่ายสูง กระบวนการนี้ช่วยให้มั่นใจได้ว่าไม่มีจุลินทรีย์ที่เป็นอันตรายรบกวนการทำงานของเครื่องปฏิกรณ์ชีวภาพ ปกป้องทั้งคุณภาพของผลิตภัณฑ์และความสามารถในการทำกำไร ด้วยอัตราการปนเปื้อนเฉลี่ย 11.2% - และเพิ่มขึ้นเป็น 19.5% สำหรับการผลิตขนาดใหญ่ ผู้ผลิตต้องเผชิญกับความท้าทายที่สำคัญในการรักษาสภาพแวดล้อมที่ปลอดเชื้อ
ประเด็นสำคัญได้แก่:
- แหล่งที่มาของการปนเปื้อนหลัก: บุคลากร วัตถุดิบ และการดำเนินงานของเครื่องปฏิกรณ์ชีวภาพเป็นจุดเริ่มต้นทั่วไปสำหรับจุลินทรีย์
- วิธีการทดสอบ: การกรองผ่านเยื่อสำหรับปริมาณมาก การฉีดตรงสำหรับตัวอย่างขนาดเล็ก และการทดสอบปริมาณจุลินทรีย์ระหว่างการผลิตเป็นที่นิยมใช้กันอย่างแพร่หลาย
- การตรวจสอบแบบเรียลไทม์: เครื่องมือเช่นเซ็นเซอร์ออกซิเจนที่ละลายและการวิเคราะห์ก๊าซที่ปล่อยออกมาช่วยให้สามารถตรวจจับกิจกรรมของจุลินทรีย์ได้ตั้งแต่เนิ่นๆ
- เทคโนโลยีที่เกิดขึ้นใหม่: การตรวจสอบด้วย AI, การฆ่าเชื้อด้วยพลาสมาเย็น, และระบบการถ่ายภาพอัตโนมัติ ช่วยให้การจัดการการปนเปื้อนรวดเร็วและแม่นยำยิ่งขึ้น
สำหรับผู้ผลิตเนื้อสัตว์ที่เพาะเลี้ยง การผสมผสานการทดสอบความปลอดเชื้อแบบดั้งเดิมกับโซลูชันการตรวจสอบขั้นสูงเป็นสิ่งสำคัญเพื่อลดความเสี่ยงและปรับปรุงประสิทธิภาพการผลิต
Rocker Discover - วิธีการทดสอบความปลอดเชื้อ?
sbb-itb-ffee270
แหล่งที่มาของการปนเปื้อนในระบบไบโอรีแอคเตอร์
เพื่อป้องกันความล้มเหลวของชุดการผลิตในระบบไบโอรีแอคเตอร์ การระบุแหล่งที่มาของการปนเปื้อนเป็นสิ่งสำคัญ โดยทั่วไปแล้วสารปนเปื้อนจะแบ่งออกเป็นสามประเภทหลัก: จุลินทรีย์, อนุภาค, และเอนโดท็อกซิน แต่ละประเภทมีความท้าทายเฉพาะสำหรับการผลิตเนื้อสัตว์ที่เพาะเลี้ยง ทำให้จำเป็นต้องพัฒนากลยุทธ์การป้องกันเฉพาะเจาะจง
บุคลากรเป็นแหล่งปนเปื้อนหลัก มักนำสารปนเปื้อนเข้ามาผ่านการหลุดลอกของผิวหนัง การสวมใส่ชุดที่ไม่เหมาะสม หรือการรักษาสุขอนามัยของมือที่ไม่ดี [4][7]. แม้จะมีมาตรการที่เข้มงวด การเคลื่อนไหวง่ายๆ ก็สามารถรบกวนการไหลของอากาศ ทำให้เกิดความปั่นป่วนหรือพื้นที่นิ่งที่สารปนเปื้อนสามารถสะสมได้ [4][9]. U.S. องค์การอาหารและยาเน้นย้ำถึงความเสี่ยงที่เกี่ยวข้อง โดยระบุว่า "การจัดการด้วยมือหรือเครื่องจักรใดๆ ของยาที่ผ่านการฆ่าเชื้อแล้ว ส่วนประกอบ ภาชนะ หรือฝาปิดก่อนหรือระหว่างการประกอบแบบปลอดเชื้อมีความเสี่ยงต่อการปนเปื้อนและจึงจำเป็นต้องมีการควบคุมอย่างระมัดระวัง" [4].
ปัจจัยด้านสิ่งแวดล้อมก็มีบทบาทสำคัญเช่นกัน.ตัวอย่างเช่น การไม่สามารถรักษาความดันบวกที่ 10–15 พาสคาล อาจทำให้อากาศที่ไม่ได้กรองเข้าสู่เขตปลอดเชื้อได้ [3][4] นอกจากนี้ ปัญหาเช่นประสิทธิภาพของแผ่นกรอง HEPA ที่ลดลง - เมื่อการกักเก็บอนุภาคต่ำกว่า 99.97% - หรือแผ่นกรองก๊าซอัดที่ถูกทำลาย อาจทำให้ความปลอดเชื้อถูกทำลายได้อย่างรวดเร็ว [4].
การปนเปื้อนของวัตถุดิบและสายเซลล์
วัตถุดิบที่เข้าสู่ระบบไบโอรีแอคเตอร์เป็นความเสี่ยงหลักของการปนเปื้อน ส่วนประกอบของวัตถุดิบที่ไม่ได้รับการตรวจสอบ ส่วนประกอบของสื่อการเจริญเติบโต และสายเซลล์ (ที่มีอยู่ผ่าน ตลาด B2B เฉพาะทาง) สามารถนำเชื้อโรคที่ฉวยโอกาสเข้ามาได้ [2] สภาพแวดล้อมที่อุดมไปด้วยสารอาหารของสื่อการเพาะเลี้ยงเซลล์มีความเสี่ยงต่อการปนเปื้อนเป็นพิเศษ ทำให้กระบวนการผลิตเนื้อสัตว์ที่เพาะเลี้ยงมีความเสี่ยงมากกว่ากระบวนการทางชีวภาพของจุลินทรีย์ [8]
ส่วนผสมที่ไวต่อความร้อนที่ไม่สามารถผ่านการฆ่าเชื้อด้วยเครื่องออโตเคลฟได้มีความเสี่ยงเป็นพิเศษ เนื่องจากต้องใช้วิธีการฆ่าเชื้อทางเลือกเช่นการกรอง [1][8]. นอกจากนี้ กระบวนการฉีดวัคซีนเองก็มีความเสี่ยงโดยธรรมชาติ แม้ว่าเมมเบรนจะถูกฆ่าเชื้อด้วยแอลกอฮอล์หรือกระบวนการจะดำเนินการใกล้เปลวไฟเปิด ก็ไม่มีการรับประกันอย่างแน่นอนว่าจะไม่เกิดการปนเปื้อนในระหว่างการแนะนำสายเซลล์ [8]. ความเสี่ยงเหล่านี้เน้นย้ำถึงความสำคัญของการตรวจสอบวัตถุดิบอย่างละเอียดก่อนที่จะนำเข้าสู่ระบบ.
ความเสี่ยงในการดำเนินงานของเครื่องปฏิกรณ์ชีวภาพ
การดำเนินงานประจำวันภายในเครื่องปฏิกรณ์ชีวภาพมีโอกาสเกิดการปนเปื้อนมากมาย การสุ่มตัวอย่างด้วยมือมีความเสี่ยงสูงเป็นพิเศษ เนื่องจากทุกจุดเข้าถึงเพิ่มโอกาสในการนำสิ่งปนเปื้อนเข้ามา [1].ปัญหาต่าง ๆ เช่น ซีลที่ถูกทำลาย, โอริงที่เสียหาย, หรือการปิดที่ไม่ได้ผ่านการฆ่าเชื้อ ยิ่งเพิ่มความเสี่ยงมากขึ้น [4][8]. นอกจากนี้ การถ่ายโอนวัสดุจากพื้นที่ที่มีการจัดระดับต่ำกว่าไปยังโซนที่มีการจัดระดับสูงกว่าโดยไม่ผ่านการฆ่าเชื้ออย่างถูกต้องเป็นอีกหนึ่งช่องโหว่ที่สำคัญ [7].
การรักษาการควบคุมสิ่งแวดล้อมอย่างเข้มงวดเป็นสิ่งที่ไม่สามารถต่อรองได้ ความแตกต่างของความดันระหว่างพื้นที่ห้องสะอาดควรถูกตรวจสอบอย่างต่อเนื่อง และการเปลี่ยนแปลงที่ผิดปกติใด ๆ ต้องถูกตรวจสอบทันที [4]. ในพื้นที่วิกฤต Class 100 (ISO 5) จำนวนอนุภาคสำหรับขนาด ≥0.5 μm ต้องคงอยู่ต่ำกว่า 3,520 อนุภาคต่อหนึ่งลูกบาศก์เมตรระหว่างการดำเนินงาน [4].นอกจากนี้ การพ่นละอองน้ำยาฆ่าเชื้อหรือแอลกอฮอล์ไอโซโพรพิล 70% ใกล้กับเครื่องเก็บตัวอย่างอากาศสามารถเพิ่มการอ่านค่าฝุ่นละอองได้ ในขณะที่การควบแน่นบนตัวกรองก๊าซอาจทำให้เกิดการอุดตันหรือส่งเสริมการเจริญเติบโตของจุลินทรีย์ [4][7].
ความเสี่ยงในการดำเนินงานเหล่านี้เน้นย้ำถึงความสำคัญของการใช้วิธีการทดสอบความปลอดเชื้อที่เข้มงวดเพื่อปกป้องกระบวนการของไบโอรีแอคเตอร์
วิธีการทดสอบความปลอดเชื้อสำหรับไบโอรีแอคเตอร์
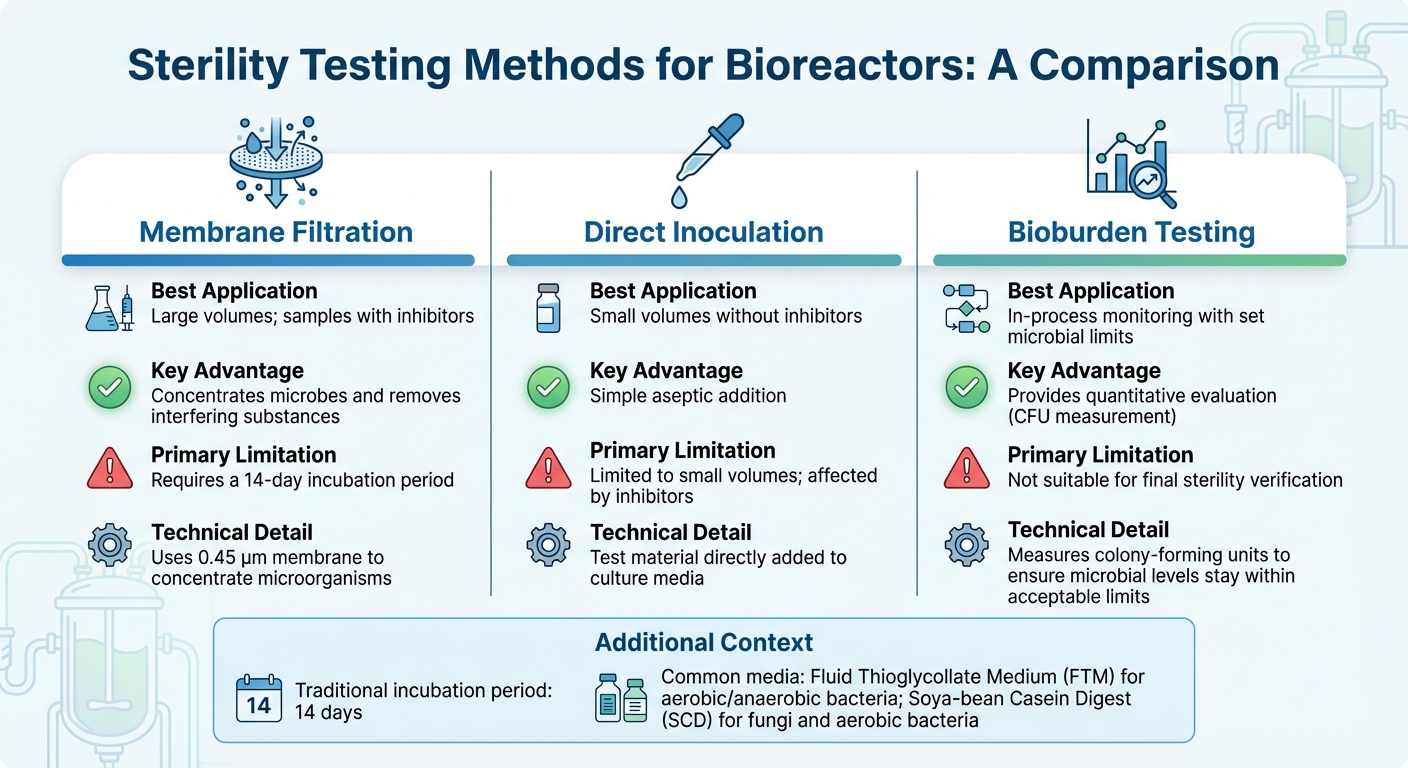
การเปรียบเทียบวิธีการทดสอบความปลอดเชื้อสำหรับไบโอรีแอคเตอร์
การเลือกวิธีทดสอบความปลอดเชื้อที่เหมาะสมสำหรับไบโอรีแอคเตอร์ขึ้นอยู่กับปัจจัยต่างๆ เช่น ขนาดของไบโอรีแอคเตอร์ ขั้นตอนการผลิตและความท้าทายในการขยายขนาด และองค์ประกอบของตัวอย่าง - โดยเฉพาะเมื่อมีสารยับยั้งอยู่ สำหรับการใช้งานในอุตสาหกรรมส่วนใหญ่ การกรองผ่านเยื่อเมมเบรน เป็นวิธีที่นิยมใช้ [3].ในขณะเดียวกัน เทคนิคทางโมเลกุลเช่น PCR เสนอการตรวจจับที่รวดเร็วขึ้นสำหรับสารปนเปื้อนเฉพาะ ด้านล่างนี้ เราจะสำรวจวิธีการที่ปรับให้เหมาะสมกับการผลิตเนื้อสัตว์ที่เพาะเลี้ยง โดยจัดการกับความท้าทายที่ไม่เหมือนใครของการทดสอบตัวอย่างทั้งขนาดใหญ่และขนาดเล็ก
สำหรับตัวอย่างปริมาณมาก ซึ่งพบได้ทั่วไปในเครื่องปฏิกรณ์ชีวภาพขนาดอุตสาหกรรม การกรองผ่านเยื่อเมมเบรน ใช้เยื่อเมมเบรนขนาด 0.45 µm เพื่อรวมจุลินทรีย์เข้าด้วยกัน เพิ่มความไวในการตรวจจับ [10] วิธีนี้มีประสิทธิภาพเป็นพิเศษสำหรับตัวอย่างที่มีสารปฏิชีวนะ เนื่องจากการล้างสามารถกำจัดสารยับยั้งก่อนการบ่ม ในทางกลับกัน การฉีดเชื้อโดยตรง ซึ่งวัสดุทดสอบจะถูกเพิ่มลงในสื่อเพาะเลี้ยงโดยตรง ทำงานได้ดีกว่าสำหรับปริมาณตัวอย่างที่น้อยกว่า แต่มีปัญหาในการจัดการกับสารยับยั้ง หลังจากรวมตัวอย่างและกำจัดสารยับยั้งแล้ว การบ่มและการตรวจสอบความถูกต้องจะช่วยให้มั่นใจในความถูกต้องของผลลัพธ์
การทดสอบความปลอดเชื้อแบบดั้งเดิมต้องอาศัยระยะเวลาการบ่ม 14 วันเพื่อยืนยันการเจริญเติบโตของจุลินทรีย์ด้วยการมองเห็น [3]. สื่อที่ใช้กันทั่วไปได้แก่ Fluid Thioglycollate Medium (FTM) สำหรับแบคทีเรียที่ต้องการออกซิเจนและไม่ต้องการออกซิเจน และ Soya-bean Casein Digest (SCD) สำหรับเชื้อราและแบคทีเรียที่ต้องการออกซิเจน ก่อนทำการทดสอบความปลอดเชื้อใด ๆ จำเป็นต้องตรวจสอบให้แน่ใจว่าผลิตภัณฑ์ไม่ยับยั้งการเจริญเติบโตของจุลินทรีย์ผ่านการทดสอบการยับยั้งแบคทีเรียและเชื้อรา
สำหรับการตรวจสอบกระบวนการอย่างต่อเนื่อง การทดสอบปริมาณจุลินทรีย์ (bioburden) เชิงปริมาณ เสนอวิธีแก้ปัญหาที่ใช้งานได้จริงมากกว่าการทดสอบความปลอดเชื้อแบบไบนารี โดยเฉพาะในการผลิตเนื้อสัตว์ที่เพาะเลี้ยง ไม่เหมือนกับการทดสอบความปลอดเชื้อที่ให้ผลลัพธ์แบบผ่าน/ไม่ผ่าน การทดสอบปริมาณจุลินทรีย์จะวัดหน่วยสร้างอาณานิคม (CFU) เพื่อให้แน่ใจว่าระดับจุลินทรีย์อยู่ในขอบเขตที่ยอมรับได้วิธีการนี้สอดคล้องกับมาตรฐานอาหารที่เกิดขึ้นใหม่ โดยสร้างสมดุลระหว่างการควบคุมทางเภสัชกรรมที่เข้มงวดและความเป็นจริงทางเศรษฐกิจของการผลิตอาหารขนาดใหญ่
สำหรับอุปกรณ์ทดสอบความปลอดเชื้อและโซลูชันไบโอรีแอคเตอร์ ผู้เชี่ยวชาญด้านเนื้อสัตว์ที่เพาะเลี้ยงสามารถหันไปหาผู้ให้บริการที่เชื่อถือได้ เช่น
| วิธีการ | การใช้งานที่ดีที่สุด | ข้อได้เปรียบหลัก | ข้อจำกัดหลัก |
|---|---|---|---|
| การกรองด้วยเมมเบรน | ปริมาณมาก; ตัวอย่างที่มีสารยับยั้ง | เข้มข้นจุลินทรีย์และกำจัดสารรบกวน[3] | ต้องใช้ระยะเวลาบ่ม 14 วัน[3] |
| การฉีดโดยตรง | ปริมาณน้อยโดยไม่มีสารยับยั้ง | การเติมเชื้อแบบปลอดเชื้อที่ง่าย | จำกัดเฉพาะปริมาณน้อย; ได้รับผลกระทบจากสารยับยั้ง[3] |
| การทดสอบปริมาณจุลินทรีย์ | การตรวจสอบระหว่างกระบวนการด้วยขีดจำกัดจุลินทรีย์ที่กำหนด | ให้การประเมินเชิงปริมาณ | ไม่เหมาะสำหรับการตรวจสอบความปลอดเชื้อขั้นสุดท้าย [3] |
การตรวจสอบแบบเรียลไทม์และการรับรองความปลอดเชื้อ
การพึ่งพาการทดสอบความปลอดเชื้อแบบดั้งเดิมที่ใช้เวลา 14 วันมีความเสี่ยงที่จะสูญเสียทั้งชุดหากพบการปนเปื้อนช้าเกินไปการตรวจสอบแบบเรียลไทม์นำเสนอวิธีการแก้ปัญหาเชิงรุกโดยการเฝ้าดูพารามิเตอร์กระบวนการที่สำคัญในขณะที่เกิดขึ้น ซึ่งช่วยให้สามารถดำเนินการได้ทันทีหากมีสิ่งผิดปกติเกิดขึ้น ในการผลิตเนื้อสัตว์ที่เพาะเลี้ยง ซึ่งการทำงานของเครื่องปฏิกรณ์ชีวภาพใช้เวลาหลายสัปดาห์และใช้สื่อการเจริญเติบโตที่มีค่าใช้จ่ายสูง การตรวจพบการปนเปื้อนในระยะแรกสามารถประหยัดเงินได้หลายพันปอนด์และหลีกเลี่ยงความล่าช้าในการผลิต โดยการรวมข้อมูลแบบเรียลไทม์กับการทดสอบความปลอดเชื้อแบบดั้งเดิม ผู้ผลิตสามารถเชื่อมช่องว่างระหว่างการยืนยันที่ล่าช้าและการแทรกแซงอย่างรวดเร็ว
การตรวจสอบด้วยเซ็นเซอร์
ตัวบ่งชี้ที่สำคัญเช่นระดับออกซิเจนที่ละลาย (DO) และระดับ pH สามารถส่งสัญญาณการปนเปื้อนได้ในระยะแรก เมื่อแบคทีเรียหรือเชื้อราบุกเข้าไปในเครื่องปฏิกรณ์ชีวภาพ พวกมันจะบริโภคออกซิเจนอย่างรวดเร็ว - ทำให้ระดับ DO ลดลง - และปล่อยกรดเมตาบอลิกที่ลด pH ลงอย่างมาก [12] การเปลี่ยนแปลงเหล่านี้สามารถตรวจพบได้หลายชั่วโมงก่อนที่การปนเปื้อนจะปรากฏให้เห็นได้ชัดเจนในขณะที่การทดสอบความปลอดเชื้อแบบดั้งเดิมยืนยันผลลัพธ์หลังจากกระบวนการเสร็จสิ้น การตรวจสอบแบบเรียลไทม์ทำหน้าที่เป็นการป้องกัน เพื่อให้แน่ใจว่ากระบวนการดำเนินไปตามแผนและจัดการกับความเสี่ยงของการปนเปื้อนล่วงหน้า
การวิเคราะห์ก๊าซที่ปล่อยออกมา โดยใช้แมสสเปกโตรเมตรีแบบเซกเตอร์แม่เหล็ก วัดระดับออกซิเจนและคาร์บอนไดออกไซด์ในก๊าซไอเสียของไบโอรีแอคเตอร์อย่างต่อเนื่อง ในการศึกษาการปนเปื้อนที่ควบคุมได้ วิธีนี้สามารถระบุการเจริญเติบโตของจุลินทรีย์ภายใน 22.4 ชั่วโมงผ่านการเปลี่ยนแปลงของออกซิเจน ในขณะที่การตรวจจับด้วยค่า pH ล่าช้ากว่าอยู่ที่ 25.8 ชั่วโมง [13] ระบบเซกเตอร์แม่เหล็กให้การวัดออกซิเจนที่แม่นยำด้วยความแม่นยำสูงถึง 0.003% (v/v) ตลอดเจ็ดวัน ซึ่งมีประสิทธิภาพดีกว่าตัวตรวจจับพาราแมกเนติกแบบดั้งเดิมที่มีความแม่นยำเพียง ±0.2% (v/v) [13].
เซ็นเซอร์สเปกโตรสโกปี ให้การตรวจสอบแบบไม่รุกล้ำผ่านผนังของไบโอรีแอคเตอร์แบบใช้ครั้งเดียว ซึ่งมีความสำคัญต่อการรักษาความปลอดเชื้อUV-vis spectroscopy can detect membrane damage by measuring light absorption at 350–400 nm, while leaked intracellular materials appear at 800–900 nm [14]. Capacitance probes, the only commercially available sensors designed to measure viable cell density, achieve this by detecting changes in membrane polarisation [14]. For facilities managing multiple bioreactors, tools like the Rapid Multi-Stream Sampler can monitor up to 16 gas streams simultaneously [13].
These sensor-based systems, combined with environmental controls, such as HVAC contamination prevention, create a robust defence against contamination.
Environmental and Pressure Controls
Maintaining positive pressure between cleanroom zones is crucial for preventing contaminants from entering [3].ระบบแรงดันบวก เมื่อจับคู่กับการกรอง HEPA จะทำหน้าที่เป็นเกราะป้องกันทางกายภาพต่อการบุกรุกของจุลินทรีย์ สัญญาณเตือนที่ได้ยินหรือมองเห็นบนตัวกรอง HEPA สามารถแจ้งเตือนพนักงานได้ทันทีหากแรงดันลดลงต่ำกว่าระดับที่ยอมรับได้ [3].
การนับอนุภาคที่ไม่สามารถมีชีวิตได้ เป็นอีกชั้นหนึ่งของการป้องกัน เครื่องนับอนุภาคเลเซอร์ตรวจสอบอย่างต่อเนื่องว่าสภาพแวดล้อมเป็นไปตามมาตรฐานความสะอาดของอากาศ ISO ระหว่างการดำเนินงาน โดยการตรวจสอบอนุภาคทั้ง 0.5 µm และ 5.0 µm อุปกรณ์เหล่านี้รับรองว่าคุณภาพอากาศยังคงอยู่ในขอบเขตที่กำหนด [7]. หากเกิดการเบี่ยงเบนที่ไม่คาดคิด เช่น การลดลงของ DO อย่างกะทันหันหรือความผันผวนของ pH การแยกตัวของไบโอรีแอคเตอร์ที่ได้รับผลกระทบและการหยุดการเติมอาหารทันทีสามารถป้องกันการแพร่กระจายของการปนเปื้อนได้ [12].
สำหรับการจัดหาตัวเซ็นเซอร์และอุปกรณ์เฉพาะทางที่ปรับแต่งให้เหมาะสมกับการดำเนินงานเนื้อสัตว์ที่เพาะเลี้ยง บริษัทต่างๆ เช่น
เทคโนโลยีใหม่ในการทดสอบความปลอดเชื้อ
วิธีการทดสอบความปลอดเชื้อแบบดั้งเดิมมักจะไม่เพียงพอเนื่องจากระยะเวลาการบ่ม 14 วันที่ยาวนานและการพึ่งพาการสุ่มตัวอย่างด้วยตนเอง ซึ่งอาจทำให้เกิดช่องว่างในการตรวจจับได้ เทคโนโลยีใหม่กำลังเข้ามาแก้ไขปัญหาเหล่านี้ โดยเสนอการตรวจจับการปนเปื้อนที่รวดเร็วและแม่นยำยิ่งขึ้น ซึ่งมีความสำคัญอย่างยิ่งในการผลิตเนื้อสัตว์ที่เพาะเลี้ยง ซึ่งต้นทุนสูงของสื่อการเจริญเติบโตและระยะเวลาการเพาะเลี้ยงที่ยาวนานทำให้การปนเปื้อนในระยะท้ายเป็นฝันร้ายทางการเงิน
ระบบการตรวจสอบที่ขับเคลื่อนด้วย AI
ปัญญาประดิษฐ์กำลังเปลี่ยนแปลงการตรวจจับการปนเปื้อนโดยการวิเคราะห์ข้อมูลแบบเรียลไทม์เพื่อระบุการบุกรุกของจุลินทรีย์เมื่อแบคทีเรียบุกรุกเข้าไปในเครื่องปฏิกรณ์ชีวภาพ พวกมันจะบริโภคออกซิเจนและผลิตกรดเมตาบอลิก ทำให้ระดับออกซิเจนละลายและค่า pH ลดลงอย่างเห็นได้ชัด ระบบ AI สามารถตรวจจับ การเบี่ยงเบนในการบริโภคออกซิเจนและสารอาหาร โดยการแจ้งเตือนการปนเปื้อนที่อาจเกิดขึ้นได้เร็วกว่าการทดสอบ การปนเปื้อนทางชีวภาพและโปรโตคอลการปลอดเชื้อ แบบดั้งเดิมที่สามารถให้ผลลัพธ์ [12].
แพลตฟอร์ม AI เหล่านี้ยังรวมโมเดลทางคณิตศาสตร์เพื่อ ระบุเวลาที่เกิดการปนเปื้อนอย่างแม่นยำ และจำลองการเติบโตของประชากรจุลินทรีย์เมื่อเวลาผ่านไป ซึ่งช่วยให้ผู้ปฏิบัติงานสามารถติดตามการปนเปื้อนไปยังแหล่งที่มา ไม่ว่าจะเป็นแหล่งอาหารที่มีปัญหา ความผิดพลาดในการดำเนินงาน หรือปัญหาอุปกรณ์ เทคนิคเช่นการวิเคราะห์ความน่าจะเป็นของปัวซองยังช่วยเพิ่มความแม่นยำในการทดสอบการปนเปื้อนทางชีวภาพ ลดโอกาสของผลลบเท็จ [12].
"แบบจำลองทางคณิตศาสตร์ช่วยในการประมาณเวลาการปนเปื้อนและการเจริญเติบโตของจุลินทรีย์ ทำให้การติดตามการปนเปื้อนมีประสิทธิภาพมากขึ้น" - Naveenganesh Muralidharan, ผู้จัดการอาวุโส, MSAT, AGC Biologics [12]
เมื่อมีการแจ้งเตือนความผิดปกติ การดำเนินการทันที - เช่น การแยกไบโอรีแอคเตอร์และหยุดการเติมอาหารทั้งหมด - สามารถป้องกันปัญหาจากการแพร่กระจาย [12]. การใช้วิธีการอย่างเป็นระบบที่รวมถึงการทดสอบการปนเปื้อน การระบุโมเลกุล และการวิเคราะห์อัตราการเจริญเติบโตเป็นสิ่งจำเป็นสำหรับการระบุสาเหตุที่แท้จริงและการดำเนินการแก้ไข เครื่องมือ AI เหล่านี้เชื่อมช่องว่างระหว่างวิธีการแบบดั้งเดิมและการจัดการการปนเปื้อนเชิงรุก.
การฆ่าเชื้อด้วยพลาสมาเย็น
เทคโนโลยีพลาสมาเย็นเสนอทางเลือกการฆ่าเชื้อที่ไม่ใช้ความร้อนซึ่งเหมาะสมอย่างยิ่งสำหรับการผลิตเนื้อสัตว์ที่เพาะเลี้ยง.ทำงานที่หรือใกล้เคียงกับอุณหภูมิห้อง มันเหมาะสำหรับการฆ่าเชื้อ ชิ้นส่วนที่ไวต่อความร้อน เช่น ชิ้นส่วนของไบโอรีแอคเตอร์, เซ็นเซอร์, และพลาสติก ที่ไม่สามารถทนต่อความร้อนของการฆ่าเชื้อด้วยความร้อนแบบดั้งเดิม [15][16][17]. วิธีนี้ใช้อนุพันธ์ออกซิเจนและไนโตรเจนที่มีปฏิกิริยา พร้อมกับแสงยูวี เพื่อทำลายเยื่อหุ้มเซลล์และดีเอ็นเอของจุลินทรีย์ มันมีประสิทธิภาพต่อสารปนเปื้อนหลากหลายชนิด รวมถึงสปอร์ของแบคทีเรีย (Bacillus, Clostridium), เชื้อรา, ไวรัส, และแม้กระทั่งพรีออน [15][17].
หนึ่งในคุณสมบัติเด่นของพลาสมาเย็นคือมันไม่ทิ้ง สารตกค้างที่เป็นพิษ. เมื่อปิดเครื่องแล้ว อนุพันธ์ที่มีปฏิกิริยาจะกลับคืนสู่สภาพออกซิเจนอย่างรวดเร็ว ทำให้ไม่จำเป็นต้องมีขั้นตอนการดูดซับ [16][18].มันยังประหยัดพลังงาน โดยต้องการเพียงเต้าเสียบไฟฟ้ามาตรฐานแทนแหล่งความร้อนที่ใช้เชื้อเพลิงฟอสซิล [15][16] ตัวอย่างเช่น การศึกษาพบว่า พลาสมาเย็นสามารถลด >5 log ของสปอร์ Bacillus cereus ภายใน 25 นาที ที่กำลังไฟ 300W [15].
อย่างไรก็ตาม เทคโนโลยีนี้ไม่ได้ปราศจากข้อจำกัด ผลของการฆ่าเชื้อส่วนใหญ่จะอยู่ที่ ระดับผิวหน้า ซึ่งหมายความว่ามันมีปัญหาในการเจาะเข้าไปในรูปทรงที่ซับซ้อนที่จุลินทรีย์อาจซ่อนตัวอยู่ในรอยแตกหรือร่อง [15][16] ปริมาณโปรตีนหรือไขมันสูงในสภาพแวดล้อมของเครื่องปฏิกรณ์ชีวภาพยังสามารถป้องกันจุลินทรีย์โดยการเก็บกักชนิดที่ทำปฏิกิริยา ลดประสิทธิภาพของการฆ่าเชื้อ [15][18]
| คุณสมบัติ | พลาสมาเย็น |
|---|---|
| ข้อดี | ไม่ใช้ความร้อน, ไม่เป็นพิษ, ประหยัดพลังงาน, ไม่มีสารตกค้าง, รวดเร็ว[16] |
| ข้อจำกัด | การแทรกซึมจำกัด, ประสิทธิภาพลดลงในรูปทรงที่ซับซ้อน[15][16] |
ระบบตรวจจับภาพอัตโนมัติ
การเพิ่มระบบภาพอัตโนมัติเป็นเครื่องมือที่ทรงพลังสำหรับการตรวจจับการปนเปื้อนแบบเรียลไทม์ ระบบเหล่านี้ให้ข้อมูลเชิงลึกทางสัณฐานวิทยาอย่างละเอียดเกี่ยวกับการเจริญเติบโตของเซลล์ซึ่งมีความสำคัญต่อการระบุรูปแบบการปนเปื้อนเมื่อเกิดขึ้น[19].ไม่เหมือนกับกล้องจุลทรรศน์แบบออฟไลน์ดั้งเดิม - ซึ่งต้องการการเก็บตัวอย่างและการย้อมสีด้วยมือ - การถ่ายภาพอัตโนมัติสามารถผสานเข้ากับการตั้งค่าการตรวจสอบออนไลน์หรือที่สายได้อย่างราบรื่น สิ่งนี้ช่วยให้ผู้ปฏิบัติงานสามารถตรวจสอบชีวมวลและสุขภาพของเซลล์โดยไม่กระทบต่อความปลอดเชื้อ [19].
โดยการลดการแทรกแซงด้วยมือ ระบบเหล่านี้ช่วยลดข้อผิดพลาดของมนุษย์และปรับปรุงความสามารถในการทำซ้ำในกระบวนการเพาะเลี้ยง [19]. อัลกอริธึมการประมวลผลภาพขั้นสูงสามารถติดตามความก้าวหน้าของการหมัก ปรับปรุงการผลิตเมตาโบไลต์ และรับรองความสม่ำเสมอ - ซึ่งเป็นปัจจัยสำคัญเมื่อขยายกระบวนการทางชีวภาพ [19].
"การมีอยู่ของเทคนิคการเก็บตัวอย่างขั้นสูงที่รวมกับเครื่องมือวัดอัตโนมัติ...อาจลดเวลาที่จำเป็นสำหรับการเลือกสายพันธุ์ การพัฒนากระบวนการ และการควบคุมกระบวนการได้อย่างมากโดยลดจำนวนขั้นตอนในกระบวนการผลิต/การเพาะเลี้ยง โดยเฉพาะขั้นตอนที่ทำด้วยมือ และลดการแพร่กระจายของข้อผิดพลาด" - A.C. Veloso และ E.C. Ferreira, มหาวิทยาลัย Minho [19]
แม้จะมีข้อดีของพวกเขา การรวมระบบเหล่านี้ไม่ใช่เรื่องง่ายเสมอไป การเพาะเลี้ยงเซลล์มีความซับซ้อน วัตถุดิบมีความหลากหลาย และเซ็นเซอร์ต้องทนต่อวิธีการฆ่าเชื้อที่รุนแรง เช่น การใช้ไอน้ำหรือการฉายรังสีแกมมา [19]. สำหรับบริษัทที่ต้องการนำเทคโนโลยีเหล่านี้มาใช้ แพลตฟอร์มเช่น
สรุป
การรับรองความปลอดเชื้อของเครื่องปฏิกรณ์ชีวภาพในการผลิตเนื้อสัตว์เพาะเลี้ยงไม่ใช่เรื่องง่าย แต่กลยุทธ์การทดสอบความปลอดเชื้อแบบบูรณาการสามารถทำให้เป็นไปได้กลยุทธ์นี้ผสมผสานวิธีการแบบดั้งเดิม เช่น การกรองเมมเบรนสำหรับปริมาณตัวอย่างที่มากขึ้นและการฉีดเชื้อโดยตรงสำหรับตัวอย่างที่น้อยกว่า กับเครื่องมือโมเลกุลสมัยใหม่ เช่น PCR และ qPCR สำหรับการคัดกรองเชื้อโรคอย่างรวดเร็ว นอกจากนี้ การตรวจสอบสิ่งแวดล้อม - ผ่านการเก็บตัวอย่างอากาศและการเช็ดพื้นผิว - เพิ่มการป้องกันเพิ่มเติม โดยจัดการกับ ความเสี่ยงของการปนเปื้อนในระบบ HVAC จับการปนเปื้อนที่อาจเกิดขึ้นก่อนที่จะส่งผลกระทบต่อภาชนะผลิต [11].
การเลือกวิธีการทดสอบขึ้นอยู่กับปัจจัยต่างๆ เช่น ขนาดตัวอย่าง การมีอยู่ของสารที่อาจรบกวนผลลัพธ์ และว่ามุ่งเน้นไปที่การตรวจสอบความปลอดเชื้อทั้งหมดหรือเพียงแค่การตรวจสอบปริมาณจุลินทรีย์ การเก็บตัวอย่างจากหลายจุดในเครื่องปฏิกรณ์ชีวภาพ - ด้านบน กลาง และล่าง - ช่วยสร้างโปรไฟล์จุลินทรีย์ที่ครอบคลุมและลดโอกาสที่จะพลาดการปนเปื้อนในท้องถิ่น [1].สิ่งนี้มีความสำคัญอย่างยิ่งเนื่องจากความเสี่ยงของการปนเปื้อนในการผลิตเนื้อสัตว์ที่เพาะเลี้ยงนั้นสูงกว่าการผลิตยาชีวภาพอย่างเห็นได้ชัด ซึ่งเน้นย้ำถึงความจำเป็นในการใช้โปรโตคอลความปลอดเชื้อที่เข้มงวด [6].
กุญแจสำคัญในการรักษา ความปลอดเชื้อของสื่อในเครื่องปฏิกรณ์ชีวภาพ คือการจัดหาอุปกรณ์ที่เหมาะสม เครื่องมือเช่นระบบสุ่มตัวอย่างปลอดเชื้อที่มีฝาปิดที่ผ่านการฆ่าเชื้อแล้วและตัวกรอง HEPA ที่สามารถดักจับอนุภาคขนาดใหญ่กว่า 0.3 μm ได้ถึง 99.97% เป็นสิ่งจำเป็น [4]. แพลตฟอร์มเช่น
เมื่ออุตสาหกรรมเติบโตขึ้น แนวทางความปลอดเชื้อแบบผสมผสานก็มีความสำคัญมากขึ้นเรื่อยๆการใช้การควบคุมระดับเภสัชกรรมในช่วงต้นของการเพาะเมล็ด ในขณะที่ใช้มาตรฐานระดับอาหารสำหรับการผลิตขนาดใหญ่ เป็นการสร้างสมดุลระหว่างความปลอดภัยและความคุ้มค่า [5][6] มาตรการแบบบูรณาการเหล่านี้จะเป็นรากฐานของการผลิตเนื้อสัตว์เพาะเลี้ยงที่ปลอดภัยและมีประสิทธิภาพเมื่อสาขานี้ยังคงก้าวหน้า
คำถามที่พบบ่อย
สาเหตุหลักของการปนเปื้อนในระบบเครื่องปฏิกรณ์ชีวภาพที่ใช้ในการผลิตเนื้อสัตว์เพาะเลี้ยงคืออะไร?
การปนเปื้อนในระบบเครื่องปฏิกรณ์ชีวภาพเกิดขึ้นเมื่อสภาพแวดล้อมที่ปลอดเชื้อถูกทำลายหรือเมื่อสื่อที่อุดมด้วยสารอาหารสร้างสภาพแวดล้อมที่เหมาะสมสำหรับจุลินทรีย์ในการเจริญเติบโต ซึ่งอาจเกิดจากหลายปัจจัย เช่น การรั่วไหลระหว่างการสุ่มตัวอย่าง การบำรุงรักษา หรือการเก็บเกี่ยวเซลล์; ตัวกรองก๊าซที่เสียหายหรืออุดตัน; การปนเปื้อนที่มีอยู่แล้วในสื่อการเจริญเติบโต; หรือการเปิดชั่วคราวที่เกิดขึ้นเมื่อทำการติดตั้งหรือบำรุงรักษาเซ็นเซอร์นอกจากนี้ อุปกรณ์ที่สึกหรอสามารถปล่อยอนุภาคไมโครพลาสติก ซึ่งอาจเป็นที่อยู่อาศัยของจุลินทรีย์ได้
ในการผลิตเนื้อสัตว์ที่เพาะเลี้ยง แม้แต่การปนเปื้อนที่เล็กที่สุดก็สามารถทำลายทั้งความปลอดภัยและผลผลิตของชุดการผลิตได้ เพื่อลดความเสี่ยงเหล่านี้ การลงทุนในอุปกรณ์คุณภาพสูง เช่น ตัวกรองปลอดเชื้อ เครื่องปฏิกรณ์ชีวภาพ และชุดเซ็นเซอร์ที่เป็นไปตามมาตรฐานปลอดเชื้อที่เข้มงวดจึงเป็นสิ่งสำคัญ แพลตฟอร์มอย่าง
ปัญญาประดิษฐ์ช่วยเพิ่มประสิทธิภาพการทดสอบความปลอดเชื้อในเครื่องปฏิกรณ์ชีวภาพได้อย่างไร
ระบบที่ขับเคลื่อนด้วย AI กำลังเปลี่ยนแปลงการทดสอบความปลอดเชื้อในเครื่องปฏิกรณ์ชีวภาพสำหรับเนื้อสัตว์ที่เพาะเลี้ยง โดยให้ข้อมูลเชิงลึกแบบเรียลไทม์ผ่านการตรวจสอบอย่างต่อเนื่อง ใช้เซ็นเซอร์ชีวภาพขั้นสูง ระบบเหล่านี้ติดตามปัจจัยสำคัญเช่น pH, ออกซิเจนละลาย, และเมตาบอไลต์ที่จำเป็นเช่นกลูโคสและกรดอะมิโน ทั้งหมดนี้เกิดขึ้นโดยไม่ต้องตรวจสอบด้วยตนเอง ซึ่งช่วยลดความเสี่ยงของการปนเปื้อนอย่างมาก
สิ่งที่ทำให้ระบบเหล่านี้แตกต่างคือความสามารถในการวิเคราะห์ข้อมูลโดยใช้อัลกอริทึมที่เปรียบเทียบการอ่านค่ากับมาตรฐานความปลอดเชื้อที่กำหนดไว้ ซึ่งหมายความว่าพวกเขาสามารถตรวจจับสัญญาณการเจริญเติบโตของจุลินทรีย์ที่เล็กที่สุดได้เร็วกว่าวิธีการแบบดั้งเดิม นอกเหนือจากการตรวจจับแล้ว การวิเคราะห์เชิงคาดการณ์ยังมีบทบาทในการระบุความเสี่ยงที่อาจเกิดขึ้น เช่น ปัญหาระหว่างการติดตั้งเซ็นเซอร์หรือการเข้าผ่านพอร์ต ระบบเหล่านี้ยังแนะนำมาตรการแก้ไขเพื่อช่วยให้ผู้ผลิตหลีกเลี่ยงการสูญเสียแบทช์ที่มีค่าใช้จ่ายสูง
การใช้กล้องจุลทรรศน์ที่ขับเคลื่อนด้วย AI เพิ่มประสิทธิภาพอีกชั้นหนึ่งโดยการแยกแยะระหว่างเซลล์ที่แข็งแรงและสารปนเปื้อนได้ทันที เร่งกระบวนการตรวจสอบความปลอดเชื้อสำหรับผู้ผลิต แพลตฟอร์มเช่น
ความท้าทายใดที่จำกัดการใช้การฆ่าเชื้อด้วยพลาสมาเย็นในเครื่องปฏิกรณ์ชีวภาพสำหรับการผลิตเนื้อสัตว์ที่เพาะเลี้ยง?
การฆ่าเชื้อด้วยพลาสมาเย็นมีประสิทธิภาพในการทำลายจุลินทรีย์ แต่มีความท้าทายหลายประการเมื่อใช้กับเครื่องปฏิกรณ์ชีวภาพในการผลิตเนื้อสัตว์ที่เพาะเลี้ยง ปัญหาหลักคือความลึกของการแทรกซึมที่จำกัดของสารที่เกิดจากพลาสมา ซึ่งทำให้ยากต่อการฆ่าเชื้อในปริมาณมากหรือสื่อที่บรรจุแน่นอย่างทั่วถึง นอกจากนี้ การทำให้ครอบคลุมพลาสมาอย่างสม่ำเสมอทั่วทั้งเครื่องปฏิกรณ์จะยากขึ้นเมื่อขนาดของระบบเพิ่มขึ้น
การขยายระบบพลาสมาเย็นจากการตั้งค่าในห้องปฏิบัติการไปยังเครื่องปฏิกรณ์ชีวภาพในระดับการค้าเพิ่มอุปสรรคเพิ่มเติมเครื่องปฏิกรณ์ขนาดใหญ่ต้องการอัตราส่วนพลังงานต่อปริมาตรที่สูงขึ้น ซึ่งอาจส่งผลให้เวลาการฆ่าเชื้อไม่เป็นไปตามที่คาดหวัง ระบบพลาสมาเย็นหลายระบบยังทำงานภายใต้สภาวะสุญญากาศหรือพึ่งพาแก๊สที่มีปฏิกิริยา ซึ่งเพิ่มความซับซ้อนในแง่ของความปลอดภัย การปฏิบัติตามกฎระเบียบ และการออกแบบอุปกรณ์ ปัจจัยเหล่านี้ทำให้วิธีการนี้ไม่เหมาะสำหรับเครื่องปฏิกรณ์ชีวภาพขนาดใหญ่ที่จำเป็นในกระบวนการผลิตเนื้อสัตว์เพาะเลี้ยงในเชิงพาณิชย์ อีกหนึ่งข้อกังวลคือความเสียหายที่อาจเกิดจากอนุพันธ์ออกซิเจนและไนโตรเจนที่มีปฏิกิริยา (RONS) ซึ่งเป็นกุญแจสำคัญในการทำลายจุลินทรีย์ อนุพันธ์เหล่านี้สามารถทำลายเซลล์สัตว์เลี้ยงลูกด้วยนมที่ไวต่อการกระทบหรือทำให้ส่วนประกอบของสื่อเสื่อมสภาพได้ จำเป็นต้องมีการปรับแต่งอย่างระมัดระวังเพื่อรักษาความมีชีวิตของเซลล์ ดังนั้น พลาสมาเย็นมักถูกใช้ร่วมกับเทคนิคการฆ่าเชื้ออื่น ๆ แทนที่จะใช้เป็นวิธีการเดียว











