การเก็บรักษาในสภาพแช่แข็ง เป็นกระบวนการแช่แข็งและเก็บรักษาเซลล์ที่มีชีวิตที่อุณหภูมิต่ำมากเพื่อรักษาความมีชีวิตของพวกมันในระยะยาว วิธีนี้มีความสำคัญต่อการผลิตเนื้อที่เพาะเลี้ยง โดยมั่นใจได้ว่าเซลล์มีเสถียรภาพและสม่ำเสมอ และป้องกันการสูญเสียจากการปนเปื้อนหรือความล้มเหลวของอุปกรณ์ ขั้นตอนสำคัญประกอบด้วย:
- การเตรียม: เก็บเซลล์ในระหว่างช่วงการเจริญเติบโต ตรวจสอบความมีชีวิต (ตั้งเป้า ≥90%) และเตรียมในสื่อแช่แข็งที่มีสารป้องกันการแช่แข็ง เช่น DMSO หรือกลีเซอรีน.
- การแช่แข็ง: ใช้อัตราการทำความเย็นที่ควบคุม (-1°C ถึง -3°C ต่อ นาที) เพื่อป้องกันความเสียหายจากผลึกน้ำแข็ง เก็บเซลล์ในไอน้ำไนโตรเจนเหลว (-135°C ถึง -190°C) เพื่อการเก็บรักษาระยะยาว.
- การละลาย: ละลายเซลล์อย่างรวดเร็วในอ่างน้ำที่อุณหภูมิ 37°C เพื่อลดความเป็นพิษของสารป้องกันการแช่แข็ง จากนั้นย้ายไปยังสื่อการเจริญเติบโตเพื่อการฟื้นตัว.
- การควบคุมคุณภาพ: ระบุขวดอย่างถูกต้อง, ตรวจสอบสภาพการเก็บรักษา, และทดสอบความมีชีวิตหลังการละลายเพื่อให้แน่ใจว่าการเก็บรักษาประสบความสำเร็จ.
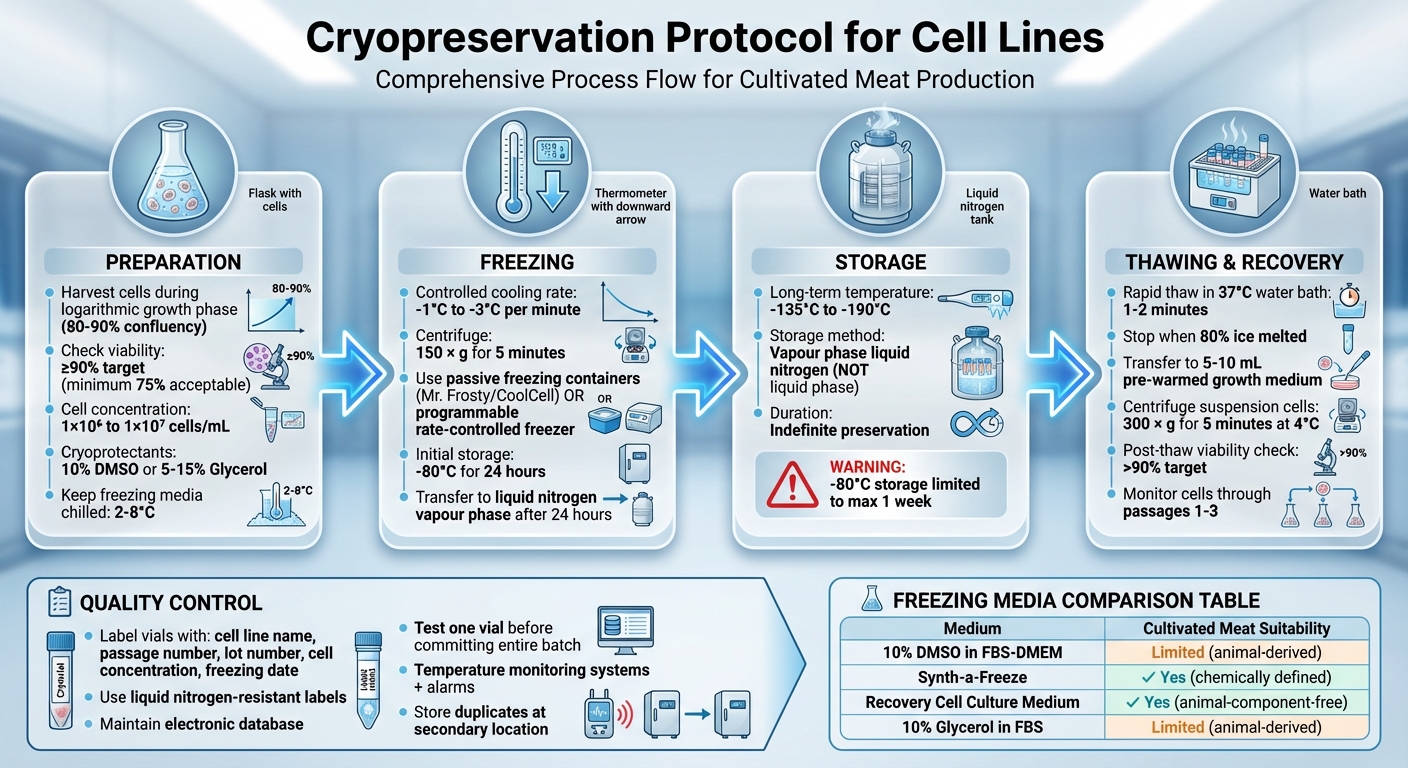
โปรโตคอลการเก็บรักษาเซลล์ด้วยการแช่แข็งแบบครบวงจร: กระบวนการ 4 ขั้นตอนจากการเตรียมการจนถึงการเก็บรักษา
การเตรียมเซลล์สำหรับการเก็บรักษาแบบแช่แข็ง
การเก็บเกี่ยวเซลล์และการตรวจสอบความมีชีวิต
เพื่อให้แน่ใจว่าการฟื้นตัวที่ดีที่สุดหลังการละลาย ให้เก็บเกี่ยวเซลล์ในระยะการเจริญเติบโตแบบลอการิธมิก (log) โดยทั่วไปจะเป็นช่วงที่เซลล์มีความหนาแน่น 80–90% [2][3][6].
ตรวจสอบความมีชีวิตของเซลล์โดยใช้วิธีการยกเว้น Trypan Blue ผสมส่วนเท่าๆ กัน (1:1) ของ 0.4% Trypan Blue กับการระงับเซลล์ จากนั้นนับเซลล์โดยใช้เครื่องนับเซลล์.เซลล์ที่มีชีวิตจะไม่ดูดซับสีย้อมและจะปรากฏสว่างใต้กล้องจุลทรรศน์ ในขณะที่เซลล์ที่ไม่มีชีวิตจะมีสีฟ้า [4] โดยทั่วไปแล้ว ควรตั้งเป้าหมายให้มีอัตราการมีชีวิตอย่างน้อย 90% เพื่ออัตราการฟื้นตัวที่ดีที่สุด แม้ว่าบางโปรโตคอลอาจยอมรับขั้นต่ำที่ 75% [1][2][3][5].
ก่อนการเก็บเกี่ยว ให้ใช้กล้องจุลทรรศน์เพื่อตรวจสอบการปนเปื้อนจากแบคทีเรียหรือเชื้อรา เซลล์ที่แข็งแรงในสารแขวนลอยควรปรากฏสว่าง กลม และมีการหักเหของแสงใต้กล้องจุลทรรศน์แบบย้อนกลับ [2][3].
เมื่อเซลล์ตรงตามมาตรฐานการมีชีวิตที่กำหนดแล้ว ให้ดำเนินการไปยังขั้นตอนก่อนการแช่แข็ง
การเตรียมการก่อนการแช่แข็ง
สำหรับเซลล์ที่ยึดติด ใช้วิธีการแยกเซลล์อย่างอ่อนโยน เช่น ทริปซินหรือ TrypLE Express และจำกัดเวลาในการเพาะเลี้ยงเพื่อลดความเสียหายต่อเยื่อหุ้มเซลล์ [5]. เตรียมเซลล์ที่ความเข้มข้น 1 × 10⁶ ถึง 1 × 10⁷ เซลล์/mL ขึ้นอยู่กับสายเซลล์ [1][6]. ในขณะที่แบ่งปัน ให้แน่ใจว่าสารแขวนลอยของเซลล์ถูกผสมบ่อยๆ เพื่อรักษาการกระจายที่สม่ำเสมอใน cryovials [5].
เก็บสื่อแช่แข็งให้เย็นระหว่าง 2°C ถึง 8°C ในระหว่างการฟื้นฟูเพื่อลดความเป็นพิษของสารป้องกันการแช่แข็งก่อนที่กระบวนการแช่แข็งจะเริ่มขึ้น [5]. เมื่อเซลล์ถูกฟื้นฟูในสื่อแช่แข็ง ให้ดำเนินการตามโปรโตคอลการแช่แข็งอย่างรวดเร็ว [1].ควรทำการเก็บรักษาเซลล์ด้วยการแช่แข็งในสภาพแวดล้อมที่ต่ำที่สุดเท่าที่จะเป็นไปได้เพื่อลดความเสี่ยงของการเปลี่ยนแปลงทางพันธุกรรมหรือการเปลี่ยนแปลงทางรูปแบบ [5][7].
การเลือกสารป้องกันการแช่แข็งและสื่อแช่แข็ง
ตัวเลือกสารป้องกันการแช่แข็งและฟังก์ชันของพวกเขา
ไดเมทิลซัลฟอกไซด์ (DMSO) ถูกใช้กันอย่างแพร่หลายเป็นสารป้องกันการแช่แข็ง โดยทั่วไปจะใช้ในความเข้มข้น 10% [2]. มันทำงานโดยการซึมผ่านเยื่อหุ้มเซลล์และลดการเกิดน้ำแข็งระหว่างการแช่แข็ง อย่างไรก็ตาม DMSO อาจเป็นพิษต่อเซลล์ที่อุณหภูมิห้อง ดังนั้นการละลายอย่างรวดเร็วจึงเป็นสิ่งสำคัญเพื่อลดการสัมผัสและเจือจางอย่างรวดเร็ว [1].
กลีเซอรีน เป็นทางเลือกที่มีประโยชน์สำหรับเซลล์ที่ไวต่อ DMSO โดยทั่วไปจะใช้ในความเข้มข้นตั้งแต่ 5% ถึง 15% [8].มันมีประสิทธิภาพโดยเฉพาะสำหรับประเภทเซลล์ที่ DMSO อาจทำให้เกิดการแยกประเภทที่ไม่ต้องการ [3] และมักมีความเป็นพิษต่ำกว่าเมื่อเปรียบเทียบกับ DMSO.
ในแอปพลิเคชันเนื้อสัตว์ที่เพาะเลี้ยง โปรโตคอลการแช่แข็งแบบดั้งเดิมมักใช้ส่วนผสมของ Fetal Bovine Serum (FBS) 90% และ DMSO 10% [1] อย่างไรก็ตาม การพึ่งพาส่วนประกอบที่มาจากสัตว์จำกัดวิธีการเหล่านี้ในแง่ของการขยายขนาดและการอนุมัติจากหน่วยงานกำกับดูแล [9] เพื่อแก้ไขปัญหาเหล่านี้ สื่อที่กำหนดทางเคมี - เช่น Synth-a-Freeze หรือ Recovery Cell Culture Medium - ให้ทางเลือกที่ปราศจากส่วนประกอบจากสัตว์ สื่อเหล่านี้รักษาความมีชีวิตของเซลล์หลังการละลายน้ำแข็งในระดับสูงในขณะที่เอาชนะความท้าทายที่เกี่ยวข้องกับส่วนประกอบที่มีต้นกำเนิดจากสัตว์ [9]
การเปรียบเทียบสื่อการแช่แข็ง
นี่คือการสรุปข้อดีและข้อจำกัดของสื่อการแช่แข็งต่างๆ ที่ใช้ในการผลิตเนื้อที่เพาะเลี้ยง:
| สื่อ | ข้อดี | ข้อเสีย | ความเหมาะสมของเนื้อที่เพาะเลี้ยง |
|---|---|---|---|
| 10% DMSO ใน FBS-DMEM | โปรโตคอลที่จัดตั้งขึ้น [1] | มีส่วนประกอบที่มาจากสัตว์; ความแปรปรวนของแบทช์ [9] | ขีดจำกัดในการขยายขนาด |
| Synth-a-Freeze | กำหนดทางเคมี; คุณภาพสม่ำเสมอ; ปราศจากส่วนประกอบจากสัตว์ [9] | ต้นทุนเริ่มต้นสูงกว่า [9] | ใช่ |
| สื่อเพาะเลี้ยงเซลล์ฟื้นฟู | ใช้งานง่าย; ออกแบบมาสำหรับการฟื้นฟูอย่างรวดเร็ว [9] | อาจต้องการการปรับแต่งสำหรับเซลล์ไลน์เฉพาะ | ใช่ |
| กลีเซอรีน 10% ใน FBS | ทางเลือกสำหรับเซลล์ที่ไวต่อ DMSO [1] | ขึ้นอยู่กับเซรั่มที่มีต้นกำเนิดจากสัตว์ [9] | ขีดจำกัดในการขยายขนาด |
ในเดือนกุมภาพันธ์ 2023 นักวิจัยที่ มหาวิทยาลัยการแพทย์หญิงโตเกียว นำโดย Hironobu Takahashi ได้แสดงให้เห็นถึงความสำคัญของการเลือกสื่อการแช่แข็งที่เหมาะสม.ใช้ตัวเลือกเชิงพาณิชย์เช่น CELLBANKER 1 และ 2 พวกเขาประสบความสำเร็จในการแช่แข็งเซลล์กล้ามเนื้อโบวีนหลักที่อุณหภูมิ -80°C เป็นเวลานานถึงหนึ่งปี อย่างน่าทึ่ง เซลล์เหล่านี้ยังคงสามารถเจริญเติบโตและแยกตัวเป็นเนื้อเยื่อกล้ามเนื้อที่หดตัวได้โดยมีโครงสร้างซาร์โคเมียร์ที่สมบูรณ์หลังจากการละลาย [10].
สำหรับการผลิตเนื้อที่ปลูกในห้องปฏิบัติการ สื่อที่มีการกำหนดทางเคมีและเป็นไปตามมาตรฐาน GMP กำลังได้รับความนิยมมากขึ้น ตามที่ STEMCELL Technologies เน้นย้ำ:
ในสาขาที่มีการควบคุมอย่างเข้มงวด เช่น การบำบัดด้วยเซลล์และยีน แนะนำให้ใช้สื่อการแช่แข็งที่ผลิตตาม GMP และมีการกำหนดอย่างเต็มที่เพื่อให้แน่ใจว่าผลิตภัณฑ์ถูกผลิตและควบคุมอย่างสม่ำเสมอตามมาตรฐานคุณภาพ [9].
แพลตฟอร์มเช่น
ขั้นตอนการแช่แข็งและอัตราการทำความเย็น
โปรโตคอลการแช่แข็งแบบทีละขั้น
กุญแจสำคัญในการแช่แข็งที่ประสบความสำเร็จอยู่ที่การรักษาอัตราการทำความเย็นที่คงที่ที่ -1°C ถึง -3°C ต่อ นาที[2]. กระบวนการที่ค่อยเป็นค่อยไปนี้ช่วยให้น้ำออกจากเซลล์ได้อย่างช้าๆ ป้องกันการเกิดผลึกน้ำแข็งภายในเซลล์ที่เป็นอันตรายซึ่งอาจทำให้เยื่อหุ้มเซลล์แตก[1].
เริ่มต้นโดยการปั่นเซลล์ที่ 150 x g เป็นเวลา 5 นาที[3]. เมื่อลงปั่นแล้ว ให้ทำการละลายเซลล์ในสื่อการแช่แข็งที่เย็นซึ่งมี 10% DMSO ที่ความเข้มข้น 2–4×10⁶ เซลล์/mL[3].เพื่อลดการสัมผัสกับ DMSO ให้เคลื่อนที่ไปยังขั้นตอนถัดไปอย่างรวดเร็ว - การแช่แข็ง.
แจกจ่ายการระงับเซลล์ลงในขวดแช่แข็งที่มีป้ายกำกับล่วงหน้าแต่ละขวดควรระบุรายละเอียดที่สำคัญอย่างชัดเจน เช่น ชื่อสายเซลล์ หมายเลขการผ่าน จำนวนล็อต ความเข้มข้นของเซลล์ และวันที่แช่แข็ง[3]. เมื่อเตรียมขวดเสร็จแล้ว ถึงเวลาเลือกและใช้เครื่องมือทำความเย็นที่เหมาะสม.
อุปกรณ์ทำความเย็นและเทคนิค
วางขวดลงในอุปกรณ์ทำความเย็นที่ควบคุมอัตราได้ทันที ภาชนะแช่แข็งแบบพาสซีฟ เช่น Nalgene "Mr Frosty" (ซึ่งใช้ไอโซโพรพานอล) หรือ Corning "CoolCell" เป็นตัวเลือกที่ได้รับความนิยม เครื่องมือเหล่านี้สามารถทำให้เกิดอัตราการทำความเย็นประมาณ 1°C ต่อ นาที เมื่อวางในช่องแช่แข็งที่ -80°C[2].
สำหรับการดำเนินงานในขนาดใหญ่ที่ความสม่ำเสมอเป็นสิ่งสำคัญ ตู้แช่แข็งที่ควบคุมอัตราได้แบบโปรแกรมเป็นตัวเลือกที่ดีที่สุด ตามที่ Sigma-Aldrich ระบุไว้:
ECACC ใช้ตู้แช่แข็งที่ควบคุมอัตราได้แบบโปรแกรมเป็นประจำ นี่คือวิธีที่เชื่อถือได้และสามารถทำซ้ำได้มากที่สุดในการแช่แข็งเซลล์[3].
หลังจากประมาณ 24 ชั่วโมง ที่ -80°C ให้ย้ายขวดไปยังเฟสไอของไนโตรเจนเหลว ซึ่งอุณหภูมิจะอยู่ระหว่าง -135°C และ -190°C สำหรับการเก็บรักษาระยะยาว[4]. หลีกเลี่ยงการเก็บเซลล์ที่ -80°C นานกว่าหนึ่งสัปดาห์ เนื่องจากอาจทำให้ความมีชีวิตของเซลล์ลดลง อุณหภูมิที่ต่ำกว่า -135°C เป็นสิ่งจำเป็นสำหรับการเก็บรักษาอย่างไม่มีกำหนด[2]. การใช้เฟสไอแทนเฟสของเหลวช่วยลดความเสี่ยงของการปนเปื้อนข้ามในขณะที่ยังคงอุณหภูมิที่ต่ำพอสมควร
โปรโตคอลการละลายและฟื้นฟู
กระบวนการละลาย
การละลายเซลล์อย่างรวดเร็วเป็นสิ่งสำคัญเพื่อจำกัดการสัมผัสกับสารป้องกันการแช่แข็งที่เป็นพิษและป้องกันไม่ให้ผลึกน้ำแข็งทำให้เกิดความเสียหาย ตรวจสอบให้แน่ใจว่าได้สวมหน้ากากเต็มหน้าและถุงมือที่มีฉนวนเพื่อความปลอดภัย เริ่มต้นโดยการนำขวดแช่แข็งออกจากไนโตรเจนเหลวและคลายฝาออกเล็กน้อยเพื่อปล่อยความดันที่สะสมอยู่ จากนั้นให้ขันฝาให้แน่นอีกครั้ง.
วางขวดในอ่างน้ำที่อุณหภูมิ 37°C โดยให้แน่ใจว่าฝาอยู่เหนือระดับน้ำ ปล่อยให้ละลายเป็นเวลา 1–2 นาที หรือจนกว่าจะมีผลึกน้ำแข็งเหลือเพียงไม่กี่ชิ้น เมื่อละลายแล้ว ให้เช็ดด้านนอกของขวดด้วยแอลกอฮอล์ 70% เพื่อรักษาความสะอาด.
โอนเนื้อหาของขวดไปยังหลอดที่มีสื่อการเจริญเติบโตที่อุ่นล่วงหน้า 5–10 มิลลิลิตร เพิ่มสื่ออย่างช้าๆ เพื่อช่วยลดการช็อกออสโมติก หากคุณกำลังทำงานกับเซลล์สายการระงับ ให้ปั่นเซลล์ระงับทันทีที่ 300 × g เป็นเวลา 5 นาทีที่ 4°C.ขั้นตอนนี้ช่วยในการทำให้เซลล์เป็นเม็ดและกำจัดสารป้องกันการแช่แข็ง หลังจากการปั่นเหวี่ยง ให้ทำการละลายเซลล์ในสื่อใหม่ สำหรับเซลล์ที่ยึดติด การปั่นเหวี่ยงมักจะไม่จำเป็น แทนที่จะทำเช่นนั้น ให้เพาะเซลล์ลงในภาชนะเพาะเลี้ยงที่เหมาะสมและกำจัด DMSO ที่เหลืออยู่ในระหว่างการเปลี่ยนสื่อครั้งแรก ซึ่งมักจะทำหลังจาก 24 ชั่วโมง.
การประเมินหลังการละลาย
ทันทีหลังจากการละลาย ให้ตรวจสอบความมีชีวิตของเซลล์เพื่อให้แน่ใจว่าการฟื้นฟูประสบความสำเร็จ ใช้เมธอดการยกเว้น Trypan Blue สำหรับการประเมินนี้ โดยทั่วไปแล้ว ความมีชีวิตของเซลล์ควรเกิน 90% [11] แต่ขั้นต่ำที่ยอมรับได้คือ 75% หลังจาก 24 ชั่วโมง ให้ตรวจสอบเซลล์ภายใต้กล้องจุลทรรศน์แบบคอนทราสต์เฟสเพื่อยืนยันการยึดติด ประเมินความหนาแน่นของเซลล์ และตรวจสอบสัญญาณของการปนเปื้อน.
ติดตามเซลล์ต่อไปผ่านการส่งต่อ 1–3 เพื่อให้แน่ใจว่ามีการเจริญเติบโตตามปกติและพวกมันยังคงรักษาลักษณะที่คาดหวังไว้.สำหรับเซลล์ไลน์ที่ฟื้นตัวช้ากว่า คุณสามารถปรับปรุงการอยู่รอดโดยการเพิ่มความเข้มข้นของเซรุ่มโคท้องแก่เริ่มต้นเป็นประมาณ 20% v/v.
sbb-itb-ffee270
การเก็บรักษาและความมีชีวิตในระยะยาว
เงื่อนไขการเก็บรักษาและระยะเวลา
เพื่อรักษาความมีชีวิตของเซลล์ไลน์ในระยะยาว จำเป็นต้องเก็บรักษาที่อุณหภูมิต่ำกว่า -135°C [7][2]. ซึ่งจะทำให้เซลล์ถูกเก็บรักษาไว้ได้ไม่มีกำหนด.
วิธีที่แนะนำในการเก็บรักษาเซลล์ไลน์เนื้อสัตว์ที่เพาะเลี้ยงคือการใช้ไนโตรเจนเหลวในรูปแบบไอ วิธีนี้จะรักษาอุณหภูมิให้อยู่ระหว่าง -135°C ถึง -190°C ทำให้เหมาะสำหรับการเก็บรักษาในระยะยาวและมีความปลอดภัยมากกว่าการเก็บรักษาในรูปแบบของเหลว.
หากคุณต้องการเก็บเซลล์ที่ -80°C ให้จำกัดระยะเวลาไว้ที่ 24 ชั่วโมงถึงหนึ่งสัปดาห์ นอกเหนือจากนี้ ความมีชีวิตของเซลล์อาจลดลง.สำหรับการเก็บรักษาชั่วคราวที่อุณหภูมินี้ ให้โอนเซลล์ไปยังการเก็บรักษาในไนโตรเจนเหลวโดยเร็วที่สุด.
ใช้ขวดเก็บรักษาแบบเยือกแข็งที่ปราศจากเชื้อมาตรฐาน (1–2 มล.) ที่มีเกลียวภายในและ O-ring เพื่อการเก็บรักษาที่ปลอดภัย [4][5]. ควรวางขวดเยือกแข็งที่ปิดสนิทในเฟสก๊าซแทนที่จะเป็นเฟสของเหลวของไนโตรเจนเพื่อลดความเสี่ยงของการระเบิดของขวดในระหว่างการละลาย [5]. นอกจากนี้ ควรตรวจสอบให้แน่ใจว่าเรือไนโตรเจนเหลวขนาดใหญ่มีระดับน้ำอย่างน้อยครึ่งหนึ่งเพื่อรักษาเบาะความปลอดภัย.
สุดท้ายนี้ มาตรการควบคุมคุณภาพที่เข้มงวดเป็นสิ่งสำคัญเพื่อให้แน่ใจว่าสภาพความมีชีวิตของเซลล์ในระยะยาว.
การตรวจสอบคุณภาพ
เพื่อให้แน่ใจในความเชื่อถือได้ของเซลล์สายพันธุ์ที่เก็บรักษาไว้ ให้ปฏิบัติตามโปรโตคอลที่เข้มงวดสำหรับการควบคุมคุณภาพ เริ่มต้นด้วยการติดป้ายแต่ละขวดด้วยป้ายที่ทนต่อไนโตรเจนเหลวอย่างถูกต้อง.รวมรายละเอียดที่สำคัญ เช่น ตัวตนของเซลล์ หมายเลขล็อต หมายเลขการผ่าน และวันที่แช่แข็ง รักษาฐานข้อมูลอิเล็กทรอนิกส์เพื่อติดตามตำแหน่งที่แน่นอนของแต่ละขวด ซึ่งช่วยลดเวลาที่ภาชนะจัดเก็บต้องเปิดอยู่ [7][2].
ก่อนที่จะส่งมอบชุดทั้งหมดไปยังการจัดเก็บระยะยาว ให้ทดสอบความมีชีวิตของขวดหนึ่งหลังจากการจัดเก็บในระยะสั้นในสภาพก๊าซ ขั้นตอนนี้ช่วยยืนยันว่ากระบวนการแช่แข็งประสบความสำเร็จและระบุปัญหาที่อาจเกิดขึ้น [4][7][2]. สำหรับสต็อกเซลล์ที่มีค่ามาก ควรจัดเก็บสำเนาที่สถานที่รองเพื่อป้องกันความล้มเหลวของอุปกรณ์หรือภัยพิบัติในท้องถิ่น [7][2].
ติดตั้งระบบตรวจสอบอุณหภูมิและสัญญาณเตือนในภาชนะเก็บทั้งหมดเพื่อตรวจจับระดับไนโตรเจนเหลวต่ำ [7]. นอกจากนี้ ให้ติดตั้งสัญญาณเตือนออกซิเจนในพื้นที่เก็บของ โดยตั้งค่าให้ทำงานเมื่อมีออกซิเจน 18% (v/v) เพื่อลดความเสี่ยงจากการขาดอากาศหายใจสำหรับบุคลากรที่ทำงานกับไนโตรเจนเหลว [7][2].
โปรโตคอลวิดีโอการเก็บรักษาเซลล์ในอุณหภูมิต่ำ
บทสรุปและข้อคิดสำคัญ
นี่คือการสรุปขั้นตอนและคำแนะนำที่สำคัญสำหรับการเก็บรักษาในอุณหภูมิต่ำอย่างมีประสิทธิภาพในการผลิตเนื้อที่เพาะเลี้ยง:
- การเก็บเกี่ยวเซลล์: เก็บเซลล์ในระยะการเจริญเติบโตแบบลอการิธมิค โดยต้องมั่นใจว่าความมีชีวิตอยู่เกิน 90% ใช้ DMSO 10% เป็นสารป้องกันการแช่แข็ง แม้ว่ากลีเซอรีนจะเป็นทางเลือกสำหรับเซลล์ที่บอบบางมากขึ้น [11][1].
- การทำความเย็นและการเก็บรักษา: รักษาอัตราการทำความเย็นที่ควบคุมได้และโอนขวดอย่างรวดเร็วไปยังการเก็บรักษาในไนโตรเจนเหลวในรูปแบบไอเพื่อปกป้องความสมบูรณ์ของเซลล์ [11]
การศึกษาของ Roka Kakehi et al. เน้นความสำคัญของความแม่นยำในการแช่แข็งเซลล์ [10]:
"การรับประกันแหล่งเซลล์ที่เชื่อถือได้และสม่ำเสมอโดยการใช้การแช่แข็งเซลล์จะช่วยให้เราสามารถเพิ่มปริมาณเซลล์ที่มีแนวโน้มสำหรับการผลิตเนื้อที่เพาะเลี้ยงได้" - Roka Kakehi et al., Tokyo Women's Medical University
- กระบวนการละลาย: ละลายเซลล์ในอ่างน้ำที่อุณหภูมิ 37°C เป็นเวลาประมาณสองนาที หยุดเมื่อมีน้ำแข็งละลายไป 80% ซึ่งจะช่วยลดความเป็นพิษของ DMSO และปรับปรุงการฟื้นฟูเซลล์ [1]. ติดตามด้วยการตรวจสอบความมีชีวิตหลังการละลายเพื่อให้แน่ใจว่าประสบความสำเร็จและปรับปรุงขั้นตอนในอนาคต.
วิธีการเหล่านี้ทำงานร่วมกันกับการควบคุมคุณภาพที่เข้มงวดเสมอ ระบุขวดอย่างถูกต้อง รักษาบันทึกให้เป็นระเบียบ และดำเนินการตรวจสอบอย่างละเอียดก่อนการเก็บรักษาระยะยาว [11]. สำหรับความต้องการการเก็บรักษาในสภาพแช่แข็งที่เฉพาะเจาะจง แพลตฟอร์มเช่น
คำถามที่พบบ่อย
ข้อดีของการใช้สื่อที่กำหนดทางเคมีสำหรับการเก็บรักษาเซลล์ในสภาพแช่แข็งในการผลิตเนื้อที่เพาะเลี้ยงคืออะไร?
สื่อที่กำหนดทางเคมีมีประโยชน์หลายประการเมื่อพูดถึงการเก็บรักษาเซลล์ในสภาพแช่แข็งสำหรับการผลิตเนื้อที่เพาะเลี้ยง โดยการกำจัดส่วนประกอบที่ไม่ชัดเจน เช่น เซรั่มที่ได้จากสัตว์ พวกเขาช่วยให้ ผลลัพธ์ที่สม่ำเสมอและคาดการณ์ได้ - เป็นปัจจัยที่สำคัญสำหรับการรักษาความน่าเชื่อถือในระยะยาวของเซลล์.
ข้อได้เปรียบอีกประการหนึ่งคือความเสี่ยงที่ลดลงจากการปนเปื้อนและความแปรปรวน ซึ่งไม่เพียงแต่สนับสนุนมาตรฐานคุณภาพและความปลอดภัยที่สูงขึ้น แต่ยังสอดคล้องอย่างสมบูรณ์แบบกับความแม่นยำและความสามารถในการขยายตัวที่จำเป็นเพื่อตอบสนองความต้องการด้านกฎระเบียบและความคาดหวังของผู้บริโภคในอุตสาหกรรมเนื้อที่เพาะเลี้ยง
การเลือกสารป้องกันการแช่แข็งมีผลต่อการอยู่รอดของเซลล์ในระหว่างการแช่แข็งและการละลายอย่างไร?
การเลือกสารป้องกันการแช่แข็งเป็นปัจจัยสำคัญในการรักษาสุขภาพของเซลล์ในระหว่างการแช่แข็งและการละลาย ตัวเลือกที่ใช้กันอย่างแพร่หลายสองตัวคือ dimethyl sulfoxide (DMSO) และ glycerol ซึ่งแต่ละตัวมีลักษณะที่แตกต่างกัน DMSO เป็นที่รู้จักในด้านความสามารถในการซึมเข้าสู่เซลล์ได้อย่างรวดเร็วและให้การป้องกันที่แข็งแกร่ง อย่างไรก็ตาม มันมีข้อควรระวัง: ที่ความเข้มข้นสูงหรือเมื่อสัมผัสเป็นเวลานาน อาจทำให้เกิดความเป็นพิษซึ่งอาจลดความมีชีวิตของเซลล์
ในทางตรงกันข้าม กลีเซอรีนมีความเป็นพิษน้อยกว่าและสามารถนำไปใช้โดยตรงได้ข้อเสียของมันอยู่ที่อัตราการซึมผ่านของเซลล์ที่ช้ากว่า ซึ่งอาจส่งผลให้การป้องกันที่ได้ไม่ทันทีเท่ากับ DMSO.
การบรรลุความสมดุลที่เหมาะสมเป็นสิ่งสำคัญ การปรับความเข้มข้นและระยะเวลาในการสัมผัสของสารป้องกันการแช่แข็งอย่างเหมาะสมช่วยปกป้องเซลล์ในขณะที่ลดความเสี่ยงของความเป็นพิษ นอกจากนี้ การปฏิบัติตามแนวทางที่ดีที่สุดสำหรับอัตราการทำความเย็นและสภาพการเก็บรักษาเป็นสิ่งจำเป็นเพื่อให้แน่ใจว่ามีอัตราการฟื้นตัวที่สูงที่สุดหลังจากการละลาย.
ทำไมการควบคุมอัตราการทำความเย็นจึงสำคัญในระหว่างการแช่แข็ง?
การรักษาอัตราการทำความเย็นที่คงที่ ซึ่งปกติอยู่ระหว่าง –1°C ถึง –3°C ต่อ นาที เป็นกุญแจสำคัญในการรักษาเซลล์ให้มีชีวิต อุณหภูมิที่ลดลงอย่างค่อยเป็นค่อยไปช่วยให้เซลล์สามารถขจัดน้ำออกได้ในอัตราที่ควบคุมได้ ลดโอกาสในการเกิดผลึกน้ำแข็งที่เป็นอันตรายซึ่งอาจทำให้เยื่อหุ้มเซลล์ฉีกขาดหรือเสียหาย.
วิธีการที่มีการวัดนี้ช่วยปกป้องโครงสร้างของเซลล์ เพิ่มอัตราการอยู่รอดและการทำงานของเซลล์เมื่อถูกละลาย.การปฏิบัติตามโปรโตคอลการทำความเย็นอย่างแม่นยำเป็นสิ่งสำคัญเพื่อให้แน่ใจว่าการเก็บรักษาและการฟื้นฟูเซลล์สายพันธุ์ในระยะยาวประสบความสำเร็จ.











