扩大用于培养肉生产的生物反应器是复杂的,尤其是在管理剪切应力时,这是一种在放大过程中可能损害哺乳动物细胞的机械力。与微生物细胞不同,哺乳动物细胞脆弱且对湍流和曝气力敏感。当剪切应力超过3 Pa时,细胞可能破裂,降低活力和生产力。
为了解决这些挑战,工程师依靠计算流体动力学 (CFD)和缩小模型来预测和管理剪切应力,然后再进行全面生产。CFD 分析生物反应器中的流动模式、剪切区和混合效率,而缩小模型则通过实验验证这些预测,最大限度地降低放大过程中的风险。
关键要点:
- 剪切应力限制:哺乳动物细胞可耐受高达3 Pa;超过此值会损害细胞。
- CFD 工具:先进的方法如大涡模拟 (LES) 和格子-Boltzmann 模拟 (LB-LES) 能够精确地模拟流动和湍流。
- 缩小模型:这些模型在较小的设置中复制大型生物反应器的条件,以验证 CFD 预测。
-
设计考虑:
- 使用倾斜叶片搅拌器以降低剪切力。
- 保持 Kolmogorov 涡流长度大于 20 μm 以防止细胞损伤。
- 保持搅拌器尖端速度低于 1.5 m/s。
通过结合 CFD 洞察与实验验证,团队可以优化生物反应器设计以用于培养肉生产,确保细胞存活和高效扩展。
CFD指南针 | 生物反应器CFD最佳实践
使用计算流体动力学 (CFD) 模拟剪切应力
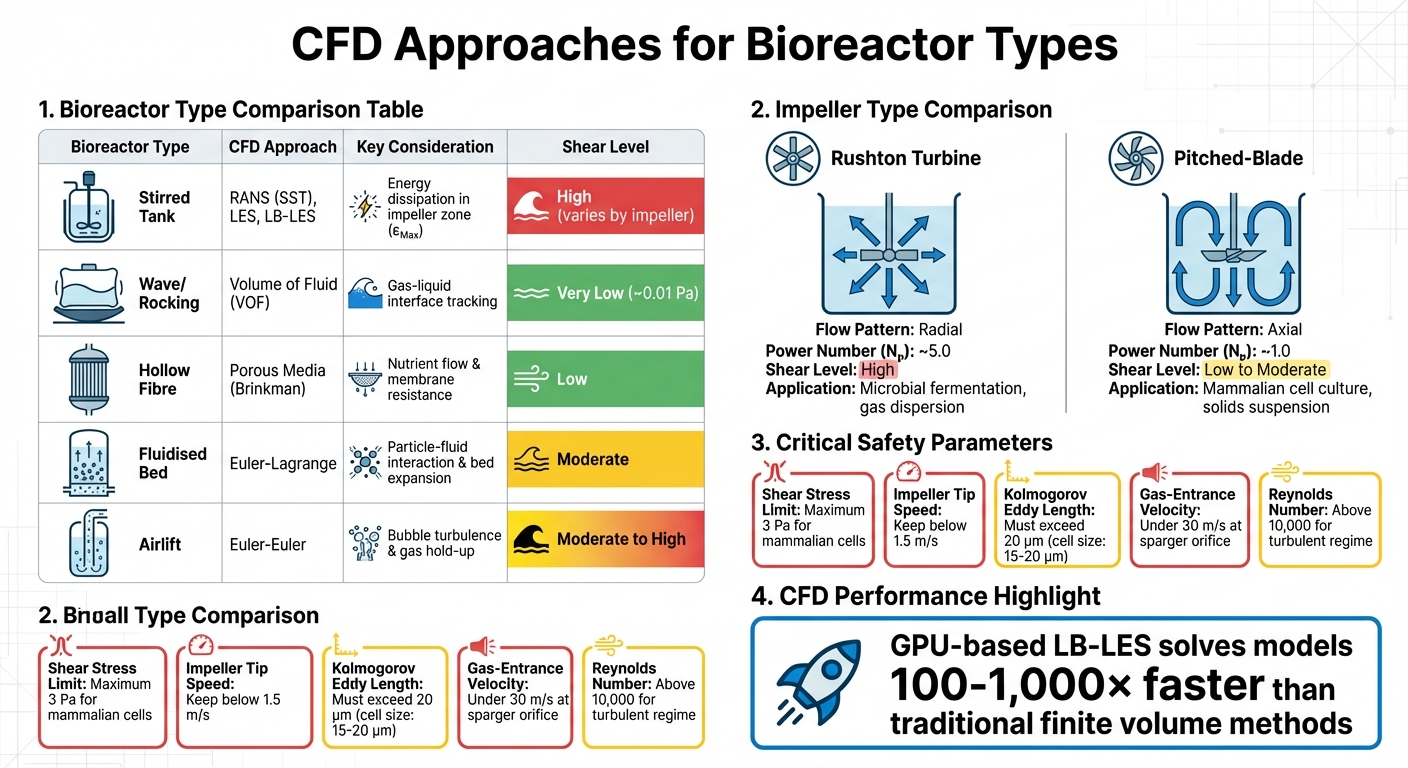
培养肉生产中不同生物反应器类型的CFD方法和关键参数
CFD模拟为工程师提供了在生物反应器物理建造之前绘制流体动力学和剪切力的工具。CFD帮助预测关键因素,如高剪切区、湍流涡流和容器特定部位的细胞活力,而不是依赖于生产规模的试错法。这在培养肉生产中尤为重要,因为生物反应器的规模最终可能达到200,000升——远大于传统生物制药容器[8]。这些预测性见解指导缩小实验并影响设备选择。
计算技术的发展是显著的。虽然雷诺平均纳维-斯托克斯(RANS)模型,如k-ε,仍在工业中广泛使用,但像大涡模拟(LES)和GPU驱动的格子玻尔兹曼模拟(LB-LES)这样的先进方法正在突破界限。根据来自布拉格化学技术大学的Miroslav Soos教授的说法,基于GPU的LB-LES可以“比常用的有限体积法求解器快100到1000倍”[2]。这种速度优势使工程师能够以检测细胞损伤涡流所需的精度模拟大型容器。
CFD能力的一个实际例子来自Regeneron Ireland DAC和Thermo Fisher Scientific的研究人员。他们成功地将细胞培养过程从一个2,000升的生物反应器扩展到一个几何形状不同的5,000升一次性生物反应器。相较于依赖经验性启发法,他们使用CFD分析了质量传递速率、混合时间和剪切速率等参数。这种方法使得首次放大就取得了成功,避免了与基于功率-体积比的放大相关的高成本失败。[5].
搅拌罐生物反应器的CFD设置
要为搅拌罐生物反应器设置CFD,首先定义容器几何形状——包括罐体尺寸、搅拌器设计(e.g., Rushton或斜叶片)和挡板位置。选择合适的湍流模型至关重要:可实现的k-ε模型适用于气液系统,而LB-LES则提供更高的分辨率以识别可能损害细胞的峰值应力。网格收敛性研究确保结果不依赖于网格大小。
边界条件必须反映真实世界的操作参数,例如叶轮速度、气体喷射速率、流体密度和粘度。对于培养肉应用,通常使用保守的气泡阻力模型来估算剪切应力[8]。系统应在完全湍流状态下运行,雷诺数超过10,000,以确保功率数在不同叶轮速度下保持一致[1]。
氧气传递、混合时间和流体动力学应力的CFD预测应与使用剪切敏感微探针或纳米颗粒聚集体收集的实验数据一致[2]。例如,一个数学传质模型指导了从2升台式单元到1,500升工业生物反应器的CHO细胞培养过程的直接放大Sartorius。通过使用CFD预测氧气需求和CO₂去除,团队在不同规模中保持了一致的产品质量属性 - 如N-聚糖和电荷变体 - [6].
其他生物反应器类型的CFD
虽然搅拌罐在工业细胞培养中占主导地位,但其他生物反应器设计需要量身定制的CFD方法。例如,摇摆或波动生物反应器依赖于流体体积(VOF)方法来模拟气液界面,因为波动运动在这些系统中驱动剪切应力。这些设计创造了更温和的剪切环境 - 最大应力约为0.01 Pa,相比于搅拌罐 - 但其在大规模培养肉生产中的可扩展性有限[4].
另一方面,空心纤维生物反应器使用基于Brinkman方程的多孔介质模型来模拟通过膜的营养扩散和流动阻力。流化床系统需要欧拉-拉格朗日模型来捕捉颗粒-流体相互作用和床层膨胀,而气升式生物反应器使用欧拉-欧拉方法来分析气泡引起的湍流和气体滞留[4]。每种设计都有其独特的挑战:流化床必须在微载体分布和剪切暴露之间取得平衡,而气升系统需要管理由气泡破裂引起的应力,这是曝气生物反应器中细胞死亡的主要原因[1] [7]。
理解这些CFD方法对于控制用于培养肉生产的不同生物反应器设计中的剪切应力至关重要。
| 生物反应器类型 | CFD 方法 | 关键考虑因素 |
|---|---|---|
| 搅拌罐 | RANS (SST), LES, LB-LES | 叶轮区的能量耗散 (εMax) |
| 波浪/摇摆 | 流体体积 (VOF) | 气液界面的跟踪 |
| 中空纤维 | 多孔介质 (Brinkman) | 营养流动和膜阻力 |
| 流化床 | 欧拉-拉格朗日 | 颗粒与流体的相互作用,床膨胀 |
| 气升式 | 欧拉-欧拉 | 气泡引起的湍流和气体滞留 |
这些多样化的CFD方法突显了定制化策略的必要性,这在设备选择和剪切应力管理中起着关键作用。
缩小模型和实验验证
虽然计算流体动力学 (CFD) 提供了有价值的预测,但在放大工艺时,它不能替代实际测试的需求。实验验证在确保计算模型准确反映真实世界的剪切应力条件方面起着至关重要的作用。这就是缩小模型的用武之地,它在较小、易于管理的系统中模拟大型生产生物反应器的流体动力环境。通过这样做,它们减少了从小规模到工业规模操作时发生昂贵错误的风险。这一步不仅确认了 CFD 的预测,还确保了更可靠和有效的放大过程。
创建缩小模型
设计缩小模型始于保持几何相似性。这意味着保持关键组件之间的相同比例,例如容器的高度与直径以及搅拌器直径与罐直径的比例[11]。一旦几何形状对齐,工程师选择一个缩放标准。常见的选择包括每单位体积的功率(P/V)、搅拌器尖端速度或能量耗散率(EDR)。然而,关注局部EDR而不是平均P/V可以更好地理解剪切异质性,这对于准确建模至关重要。
一种更先进的方法涉及多隔室模拟器。例如,在2021年2月,Emmanuel Anane及其团队开发了一种结合搅拌罐反应器(STR)和活塞流反应器(PFR)的双隔室缩小模拟器。该模型用于研究CHO细胞如何响应溶解氧梯度。他们的研究揭示了一个关键的停留时间阈值为90秒。在此之后,CHO细胞的活细胞密度下降了15%,乳酸积累增加[10]。这一发现为设计保持细胞活力的工业生物反应器提供了明确的基准
。为了保护细胞生长,工程师通常会将叶轮尖端速度保持在1.5 m/s以下[1]。此外,Kolmogorov微涡长度——湍流的一个衡量标准——应超过细胞的大小,通常哺乳动物细胞为20 μm或更大,以避免流体动力学损伤[1][3]。例如,在动物细胞培养中能量输入为0.1 W/kg时,最小的涡流约为60 μm,提供了一个安全缓冲[3]。
通过实验验证CFD预测
一旦缩小模型到位,实验方法对于验证从CFD得出的参数至关重要。粒子图像测速(PIV)是一种广泛使用的技术。通过跟踪流体中的粒子,PIV有助于确认缩小模型中的流动模式和速度场是否与CFD预测一致[12][4]。
示踪剂注入和脱色方法也用于验证混合时间。在此过程中,酸、碱或盐溶液等示踪剂被引入到靠近搅拌器的位置,并监测其分布,直到达到95%的均匀性[12][3]。对于大型哺乳动物细胞生物反应器(5,000 L到20,000 L),混合时间通常在80到180秒之间[10]。
2020年3月,James Scully和他在Regeneron Ireland DAC的团队成功地将细胞培养工艺从2000升生物反应器扩展到具有不同几何形状的5000升一次性生物反应器。他们依靠CFD预测关键参数,如传质速率、混合时间和剪切速率。这些预测随后通过单相和多相实验得到验证,使得首次扩展尝试成功,而无需进行大规模试验运行[5]。
“CFD模拟越来越多地用于补充实验室中的经典工艺工程调查,提供空间和时间上分辨的结果,甚至在实验室调查不可能时取而代之。" - Stefan Seidel, School of Life Sciences, ZHAW [12]
其他验证技术包括扭矩测量以确认特定功率输入 (P/V) 和在特定搅拌速度下的无量纲功率数 [12][3]。氧气传递率通过排气或亚硫酸盐技术等方法验证,这些方法确定体积氧气传递系数 (kLa) [12][7]。对于使用微载体的系统,采用光衰减或基于摄像机的方法来找到悬浮所有颗粒所需的最小速度,以确保 CFD 对固相分布的预测准确 [12][4]。
sbb-itb-ffee270
影响生物反应器中剪切应力的因素
为了在放大过程中保护细胞活力,了解驱动剪切应力的物理因素至关重要。计算流体动力学(CFD)预测和缩小验证表明,能量耗散率(EDR)起着关键作用。EDR衡量叶轮动能如何转化为热量,导致能量分布不均。例如,在倾斜叶片叶轮中,能量往往集中在叶轮周围,形成高剪切区,如果管理不当,可能会损害细胞。
叶轮设计和功率输入
使用的叶轮类型显著影响流动模式和剪切强度。例如,Rushton涡轮产生径向流动和高剪切,使其非常适合微生物发酵,但不太适合剪切敏感的哺乳动物细胞。另一方面,倾斜叶片搅拌器在相同功率输入下产生轴向流动,剪切力较低且泵送效率更高。这使得它们成为培养肉生产等应用的首选,在这些应用中,细胞活力是优先考虑的。
| 搅拌器类型 | 流动模式 | 功率数 (Nₚ) | 剪切水平 | 主要应用 |
|---|---|---|---|---|
| Rushton 涡轮 | 径向 | ~5.0 | 高 | 微生物发酵;气体分散[3] |
| 倾斜叶片 | 轴向 | ~1.0 | 低到中等 | 哺乳动物细胞培养;固体悬浮 [3] |
放大策略通常依赖于保持每单位体积的恒定功率输入(P/V)。然而,随着反应器尺寸的增加,这可能导致更高的搅拌器尖端速度。对于哺乳动物细胞,尖端速度应保持在 1.5 m/s 以下以避免生长问题 [1]。在大规模反应器中,曝气引入的流体动力学应力甚至可能超过搅拌器,尤其是在超过 20 m³ 的容器中 [9]。这些因素与湍流密切相关,这将在 Kolmogorov 尺度讨论中进一步探讨。
Kolmogorov 尺度和湍流建模
Kolmogorov 尺度(λ)定义了最小湍流涡流的大小,其中能量以热量形式消散。如果这些涡流小于细胞直径,机械损伤就成为一个问题。对于通常大小为15–20 μm的哺乳动物细胞,涡流长度必须超过20 μm以避免损伤[1][3]。例如,在0.1 W/kg的能量输入下,Kolmogorov涡流直径约为60 μm,提供了一个安全缓冲[3]。
“如果生物实体(e.g., 哺乳动物细胞)在生物反应器中小于λ [Kolmogorov尺度],那么这些实体不会发生剪切损伤。” - Muhammad Arshad Chaudhry[3]
2024年8月,来自Boehringer Ingelheim Pharma和布拉格化学技术大学的研究人员使用Lattice-Boltzmann大涡流模拟(LB-LES)验证了在12,500 L工业生物反应器中的CFD预测。通过使用剪切敏感的纳米粒子聚集体,他们测量了最大流体动力学应力,并证明LB-LES可以比传统方法快100-1,000倍解决湍流尺度。这些发现对于制定减少剪切应力的策略具有重要意义。 使用建模数据减少剪切应力 CFD建模使工程师能够确定高剪切区域并相应调整操作条件。一种有效的方法是在叶轮区附近引入基质、pH碱或消泡剂,而不是在液体表面。这确保了快速分布并最小化局部浓度梯度。在培养肉生产中,过度剪切会使细胞从微载体上脱落,而搅拌不足会导致微载体沉降和营养失衡。
像Pluronic F-68(聚氧乙烯-聚氧丙烯嵌段共聚物188)这样的保护性添加剂通常用于保护细胞免受剪切力的影响,特别是由液体表面气泡破裂引起的剪切力——这是生物反应器中细胞死亡的主要原因之一[1]。使用这些表面活性剂时,据报道能量输入高达100,000 W/m³而不会产生致命影响[1]。此外,将气体进入喷射器孔口的速度保持在30 m/s以下有助于减少生产力损失和细胞死亡率[1]。
寻找生物反应器规模化设备
如何Cellbase 支持生物反应器采购
用于培养肉生产的生物反应器规模化面临一系列挑战。这就是
使用
在生物制药行业中使用的生物反应器的成功扩展在这些产品的质量和上市时间中起着重要作用[5]。
通过利用CFD支持的数据,团队可以简化设备选择并减少重复试验的需求[5]。这些见解对于选择设计时考虑到最佳剪切应力管理的生物反应器至关重要。
选择用于剪切应力控制的设备
为了有效控制剪切应力,某些设备规格尤为重要。叶轮几何形状是一个关键因素。例如,倾斜叶片叶轮产生的轴向流动的功率数(Np)大约为1.0,而Rushton涡轮的Np则高得多,大约为5.0。这意味着在相同的转速下,倾斜叶片设计产生的功率显著减少,因此剪切力也减少[3]。对于涉及用于培养肉的哺乳动物细胞的应用,保持叶轮尖端速度低于1.5 m/s对于避免细胞损伤至关重要[1]。
曝气器配置是另一个关键考虑因素。为了防止过度剪切,设备应确保曝气器孔口的气体进入速度保持在30 m/s以下,并且孔口雷诺数保持在2,000以下。超过这些阈值可能导致“喷射状态”,其中气泡分散不均并产生局部剪切区[1]。与微曝气器相比,钻孔或开放管曝气器更适合剪切敏感细胞。此外,设备应支持缩小兼容性。供应商提供台式模型(e.g。, 3 L 系统) 在几何上与大规模系统 (2,000 L 或更多) 相似,使团队能够在小规模上验证 CFD 预测,然后再进行全面生产 [1][2].
结论
培养肉生产的生物反应器规模化需要摒弃传统的试错法,采用模型驱动的策略来解决局部剪切差异。计算流体动力学 (CFD) 已成为这一过程中的关键工具,使工程师能够预测流体动力环境并可视化剪切区,而不仅仅是简单的功率与体积比 [1]。通过遵循关键参数 - 如保持 Kolmogorov 涡流长度在 20 μm 以上和叶轮尖端速度低于 1.5 m/s - 工程师可以保护哺乳动物细胞免受剪切损伤,同时确保适当的混合和氧气传递 [1]。
先进的计算方法,如大涡模拟(LES)和格子-Boltzmann技术,已证明其在放大工艺中的有效性。例如,在2020年3月,Regeneron Ireland DAC成功地将细胞培养工艺从2000升生物反应器首次尝试放大到几何上不同的5000升一次性使用系统。这是通过多参数CFD预测实现的,消除了大量物理试验的需要[5]。这种“首次正确”策略不仅降低了污染风险,还缩短了上市时间——这对培养肉行业至关重要。
实验验证方法,如粒子图像测速(PIV),进一步确认了CFD模型的准确性[2]。这些经过验证的模型现在在采购决策中起着关键作用。像
常见问题
计算流体动力学(CFD)如何支持培养肉类生产的生物反应器放大?
计算流体动力学(CFD)在培养肉类生物反应器放大方面是一个变革者。它提供了对流动动力学、剪切应力、混合效率和传质速率的深入理解——这些都是为细胞生长创造理想环境的关键因素。
通过CFD,工程师可以优化叶轮设计、搅拌速度和气体喷射等关键元素。这确保了生物反应器在最佳条件下运行,保障细胞健康和生产力。
更重要的是,CFD使得从小型实验室装置到大型工业规模生物反应器的过渡成为可能,而不会影响效率或一致性。这意味着培养肉生产可以顺利扩大规模,同时保持高标准。
是什么让大涡模拟(LES)比传统的生物反应器建模方法更好?
大涡模拟(LES)相比传统方法如雷诺平均纳维-斯托克斯(RANS),提供了对生物反应器内湍流流动更深入和更精确的观察。通过专注于大规模涡流并仅对最小的耗散运动进行建模,LES可以精确定位关键的剪切应力热点,例如涡流引起的高剪切区域,这些区域可能会被忽视。这种细节水平在减少细胞损伤和确保在扩大培养肉生产时的更高可靠性方面起着关键作用。
与严重依赖经验相关性的方法不同,LES在从实验室规模到工业规模生物反应器的转变中提供了更强的预测能力。计算技术的进步也使LES更易于获取,允许进行详细的模拟而无需高昂的计算资源。对于希望整合LES驱动设计的企业,
为什么保持Kolmogorov涡流长度在20 µm以上对哺乳动物细胞的存活性很重要?
在生物反应器操作中,保持Kolmogorov涡流长度大约在20 µm以上对于保护哺乳动物细胞至关重要。当这些湍流涡流缩小到细胞大小以下时,它们可能会使细胞暴露于过度的剪切应力,从而有损伤细胞膜并降低细胞存活率的风险。
保持最小的湍流结构大于细胞有助于减少机械损伤的可能性。这不仅促进了更健康的细胞培养,还提高了生物反应器的整体性能。在生物反应器放大过程中,这一考虑变得更加重要,因为确保一致的剪切应力条件尤其困难。











