Steriliteettitestaus on kriittistä viljellyn lihan tuotannossa, jossa jopa pieni kontaminaatio voi johtaa kalliisiin eräepäonnistumisiin. Tämä prosessi varmistaa, ettei haitallisia mikro-organismeja häiritse bioreaktorin toimintaa, suojaten sekä tuotteen laatua että taloudellista kannattavuutta. Kontaminaatiotasojen keskiarvo on 11.2% - ja nousee 19.5% suurimittakaavaisessa tuotannossa - tuottajat kohtaavat merkittäviä haasteita steriilien ympäristöjen ylläpitämisessä.
Keskeisiä kohtia ovat:
- Pääasialliset kontaminaatiolähteet: Henkilöstö, raaka-aineet ja bioreaktorin toiminnot ovat yleisiä mikrobien sisääntulopisteitä.
- Testausmenetelmät: Kalvosuodatus suurille määrille, suora inokulaatio pienemmille näytteille ja biokuormitustestaus tuotannon aikana ovat laajalti käytössä.
- Reaaliaikainen seuranta: Työkalut, kuten liuenneen hapen anturit ja poiskaasuanalyysi, mahdollistavat mikrobitoiminnan varhaisen havaitsemisen.
- Nousevat teknologiat: AI-ohjattu seuranta, kylmäplasman sterilointi ja automatisoidut kuvantamisjärjestelmät tarjoavat nopeampaa ja tarkempaa kontaminaation hallintaa.
Viljellyn lihan tuottajille perinteisten steriiliystestien yhdistäminen kehittyneisiin seurantaratkaisuihin on olennaista riskien vähentämiseksi ja tuotannon tehokkuuden parantamiseksi.
Rocker Discover - Kuinka suorittaa steriiliystesti?
sbb-itb-ffee270
Kontaminaation lähteet bioreaktorijärjestelmissä
Erien epäonnistumisen estämiseksi bioreaktorijärjestelmissä on tärkeää tunnistaa, mistä kontaminaatio on peräisin. Kontaminantit jakautuvat tyypillisesti kolmeen pääkategoriaan: mikrobiologiset, partikkelit ja endotoksiinit. Jokainen tyyppi aiheuttaa ainutlaatuisia haasteita viljellyn lihan tuotannossa, joten on olennaista kehittää erityisiä ennaltaehkäiseviä strategioita.
Henkilöstö on ensisijainen saastumisen lähde, usein tuoden epäpuhtauksia ihon hilseilyn, virheellisen pukeutumisen tai huonon käsihygienian kautta [4][7]. Vaikka protokollat olisivat tiukat, yksinkertaiset liikkeet voivat häiritä ilmavirtausta, mikä johtaa turbulenssiin tai pysähtyneisiin alueisiin, joihin epäpuhtaudet voivat kerääntyä [4][9]. The U.S. Elintarvike- ja lääkevirasto korostaa riskejä, todeten, että "kaikki sterilisoidun lääkkeen, komponenttien, säiliöiden tai sulkimien manuaalinen tai mekaaninen käsittely ennen aseptista kokoonpanoa tai sen aikana aiheuttaa saastumisriskin ja vaatii siten huolellista valvontaa" [4].
Ympäristötekijät vaikuttavat myös merkittävästi.Esimerkiksi, epäonnistuminen ylläpitää positiivista painetta 10–15 Pascalia voi sallia suodattamattoman ilman pääsyn steriileille alueille [3][4]. Lisäksi ongelmat, kuten HEPA-suodattimien tehottomuus - jossa hiukkasten pidätys laskee alle 99.97% - tai heikentyneet paineilmasuodattimet voivat nopeasti vaarantaa steriiliyden [4].
Raaka-aineiden ja solulinjojen kontaminaatio
Bioreaktorijärjestelmään tulevat raaka-aineet ovat merkittävä kontaminaatioriski. Vahvistamattomat ainesosat, kasvatusväliaineen komponentit ja solulinjat (saatavilla erikoistuneiden B2B-markkinapaikkojen kautta) voivat tuoda mukanaan opportunistisia patogeeneja [2]. Soluviljelyväliaineen ravinteikas ympäristö on erityisen altis kontaminaatiolle, mikä tekee viljellyn lihan prosesseista haavoittuvampia verrattuna mikrobibioprosesseihin [8].
Lämpöherkät ainesosat, joita ei voida autoklavoida, ovat erityisen riskialttiita, koska ne vaativat vaihtoehtoisia sterilointimenetelmiä, kuten suodatusta [1][8]. Lisäksi inokulaatioprosessi itsessään sisältää luontaisia riskejä. Vaikka kalvot desinfioidaan alkoholilla tai toimenpiteet suoritetaan avotulen lähellä, ei ole absoluuttista takuuta kontaminaation estämiseksi solulinjan käyttöönoton aikana [8]. Nämä riskit korostavat perusteellisen raaka-aineiden tarkistuksen tärkeyttä ennen niiden käyttöönottoa järjestelmään.
Bioreaktorin toiminnalliset riskit
Päivittäiset toiminnot bioreaktoreissa tarjoavat lukuisia kontaminaatiomahdollisuuksia. Käsin otettavat näytteet ovat erityisen korkean riskin toimenpide, sillä jokainen pääsykohta lisää kontaminanttien pääsyn mahdollisuutta [1].Ongelmia, kuten vaurioituneet tiivisteet, rikkoutuneet O-renkaat tai sterilisoimattomat sulkimet, lisäävät riskiä [4][8]. Lisäksi materiaalien siirtäminen alempiluokitelluista alueista korkeampiluokiteltuihin vyöhykkeisiin ilman asianmukaista dekontaminaatiota on toinen kriittinen haavoittuvuus [7].
Tiukkojen ympäristövalvontatoimenpiteiden ylläpitäminen on ehdoton vaatimus. Puhdastilojen välisten paine-erojen tulisi olla jatkuvassa seurannassa, ja kaikki epätavalliset muutokset on tutkittava välittömästi [4]. Luokan 100 (ISO 5) kriittisillä alueilla partikkelimäärien, joiden koko on ≥0,5 μm, on pysyttävä alle 3 520 partikkelin kuutiometrissä toiminnan aikana [4].Lisäksi desinfiointiaineiden tai 70% isopropyylialkoholin aerosolointi lähellä ilmanäytteiden kerääjiä voi lisätä hiukkaslukemia, kun taas kondensaatti kaasusuodattimissa voi aiheuttaa tukkeumia tai edistää mikrobien kasvua [4][7].
Nämä toiminnalliset riskit korostavat tiukkojen steriiliystestausmenetelmien käyttöönoton tärkeyttä bioreaktoriprosessien suojaamiseksi.
Steriiliystestausmenetelmät bioreaktoreille
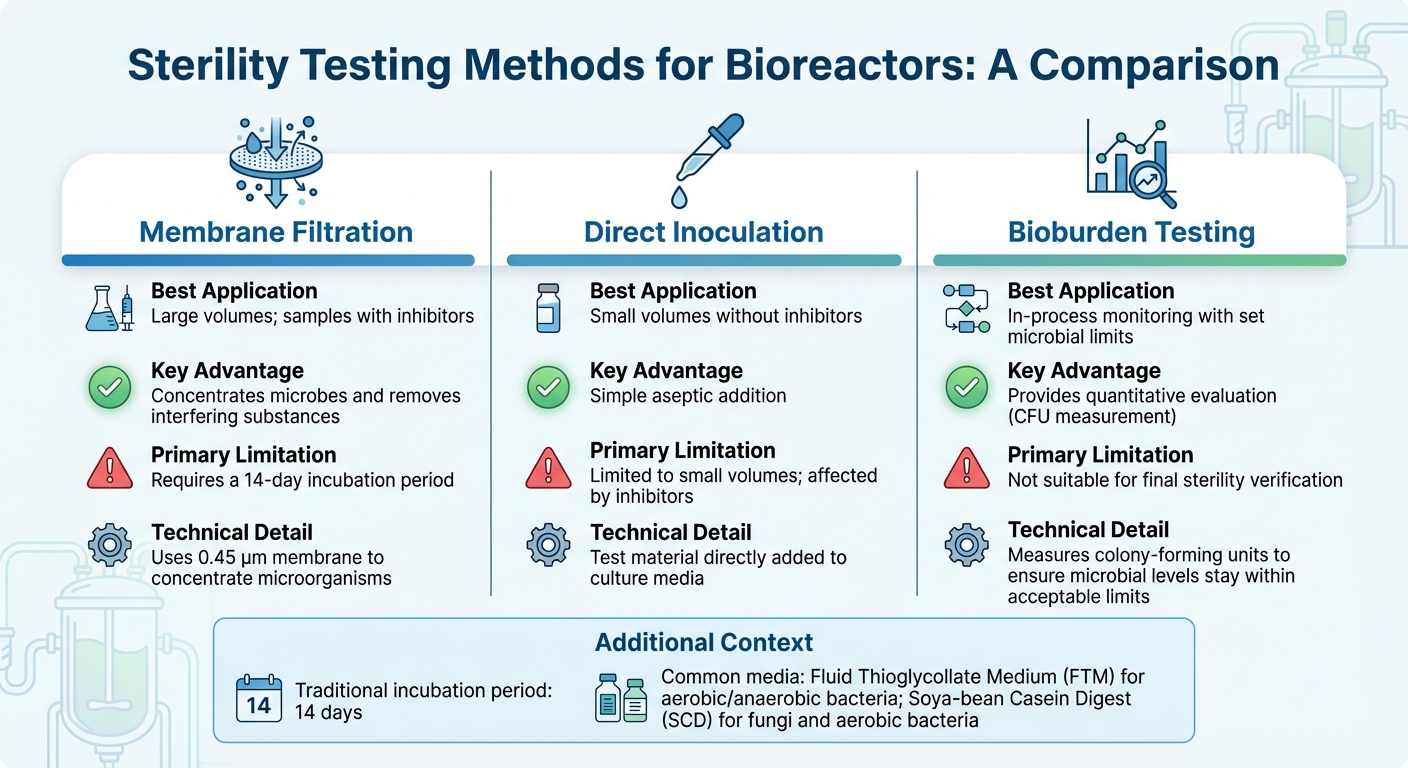
Bioreaktoreiden steriiliystestausmenetelmien vertailu
Oikean steriiliystestin valinta bioreaktoreille riippuu tekijöistä, kuten bioreaktorin koosta, tuotantovaiheesta ja skaalaushaasteista, sekä näytteen koostumuksesta - erityisesti kun estäviä aineita on läsnä. Useimmissa teollisissa sovelluksissa kalvosuodatus on ensisijainen menetelmä [3].Samaan aikaan molekyylitekniikat, kuten PCR, tarjoavat nopeamman tavan havaita tiettyjä epäpuhtauksia. Alla tarkastelemme menetelmiä, jotka on räätälöity viljellyn lihan tuotantoon, käsitellen sekä suurten että pienten näytteiden testauksen ainutlaatuisia haasteita.
Teollisen mittakaavan bioreaktoreissa yleisille suurivolyymisille näytteille kalvosuodatus käyttää 0,45 µm kalvoa mikro-organismien konsentroimiseksi, mikä parantaa havaitsemisherkkyyttä [10]. Tämä menetelmä on erityisen tehokas näytteille, jotka sisältävät antibiootteja, koska huuhtelu voi poistaa inhibiittorit ennen inkubointia. Toisaalta suora inokulointi, jossa testimateriaali lisätään suoraan viljelyalustaan, toimii paremmin pienemmille näytemäärille, mutta sillä on vaikeuksia käsitellä inhiboivia aineita. Näytteiden konsentroinnin ja inhibiittorien poistamisen jälkeen inkubointi ja validointi varmistavat tulosten tarkkuuden.
Perinteiset steriliteettitestit perustuvat 14 päivän inkubaatioaikaan mikrobikasvun visuaaliseen varmistamiseen [3]. Yleisesti käytettyjä kasvualustoja ovat Fluid Thioglycollate Medium (FTM) aerobisten ja anaerobisten bakteerien osalta sekä Soya-bean Casein Digest (SCD) sienille ja aerobisten bakteerien osalta. Ennen minkään steriliteettitestin suorittamista on tärkeää varmistaa, ettei tuote estä mikrobikasvua bakteriostaasi- ja fungistaasitestauksen avulla.
Jatkuvaan prosessiseurantaan kvantitatiivinen bioburden-testaus tarjoaa käytännöllisemmän ratkaisun kuin binääriset steriliteettitestit, erityisesti viljellyn lihan tuotannossa. Toisin kuin steriliteettitestit, jotka antavat yksinkertaisen läpäisy/hylkäystuloksen, bioburden-testaus mittaa pesäkkeitä muodostavia yksiköitä (CFU) varmistaakseen, että mikrobitasot pysyvät hyväksyttävissä rajoissa.Tämä menetelmä noudattaa uusia elintarvikelaatustandardeja, tasapainottaen tiukat farmaseuttiset valvonnat ja suurimittaisen elintarviketuotannon taloudelliset realiteetit.
Steriliteettitestaustarvikkeiden ja bioreaktoriratkaisujen osalta viljellyn lihan ammattilaiset voivat kääntyä luotettavien toimittajien puoleen, kuten
| Menetelmä | Paras sovellus | Keskeinen etu | Pääasiallinen rajoitus |
|---|---|---|---|
| Kalvosuodatus | Suuret määrät; näytteet, joissa on inhibiittoreita | Keskittää mikrobit ja poistaa häiritsevät aineet[3] | Vaatii 14 päivän inkubaatioajan[3] |
| Suora inokulaatio | Pienet määrät ilman inhibiittoreita | Yksinkertainen aseptinen lisäys | Rajoittuu pieniin määriin; inhibiittorit vaikuttavat[3] |
| Bioburden-testaus | Prosessin aikainen seuranta asetetuilla mikrobirajoilla | Tarjoaa kvantitatiivisen arvioinnin | Ei sovellu lopulliseen steriiliyden varmistamiseen [3] |
Reaaliaikainen seuranta ja steriiliyden varmistus
Perinteisiin 14 päivän steriilisyystesteihin luottaminen sisältää riskin menettää kokonaisia eriä, jos kontaminaatio havaitaan liian myöhään.Reaaliaikainen seuranta tarjoaa ennakoivan ratkaisun pitämällä silmällä kriittisiä prosessiparametreja niiden tapahtuessa. Tämä mahdollistaa välittömät toimenpiteet, jos jokin menee pieleen. Viljellyn lihan tuotannossa, jossa bioreaktorin ajot kestävät viikkoja ja käytetään kallista kasvatusalustaa, saastumisen varhainen havaitseminen voi säästää tuhansia puntia ja välttää tuotantoviiveet. Yhdistämällä reaaliaikaiset tiedot perinteisiin steriiliystesteihin, tuottajat voivat kuroa umpeen viivästyneen vahvistuksen ja nopean puuttumisen välisen kuilun.
Anturipohjainen seuranta
Avaintunnusmerkit, kuten liuennut happi (DO) ja pH-tasot, voivat varoittaa saastumisesta varhain. Kun bakteerit tai sienet tunkeutuvat bioreaktoriin, ne kuluttavat nopeasti happea - aiheuttaen DO-tasojen laskun - ja vapauttavat aineenvaihduntahappoja, jotka laskevat pH:ta merkittävästi [12]. Nämä muutokset voidaan havaita tunteja ennen kuin saastuminen tulee näkyväksi.Vaikka perinteiset steriiliystestit vahvistavat tulokset prosessin jälkeen, reaaliaikainen seuranta toimii turvatoimena, varmistaen prosessin pysymisen oikealla tiellä ja käsitellen kontaminaatioriskit aikaisemmin.
Poistokaasuanalyysi, käyttäen magneettisektori-massaspektrometriaa, mittaa jatkuvasti hapen ja hiilidioksidin tasoja bioreaktorin poistokaasussa. Kontrolloiduissa kontaminaatiotutkimuksissa tämä menetelmä tunnisti mikrobikasvun 22,4 tunnin kuluessa hapen muutosten kautta, kun taas pH-pohjainen havaitseminen viivästyi 25,8 tuntiin [13]. Magneettisektorisysteemit tarjoavat tarkkoja happimittauksia jopa 0.003% (v/v) tarkkuudella seitsemän päivän ajan, ylittäen perinteiset paramagneettiset detektorit, jotka ovat tarkkoja vain ±0.2% (v/v) [13].
Spektroskooppiset sensorit tarjoavat ei-invasiivista seurantaa kertakäyttöisten bioreaktoreiden seinien läpi, mikä on elintärkeää steriiliyden ylläpitämiseksi.UV-vis-spektroskopia voi havaita kalvovaurioita mittaamalla valon absorptiota 350–400 nm:n aallonpituudella, kun taas vuotaneet solunsisäiset aineet näkyvät 800–900 nm:n aallonpituudella [14]. Kapasitanssianturit, ainoat kaupallisesti saatavilla olevat anturit, jotka on suunniteltu mittaamaan elinkelpoisten solujen tiheyttä, saavuttavat tämän havaitsemalla muutoksia kalvon polarisaatiossa [14]. Laitoksille, jotka hallinnoivat useita bioreaktoreita, työkalut kuten Rapid Multi-Stream Sampler voivat valvoa jopa 16 kaasujohdetta samanaikaisesti [13].
Nämä anturipohjaiset järjestelmät, yhdistettynä ympäristön hallintalaitteisiin, kuten HVAC-kontaminaation estäminen, luovat vahvan puolustuksen kontaminaatiota vastaan.
Ympäristö- ja paineenhallinta
Positiivisen paineen ylläpitäminen puhdastilavyöhykkeiden välillä on ratkaisevan tärkeää estämään epäpuhtauksien pääsy [3].Positiiviset painejärjestelmät, kun ne yhdistetään HEPA-suodatukseen, toimivat fyysisinä esteinä mikrobien tunkeutumiselle. Kuulo- tai visuaaliset hälytykset HEPA-suodattimissa voivat välittömästi ilmoittaa henkilökunnalle, jos paine laskee hyväksyttävien tasojen alapuolelle [3].
Ei-elinkelpoisten hiukkasten laskenta on toinen puolustuskerros. Laseri-hiukkaslaskurit varmistavat jatkuvasti, että ympäristö täyttää ISO-ilman puhtausstandardit toiminnan aikana. Seuraamalla sekä 0,5 µm että 5,0 µm hiukkasia, nämä laitteet varmistavat, että ilmanlaatu pysyy vaadituissa rajoissa [7]. Jos odottamattomia poikkeamia ilmenee - kuten äkillinen DO:n lasku tai pH:n vaihtelu - vaikuttavan bioreaktorin välitön eristäminen ja syötön lisäysten keskeyttäminen voivat estää kontaminaation leviämisen [12].
Erikoistuneiden antureiden ja laitteiden hankintaan viljellyn lihan tuotantoon, yritykset kuten
Uudet teknologiat steriiliyden testauksessa
Perinteiset steriiliyden testausmenetelmät jäävät usein vajaiksi niiden pitkien 14 päivän inkubaatioaikojen ja manuaaliseen näytteenottoon perustuvan luonteensa vuoksi, mikä voi jättää tilaa havaitsemisaukkoihin. Uudemmat teknologiat astuvat esiin ratkaisemaan näitä haasteita, tarjoten nopeampaa ja tarkempaa kontaminaation havaitsemista. Tämä on erityisen tärkeää viljellyn lihan tuotannossa, jossa kasvatusalustan korkea hinta ja pitkät viljelyajat tekevät myöhäisvaiheen kontaminaatiosta taloudellisen painajaisen.
AI-ohjatut valvontajärjestelmät
Tekoäly muokkaa kontaminaation havaitsemista analysoimalla reaaliaikaisia tietoja mikrobien tunkeutumisen tunnistamiseksi.
Kun bakteerit tunkeutuvat bioreaktoriin, ne kuluttavat happea ja tuottavat aineenvaihduntahappoja, mikä johtaa liuenneen hapen ja pH-tasojen huomattaviin laskuihin. AI-järjestelmät voivat havaita nämä poikkeamat hapen ja ravinteiden kulutuksessa, mikä mahdollistaa mahdollisen kontaminaation havaitsemisen paljon aikaisemmin kuin perinteiset biokuormitustestit ja steriiliysprotokollat voivat tarjota tuloksia [12].
Nämä AI-alustat sisältävät myös matemaattisia malleja tarkan kontaminaatioajankohdan määrittämiseksi ja simuloivat, miten mikrobipopulaatiot kasvavat ajan myötä. Tämä auttaa operaattoreita jäljittämään kontaminaation sen lähteeseen, olipa kyseessä viallinen syöttölähde, operatiivinen virhe tai laiteongelma. Tekniikat, kuten Poissonin todennäköisyysanalyysi, parantavat edelleen biokuormitustestauksen tarkkuutta, vähentäen väärien negatiivisten tulosten todennäköisyyttä [12].
"Matemaattiset mallit auttavat arvioimaan kontaminaation alkamisaikaa ja mikrobien kasvudynamiikkaa, parantaen kontaminaation jäljitettävyyttä." - Naveenganesh Muralidharan, Vanhempi johtaja, MSAT, AGC Biologics [12]
Kun poikkeavuuksia havaitaan, välittömät toimenpiteet - kuten bioreaktorin eristäminen ja kaikkien syöttöjen keskeyttäminen - voivat estää ongelman leviämisen [12]. Järjestelmällinen lähestymistapa, joka sisältää bioburden-testauksen, molekyylitunnistuksen ja kasvunopeuden analyysin, on olennaista juurisyyn tunnistamiseksi ja korjaavien toimenpiteiden toteuttamiseksi. Nämä tekoälytyökalut yhdistävät perinteiset menetelmät ja ennakoivan kontaminaation hallinnan.
Kylmäplasman sterilointi
Kylmäplasman teknologia tarjoaa ei-lämpöisen sterilointivaihtoehdon, joka soveltuu erityisesti viljellyn lihan tuotantoon.Toimien huoneenlämpötilassa tai sen lähellä, se on ihanteellinen herkkien komponenttien, kuten bioreaktorin osien, antureiden ja muovien sterilointiin, jotka eivät kestä perinteisen autoklaavauksen kuumuutta [15][16][17]. Tämä menetelmä käyttää reaktiivisia happi- ja typpilajeja sekä UV-valoa mikrobikalvojen ja DNA:n häiritsemiseen. Se on tehokas laajaa saastuttajien kirjoa vastaan, mukaan lukien bakteerien itiöt (Bacillus, Clostridium), sienet, virukset ja jopa prionit [15][17].
Yksi kylmäplasman erottuvista ominaisuuksista on, että se ei jätä myrkyllisiä jäämiä. Kun virta katkaistaan, reaktiiviset lajit palautuvat nopeasti hapeksi, mikä poistaa desorptiovaiheen tarpeen [16][18].Se on myös energiatehokas, sillä se tarvitsee vain tavallisen sähköpistorasian fossiilisiin polttoaineisiin perustuvien lämmönlähteiden sijaan [15][16]. Esimerkiksi tutkimukset osoittavat, että kylmä plasma voi saavuttaa >5 logaritmin vähennyksen Bacillus cereus itiöissä 25 minuutissa 300W teholla [15].
Kuitenkin teknologialla on myös rajoituksensa. Sen sterilointivaikutukset ovat pääasiassa pintatasolla, mikä tarkoittaa, että se ei pysty tunkeutumaan monimutkaisiin geometrioihin, joissa mikrobit voivat piiloutua halkeamiin tai uurteisiin [15][16]. Korkea proteiini- tai rasvapitoisuus bioreaktoriympäristöissä voi myös suojata mikrobeja reaktiivisia lajeja vastaan, mikä vähentää steriloinnin tehokkuutta [15][18].
| Ominaisuus | Kylmä plasma |
|---|---|
| Edut | Ei-lämpöinen, myrkytön, energiatehokas, ei jäämiä, nopea [16] |
| Rajoitukset | Rajoitettu tunkeutuminen, heikentynyt teho monimutkaisissa geometrioissa [15][16] |
Automaattiset kuvapohjaiset tunnistusjärjestelmät
Lisäksi automaattiset kuvantamisjärjestelmät tarjoavat tehokkaan työkalun reaaliaikaiseen kontaminaation havaitsemiseen. Nämä järjestelmät tarjoavat yksityiskohtaisia morfologisia näkemyksiä solujen kasvusta, mikä on ratkaisevan tärkeää kontaminaatiomallien havaitsemiseksi niiden esiintyessä [19].Toisin kuin perinteinen offline-mikroskopia - joka vaatii manuaalista näytteenottoa ja värjäystä - automatisoitu kuvantaminen integroituu saumattomasti online- tai at-line-seurantajärjestelmiin. Tämä mahdollistaa operaattoreiden seurata biomassaa ja solujen terveyttä vaarantamatta steriiliyttä [19].
Vähentämällä manuaalisia toimenpiteitä, nämä järjestelmät vähentävät inhimillisiä virheitä ja parantavat toistettavuutta viljelyprosesseissa [19]. Kehittyneet kuvankäsittelyalgoritmit voivat seurata fermentaation edistymistä, optimoida metaboliittien tuotantoa ja varmistaa johdonmukaisuuden - kriittinen tekijä bioprosessien skaalaamisessa [19].
"Kehittyneiden näytteenottotekniikoiden saatavuus yhdistettynä automatisoituihin mittaustyökaluihin...voi merkittävästi vähentää aikaa, joka tarvitaan kannan valintaan, prosessikehitykseen ja prosessinhallintaan vähentämällä tuotanto-/viljelyprosessin vaiheita, erityisesti manuaalisia vaiheita, ja vähentämällä virheiden leviämistä." - A.C. Veloso ja E.C. Ferreira, Minhon yliopisto [19]
Huolimatta eduistaan, näiden järjestelmien integrointi ei ole aina yksinkertaista. Soluviljelmät ovat monimutkaisia, raaka-aineet vaihtelevat, ja antureiden on kestettävä ankaria sterilointimenetelmiä, kuten höyryä tai gammasäteilytystä [19]. Yrityksille, jotka haluavat ottaa käyttöön näitä teknologioita, alustat kuten
Päätelmä
Bioreaktorin steriiliyden varmistaminen viljellyn lihan tuotannossa ei ole pieni tehtävä, mutta integroitu steriliteettitestausstrategia voi tehdä siitä saavutettavan.Tämä strategia yhdistää perinteisiä menetelmiä, kuten kalvosuodatusta suuremmille näytemäärille ja suoraa inokulaatiota pienemmille, nykyaikaisiin molekyylityökaluihin, kuten PCR ja qPCR, nopeaan patogeenien seulontaan. Lisäksi ympäristön seuranta - ilmanäytteenoton ja pintapyyhkäisyn kautta - lisää ylimääräisen turvatoimen, käsitellen kontaminaatioriskejä HVAC -järjestelmissä, havaitsemalla mahdollisen kontaminaation ennen kuin se voi vaikuttaa tuotantoastioihin [11].
Testausmenetelmän valinta riippuu tekijöistä, kuten näytteen koosta, aineiden läsnäolosta, jotka saattavat häiritä tuloksia, ja siitä, keskitytäänkö täydelliseen steriiliyden validointiin vai pelkästään biokuorman seurantaan. Näytteenotto useista kohdista bioreaktorissa - ylhäältä, keskeltä ja alhaalta - auttaa luomaan perusteellisen mikrobiprofiilin ja vähentää paikallisen kontaminaation havaitsematta jäämisen mahdollisuutta [1].Tämä on erityisen kriittistä, koska viljellyn lihan tuotannon kontaminaatioriskit ovat huomattavasti korkeammat kuin biolääkevalmistuksessa, mikä korostaa tiukkojen steriiliysprotokollien tarvetta [6].
Avain väliaineen steriiliyden ylläpitämiseen bioreaktoreissa on oikeanlaisten laitteiden hankinta. Työkalut, kuten aseptiset näytteenottosysteemit esisteriloiduilla septoilla ja HEPA-suodattimet, jotka pystyvät sieppaamaan 99.97% yli 0,3 μm:n kokoisia hiukkasia, ovat välttämättömiä [4]. Alustat, kuten
Teollisuuden kasvaessa hybridisteriiliyslähestymistavat ovat yhä tärkeämpiä.Farmaseuttisen tason valvontatoimenpiteiden soveltaminen varhaisissa siementen kasvatusvaiheissa ja elintarviketason standardien omaksuminen suurimittakaavaisessa tuotannossa tasapainottaa turvallisuuden ja kustannustehokkuuden [5][6]. Nämä integroidut toimenpiteet ovat turvallisen ja tehokkaan viljellyn lihan tuotannon kulmakivi, kun ala kehittyy edelleen.
Usein kysytyt kysymykset
Mitkä ovat viljellyn lihan tuotannossa käytettävien bioreaktorijärjestelmien saastumisen pääasialliset syyt?
Saastuminen bioreaktorijärjestelmissä tapahtuu, kun steriili ympäristö häiriintyy tai kun ravinteikas kasvatusalusta tarjoaa ihanteellisen ympäristön mikrobeille. Tämä voi johtua useista tekijöistä, kuten näytteenoton, huollon tai solujen keräämisen aikana tapahtuneista rikkomuksista; vaurioituneista tai tukkeutuneista kaasusuodattimista; kasvatusalustassa jo olevasta saastumisesta; tai väliaikaisista aukoista, jotka syntyvät antureiden asentamisen tai huollon aikana.Sen lisäksi kulunut laitteisto voi irrottaa mikromuovihiukkasia, jotka voivat toimia mikro-organismien kotina.
Viljellyn lihan tuotannossa jopa pienin kontaminaatio voi vaarantaa erän sekä turvallisuuden että tuoton. Näiden riskien vähentämiseksi on tärkeää investoida korkealaatuisiin laitteisiin, kuten steriileihin suodattimiin, bioreaktoreihin ja anturisarjoihin, jotka noudattavat tiukkoja aseptisia standardeja. Alustat kuten
Kuinka tekoäly parantaa steriiliystestausta bioreaktoreissa?
AI-pohjaiset järjestelmät muuttavat steriiliystestausta viljellyn lihan bioreaktoreissa tarjoamalla reaaliaikaisia näkemyksiä jatkuvan seurannan kautta.Käyttämällä edistyneitä biosensoreita, nämä järjestelmät seuraavat kriittisiä tekijöitä, kuten pH, liuennut happi ja olennaiset metaboliitit, kuten glukoosi ja aminohapot. Kaikki tämä tapahtuu ilman manuaalisia tarkastuksia, mikä vähentää merkittävästi kontaminaatioriskiä.
Mikä erottaa nämä järjestelmät muista, on niiden kyky analysoida dataa algoritmien avulla, jotka vertaavat lukemia vakiintuneisiin steriiliysstandardeihin. Tämä tarkoittaa, että ne voivat havaita jopa pienimmätkin merkit mikrobikasvusta paljon aikaisemmin kuin perinteiset menetelmät. Pelkän havaitsemisen lisäksi ennakoiva analytiikka tulee mukaan, tunnistaen mahdolliset riskit, kuten ongelmat anturin asennuksen aikana tai porttien kautta tapahtuva pääsy. Nämä järjestelmät jopa ehdottavat korjaavia toimenpiteitä auttaakseen tuottajia välttämään kalliita erätappioita.
AI-tehostettu mikroskopia lisää tehokkuutta erottamalla välittömästi terveet solut ja kontaminantit, nopeuttaen steriiliyden varmistusprosesseja.Tuottajille alustat, kuten
Mitkä haasteet rajoittavat kylmäplasman steriloinnin käyttöä bioreaktoreissa viljellyn lihan tuotannossa?
Kylmäplasman sterilointi on tehokas mikrobien neutraloinnissa, mutta siihen liittyy haasteita, kun sitä sovelletaan bioreaktoreihin viljellyn lihan tuotannossa. Yksi merkittävä ongelma on plasman tuottamien reaktiivisten lajien rajallinen tunkeutumissyvyys. Tämä tekee suurten tilavuuksien tai tiheästi pakatun väliaineen perusteellisesta steriloinnista vaikeaa. Lisäksi tasaisen plasman peiton saavuttaminen koko reaktorissa tulee yhä vaikeammaksi järjestelmän koon kasvaessa.
Kylmäplasman järjestelmien skaalaaminen laboratoriotiloista kaupallisen mittakaavan bioreaktoreihin tuo mukanaan lisähaasteita.Suuremmat reaktorit vaativat korkeampia teho-tilavuus-suhteita, mikä voi johtaa sterilointiaikoihin, jotka ovat kaukana käytännöllisistä. Monet kylmäplasmajärjestelmät toimivat myös tyhjiöolosuhteissa tai tukeutuvat reaktiivisiin kaasuihin, mikä lisää monimutkaisuutta turvallisuuden, säädösten noudattamisen ja laitesuunnittelun osalta. Nämä tekijät tekevät menetelmästä vähemmän ihanteellisen suurille bioreaktoreille, joita tyypillisesti tarvitaan kaupallisessa viljellyn lihan tuotannossa.
Toinen huolenaihe on reaktiivisten happi- ja typpilajien (RONS) aiheuttama mahdollinen vahinko, jotka ovat avain mikrobien inaktivointiin. Nämä reaktiiviset lajit voivat vahingoittaa herkkiä nisäkässoluja tai heikentää väliaineen komponentteja, mikä vaatii huolellista optimointia solujen elinkelpoisuuden ylläpitämiseksi. Tämän seurauksena kylmäplasmaa käytetään usein yhdessä muiden sterilointitekniikoiden kanssa sen sijaan, että se olisi itsenäinen ratkaisu.











