O teste de esterilidade é crucial para a produção de carne cultivada, onde até mesmo uma contaminação menor pode levar a falhas de lote custosas. Este processo garante que nenhum microrganismo nocivo interrompa as operações do biorreator, protegendo tanto a qualidade do produto quanto a viabilidade financeira. Com taxas de contaminação em média de 11,2% - e subindo para 19,5% para produção em larga escala - os produtores enfrentam desafios significativos em manter ambientes estéreis.
Pontos principais incluem:
- Principais Fontes de Contaminação: Pessoal, matérias-primas e operações de biorreator são pontos de entrada comuns para micróbios.
- Métodos de Teste: Filtração por membrana para grandes volumes, inoculação direta para amostras menores e teste de biocarga durante a produção são amplamente utilizados.
- Monitoramento em Tempo Real: Ferramentas como sensores de oxigênio dissolvido e análise de gás residual permitem a detecção precoce de atividade microbiana.
- Tecnologias Emergentes: Monitoramento impulsionado por IA, esterilização por plasma frio e sistemas de imagem automatizados oferecem um gerenciamento de contaminação mais rápido e preciso.
Para produtores de carne cultivada, combinar testes de esterilidade tradicionais com soluções de monitoramento avançadas é essencial para reduzir riscos e melhorar a eficiência da produção.
Rocker Discover - Como Realizar um Teste de Esterilidade?
sbb-itb-ffee270
Fontes de Contaminação em Sistemas de Biorreatores
Para prevenir falhas em lotes nos sistemas de biorreatores, é crucial identificar de onde a contaminação se origina. Os contaminantes geralmente se dividem em três categorias principais: microbiana, particulada e endotoxina. Cada tipo apresenta desafios únicos para a produção de carne cultivada, tornando essencial o desenvolvimento de estratégias preventivas específicas.
O pessoal é a principal fonte de contaminação, muitas vezes introduzindo contaminantes através da descamação da pele, vestimenta inadequada ou má higiene das mãos [4][7]. Mesmo com protocolos rigorosos, movimentos simples podem perturbar o fluxo de ar, levando a turbulência ou áreas estagnadas onde contaminantes podem se acumular [4][9]. A U.S. Food and Drug Administration destaca os riscos envolvidos, afirmando que "qualquer manipulação manual ou mecânica do medicamento esterilizado, componentes, recipientes ou tampas antes ou durante a montagem asséptica representa o risco de contaminação e, portanto, requer controle cuidadoso" [4].
Fatores ambientais também desempenham um papel significativo.Por exemplo, não manter uma pressão positiva de 10–15 Pascals pode permitir que ar não filtrado entre em zonas estéreis [3][4]. Além disso, problemas como ineficiências de filtros HEPA - onde a retenção de partículas cai abaixo de 99,97% - ou filtros de gás comprimido comprometidos podem rapidamente comprometer a esterilidade [4].
Contaminação de Matéria-Prima e Linhagem Celular
Matérias-primas que entram no sistema de biorreator são um grande risco de contaminação. Ingredientes não verificados, componentes de meios de crescimento e linhagens celulares (disponíveis através de marketplaces B2B especializados) podem introduzir patógenos oportunistas [2]. O ambiente rico em nutrientes dos meios de cultura celular é particularmente suscetível à contaminação, tornando os processos de carne cultivada mais vulneráveis em comparação com bioprocessos microbianos [8].
Ingredientes sensíveis ao calor que não podem passar por autoclavagem são especialmente arriscados, pois requerem métodos alternativos de esterilização, como filtração [1][8]. Além disso, o próprio processo de inoculação carrega riscos inerentes. Mesmo quando as membranas são desinfetadas com álcool ou os procedimentos são realizados perto de uma chama aberta, não há garantia absoluta contra contaminação durante a introdução da linha celular [8]. Esses riscos destacam a importância de uma verificação minuciosa das matérias-primas antes de serem introduzidas no sistema.
Riscos Operacionais do Biorreator
As operações diárias dentro dos biorreatores apresentam inúmeras oportunidades de contaminação. A amostragem manual é particularmente de alto risco, pois cada ponto de acesso aumenta a chance de introduzir contaminantes [1].Questões como selos comprometidos, anéis de vedação danificados ou fechamentos não esterilizados aumentam ainda mais o risco [4][8]. Além disso, transferir materiais de áreas menos classificadas para zonas mais classificadas sem a devida descontaminação é outra vulnerabilidade crítica [7].
Manter controles ambientais rigorosos é inegociável. As diferenças de pressão entre as áreas de sala limpa devem ser monitoradas continuamente, e quaisquer alterações incomuns devem ser investigadas imediatamente [4]. Em áreas críticas Classe 100 (ISO 5), a contagem de partículas para tamanhos ≥0,5 μm deve permanecer abaixo de 3.520 partículas por metro cúbico durante as operações [4].Além disso, a aerossolização de desinfetantes ou álcool isopropílico a 70% perto de amostradores de ar pode aumentar as leituras de partículas, enquanto o condensado em filtros de gás pode causar obstruções ou incentivar o crescimento microbiano [4][7].
Esses riscos operacionais destacam a importância de implementar métodos rigorosos de teste de esterilidade para proteger os processos de biorreatores.
Métodos de Teste de Esterilidade para Biorreatores
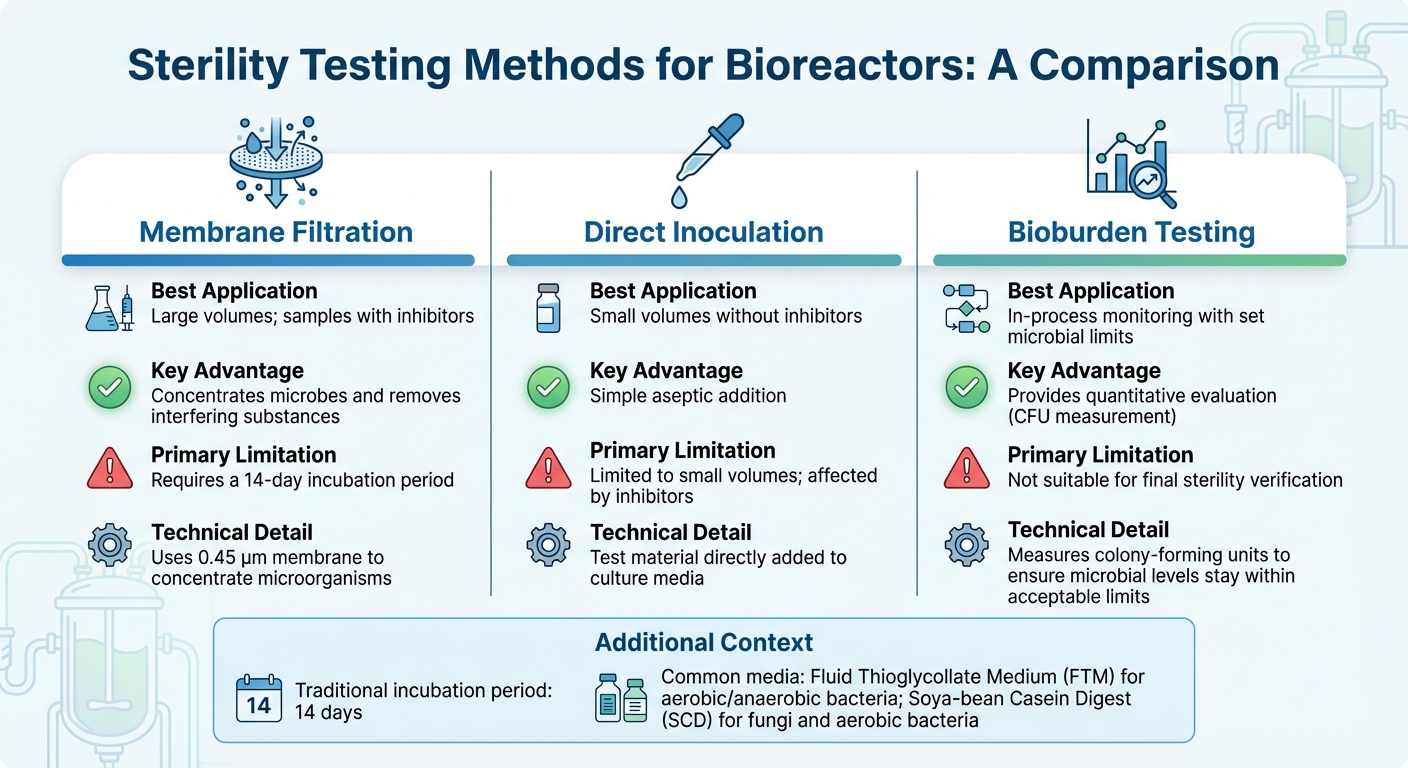
Comparação de Métodos de Teste de Esterilidade para Biorreatores
A seleção do teste de esterilidade adequado para biorreatores depende de fatores como o tamanho do biorreator, estágio de produção e desafios de escalonamento, e a composição da amostra - especialmente quando inibidores estão presentes. Para a maioria das aplicações industriais, filtração por membrana é o método preferido [3].Enquanto isso, técnicas moleculares como PCR oferecem detecção mais rápida para contaminantes específicos. Abaixo, exploraremos métodos adaptados à produção de carne cultivada, abordando os desafios únicos de testes de amostras grandes e pequenas.
Para amostras de grande volume, comuns em biorreatores em escala industrial, filtração por membrana emprega uma membrana de 0,45 µm para concentrar microrganismos, melhorando a sensibilidade de detecção [10]. Este método é particularmente eficaz para amostras contendo antibióticos, pois a lavagem pode eliminar inibidores antes da incubação. Por outro lado, inoculação direta, onde o material de teste é adicionado diretamente ao meio de cultura, funciona melhor para volumes de amostras menores, mas tem dificuldade em lidar com substâncias inibitórias. Após concentrar as amostras e remover os inibidores, a incubação e validação garantem a precisão dos resultados.
Os testes de esterilidade tradicionais dependem de um período de incubação de 14 dias para confirmar visualmente o crescimento microbiano [3]. Os meios comumente usados incluem Meio de Tioglicolato Fluido (FTM) para bactérias aeróbicas e anaeróbicas, e Digestão de Caseína de Soja (SCD) para fungos e bactérias aeróbicas. Antes de realizar qualquer teste de esterilidade, é crucial validar que o produto não inibe o crescimento microbiano através de testes de bacteriostase e fungistase.
Para monitoramento contínuo de processos, testes quantitativos de biocarga oferecem uma solução mais prática do que testes de esterilidade binários, particularmente na produção de carne cultivada. Ao contrário dos testes de esterilidade que fornecem um resultado simples de aprovação/reprovação, os testes de biocarga medem unidades formadoras de colônias (UFC) para garantir que os níveis microbianos permaneçam dentro dos limites aceitáveis. Este método está alinhado com os padrões emergentes de qualidade alimentar, equilibrando os rigorosos controles farmacêuticos com as realidades econômicas da produção de alimentos em larga escala.
Para suprimentos de teste de esterilidade e soluções de biorreatores, os profissionais de carne cultivada podem recorrer a fornecedores confiáveis como
| Método | Melhor Aplicação | Vantagem Principal | Limitação Primária |
|---|---|---|---|
| Filtração por Membrana | Grandes volumes; amostras com inibidores | Concentra microrganismos e remove substâncias interferentes [3] | Requer um período de incubação de 14 dias [3] |
| Inoculação Direta | Pequenos volumes sem inibidores | Adição asséptica simples | Limitado a pequenos volumes; afetado por inibidores [3] |
| Teste de Biocarga | Monitoramento em processo com limites microbianos definidos | Fornece uma avaliação quantitativa | Não adequado para verificação final de esterilidade [3] |
Monitoramento em Tempo Real e Garantia de Esterilidade
Confiar em testes de esterilidade tradicionais de 14 dias traz o risco de perder lotes inteiros se a contaminação for descoberta tarde demais.O monitoramento em tempo real oferece uma solução proativa ao observar parâmetros críticos do processo à medida que ocorrem. Isso permite uma ação imediata se algo der errado. Na produção de carne cultivada, onde as operações de biorreatores duram semanas e utilizam meios de crescimento caros, a detecção precoce de contaminação pode economizar milhares de libras e evitar atrasos na produção. Ao combinar dados em tempo real com testes de esterilidade convencionais, os produtores podem preencher a lacuna entre a confirmação atrasada e a intervenção rápida.
Monitoramento Baseado em Sensores
Indicadores chave como níveis de oxigênio dissolvido (DO) e pH podem sinalizar contaminação precocemente. Quando bactérias ou fungos infiltram um biorreator, eles rapidamente consomem oxigênio - fazendo com que os níveis de DO caiam - e liberam ácidos metabólicos que reduzem significativamente o pH [12]. Essas mudanças podem ser detectadas horas antes de a contaminação se tornar visualmente aparente.Enquanto os testes de esterilidade tradicionais confirmam os resultados após o processo, o monitoramento em tempo real atua como uma salvaguarda, garantindo que o processo permaneça no caminho certo e abordando os riscos de contaminação mais cedo.
Análise de gases de escape, usando espectrometria de massa de setor magnético, mede continuamente os níveis de oxigênio e dióxido de carbono no gás de exaustão de um biorreator. Em estudos de contaminação controlada, este método identificou crescimento microbiano em 22,4 horas através de mudanças de oxigênio, enquanto a detecção baseada em pH demorou 25,8 horas [13]. Os sistemas de setor magnético fornecem medições precisas de oxigênio com uma precisão de até 0,003% (v/v) ao longo de sete dias, superando os detectores paramagnéticos tradicionais, que são precisos apenas até ±0,2% (v/v) [13].
Sensores espectroscópicos fornecem monitoramento não invasivo através das paredes de biorreatores de uso único, o que é vital para manter a esterilidade.A espectroscopia UV-vis pode detectar danos na membrana medindo a absorção de luz em 350–400 nm, enquanto materiais intracelulares vazados aparecem em 800–900 nm [14]. Sondas de capacitância, os únicos sensores comercialmente disponíveis projetados para medir a densidade celular viável, conseguem isso detectando mudanças na polarização da membrana [14]. Para instalações que gerenciam múltiplos biorreatores, ferramentas como o Rapid Multi-Stream Sampler podem monitorar até 16 fluxos de gás simultaneamente [13].
Esses sistemas baseados em sensores, combinados com controles ambientais, como prevenção de contaminação HVAC, criam uma defesa robusta contra contaminação.
Controles Ambientais e de Pressão
Manter a pressão positiva entre zonas de sala limpa é crucial para evitar que contaminantes entrem [3].Sistemas de pressão positiva, quando combinados com filtração HEPA, atuam como barreiras físicas contra a intrusão microbiana. Alarmes audíveis ou visuais nos filtros HEPA podem notificar imediatamente a equipe se a pressão cair abaixo dos níveis aceitáveis [3].
A contagem de partículas não viáveis é outra camada de defesa. Contadores de partículas a laser verificam continuamente se o ambiente atende aos padrões de limpeza do ar ISO durante a operação. Ao monitorar partículas de 0,5 µm e 5,0 µm, esses dispositivos garantem que a qualidade do ar permaneça dentro dos limites exigidos [7]. Se ocorrerem desvios inesperados - como uma queda repentina no DO ou uma flutuação de pH - o isolamento imediato do biorreator afetado e a interrupção das adições de alimentação podem evitar que a contaminação se espalhe [12].
Para obter sensores especializados e equipamentos adaptados para operações de carne cultivada, empresas como
Novas Tecnologias em Testes de Esterilidade
Métodos tradicionais de teste de esterilidade muitas vezes falham devido aos seus longos períodos de incubação de 14 dias e à dependência de amostragem manual, o que pode deixar espaço para lacunas na detecção. Tecnologias mais recentes estão surgindo para enfrentar esses desafios, oferecendo detecção de contaminação mais rápida e precisa. Isso é especialmente crucial na produção de carne cultivada, onde o alto custo do meio de crescimento e os longos tempos de cultivo tornam a contaminação em estágio avançado um pesadelo financeiro.
Sistemas de Monitoramento Baseados em IA
A inteligência artificial está remodelando a detecção de contaminação ao analisar dados em tempo real para identificar intrusões microbianas.Quando bactérias invadem um biorreator, elas consomem oxigênio e produzem ácidos metabólicos, levando a quedas perceptíveis nos níveis de oxigênio dissolvido e pH. Sistemas de IA podem detectar essas desvios no consumo de oxigênio e nutrientes, sinalizando uma possível contaminação muito antes do que os testes de biocarga e protocolos de esterilidade tradicionais podem fornecer resultados [12].
Essas plataformas de IA também incorporam modelos matemáticos para identificar o momento exato em que a contaminação ocorreu e simular como as populações microbianas crescem ao longo do tempo. Isso ajuda os operadores a rastrear a contaminação até sua fonte, seja uma fonte de alimentação defeituosa, um erro operacional ou um problema de equipamento. Técnicas como a análise de probabilidade de Poisson aumentam ainda mais a precisão dos testes de biocarga, reduzindo a probabilidade de falsos negativos [12].
"Modelos matemáticos ajudam a estimar o tempo de introdução de contaminação e a dinâmica de crescimento microbiano, melhorando a rastreabilidade da contaminação." - Naveenganesh Muralidharan, Gerente Sênior, MSAT, AGC Biologics [12]
Quando anomalias são sinalizadas, ações imediatas - como isolar o biorreator e interromper todas as adições de alimentação - podem evitar que o problema se espalhe [12]. Uma abordagem sistemática envolvendo testes de biocarga, identificação molecular e análise de taxa de crescimento é essencial para identificar a causa raiz e implementar medidas corretivas. Essas ferramentas de IA preenchem a lacuna entre métodos tradicionais e o gerenciamento proativo de contaminação.
Esterilização por Plasma Frio
A tecnologia de plasma frio oferece uma opção de esterilização não térmica que é particularmente adequada para a produção de carne cultivada.Operando em ou próximo à temperatura ambiente, é ideal para esterilizar componentes sensíveis como partes de biorreatores, sensores e plásticos que não suportam o calor da autoclavação tradicional [15][16][17]. Este método utiliza espécies reativas de oxigênio e nitrogênio, juntamente com luz UV, para interromper membranas microbianas e DNA. É eficaz contra uma ampla gama de contaminantes, incluindo esporos bacterianos (Bacillus, Clostridium), fungos, vírus e até príons [15][17].
Uma das características de destaque do plasma frio é que ele não deixa resíduos tóxicos. Uma vez que a energia é desligada, as espécies reativas rapidamente se convertem em oxigênio, eliminando a necessidade de uma fase de dessorção [16][18].Também é eficiente em termos de energia, exigindo apenas uma tomada elétrica padrão em vez de fontes de calor baseadas em combustíveis fósseis [15][16]. Por exemplo, estudos mostram que o plasma frio pode alcançar uma &redução >5 log em esporos de Bacillus cereus em 25 minutos a 300W de potência [15].
No entanto, a tecnologia não está isenta de limitações. Seus efeitos de esterilização são principalmente superficiais, o que significa que tem dificuldade em penetrar em geometrias complexas onde os micróbios podem se esconder em fendas ou sulcos [15][16]. Alto teor de proteína ou gordura em ambientes de biorreatores também pode proteger micróbios ao capturar espécies reativas, reduzindo a eficiência da esterilização [15][18].
| Recurso | Plasma Frio |
|---|---|
| Vantagens | Não térmico, não tóxico, eficiente em termos de energia, sem resíduos, rápido [16] |
| Limitações | Penetração limitada, eficácia reduzida em geometria complexa [15][16] |
Sistemas Automatizados de Detecção Baseada em Imagem
Adicionando à mistura, sistemas de imagem automatizados fornecem uma ferramenta poderosa para detecção de contaminação em tempo real. Esses sistemas oferecem insights morfológicos detalhados sobre o crescimento celular, o que é crucial para identificar padrões de contaminação à medida que ocorrem [19].Ao contrário da microscopia offline tradicional - que requer amostragem e coloração manuais - a imagem automatizada se integra perfeitamente em configurações de monitoramento online ou at-line. Isso permite que os operadores monitorem a biomassa e a saúde celular sem comprometer a esterilidade [19].
Ao reduzir intervenções manuais, esses sistemas diminuem o erro humano e melhoram a reprodutibilidade em processos de cultivo [19]. Algoritmos avançados de processamento de imagem podem acompanhar o progresso da fermentação, otimizar a produção de metabólitos e garantir consistência - um fator crítico ao escalar bioprocessos [19].
"A disponibilidade de técnicas avançadas de amostragem combinadas com ferramentas de medição automatizadas...pode reduzir significativamente o tempo necessário para a seleção de cepas, desenvolvimento de processos e controle de processos, diminuindo o número de etapas no processo de produção/cultivo, especialmente etapas manuais, e reduzindo a propagação de erros." - A.C. Veloso e E.C. Ferreira, Universidade do Minho [19]
Apesar de suas vantagens, integrar esses sistemas nem sempre é simples. Culturas celulares são complexas, matérias-primas variam, e sensores devem suportar métodos de esterilização rigorosos como vapor ou irradiação gama [19]. Para empresas que buscam adotar essas tecnologias, plataformas como
Conclusão
Garantir a esterilidade do biorreator na produção de carne cultivada não é uma tarefa pequena, mas uma estratégia integrada de teste de esterilidade pode torná-la viável.Esta estratégia combina métodos tradicionais, como filtração por membrana para volumes de amostra maiores e inoculação direta para volumes menores, com ferramentas moleculares modernas, como PCR e qPCR, para triagem rápida de patógenos. Além disso, o monitoramento ambiental - por meio de amostragem de ar e swabbing de superfícies - adiciona uma proteção extra, abordando riscos de contaminação em sistemas HVAC, detectando contaminação potencial antes que possa impactar os vasos de produção [11].
A escolha da abordagem de teste depende de fatores como o tamanho da amostra, a presença de substâncias que possam interferir nos resultados e se o foco está na validação completa de esterilidade ou simplesmente no monitoramento da carga microbiana. A amostragem de múltiplos pontos no biorreator - topo, meio e fundo - ajuda a criar um perfil microbiano completo e reduz a chance de perder contaminações localizadas [1].Isso é particularmente crítico, dado que os riscos de contaminação na produção de carne cultivada são notavelmente maiores do que na fabricação biofarmacêutica, destacando a necessidade de protocolos rigorosos de esterilidade [6].
Essencial para manter a esterilidade do meio em biorreatores é obter o equipamento certo. Ferramentas como sistemas de amostragem asséptica com septos pré-esterilizados e filtros HEPA capazes de capturar 99,97% das partículas maiores que 0,3 μm são essenciais [4]. Plataformas como
À medida que a indústria cresce, abordagens híbridas de esterilidade estão se tornando cada vez mais importantes.Aplicar controles de grau farmacêutico durante as etapas iniciais de cultivo de sementes, enquanto adota padrões de grau alimentício para produção em larga escala, equilibra segurança e custo-benefício [5][6]. Essas medidas integradas serão a base para uma produção segura e eficiente de carne cultivada à medida que o campo continua a avançar.
Perguntas Frequentes
Quais são as principais causas de contaminação em sistemas de biorreatores usados para a produção de carne cultivada?
A contaminação em sistemas de biorreatores ocorre quando o ambiente estéril é interrompido ou quando meios ricos em nutrientes fornecem um ambiente ideal para a proliferação de micróbios. Isso pode ser causado por vários fatores, como falhas durante a amostragem, manutenção ou colheita de células; filtros de gás danificados ou bloqueados; contaminação já presente no meio de crescimento; ou aberturas temporárias criadas durante a instalação ou manutenção de sensores.Além disso, equipamentos desgastados podem liberar partículas de microplástico, que podem servir de lar para microrganismos.
Na produção de carne cultivada, até mesmo a menor contaminação pode comprometer tanto a segurança quanto o rendimento de um lote. Para reduzir esses riscos, é crucial investir em equipamentos de alta qualidade, como filtros estéreis, biorreatores e kits de sensores que atendem a rigorosos padrões assépticos. Plataformas como
Como a inteligência artificial melhora o teste de esterilidade em biorreatores?
Sistemas com tecnologia de IA estão transformando o teste de esterilidade em biorreatores de carne cultivada, oferecendo insights em tempo real por meio de monitoramento contínuo.Usando biossensores avançados, esses sistemas monitoram fatores críticos como pH, oxigênio dissolvido e metabólitos essenciais, como glicose e aminoácidos. Tudo isso acontece sem a necessidade de verificações manuais, o que reduz drasticamente o risco de contaminação.
O que diferencia esses sistemas é a capacidade de analisar dados usando algoritmos que comparam as leituras com padrões de esterilidade estabelecidos. Isso significa que eles podem detectar até os menores sinais de crescimento microbiano muito antes dos métodos tradicionais. Além da detecção, a análise preditiva entra em ação, identificando riscos potenciais, como problemas durante a instalação de sensores ou entrada através de portas. Esses sistemas até sugerem medidas corretivas para ajudar os produtores a evitar perdas de lotes custosas.
A microscopia com inteligência artificial adiciona outra camada de eficiência ao distinguir instantaneamente entre células saudáveis e contaminantes, acelerando os processos de verificação de esterilidade.Para os produtores, plataformas como
Quais desafios limitam o uso da esterilização por plasma frio em biorreatores para a produção de carne cultivada?
A esterilização por plasma frio é eficaz na neutralização de micróbios, mas apresenta um conjunto de desafios quando aplicada a biorreatores na produção de carne cultivada. Um problema importante é a profundidade de penetração limitada das espécies reativas produzidas pelo plasma. Isso dificulta a esterilização completa de grandes volumes ou meios densamente compactados. Além disso, alcançar uma cobertura uniforme de plasma em todo o reator torna-se cada vez mais difícil à medida que o tamanho do sistema aumenta.
Escalar sistemas de plasma frio de configurações de laboratório para biorreatores em escala comercial introduz obstáculos adicionais.Reatores maiores exigem relações potência-volume mais altas, o que pode resultar em tempos de esterilização que estão longe de ser práticos. Muitos sistemas de plasma frio também operam sob condições de vácuo ou dependem de gases reativos, adicionando camadas de complexidade em termos de segurança, conformidade regulatória e design de equipamentos. Esses fatores tornam o método menos ideal para os biorreatores em grande escala tipicamente necessários na produção comercial de carne cultivada.
Outra preocupação é o potencial de danos causados por espécies reativas de oxigênio e nitrogênio (RONS), que são fundamentais para a inativação microbiana. Essas espécies reativas podem prejudicar células mamíferas sensíveis ou degradar componentes do meio, necessitando de uma otimização cuidadosa para manter a viabilidade celular. Como resultado, o plasma frio é frequentemente usado em combinação com outras técnicas de esterilização, em vez de como uma solução independente.











