Sterilite testi, kültür et üretimi için kritik öneme sahiptir; çünkü küçük bir kontaminasyon bile maliyetli parti hatalarına yol açabilir. Bu süreç, biyoreaktör operasyonlarını aksatacak zararlı mikroorganizmaların olmadığını garanti eder, hem ürün kalitesini hem de finansal sürdürülebilirliği korur. Kontaminasyon oranları ortalama %11,2 olup, büyük ölçekli üretimde %19,5'e kadar çıkmaktadır; bu da üreticilerin steril ortamları korumada önemli zorluklarla karşılaşmasına neden olmaktadır.
Anahtar noktalar şunlardır:
- Başlıca Kontaminasyon Kaynakları: Personel, ham maddeler ve biyoreaktör operasyonları, mikropların yaygın giriş noktalarıdır.
- Test Yöntemleri: Büyük hacimler için membran filtrasyonu, daha küçük numuneler için doğrudan inokülasyon ve üretim sırasında biyoburden testi yaygın olarak kullanılmaktadır.
- Gerçek Zamanlı İzleme: Çözünmüş oksijen sensörleri ve gaz analizi gibi araçlar, mikrobiyal aktivitenin erken tespitini sağlar.
- Gelişen Teknolojiler: Yapay zeka destekli izleme, soğuk plazma sterilizasyonu ve otomatik görüntüleme sistemleri, daha hızlı ve daha hassas kontaminasyon yönetimi sunar.
Yetiştirilmiş et üreticileri için, geleneksel sterilite testlerini gelişmiş izleme çözümleriyle birleştirmek, riskleri azaltmak ve üretim verimliliğini artırmak için gereklidir.
Rocker Discover - Sterilite Testi Nasıl Yapılır?
sbb-itb-ffee270
Biyoreaktör Sistemlerinde Kontaminasyon Kaynakları
Biyoreaktör sistemlerinde parti hatalarını önlemek için, kontaminasyonun nereden kaynaklandığını belirlemek çok önemlidir. Kontaminantlar genellikle üç ana kategoriye ayrılır: mikrobiyal, partikül ve endotoksin. Her tür, yetiştirilmiş et üretimi için benzersiz zorluklar sunar ve bu nedenle belirli önleyici stratejiler geliştirmek esastır.
Personel, kontaminasyonun birincil kaynağıdır, genellikle deri dökülmesi, yanlış giyinme veya yetersiz el hijyeni yoluyla kirleticiler getirir [4][7]. Sıkı protokollere rağmen, basit hareketler hava akışını bozabilir, türbülans veya kirleticilerin birikebileceği durgun alanlar oluşturabilir [4][9]. U.S. Gıda ve İlaç İdaresi, sterilize edilmiş ilaç, bileşenler, kaplar veya kapakların aseptik montajdan önce veya sırasında herhangi bir manuel veya mekanik manipülasyonunun kontaminasyon riski taşıdığını ve bu nedenle dikkatli kontrol gerektirdiğini belirtmektedir [4].
Çevresel faktörler de önemli bir rol oynar.Örneğin, 10–15 Pascal pozitif basıncın korunamaması, filtrelenmemiş havanın steril bölgelere girmesine izin verebilir [3][4]. Ayrıca, partikül tutma oranının %99.97'nin altına düştüğü HEPA filtre verimsizlikleri veya sıkıştırılmış gaz filtrelerinin bozulması gibi sorunlar, steriliteyi hızla tehlikeye atabilir [4].
Hammadde ve Hücre Hattı Kontaminasyonu
Biyoreaktör sistemine giren hammaddeler büyük bir kontaminasyon riski taşır. Doğrulanmamış bileşenler, büyüme ortamı bileşenleri ve hücre hatları (özel B2B pazar yerleri aracılığıyla temin edilebilir) fırsatçı patojenler tanıtabilir [2]. Hücre kültürü ortamının besin açısından zengin ortamı, özellikle kontaminasyona karşı hassastır ve bu da kültive edilmiş et süreçlerini mikrobiyal biyoproseslere kıyasla daha savunmasız hale getirir [8].
Otoklavlama işlemine tabi tutulamayan ısıya duyarlı bileşenler özellikle risklidir, çünkü filtrasyon gibi alternatif sterilizasyon yöntemleri gerektirirler [1][8]. Ayrıca, aşılamanın kendisi de doğasında risk taşır. Membranlar alkolle dezenfekte edilse veya işlemler açık alev yakınında yapılsa bile, hücre hattı tanıtımı sırasında kontaminasyona karşı mutlak bir garanti yoktur [8]. Bu riskler, sistem içine tanıtılmadan önce hammaddelerin kapsamlı bir şekilde doğrulanmasının önemini vurgular.
Biyoreaktör Operasyonel Riskleri
Biyoreaktörlerdeki günlük operasyonlar birçok kontaminasyon fırsatı sunar. Manuel örnekleme özellikle yüksek risklidir, çünkü her erişim noktası kirletici madde tanıtma şansını artırır [1].Mühürlerin bozulması, O-ringlerin zarar görmesi veya sterilize edilmemiş kapaklar gibi sorunlar riski daha da artırır [4][8]. Ayrıca, daha düşük sınıflandırılmış alanlardan daha yüksek sınıflandırılmış bölgelere uygun dekontaminasyon olmadan malzeme transferi başka bir kritik zayıflıktır [7].
Sıkı çevresel kontrollerin sürdürülmesi tartışılmazdır. Temiz oda alanları arasındaki basınç farkları sürekli izlenmeli ve herhangi bir olağandışı değişiklik derhal araştırılmalıdır [4]. Sınıf 100 (ISO 5) kritik alanlarda, ≥0.5 μm boyutundaki partikül sayıları operasyonlar sırasında metreküp başına 3,520 partikülün altında kalmalıdır [4].Ayrıca, hava örnekleyicilerinin yakınında dezenfektan veya %70 izopropil alkol püskürtmek partikül okumalarını artırabilirken, gaz filtrelerindeki kondensat tıkanmalara neden olabilir veya mikrobiyal büyümeyi teşvik edebilir [4][7].
Bu operasyonel riskler, biyoreaktör süreçlerini korumak için titiz sterilite test yöntemlerinin uygulanmasının önemini vurgulamaktadır.
Biyoreaktörler için Sterilite Test Yöntemleri
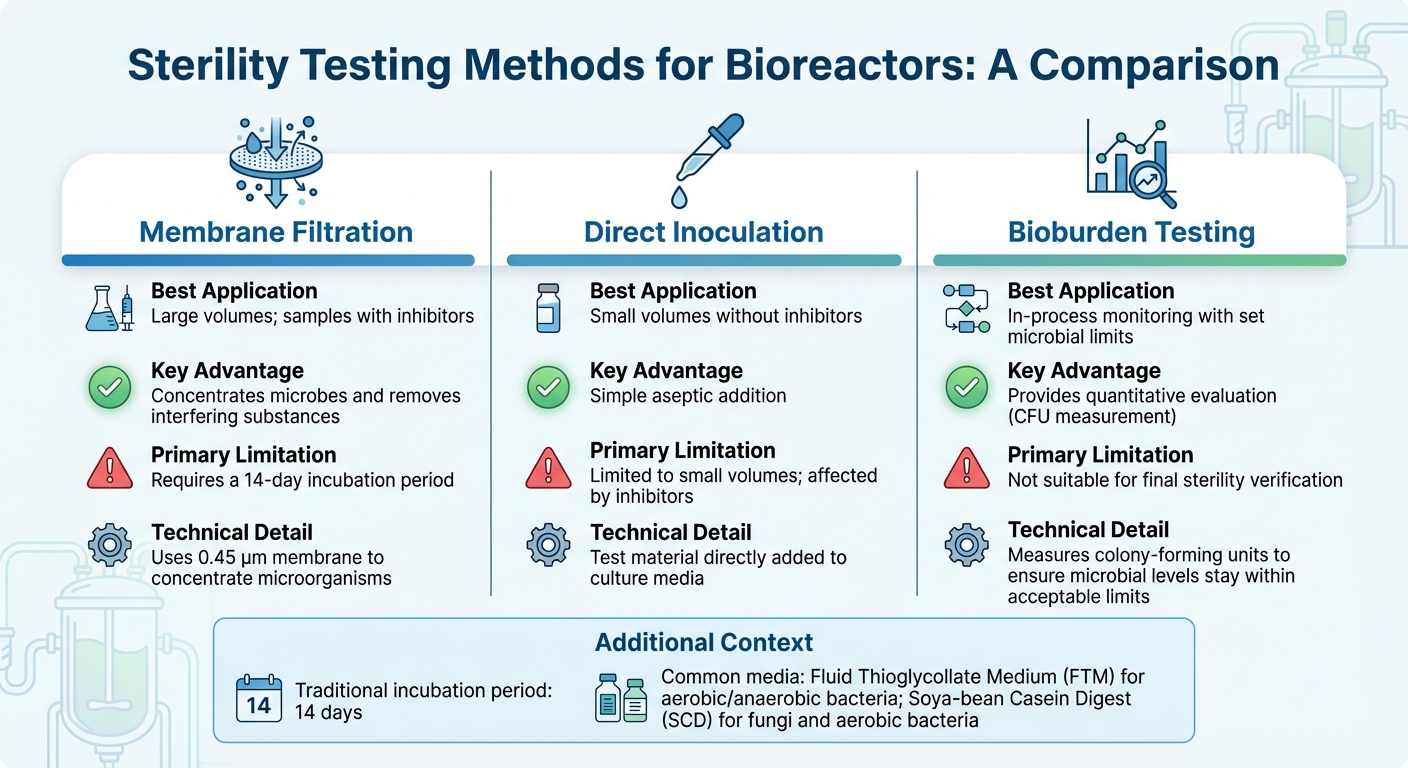
Biyoreaktörler için Sterilite Test Yöntemlerinin Karşılaştırılması
Biyoreaktörler için doğru sterilite testini seçmek, biyoreaktör boyutu, üretim aşaması ve ölçeklendirme zorlukları ve örneğin bileşimi gibi faktörlere bağlıdır - özellikle inhibitörler mevcut olduğunda. Çoğu endüstriyel uygulama için, membran filtrasyonu tercih edilen yöntemdir [3].Bu arada, PCR gibi moleküler teknikler belirli kirleticilerin daha hızlı tespit edilmesini sağlar. Aşağıda, hem büyük hem de küçük örnek testlerinin benzersiz zorluklarını ele alarak, kültür eti üretimine yönelik yöntemleri inceleyeceğiz.
Endüstriyel ölçekli biyoreaktörlerde yaygın olan büyük hacimli örnekler için, membran filtrasyonu mikroorganizmaları yoğunlaştırmak için 0.45 µm membran kullanır, tespit hassasiyetini artırır [10]. Bu yöntem, antibiyotik içeren örnekler için özellikle etkilidir çünkü durulama, inkübasyondan önce inhibitörleri ortadan kaldırabilir. Öte yandan, doğrudan inokülasyon, test materyalinin doğrudan kültür ortamına eklendiği yöntem, daha küçük örnek hacimleri için daha iyi çalışır ancak inhibitör maddelerle başa çıkmakta zorlanır. Örnekler yoğunlaştırıldıktan ve inhibitörler çıkarıldıktan sonra, inkübasyon ve doğrulama sonuçların doğruluğunu sağlar.
Geleneksel sterilite testleri, mikrobiyal büyümeyi görsel olarak doğrulamak için 14 günlük bir inkübasyon süresine dayanır [3]. Yaygın olarak kullanılan besiyerleri arasında aerobik ve anaerobik bakteriler için Fluid Thioglycollate Medium (FTM) ve mantarlar ve aerobik bakteriler için Soya-bean Casein Digest (SCD) bulunur. Herhangi bir sterilite testi yapmadan önce, ürünün bakteriyostaz ve fungistaz testleri yoluyla mikrobiyal büyümeyi engellemediğini doğrulamak önemlidir.
Sürekli süreç izleme için, kantitatif biyoburden testi, özellikle kültürlenmiş et üretiminde, ikili sterilite testlerinden daha pratik bir çözüm sunar. Basit bir geçme/kalma sonucu sağlayan sterilite testlerinin aksine, biyoburden testi, mikrobiyal seviyelerin kabul edilebilir sınırlar içinde kalmasını sağlamak için koloni oluşturan birimlerin (CFU) ölçümünü yapar. Bu yöntem, katı farmasötik kontroller ile büyük ölçekli gıda üretiminin ekonomik gerçekleri arasında bir denge kurarak ortaya çıkan gıda sınıfı standartlarıyla uyum sağlar.
Sterilite test malzemeleri ve biyoreaktör çözümleri için, kültive edilmiş et profesyonelleri
| Yöntem | En İyi Uygulama | Ana Avantaj | Birincil Sınırlama |
|---|---|---|---|
| Membran Filtrasyonu | Büyük hacimler; inhibitör içeren örnekler | Mikropları yoğunlaştırır ve engelleyici maddeleri uzaklaştırır [3] | 14 günlük inkübasyon süresi gerektirir [3] |
| Doğrudan Aşılama | İnhibitör içermeyen küçük hacimler | Basit aseptik ekleme | Küçük hacimlerle sınırlıdır; inhibitörlerden etkilenir [3] |
| Bioburden Testi | Belirlenmiş mikrobiyal limitlerle süreç içi izleme | Kantitatif bir değerlendirme sağlar | Son sterilite doğrulaması için uygun değil [3] |
Gerçek Zamanlı İzleme ve Sterilite Güvencesi
Geleneksel 14 günlük sterilite testlerine güvenmek, kontaminasyon çok geç keşfedilirse tüm partilerin kaybedilmesi riskiyle birlikte gelir.Gerçek zamanlı izleme, kritik süreç parametrelerini meydana geldikçe izleyerek proaktif bir çözüm sunar. Bu, bir şeyler ters gittiğinde anında müdahale edilmesine olanak tanır. Biyoreaktör çalıştırmalarının haftalar sürdüğü ve maliyetli büyüme ortamlarının kullanıldığı kültür et üretiminde, kontaminasyonun erken tespiti binlerce pound tasarruf sağlayabilir ve üretim gecikmelerini önleyebilir. Gerçek zamanlı verileri geleneksel sterilite testleriyle birleştirerek, üreticiler gecikmiş onay ile hızlı müdahale arasındaki boşluğu kapatabilir.
Sensör Tabanlı İzleme
Çözünmüş oksijen (DO) ve pH seviyeleri gibi anahtar göstergeler, kontaminasyonu erken sinyal verebilir. Bakteri veya mantarlar bir biyoreaktöre sızdığında, hızla oksijen tüketirler - bu da DO seviyelerinin düşmesine neden olur - ve pH'ı önemli ölçüde düşüren metabolik asitler salgılarlar [12]. Bu değişiklikler, kontaminasyon görsel olarak belirgin hale gelmeden saatler önce tespit edilebilir.Geleneksel sterilite testleri sonuçları işlem sonrasında doğrularken, gerçek zamanlı izleme bir güvenlik önlemi olarak hareket eder, sürecin yolunda gitmesini sağlar ve kontaminasyon risklerini daha erken ele alır.
Gaz analizi, manyetik sektör kütle spektrometrisi kullanarak, bir biyoreaktörün egzoz gazındaki oksijen ve karbondioksit seviyelerini sürekli olarak ölçer. Kontrollü kontaminasyon çalışmalarında, bu yöntem oksijen değişiklikleri yoluyla mikrobiyal büyümeyi 22.4 saat içinde tespit etti, pH tabanlı tespit ise 25.8 saat geride kaldı [13]. Manyetik sektör sistemleri, yedi gün boyunca %0.003 (v/v) hassasiyetle kesin oksijen ölçümleri sunar, geleneksel paramanyetik dedektörler ise yalnızca ±%0.2 (v/v) hassasiyete sahiptir [13].
Spektroskopik sensörler, tek kullanımlık biyoreaktörlerin duvarları aracılığıyla invaziv olmayan izleme sağlar, bu da steriliteyi korumak için hayati önem taşır.UV-vis spektroskopisi, 350–400 nm'de ışık emilimini ölçerek membran hasarını tespit edebilirken, sızan hücre içi materyaller 800–900 nm'de görünür [14]. Canlı hücre yoğunluğunu ölçmek için tasarlanmış tek ticari olarak mevcut sensörler olan kapasitans probları, bunu membran polarizasyonundaki değişiklikleri tespit ederek başarır [14]. Birden fazla biyoreaktörü yöneten tesisler için, Rapid Multi-Stream Sampler gibi araçlar aynı anda 16 gaz akışını izleyebilir [13].
Bu sensör tabanlı sistemler, HVAC kontaminasyon önleme gibi çevresel kontrollerle birleştiğinde, kontaminasyona karşı sağlam bir savunma oluşturur.
Çevresel ve Basınç Kontrolleri
Temiz oda bölgeleri arasında pozitif basıncı korumak, kirleticilerin girmesini önlemek için çok önemlidir [3].Pozitif basınç sistemleri, HEPA filtrasyon ile eşleştirildiğinde, mikrobiyal girişime karşı fiziksel bariyerler olarak işlev görür. HEPA filtreler üzerindeki işitsel veya görsel alarmlar, basınç kabul edilebilir seviyelerin altına düştüğünde personeli hemen bilgilendirebilir [3].
Canlı olmayan partikül sayımı, başka bir savunma katmanıdır. Lazer partikül sayıcılar, operasyon sırasında ortamın ISO hava temizliği standartlarını karşıladığını sürekli olarak doğrular. Hem 0.5 µm hem de 5.0 µm partikülleri izleyerek, bu cihazlar hava kalitesinin gerekli sınırlar içinde kalmasını sağlar [7]. Beklenmedik sapmalar meydana gelirse - ani bir DO düşüşü veya pH dalgalanması gibi - etkilenen biyoreaktörün derhal izole edilmesi ve besleme eklemelerinin durdurulması, kontaminasyonun yayılmasını önleyebilir [12].
Özelleştirilmiş sensörler ve ekipmanlar için kaynak sağlamak amacıyla,
Sterilite Testinde Yeni Teknolojiler
Geleneksel sterilite test yöntemleri, 14 günlük uzun inkübasyon süreleri ve manuel örneklemeye dayanmaları nedeniyle genellikle yetersiz kalır ve tespit boşluklarına yol açabilir. Daha yeni teknolojiler, bu zorlukları ele alarak daha hızlı ve daha hassas kontaminasyon tespiti sunar. Bu, özellikle büyüme medyasının yüksek maliyeti ve uzun yetiştirme süreleri nedeniyle geç aşama kontaminasyonun finansal bir kabus olduğu kültive et üretiminde çok önemlidir.
AI Destekli İzleme Sistemleri
Yapay zeka, mikrobiyal girişimleri tanımlamak için gerçek zamanlı verileri analiz ederek kontaminasyon tespitini yeniden şekillendiriyor.Bakteriler bir biyoreaktöre girdiğinde, oksijen tüketir ve metabolik asitler üretirler, bu da çözünmüş oksijen ve pH seviyelerinde belirgin düşüşlere yol açar. AI sistemleri, oksijen ve besin tüketimindeki bu sapmaları tespit edebilir, potansiyel kontaminasyonu geleneksel mikrobiyal yük testi ve sterilite protokollerinin sonuç verebileceğinden çok daha önce işaretleyebilir [12].
Bu AI platformları ayrıca, kontaminasyonun tam olarak ne zaman meydana geldiğini belirlemek ve mikrobiyal popülasyonların zamanla nasıl büyüdüğünü simüle etmek için matematiksel modelleri içerir. Bu, operatörlerin kontaminasyonu, hatalı bir besleme kaynağı, operasyonel bir aksaklık veya ekipman sorunu olup olmadığını izlemelerine yardımcı olur. Poisson olasılık analizi gibi teknikler, mikrobiyal yük testinin doğruluğunu daha da artırarak yanlış negatiflerin olasılığını azaltır [12].
"Matematiksel modeller, kontaminasyon giriş zamanını ve mikrobiyal büyüme dinamiklerini tahmin etmeye yardımcı olarak kontaminasyon izlenebilirliğini artırır." - Naveenganesh Muralidharan, Kıdemli Müdür, MSAT, AGC Biologics [12]
Anomaliler işaretlendiğinde, biyoreaktörü izole etmek ve tüm besleme eklemelerini durdurmak gibi hemen alınacak önlemler sorunun yayılmasını önleyebilir [12]. Biyoburden testi, moleküler tanımlama ve büyüme hızı analizini içeren sistematik bir yaklaşım, sorunun kök nedenini belirlemek ve düzeltici önlemler uygulamak için gereklidir. Bu yapay zeka araçları, geleneksel yöntemler ile proaktif kontaminasyon yönetimi arasındaki boşluğu doldurur.
Soğuk Plazma Sterilizasyonu
Soğuk plazma teknolojisi, özellikle kültürlenmiş et üretimi için uygun olan termal olmayan bir sterilizasyon seçeneği sunar.Oda sıcaklığında veya yakınında çalışarak, geleneksel otoklavlamanın ısısına dayanamayacak biyoreaktör parçaları, sensörler ve plastikler gibi hassas bileşenlerin sterilizasyonu için idealdir. Bu yöntem, mikrobiyal zarları ve DNA'yı bozmak için reaktif oksijen ve azot türlerini, UV ışığı ile birlikte kullanır. Bakteriyel sporlar (Bacillus, Clostridium), mantarlar, virüsler ve hatta prionlar dahil olmak üzere geniş bir kirletici yelpazesine karşı etkilidir [15][17].
Soğuk plazmanın öne çıkan özelliklerinden biri, toksik kalıntı bırakmamasıdır. Güç kapatıldığında, reaktif türler hızla oksijene geri döner, bu da desorpsiyon aşamasına olan ihtiyacı ortadan kaldırır [16][18].Aynı zamanda enerji tasarrufludur, fosil yakıt bazlı ısı kaynakları yerine sadece standart bir elektrik prizi gerektirir [15][16]. Örneğin, çalışmalar soğuk plazmanın >5 log Bacillus cereus sporlarını 25 dakika içinde 300W güçte azaltabileceğini göstermektedir [15].
Ancak, teknoloji sınırlamalarından yoksun değildir. Sterilizasyon etkileri öncelikle yüzey seviyesindedir, bu da mikropların çatlaklar veya oluklarda saklanabileceği karmaşık geometrilere nüfuz etmekte zorlandığı anlamına gelir [15][16]. Biyoreaktör ortamlarındaki yüksek protein veya yağ içeriği de reaktif türleri toplayarak mikropları koruyabilir ve sterilizasyonun verimliliğini azaltabilir [15][18].
| Özellik | Soğuk Plazma |
|---|---|
| Avantajlar | Termal olmayan, toksik olmayan, enerji verimli, kalıntı bırakmaz, hızlı [16] |
| Sınırlamalar | Sınırlı penetrasyon, karmaşık geometrilerde azalmış etkinlik [15][16] |
Otomatik Görüntü Tabanlı Tespit Sistemleri
Karışıma ek olarak, otomatik görüntüleme sistemleri, gerçek zamanlı kontaminasyon tespiti için güçlü bir araç sağlar. Bu sistemler, hücre büyümesi hakkında ayrıntılı morfolojik bilgiler sunar, bu da kontaminasyon kalıplarını meydana geldikçe tespit etmek için önemlidir [19].Geleneksel çevrimdışı mikroskopinin - manuel örnekleme ve boyama gerektiren - aksine, otomatik görüntüleme çevrimiçi veya hat içi izleme kurulumlarına sorunsuz bir şekilde entegre olur. Bu, operatörlerin biyokütle ve hücre sağlığını steriliteyi tehlikeye atmadan izlemelerine olanak tanır [19].
Manuel müdahaleleri azaltarak, bu sistemler insan hatasını azaltır ve yetiştirme süreçleri boyunca tekrarlanabilirliği artırır [19]. Gelişmiş görüntü işleme algoritmaları fermantasyon ilerlemesini izleyebilir, metabolit üretimini optimize edebilir ve tutarlılığı sağlayabilir - biyoproseslerin ölçeklendirilmesinde kritik bir faktör [19].
"Gelişmiş örnekleme tekniklerinin mevcudiyeti, otomatik ölçüm araçlarıyla birleştiğinde...üretim/kültivasyon sürecindeki adımların sayısını, özellikle manuel adımları azaltarak ve hata yayılımını keserek, suş seçimi, süreç geliştirme ve süreç kontrolü için gereken süreyi büyük ölçüde azaltabilir." - A.C. Veloso ve E.C. Ferreira, Minho Üniversitesi [19]
Avantajlarına rağmen, bu sistemlerin entegrasyonu her zaman kolay değildir. Hücre kültürleri karmaşıktır, ham maddeler değişkenlik gösterir ve sensörler buhar veya gama ışını gibi sert sterilizasyon yöntemlerine dayanmalıdır [19]. Bu teknolojileri benimsemek isteyen şirketler için,
Sonuç
Kültive edilmiş et üretiminde biyoreaktör sterilitesini sağlamak kolay bir iş değildir, ancak entegre bir sterilite test stratejisi bunu mümkün kılabilir.Bu strateji, daha büyük numune hacimleri için membran filtrasyonu ve daha küçük hacimler için doğrudan inokülasyon gibi geleneksel yöntemleri, hızlı patojen taraması için PCR ve qPCR gibi modern moleküler araçlarla birleştirir. Ayrıca, hava örneklemesi ve yüzey sürüntüsü yoluyla çevresel izleme, HVAC sistemlerindeki kontaminasyon risklerini ele alarak üretim kaplarını etkilemeden önce potansiyel kontaminasyonu yakalayarak ekstra bir güvenlik sağlar [11].
Test yaklaşımının seçimi, numune boyutu, sonuçları etkileyebilecek maddelerin varlığı ve odak noktasının tam sterilite doğrulaması mı yoksa sadece biyoyük izleme mi olduğuna bağlıdır. Biyoreaktörün birden fazla noktasından - üst, orta ve alt - örnekleme yapmak, kapsamlı bir mikrobiyal profil oluşturulmasına yardımcı olur ve lokalize kontaminasyonun gözden kaçma olasılığını azaltır [1]. Bu, özellikle kültürlenmiş et üretiminde kontaminasyon risklerinin biyofarmasötik üretime göre belirgin şekilde daha yüksek olması nedeniyle kritik bir öneme sahiptir ve bu da sıkı sterilite protokollerine olan ihtiyacı vurgulamaktadır [6].
Biyoreaktörlerde ortam sterilitesini korumanın anahtarı doğru ekipmanı temin etmektir. Önceden sterilize edilmiş septalı aseptik örnekleme sistemleri ve 0.3 μm'den büyük partiküllerin %99.97'sini yakalayabilen HEPA filtreler gibi araçlar gereklidir [4].
Endüstri büyüdükçe, hibrit sterilite yaklaşımları giderek daha önemli hale gelmektedir.Erken tohum tren aşamalarında farmasötik sınıfı kontrollerin uygulanması, büyük ölçekli üretim için gıda sınıfı standartların benimsenmesi, güvenlik ve maliyet etkinliği arasında bir denge kurar [5][6]. Bu entegre önlemler, alan ilerlemeye devam ettikçe güvenli ve verimli kültive edilmiş et üretiminin temel taşı olacaktır.
SSS
Kültive edilmiş et üretiminde kullanılan biyoreaktör sistemlerinde kontaminasyonun başlıca nedenleri nelerdir?
Biyoreaktör sistemlerinde kontaminasyon, steril ortamın bozulması veya besin açısından zengin ortamların mikropların gelişmesi için ideal bir ortam sağlaması durumunda meydana gelir. Bu, örnekleme, bakım veya hücre hasadı sırasında meydana gelen ihlaller; hasarlı veya tıkanmış gaz filtreleri; büyüme ortamında zaten mevcut olan kontaminasyon; veya sensörlerin kurulumu veya bakımı sırasında oluşturulan geçici açıklıklar gibi çeşitli faktörlerden kaynaklanabilir.Bunun yanı sıra, yıpranmış ekipman mikroplastik parçacıklar yayabilir ve bu parçacıklar mikroorganizmalar için bir yuva görevi görebilir.
Yetiştirilmiş et üretiminde, en küçük bir kontaminasyon bile bir partinin hem güvenliğini hem de verimini tehlikeye atabilir. Bu riskleri azaltmak için, steril filtreler, biyoreaktörler ve sıkı aseptik standartlara uygun sensör kitleri gibi yüksek kaliteli ekipmanlara yatırım yapmak çok önemlidir.
Yapay zeka biyoreaktörlerdeki sterilite testini nasıl geliştirir?
AI destekli sistemler, sürekli izleme yoluyla gerçek zamanlı içgörüler sunarak yetiştirilmiş et biyoreaktörlerinde sterilite testini dönüştürüyor.Gelişmiş biyosensörler kullanarak, bu sistemler pH, çözünmüş oksijen ve glikoz ve amino asitler gibi temel metabolitler gibi kritik faktörleri takip eder. Tüm bunlar manuel kontroller olmadan gerçekleşir, bu da kontaminasyon riskini önemli ölçüde azaltır.
Bu sistemleri ayıran özellik, okumaları belirlenmiş sterilite standartlarıyla karşılaştıran algoritmalar kullanarak verileri analiz etme yetenekleridir. Bu, mikrobiyal büyümenin en küçük belirtilerini bile geleneksel yöntemlerden çok daha önce tespit edebilecekleri anlamına gelir. Sadece tespit etmenin ötesinde, öngörücü analizler devreye girer, sensör kurulumu sırasında veya portlardan giriş gibi potansiyel riskleri tanımlar. Bu sistemler, üreticilerin maliyetli parti kayıplarından kaçınmalarına yardımcı olacak düzeltici önlemler bile önerir.
AI destekli mikroskopi, sağlıklı hücreler ile kontaminantları anında ayırt ederek sterilite doğrulama süreçlerini hızlandırarak başka bir verimlilik katmanı ekler.Üreticiler için,
Yetiştirilen et üretimi için biyoreaktörlerde soğuk plazma sterilizasyonunun kullanımını sınırlayan zorluklar nelerdir?
Soğuk plazma sterilizasyonu, mikropları nötralize etmede etkilidir, ancak yetiştirilen et üretiminde biyoreaktörlere uygulandığında bir dizi zorlukla birlikte gelir. Ana sorunlardan biri, plazma tarafından üretilen reaktif türlerin sınırlı penetrasyon derinliğidir. Bu, büyük hacimleri veya yoğun şekilde paketlenmiş ortamları tamamen sterilize etmeyi zorlaştırır. Bunun yanı sıra, sistem boyutu büyüdükçe, tüm reaktör boyunca eşit plazma kaplaması sağlamak giderek zorlaşır.
Soğuk plazma sistemlerini laboratuvar ortamlarından ticari ölçekli biyoreaktörlere ölçeklendirmek ek engeller getirir.Daha büyük reaktörler, sterilizasyon sürelerinin pratik olmaktan uzak olmasına neden olabilecek daha yüksek güç-hacim oranları gerektirir. Birçok soğuk plazma sistemi de vakum koşulları altında çalışır veya reaktif gazlara dayanır, bu da güvenlik, düzenleyici uyumluluk ve ekipman tasarımı açısından karmaşıklık katmanları ekler. Bu faktörler, yöntemi ticari kültürlenmiş et üretiminde tipik olarak gerekli olan büyük ölçekli biyoreaktörler için daha az ideal hale getirir.
Bir diğer endişe, mikrobiyal inaktivasyonun anahtarı olan reaktif oksijen ve azot türlerinin (RONS) neden olduğu potansiyel hasardır. Bu reaktif türler, hassas memeli hücrelerine zarar verebilir veya ortam bileşenlerini bozabilir, bu da hücre canlılığını korumak için dikkatli bir optimizasyon gerektirir. Sonuç olarak, soğuk plazma genellikle tek başına bir çözüm yerine diğer sterilizasyon teknikleriyle birlikte kullanılır.











