Kriyoprezervasyon, canlı hücrelerin zamanla canlılıklarını korumak için ultra düşük sıcaklıklarda dondurulması ve depolanması sürecidir. Bu yöntem, sürekli ve stabil hücre hatları sağlamak ve kontaminasyon veya ekipman arızası nedeniyle kayıpları önlemek için yetiştirilmiş et üretimi için kritik öneme sahiptir. Ana adımlar şunlardır:
- Hazırlık: Hücreleri büyüme aşamasında hasat edin, canlılıklarını kontrol edin (≥%90 hedefleyin) ve DMSO veya gliserol gibi kriyoprotektanlar ile dondurma ortamında hazırlayın.
- Dondurma: Buz kristali hasarını önlemek için kontrollü bir soğutma hızı (-1°C ile -3°C arasında dakikada) kullanın. Hücreleri uzun süreli koruma için sıvı azot buharında (-135°C ile -190°C arasında) depolayın.
- Çözme: Kriyoprotektan toksisitesini en aza indirmek için hücreleri 37°C su banyosunda hızlıca çözün, ardından iyileşme için büyüme ortamına aktarın.
- Kalite Kontrol: Etiketli şişeleri doğru bir şekilde etiketleyin, depolama koşullarını izleyin ve başarılı koruma sağlamak için çözülme sonrası canlılık testleri yapın.
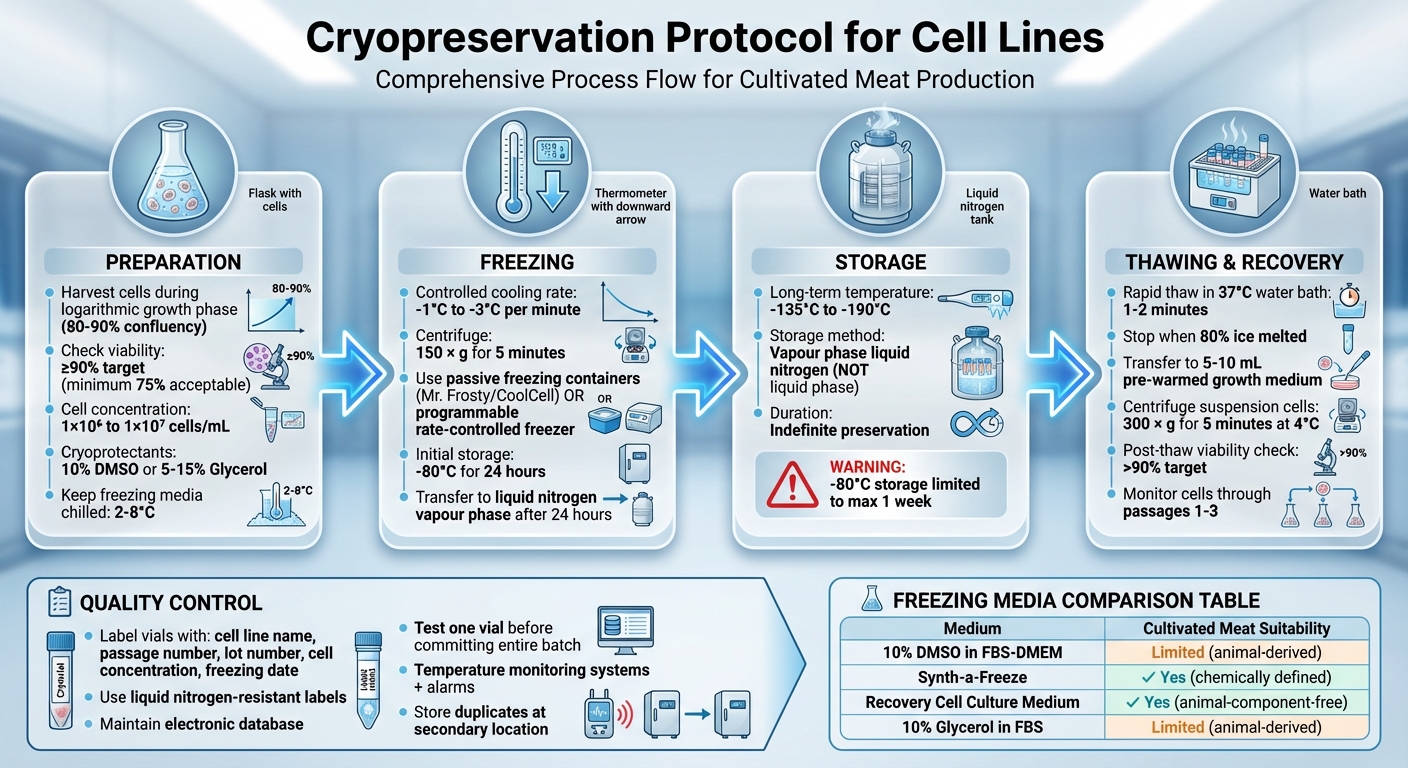
Hücre Hatları için Tam Kriyoprezervasyon Protokolü: Hazırlıktan Depolamaya 4 Adımlık Süreç
Kriyoprezervasyon için Hücrelerin Hazırlanması
Hücre Hasadı ve Canlılık Kontrolleri
Çözülme sonrası en iyi iyileşmeyi sağlamak için, hücreleri logaritmik (log) büyüme aşamasında hasat edin. Yapışkan hücre hatları için, bu genellikle %80–90 konfluens seviyesine ulaştıklarında gerçekleşir [2][3][6].
Hücrelerin canlılığını Trypan Mavi dışlama yöntemi ile kontrol edin. Hücre süspansiyonu ile 0.4% Trypan Mavi'nin eşit parçalarını (1:1) karıştırın, ardından hücreleri bir hemositometre kullanarak sayın.Geçerli hücreler boyayı dışlayacak ve mikroskop altında parlak görünecektir, oysa geçersiz hücreler mavi renkte boyanacaktır [4]. En iyi iyileşme oranları için en az %90'lık bir canlılık hedeflenmelidir, ancak bazı protokoller en az %75 kabul edebilir [1][2][3][5].
Hasat etmeden önce, bakteriyel veya fungal kontaminasyon olup olmadığını kontrol etmek için bir mikroskop kullanın. Sağlıklı süspansiyon hücreleri, ters faz-ışık mikroskobu altında parlak, yuvarlak ve kırılgan görünmelidir [2][3].
Hücreler gerekli canlılık standartlarını karşıladığında, ön dondurma adımlarına geçin.
Ön Dondurma Hazırlıkları
Adherent hücreler için, trypsin veya TrypLE Express gibi nazik ayrıştırma yöntemleri kullanın ve hücre zarlarını zarar vermemek için inkübasyon süresini sınırlayın [5]. Hücreleri, hücre hattına bağlı olarak 1 × 10⁶ ile 1 × 10⁷ hücre/mL konsantrasyonunda hazırlayın [1][6]. Alikotlama sırasında, hücre süspansiyonunun eşit dağılımını sağlamak için sık sık karıştırıldığından emin olun [5].
Dondurma medyasını, dondurma işlemi başlamadan önce kriyoprotektanın toksisitesini azaltmak için yeniden süspansiyon sırasında 2°C ile 8°C arasında soğuk tutun [5]. Hücreler dondurma medyasında süspansiyona alındıktan sonra, hızlı bir şekilde dondurma protokolüne geçin [1].Hücreleri genetik kayma veya morfolojik değişiklik riskini azaltmak için mümkün olan en düşük pasaj sayısında her zaman kriyoprezerv edin [5][7].
Kriyoprezervatifler ve Dondurma Ortamı Seçimi
Kriyoprezervatif Seçenekleri ve Fonksiyonları
Dimetil sülfoksit (DMSO) yaygın olarak bir kriyoprezervatif olarak kullanılmaktadır, genellikle %10 konsantrasyonda [2]. Hücre zarlarını geçerek dondurma sırasında buz oluşumunu azaltarak çalışır. Ancak, DMSO oda sıcaklığında hücreler için toksik olabilir, bu nedenle hızlı çözülme, maruziyeti en aza indirmek ve hızla seyreltmek için gereklidir [1].
Gliserol DMSO'ya duyarlı hücre hatları için yararlı bir alternatif olarak hizmet eder, genellikle %5 ile %15 arasında değişen konsantrasyonlarda kullanılır [8].DMSO'nun istenmeyen farklılaşmalara neden olabileceği hücre tipleri için özellikle etkilidir [3] ve DMSO'ya kıyasla daha düşük toksisiteye sahip olma eğilimindedir.
Yetiştirilen et uygulamalarında, geleneksel dondurma protokolleri genellikle %90 Fetal Bovine Serum (FBS) ve %10 DMSO karışımını kullanır [1]. Ancak, hayvan kaynaklı bileşenlere bağımlılık, bu yöntemlerin ölçeklenebilirlik ve düzenleyici onay açısından sınırlamalarını beraberinde getirir [9]. Bu sorunları ele almak için, kimyasal olarak tanımlanmış ortamlar - Synth-a-Freeze veya Recovery Cell Culture Medium gibi - hayvan bileşeni içermeyen bir alternatif sunar. Bu ortamlar, hayvan kökenli bileşenlerle ilişkili zorlukları aşarken yüksek post-thaw hücre canlılığını korur [9].
Donma Ortamlarının Karşılaştırması
Yetiştirilen et üretiminde kullanılan çeşitli donma ortamlarının avantajları ve sınırlamaları hakkında bir inceleme:
| Ortam | Avantajlar | Dezavantajlar | Yetiştirilen Et Uygunluğu |
|---|---|---|---|
| %10 DMSO içeren FBS-DMEM | Belirlenmiş protokoller [1] | Hayvansal kaynaklı bileşenler içerir; parti değişkenliği [9] | Sınırlı ölçeklenebilirlik |
| Synth-a-Freeze | Kimyasal olarak tanımlanmış; tutarlı kalite; hayvansal bileşenlerden arındırılmış [9] | Daha yüksek başlangıç maliyeti [9] | Evet |
| İyileştirme Hücre Kültürü Ortamı | Kullanımı kolay; hızlı iyileşme için tasarlandı [9] | Belirli hücre hatları için optimizasyon gerekebilir | Evet |
| FBS içinde %10 Gliserol | DMSO'ya duyarlı hücreler için alternatif [1] | Hayvan kökenli serum kullanır [9] | Sınırlı ölçeklenebilirlik |
Şubat 2023'te, Tokyo Kadınlar Tıp Üniversitesi araştırmacıları, Hironobu Takahashi liderliğinde, doğru dondurma ortamının seçiminin önemini gösterdiler.CELLBANKER 1 ve 2 gibi ticari seçenekler kullanarak, bir yıl boyunca -80°C'de birincil sığır myojenik hücrelerini başarıyla kriyoprezerv ettikleri görülmüştür. Dikkate değer bir şekilde, bu hücreler çözülme sonrası, sağlam sarkomer yapıları ile kas dokusuna farklılaşma ve çoğalma yeteneklerini korumuşlardır [10].
Yetiştirilmiş et üretimi için, kimyasal olarak tanımlanmış ve GMP uyumlu ortamlar giderek daha fazla tercih edilmektedir. STEMCELL Technologies vurguladığı gibi:
Hücre ve gen terapisi gibi yüksek derecede düzenlenmiş alanlarda, ürünlerin kalite standartlarına göre tutarlı bir şekilde üretilip kontrol edilmesini sağlamak için GMP ile üretilmiş, tamamen tanımlanmış kriyoprezervasyon ortamlarının kullanılması önerilmektedir [9].
Platformlar,
Kriyoprezervasyon Prosedürü ve Soğutma Hızları
Aşamalı Dondurma Protokolü
Başarılı kriyoprezervasyonun anahtarı, dakikada -1°C ile -3°C arasında sabit bir soğutma hızını korumakta yatmaktadır[2]. Bu yavaş süreç, suyun hücrelerden yavaşça çıkmasına olanak tanır ve hücre zarlarını yırtabilecek zararlı içsel buz kristallerinin oluşumunu önler[1].
Hücreleri 150 x g'de 5 dakika[3] santrifüjleyerek başlayın. Santrifüjleme işlemi tamamlandıktan sonra, hücre pelletini 10% DMSO içeren soğuk bir dondurma ortamında 2–4×10⁶ hücre/mL[3] yeniden askıya alın.DMSO maruziyetini azaltmak için, bir sonraki adıma - dondurmaya - hızlıca geçin.
Hücre süspansiyonunu önceden etiketlenmiş kriyojenik şişelere dağıtın. Her şişe, hücre hattı adı, geçiş numarası, parti numarası, hücre konsantrasyonu ve dondurma tarihi gibi temel bilgileri açıkça belirtmelidir.[3]. Şişeler hazır olduğunda, uygun soğutma ekipmanını seçme ve kullanma zamanı.
Soğutma Ekipmanları ve Teknikleri
Şişeleri hemen kontrollü hızda soğutma cihazına yerleştirin. İzopropanol kullanan Nalgene "Mr Frosty" veya Corning "CoolCell" gibi pasif dondurma kapları popüler tercihlerdir. Bu araçlar, -80°C dondurucuda yerleştirildiğinde yaklaşık 1°C dakikada soğutma hızı elde edebilir.[2].
Daha büyük ölçekli operasyonlar için tutarlılığın kritik olduğu durumlarda, programlanabilir hız kontrollü dondurucu en iyi seçenektir. Sigma-Aldrich tarafından belirtildiği gibi:
ECACC düzenli olarak programlanabilir hız kontrollü dondurucu kullanmaktadır. Bu, hücreleri dondurmanın en güvenilir ve tekrarlanabilir yoludur[3].
Yaklaşık 24 saat -80°C'de beklettikten sonra, ampulleri sıvı azotun buhar fazına aktarın; burada sıcaklıklar -135°C ile -190°C arasında değişmektedir, uzun süreli depolama için[4]. Hücreleri -80°C'de bir haftadan daha uzun süre saklamaktan kaçının, çünkü bu onların canlılığını tehlikeye atabilir. Sonsuz koruma için -135°C'nin altındaki sıcaklıklar gereklidir[2]. Sıvı faz yerine buhar fazını kullanmak, yeterince düşük sıcaklıkları korurken çapraz kontaminasyon riskini azaltır.
Çözme ve İyileştirme Protokolleri
Çözme Süreci
Hücreleri hızlı bir şekilde çözmek, toksik kriyoprotektan maruziyetini sınırlamak ve buz kristallerinin zarar vermesini önlemek için çok önemlidir. Güvenlik için tam yüz vizörü ve yalıtımlı eldiven giymeyi unutmayın. Öncelikle kriyovialı sıvı azottan çıkarın ve birikmiş basıncı serbest bırakmak için kapağı hafifçe gevşetin. Ardından, kapağı tekrar sıkın.
Kapağın su seviyesinin üzerinde kalmasını sağlayarak vialı 37°C su banyosuna yerleştirin. 1-2 dakika veya sadece birkaç buz kristali kalana kadar çözülmesine izin verin. Çözüldükten sonra, steriliteyi korumak için vialın dışını %70 alkol ile silin.
Vialın içeriğini 5-10 mL önceden ısıtılmış büyüme ortamı içeren bir tüpe aktarın. Osmoz şokunu azaltmaya yardımcı olmak için ortamı yavaşça ekleyin. Süspansiyon hücre hatları ile çalışıyorsanız, hücre süspansiyonunu hemen 300 × g'de 5 dakika boyunca 4°C'de santrifüjleyin.Bu adım hücreleri pellet haline getirir ve kriyoprotektanı kaldırır. Santrifüjlemeden sonra hücreleri taze ortamda yeniden süspansiyon haline getirin. Yapışkan hücreler için santrifüj genellikle gereksizdir. Bunun yerine, hücreleri uygun bir kültür kabına doğrudan ekin ve ilk ortam değişiminde, genellikle 24 saat sonra, herhangi bir kalıntı DMSO'yu kaldırın.
Çözme Sonrası Değerlendirmeler
Çözme işleminden hemen sonra, hücre canlılığını kontrol edin ve iyileşmenin başarılı olduğunu doğrulayın. Bu değerlendirme için Trypan Mavisi dışlama yöntemini kullanın. İdeal olarak, hücre canlılığı %90'ı aşmalıdır [11], ancak en az %75 kabul edilebilir. 24 saat sonra, hücreleri faz kontrast mikroskobu altında inceleyin, yapışmayı doğrulayın, hücre yoğunluğunu değerlendirin ve herhangi bir kontaminasyon belirtisi olup olmadığını kontrol edin.
Hücrelerin normal proliferasyonu sağladığından ve beklenen özelliklerini koruduğundan emin olmak için 1-3 geçiş boyunca hücreleri izlemeye devam edin.Hücre hatlarının daha yavaş iyileştiği durumlarda, başlangıç fetal sığır serumu konsantrasyonunu yaklaşık %20 v/v'ye artırarak hayatta kalmayı iyileştirebilirsiniz.
sbb-itb-ffee270
Depolama ve Uzun Süreli Canlılık
Depolama Koşulları ve Süresi
Hücre hattı canlılığını uzun vadede korumak için, bunları -135°C'nin altındaki sıcaklıklarda depolamak esastır [7][2]. Bu, onların sonsuza dek korunmasını sağlar.
Yetiştirilmiş et hücre hatlarını depolamak için tercih edilen yöntem buhar fazı sıvı azotudur. Bu teknik, sıcaklıkları -135°C ile -190°C arasında tutarak uzun süreli koruma için ideal hale getirirken, sıvı faz depolamaya göre artırılmış güvenlik sunar.
Eğer hücreleri -80°C'de depolamanız gerekiyorsa, bunu 24 saatten bir haftaya kadar sınırlayın. Bunun ötesinde, hücre canlılığı azalabilir.Bu sıcaklıkta geçici depolama için, hücreleri mümkün olan en kısa sürede sıvı azot depolamasına aktarın.
Güvenli depolama için iç dişli ve O-ringli standart steril kriyojenik şişeler (1–2 mL) kullanın [4][5]. Her zaman kapalı kriyoşişeleri, çözülme sırasında şişe patlaması riskini azaltmak için sıvı azotun gaz fazında yerleştirin [5]. Ayrıca, toplu sıvı azot kaplarının en az yarı dolu tutulduğundan emin olun, böylece bir güvenlik tamponu sağlanmış olur.
Son olarak, hücrelerin uzun vadeli canlılığını sağlamak için titiz kalite kontrol önlemleri kritik öneme sahiptir.
Kalite Kontrol Kontrolleri
Depolanan hücre hatlarının güvenilirliğini sağlamak için, kalite kontrolü için katı protokollere uyun. Her şişeyi sıvı azota dayanıklı etiketlerle doğru bir şekilde etiketleyerek başlayın.Hücre hattı kimliği, lot numarası, geçiş numarası ve dondurma tarihini içeren temel bilgileri ekleyin. Her vial'in tam konumunu kaydetmek için elektronik bir veritabanı tutun, bu da depolama kaplarının açık kalma süresini azaltır [7][2].
Tüm partileri uzun süreli depolamaya göndermeden önce, kısa süreli gaz fazı depolama sonrasında bir vial'in canlılığını test edin. Bu adım, dondurma sürecinin başarılı olduğunu doğrulamaya yardımcı olur ve olası sorunları belirler [4][7][2]. Son derece değerli hücre stokları için, ekipman arızaları veya yerel felaketlere karşı korunmak amacıyla ikincil bir konumda yedeklerini depolamak akıllıca olacaktır [7][2].
Tüm depolama kaplarını, düşük sıvı azot seviyelerini tespit etmek için sıcaklık izleme sistemleri ve alarmlar ile donatın [7]. Ayrıca, sıvı azot ile çalışan personelin boğulma risklerini en aza indirmek için depolama alanlarında %18 oksijen (v/v) seviyesinde tetiklenecek oksijen alarmları kurun [7][2].
Mamalian hücre hatlarının kriyoprezervasyonu video protokolü
Sonuç ve Anahtar Noktalar
İşte yetiştirilmiş et üretiminde etkili kriyoprezervasyon için temel adımlar ve önerilerin hızlı bir özeti:
- Hücre Hasadı: Hücreleri, canlılığın %90'ı aştığından emin olarak, logaritmik büyüme aşamasında toplayın. Kriyoprotektan olarak %10 DMSO kullanın, ancak daha hassas hücre hatları için gliserol alternatif olabilir [11][1].
- Soğutma ve Depolama: Hücre bütünlüğünü korumak için kontrollü bir soğutma oranı sağlamak ve ampulleri buhar fazı sıvı azot depolamasına hızlı bir şekilde transfer etmek [11]
Roka Kakehi ve ark. tarafından yapılan bir çalışma, kriyoprezervasyonda hassasiyetin önemini vurgulamaktadır [10]:
"Kriyoprezervasyon kullanarak güvenilir ve tutarlı bir hücre kaynağı sağlamak, yetiştirilmiş et üretimi için umut verici hücrelerin stabil tedarikini artırmamıza olanak tanıyacaktır." - Roka Kakehi ve ark., Tokyo Kadınlar Tıp Üniversitesi
- Çözme Süreci: Hücreleri 37°C su banyosunda yaklaşık iki dakika boyunca çözün, buzun %80'i eridiğinde durun. Bu, DMSO toksisitesini azaltır ve hücre iyileşmesini artırır [1]. Başarıyı sağlamak ve gelecekteki prosedürleri ince ayar yapmak için çözme sonrası canlılık kontrolleri yapın.
Bu yöntemler, sıkı kalite kontrol uygulamaları ile el ele çalışır. Ampulleri her zaman doğru bir şekilde etiketleyin, düzenli kayıtlar tutun ve uzun süreli depolama öncesinde kapsamlı kontroller gerçekleştirin [11]. Özel kriyoprezervasyon ihtiyaçları için,
SSS
Yetiştirilmiş et üretiminde hücre hatlarını kriyoprezervasyon için kimyasal olarak tanımlanmış ortamların kullanılmasının avantajları nelerdir?
Kimyasal olarak tanımlanmış ortamlar, yetiştirilmiş et üretimi için hücre hatlarını kriyoprezervasyon konusunda birçok fayda sağlar. Hayvan kaynaklı serum gibi tanımsız bileşenleri ortadan kaldırarak, tutarlı ve öngörülebilir sonuçlar elde ederler - bu, hücre hatlarının uzun vadeli güvenilirliğini korumak için kritik bir faktördür.
Bir diğer önemli avantaj, kontaminasyon ve değişkenlik riskinin azalmasıdır. Bu, yalnızca daha yüksek kalite ve güvenlik standartlarını desteklemekle kalmaz, aynı zamanda yetiştirilmiş et endüstrisindeki düzenleyici talepler ve tüketici beklentilerini karşılamak için gereken hassasiyet ve ölçeklenebilirlikle mükemmel bir şekilde uyum sağlar.
Kriyoprotektan seçimi, dondurma ve çözme sırasında hücre hayatta kalmasını nasıl etkiler?
Kriyoprotektan seçimi, dondurma ve çözme sırasında hücre sağlığını korumada anahtar bir faktördür. İki yaygın kullanılan seçenek dimetil sülfoksit (DMSO) ve gliserol'dür; her birinin kendine özgü özellikleri vardır. DMSO, hücrelere hızlı bir şekilde nüfuz etme ve güçlü koruma sağlama yeteneği ile bilinir. Ancak, yüksek konsantrasyonlarda veya uzun süreli maruz kalma durumunda toksik hale gelebilir ve bu da hücre canlılığını azaltabilir.
Gliserol ise, daha az toksik olup doğrudan uygulanabilir.Zayıf yönü, hücre penetrasyonunun daha yavaş olmasıdır; bu, DMSO'ya kıyasla daha az anlık koruma ile sonuçlanabilir.
Doğru dengeyi sağlamak çok önemlidir. Kryoprotektanın konsantrasyonunu ve maruz kalma süresini doğru bir şekilde ayarlamak, hücreleri korurken toksisite riskini en aza indirmeye yardımcı olur. Ayrıca, en yüksek olası iyileşme oranlarını sağlamak için soğutma hızları ve depolama koşulları için en iyi uygulamalara uymak da gereklidir.
Kriyoprezervasyon sırasında soğutma hızını kontrol etmenin önemi nedir?
Genellikle –1°C ile –3°C arasında sabit bir soğutma hızını korumak, hücrelerin canlı kalması için anahtardır. Yavaş soğutma, hücrelerin kontrollü bir hızda dehidrate olmasına olanak tanır ve zararlı buz kristallerinin oluşma olasılığını azaltır; bu kristaller hücre zarlarını yırtabilir veya zarar verebilir.
Bu ölçülü yaklaşım, hücrelerin yapısını korur ve çözüldüklerinde hayatta kalma ve işlevselliklerini artırır.Hücre hatlarının başarılı uzun vadeli depolanması ve geri kazanımı için kesin soğutma protokollerine uymak esastır.











