Rühren ist entscheidend in der Produktion von kultiviertem Fleisch, um sicherzustellen, dass die Zellen Sauerstoff und Nährstoffe erhalten, während die Ansammlung von Abfall vermieden wird. Übermäßiges Rühren verursacht jedoch Probleme wie Zellablösung, Membranschäden und vermindertes Wachstum. Das richtige Gleichgewicht zu finden, ist besonders in groß angelegten Bioreaktoren wichtig, wo selbst kleine Anpassungen die Produktion beeinflussen können.
Wichtige Erkenntnisse:
- Optimales Rühren: Studien zeigen, dass 60 U/min in Rührkesselreaktoren ideal sind, um die Nährstoffzufuhr und die Scherbelastung auszugleichen.
-
Bioreaktortypen:
- Rührkessel: Effektives Mischen, aber Risiko hoher Scherbelastung.
- Wellenbioreaktoren: Sanftes Mischen, begrenzt durch Sauerstoffübertragung.
- Airlift-Systeme: Gleichmäßiges Mischen mit geringer Belastung, erfordert jedoch präzise Steuerung.
- Schutzmaßnahmen: Zusätze wie Poloxamer 188 und blasenfreie Sauerstoffanreicherung reduzieren Zellschäden.
- Skalierungsherausforderungen: Größere Systeme erhöhen das Scherrisiko, was eine präzise Überwachung und CFD-Modellierung erfordert.
Die Aufrechterhaltung einer präzisen Rührkontrolle ist entscheidend für die Skalierung der Produktion von kultiviertem Fleisch, während die Zellintegrität geschützt wird.
Wie Rühren das Zellwachstum und -überleben beeinflusst
Was aktuelle Studien zeigen
Jüngste Forschungen haben spezifische Rührschwellen identifiziert, die das Zellwachstum und -überleben beeinflussen. Eine ABM-CFD-Studie mit FS-4-Zellen auf Mikrokügelchen in einem 100 mL Rührkessel-Bioreaktor zeigte beispielsweise, dass 60 U/min die optimale Mischgeschwindigkeit ist. Bei dieser Geschwindigkeit werden Nährstoffe und Sauerstoff gleichmäßig verteilt, wobei die Scherspannung zwischen 0–80 mPa bleibt. Ein Überschreiten von 60 U/min führt jedoch zu Zellschäden und Ablösung aufgrund erhöhter Kräfte. Bei 220 U/min steigt die Impeller-Reynoldszahl von 1.444 auf 5.294,7, was auf einen Übergang zu turbulenter Strömung hinweist. Diese Turbulenz erzeugt Wirbel, die kleiner als die Mikrosphären sind, was die Zellen und ihre Membranen schädigen kann [2].
Eine andere Studie, die sich auf mesenchymale Stammzellen aus menschlichen Nabelschnüren konzentrierte, hob hervor, wie selbst geringfügige Erhöhungen der Rührintensität die Adhäsionsraten signifikant reduzieren. Dies zeigt die hohe Empfindlichkeit von adhärenten Zellen gegenüber mechanischem Stress [6].
Diese Erkenntnisse unterstreichen die Bedeutung einer präzisen Kalibrierung der Mischgeschwindigkeiten, die ein Schlüsselbereich der laufenden Verfeinerung bleibt.
Die richtige Mischintensität finden
Die Hauptaufgabe besteht darin, die minimale Rührgeschwindigkeit zu finden, die erforderlich ist, um Mikrosphären zu suspendieren (N<sub>js</sub>), ohne die Scherstressgrenzen zu überschreiten.Für Fleischzellen sind die idealen Bedingungen eine Energiedissipationsrate von etwa 1 mW·kg⁻¹ und eine Mischzeit von unter 10 Sekunden [1].
"Die Aufrechterhaltung eines günstigen Mikro- und Makroumfelds für Zellen, ohne sie übermäßigen mechanischen Belastungen durch Rühren auszusetzen, erfordert Innovation und Optimierung von Bioreaktordesigns und -prozessen" [2].
Übermäßige Agitation kann zwei schädliche Auswirkungen haben: sofortigen Zelltod, wenn der Stress eine kritische Schwelle überschreitet, und kumulativen Stress, der zur Ruhe führt. Beide Ergebnisse beeinträchtigen die Produktivität. Dies macht die präzise Kontrolle der Agitationsintensität zu einem kritischen Faktor für den kommerziellen Erfolg, insbesondere bei der Produktion im großen Maßstab. In Systemen mit Volumina von bis zu 20 m³ kann selbst minimale Agitation zu Zellablösungen führen, was die Komplexität der Skalierung bei gleichzeitiger Erhaltung der Zellviabilität verdeutlicht.
Einführung in Bioreaktoren: Mischen, Rühren & Scherung
Bioreaktor-Mischmethoden und ihre Auswirkungen
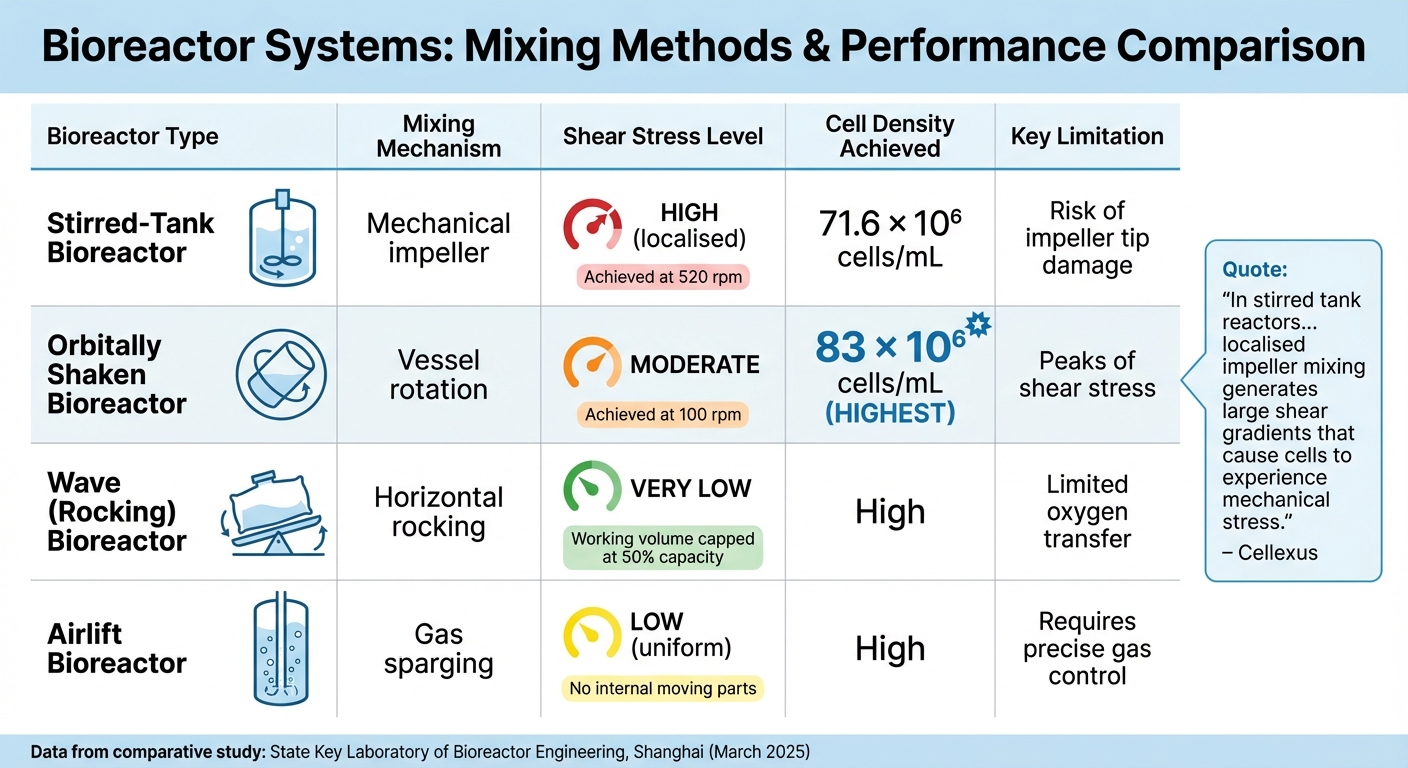
Vergleich von Bioreaktortypen für die Produktion von kultiviertem Fleisch
Vergleich verschiedener Bioreaktorsysteme
Das Design eines Bioreaktors spielt eine entscheidende Rolle bei der Balance von Nährstoffverteilung und der Bewältigung mechanischer Belastungen. Jeder Bioreaktortyp schafft unterschiedliche Mischbedingungen, die direkt das Überleben und die Produktivität der Zellen beeinflussen. Die Wahl des richtigen Systems bedeutet, ein Gleichgewicht zwischen effizienter Nährstoffzufuhr und der Minimierung mechanischer Kräfte zu finden, die den Zellen schaden könnten.
Rührkessel-Bioreaktoren verlassen sich auf mechanische Rührer, um die Kultur zu mischen. Rushton-Rührer erzeugen radiale Strömungen, die zu lokalisierten Scherzonen führen, insbesondere in der Nähe der Rührerspitzen.Im Gegensatz dazu erzeugen Schrägblatt- und Marineblatt-Rührer sanftere Strömungen, die besser für empfindliche Säugetierzellen geeignet sind. Eine im März 2025 vom State Key Laboratory of Bioreactor Engineering in Shanghai durchgeführte Studie verglich die Leistung von CHO-K1-Zellen in Rührkessel- und orbital geschüttelten Bioreaktoren. Das Rührkesselsystem erreichte 71,6 × 10⁶ Zellen/mL bei 520 U/min, während das orbital geschüttelte System 83 × 10⁶ Zellen/mL bei nur 100 U/min erreichte [4].
Wave (rocking) Bioreaktoren verzichten vollständig auf Rührer und verwenden einen Einwegbeutel, der auf einem Tablett schaukelt, um sanfte Wellen zur Durchmischung zu erzeugen. Diese Scherarme Umgebung ist ideal für fragile Zelllinien. Diese Systeme sind jedoch auf Oberflächenbelüftung angewiesen, was den Sauerstofftransfer in Hochdichtekulturen einschränken kann. Um eine effektive Wellenbildung aufrechtzuerhalten, ist das Arbeitsvolumen auf 50 % der Gesamtkapazität des Beutels begrenzt [7].
Airlift-Bioreaktoren verwenden pneumatische Durchmischung, bei der Gasdurchleitung die Flüssigkeit zwischen einem Steigrohr und einem Fallrohr zirkuliert. Da keine internen beweglichen Teile vorhanden sind, bieten Airlift-Systeme eine gleichmäßige Energiedissipation und geringere Scherkräfte im Vergleich zu Rührkesseln. Im Gegensatz zu Wellenbioreaktoren bieten Airlift-Designs aufgrund ihrer effizienten Zirkulation eine bessere Sauerstoffübertragung [7].
| Bioreaktortyp | Durchmischungsmechanismus | Scherbelastung | Erreichte Zelldichte | Hauptbegrenzung |
|---|---|---|---|---|
| Rührkessel | Mechanisches Rührwerk | Hoch (lokalisiert) | 71.6 × 10⁶ Zellen/mL | Risiko von Beschädigungen der Impellerspitze |
| Orbital geschüttelt | Gefäßrotation | Moderat | 83 × 10⁶ Zellen/mL | Spitzen der Scherbeanspruchung |
| Welle (Schaukeln) | Horizontales Schaukeln | Sehr niedrig | Hoch | Begrenzter Sauerstofftransfer |
| Airlift | Gasdurchströmung | Niedrig (gleichmäßig) | Hoch | Erfordert präzise Gassteuerung |
"In Rührkesselreaktoren... erzeugt die lokale Impellermischung große Schergradienten, die dazu führen, dass Zellen mechanischem Stress ausgesetzt sind." – Cellexus [7]
Mit der Skalierung von Bioreaktoren werden die Kompromisse zwischen Mischeffizienz und Zellschutz deutlicher.Rührkesselsysteme sind äußerst effektiv bei der Verteilung von Nährstoffen, erfordern jedoch sorgfältige Geschwindigkeitsanpassungen, um Zellschäden in Hochscherzonen zu vermeiden. Andererseits bieten Wellen- und Airlift-Bioreaktoren eine sanftere Durchmischung, wodurch das Risiko von Scherstress verringert wird, obwohl sie möglicherweise Schwierigkeiten bei der Sauerstoffversorgung in dichten Kulturen haben. Diese Vergleiche unterstreichen das empfindliche Gleichgewicht, das erforderlich ist, um großtechnische Bioprozesse zu optimieren und gleichzeitig die Zellintegrität zu schützen.
sbb-itb-ffee270
Reduzierung von Scherstress und Verbesserung des Zellwachstums
Neue Bioreaktordesigns und Schutzadditive
Die Minimierung von Scherstress ist entscheidend für die Förderung des Zellwachstums in der Produktion von kultiviertem Fleisch. Innovationen im Bioreaktordesign und der Einsatz von Schutzadditiven haben die Zellviabilität und die Mischeffizienz erheblich verbessert.Eine vielversprechende Methode umfasst orbital geschüttelte Bioreaktoren, die auf die Bewegung des Gefäßes und die Oberflächenbelüftung angewiesen sind, um die schädlichen Scherkräfte zu vermeiden, die durch rührwerksgetriebenes Mischen und Blasenbruch verursacht werden. Diese Systeme haben beeindruckende Ergebnisse gezeigt und 83 × 10⁶ Zellen/mL erzielt, verglichen mit 71,6 × 10⁶ Zellen/mL in traditionellen Rührkesselsystemen [4].
In Rührkesselsystemen macht auch die Geometrie des Rührwerks einen Unterschied. Radiale Rushton-Rührwerke erzeugen Strömungsmuster, die es den Zellen ermöglichen, sich in "ruhigen" Zonen zu erholen, wodurch die Auswirkungen hoher Scherkräfte reduziert werden. Wie Forscher von TTP beobachteten:
Zellen in radialen Rushton-Rührwerksreaktoren erholen sich während ruhiger Phasen, im Gegensatz zu denen in doppelaxialen Rührwerksystemen [5].
Für optimale Ergebnisse in der Produktion von kultiviertem Fleisch sollte die Rührwerksspitzen-Geschwindigkeit innerhalb von 0,6–1.8 m/s wird empfohlen, um das Zellwachstum zu schützen [9].
Schutzadditive wie Poloxamer 188 (Pluronic F-68) spielen eine Schlüsselrolle, indem sie die Oberflächenspannung an der Gas-Flüssigkeits-Grenzfläche reduzieren und Zellen vor Schäden während der Blasenbildung und -zerstörung schützen. Die ideale Konzentration für Poloxamer 188 beträgt 1 g/L, da höhere Mengen nur wenig zusätzlichen Nutzen bieten [9]. Für adhärente Zellen, die auf Mikrokügelchen wachsen, kann ein intermittierendes Rührregime die Ergebnisse weiter verbessern. Zum Beispiel fördert die Verwendung eines Musters von 30 Minuten AUS und 5 Minuten EIN während der Aussaatphase den Transfer von Kügelchen zu Kügelchen, während hydrodynamischer Stress minimiert wird. Dieser Ansatz hat es ermöglicht, dass Rindersatellitenzellen Dichten von 3 × 10⁶ Zellen/mL [3] erreichen.
Neben diesen Design- und Additivstrategien kann die Verbesserung der Sauerstoffzufuhr die Scherbelastung weiter reduzieren.
Verwendung von Blasenfreier Oxygenierung
Blasenfreie Oxygenierung bietet eine weitere effektive Möglichkeit, Zellen vor Schädigungen durch Scherkräfte zu schützen. Das Platzen von Blasen an der Gas-Flüssigkeits-Grenzfläche kann Energiedissipationsraten von bis zu 10⁶ bis 10⁸ W/m³ erzeugen, die weit über der subletalen Schwelle von 10⁴ W/m³ liegen, die die meisten tierischen Zellen tolerieren können [9] . Durch die Eliminierung von Blasen trägt diese Methode dazu bei, Hochdichtekulturen zu schützen.
Oberflächenbelüftung, die häufig in orbital geschüttelten und schaukelnden Bioreaktoren verwendet wird, ist besonders effektiv bei der Reduzierung von Scherkräften.Wie in einer kürzlich durchgeführten Studie hervorgehoben:
OSBs nutzen die Bewegung des Gefäßkörpers und die Oberflächenbelüftung, um Scherbeschädigungen, die durch traditionelle Rührblätter und Blasenbildung oder -bruch verursacht werden, effektiv zu mindern [4].
Schaukelbioreaktoren zeigen ebenfalls Potenzial für die Produktion von kultiviertem Fleisch. Sie bieten Vorteile wie Entsorgbarkeit, niedrige Betriebskosten und eine sanfte hydrodynamische Umgebung [8].
Allerdings steht die Oberflächenbelüftung bei sehr hohen Zelldichten vor Herausforderungen. Beispielsweise erreichte ein orbital geschüttelter Bioreaktor einen Sauerstoff-Massenübertragungskoeffizienten (kLa) von 20,12 h⁻¹ bei 100 U/min, was theoretisch Zelldichten von bis zu 118 × 10⁶ Zellen/mL unterstützt.In der Praxis jedoch, wenn die Zelldichte 80 × 10⁶ Zellen/mL überschreitet, erhöht sich die Viskosität der Suspension, was zu einem nicht-newtonschen, scherverdünnenden Verhalten führt, das die Sauerstoffübertragungseffizienz verringert. Dies unterstreicht die Notwendigkeit einer sorgfältigen Optimierung, wenn die Zelldichten steigen.
Steuerung der Agitation für die Großproduktion
Anpassung der Mischgeschwindigkeiten und Überwachungssysteme
In großtechnischen Systemen ist die präzise Kontrolle der Agitation entscheidend. Für die ersten 24 Stunden wird empfohlen, die Mischgeschwindigkeiten zwischen 30–50 U/min zu halten, um die Zellanhaftung an Mikrokörpern zu optimieren [6] . Eine Studie der East China University of Science and Technology aus dem Juni 2022 hebt die Bedeutung dieses Ansatzes hervor: Bei 45 U/min erreichten mesenchymale Stammzellen aus menschlichen Nabelschnüren eine 98.68% Adhärenzrate am Tag 1, während die Erhöhung der Geschwindigkeit auf 55 U/min die Adhärenzraten auf 51,32% [6] .
Nach der Anhaftungsphase sollte die Agitation die gerade aufgehobene Geschwindigkeit (N₍JS₎) leicht übersteigen, um Zellklumpenbildung zu verhindern. Untersuchungen zeigen, dass die Aufrechterhaltung einer Agitationsintensität nahe 1,3 × N₍JS₎ das Zellwachstum unterstützt, während ein Überschreiten auf 2 × N₍JS₎ das Wachstum aufgrund verringerter Anhaftungseffizienz hemmt [10] .
Kontinuierliche Überwachung ist entscheidend, angesichts der engen Betriebsgrenzen. Systeme wie der BioStar 1.5c Bioreaktor verwenden fortschrittliche Software, um Agitation und Gasfluss basierend auf Echtzeit-Feedback von gelösten Sauerstoff- (DO) und pH-Sonden anzupassen [6].Optische DO-Sensoren spielen hier eine entscheidende Rolle, indem sie die Präzision bieten, die erforderlich ist, um die Agitation nur dann fein abzustimmen, wenn die DO-Werte unter einen festgelegten Schwellenwert fallen - typischerweise um 40% - und dadurch die Scherbelastung zu minimieren [7] [6]. Das Team aus Ostchina verwendete diese Methode mit Mettler Toledo-Sonden, um den DO-Wert bei 40% und den pH-Wert bei 7,2 zu halten. Dieser Ansatz führte zu einer maximalen Zelldichte von 27,3 × 10⁵ Zellen/mL , was eine 2,9-fache Verbesserung gegenüber den Standard-Batch-Kulturtechniken darstellt [6].
Beim Hochskalieren sind Modelle der numerischen Strömungsmechanik (CFD) von unschätzbarem Wert, um die optimale Rührerdrehzahl zu bestimmen, um Mikrokörper in Schwebe zu halten, ohne die Schergrenzen zu überschreiten [10][6]. Anstatt einfach die Umdrehungen pro Minute zwischen den Gefäßen abzugleichen, schlägt die CFD-Analyse vor, die volumenmittlere Scherbelastungsrate zwischen den Reaktoren anzugleichen. Dies stellt sicher, dass die hydrodynamische Umgebung in einem größeren Bioreaktor - wie beim Hochskalieren von einem 200 mL Spinnerkolben zu einem 1,5 L Bioreaktor - förderlich für das Zellwachstum bleibt [6].
Diese Strategien unterstreichen die Bedeutung präziser Kontrolle und Überwachung beim Übergang zu fortschrittlichen Bioreaktorsystemen.
Finden von spezialisiertem Equipment durch Cellbase
Die Beschaffung des richtigen Equipments für die Produktion von kultiviertem Fleisch kann schwierig sein. Standard-Laborversorgungsplattformen decken oft nicht die spezifischen Bedürfnisse dieses Bereichs ab, wie z.B. Schaufelräder mit geringer Scherung oder optische gelöste Sauerstoffsensoren, die für hochdichte Säugetierzellkulturen ausgelegt sind. Hier erweist sich
Als erster dedizierter B2B-Marktplatz für die kultivierte Fleischindustrie verbindet
Ob Sie Ihre Überwachungssysteme aufrüsten oder spezialisierte Komponenten beschaffen, Plattformen wie
Fazit
Das richtige Gleichgewicht zwischen Sauerstoff- und Nährstoffzufuhr zu finden und gleichzeitig schädlichen Scherstress zu vermeiden, ist entscheidend für die Optimierung der Durchmischung in Bioreaktoren für kultiviertes Fleisch. Forschung zeigt, dass dies durch die Wahl der richtigen Bioreaktordesigns, die Feinabstimmung der Mischgeschwindigkeiten und den Einsatz von Schutzstrategien erreicht werden kann.
Techniken wie intermittierendes Rühren, radiale Rushton-Rührer und Echtzeitanpassungen, die durch CFD (Computational Fluid Dynamics) überwacht werden, spielen eine große Rolle dabei, sicherzustellen, dass sich Zellen gut erholen und stetig wachsen. Wenn die Produktion von Laborflaschen auf industrielle Volumina skaliert wird, wird das Verständnis des nicht-Newton'schen Fließverhaltens und die Aufrechterhaltung konsistenter Kolmogorov-Längenskalen entscheidend, um mechanische Schäden zu vermeiden. Diese Fortschritte erleichtern den Schutz der Zellen und vereinfachen die Skalierungsbemühungen.
Plattformen wie
FAQs
Welche Probleme kann übermäßige Agitation in Bioreaktoren für kultiviertes Fleisch verursachen?
Übermäßige Agitation in Bioreaktoren kann ein ernstes Problem für die Produktion von kultiviertem Fleisch darstellen, da sie das Zellwachstum und das Überleben negativ beeinflussen kann. Heftiges Mischen erzeugt hohe Scherkräfte, die empfindlichen tierischen Zellen schaden können. Diese Art von mechanischem Stress kann zu Zellmembranschäden, verringerter Lebensfähigkeit und sogar zu beeinträchtigter Gewebeentwicklung führen.
Um diese Herausforderungen zu vermeiden, ist es entscheidend, die Agitationsparameter fein abzustimmen.Das Ziel ist, ein Gleichgewicht zwischen effizientem Nährstoff- und Sauerstofftransfer zu erreichen und gleichzeitig mechanischen Stress zu minimieren. Wichtige Faktoren wie das Design des Rührwerks, die Mischgeschwindigkeit und die Geometrie des Bioreaktors müssen sorgfältig angepasst werden, um während des gesamten Kultivierungsprozesses gesunde, produktive Zellen zu erhalten.
Wie beeinflusst die Wahl des Bioreaktors das Zellwachstum und die Lebensfähigkeit in der Produktion von kultiviertem Fleisch?
Die Wahl des Bioreaktors in der Produktion von kultiviertem Fleisch ist entscheidend, da sie das Zellwachstum und die Gesundheit direkt beeinflusst, indem sie Faktoren wie Mischeffizienz, Sauerstofftransfer und Scherstress beeinflusst.
Rührkessel-Bioreaktoren sind eine beliebte Option für die großtechnische Produktion, da sie eine präzise Kontrolle über diese Bedingungen bieten. Sie können jedoch auch Scherkräfte erzeugen, die empfindliche Zellen schädigen könnten, weshalb es wichtig ist, das Design der Rührwerke und die Betriebsparameter fein abzustimmen, um Schäden zu minimieren.
Andere Designs, wie Airlift-Bioreaktoren , sind einfacher und verbrauchen weniger Energie. Aber sie bieten möglicherweise nicht das gleiche Maß an Kontrolle über das Mischen, was das Zellwachstum beeinträchtigen könnte. Andererseits ahmen Hohlfaser-Bioreaktoren Blutgefäße nach, um hohe Zelldichten zu unterstützen, obwohl ihre Skalierung eine Herausforderung sein kann.
Die Auswahl des richtigen Bioreaktors hängt davon ab, das richtige Gleichgewicht zwischen Faktoren wie Skalierbarkeit, Kosten und den spezifischen Bedürfnissen der Zellen zu finden, um sicherzustellen, dass sie effektiv wachsen und gedeihen für die Produktion von kultiviertem Fleisch.
Wie kann die Scherbelastung bei der großtechnischen Produktion von kultiviertem Fleisch reduziert werden?
Die Minimierung der Scherbelastung bei der großtechnischen Produktion von kultiviertem Fleisch erfordert sorgfältige Anpassungen des Bioreaktordesigns und -betriebs. Faktoren wie Impellertyp, Reaktorform und Mischeinstellungen spielen eine Schlüsselrolle.Beispielsweise kann die Reduzierung der Laufradspitzengeschwindigkeiten oder die Wahl spezifischer Laufraddesigns die Scherkräfte verringern, während dennoch eine ordnungsgemäße Durchmischung und Sauerstoffzufuhr gewährleistet wird, die für das Zellwachstum entscheidend sind.
Ein weiteres nützliches Werkzeug in diesem Prozess ist Computational Fluid Dynamics (CFD). CFD-Simulationen ermöglichen es Ingenieuren, Strömungsmuster und Scherverteilung im Detail zu untersuchen, was ihnen hilft, fundierte Designanpassungen vorzunehmen. Darüber hinaus bieten schaukelnde oder wellengemischte Bioreaktoren eine sanftere Alternative zu traditionellen Rührkesselsystemen, da sie von Natur aus geringere Scherkräfte erzeugen. Die Integration von Echtzeitüberwachung mit fortschrittlichen Sensoren und prädiktiven Steuerungsalgorithmen kann zusätzlich dazu beitragen, die Scherspannung innerhalb sicherer Grenzen zu halten und so einen reibungsloseren Produktionsprozess zu gewährleisten.











