Die Wahl zwischen bovinen und porcinen Zelllinien ist eine entscheidende Entscheidung für die Produktion von kultiviertem Fleisch. Jeder Zelltyp bietet unterschiedliche Vorteile und Herausforderungen, die die Skalierbarkeit, die Medienanforderungen und die Fähigkeit zur Herstellung strukturierter Fleischprodukte beeinflussen. Hier ist ein kurzer Überblick:
- Bovine Zelllinien eignen sich gut für die Produktion von Muskelgewebe, insbesondere für Produkte wie Steaks. Sie zeichnen sich durch Marmorierung aus, haben jedoch Herausforderungen bei der langfristigen Differenzierung und erfordern genetische Modifikationen für die Skalierbarkeit.
- Porcine Zelllinien sind ideal für die Fettproduktion, mit spontaner Immortalisierung und stabilem Wachstum über Hunderte von Verdopplungen. Sie sind kosteneffektiv für die Produktion im großen Maßstab, erfordern jedoch möglicherweise präzises Timing für die Ko-Differenzierung mit Muskelzellen.
Schneller Vergleich
| Attribut | Rinderzelllinien | Schweinezelllinien |
|---|---|---|
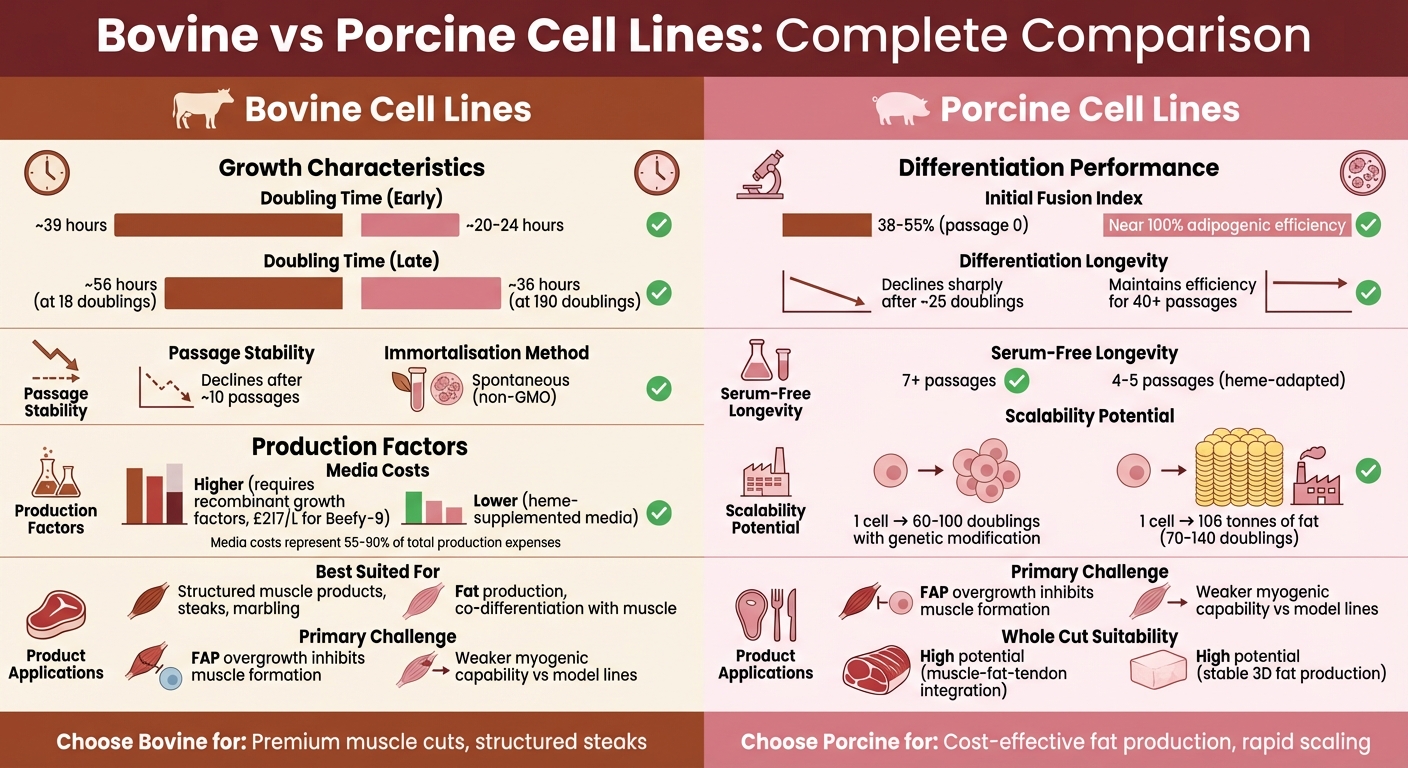
| Verdopplungszeit | ~39 Stunden (frühe Passagen) | 20–24 Stunden (frühe Passagen) |
| Immortalisierung | Erfordert genetische Modifikation | Spontan |
| Differenzierung | Stark früh, nimmt nach ~25 Verdopplungen ab | Stabile adipogene Effizienz (>200 Verdopplungen) |
| Medienkosten | Höher aufgrund rekombinanter Wachstumsfaktoren | Niedriger mit hämsupplementierten Medien |
| Eignung für strukturiertes Fleisch | Geeignet für Marmorierung und Muskel-Fett-Trennung | Effektiv für Fett-Muskel-Ko-Differenzierung |
Beide Zelllinien haben einzigartige Stärken und Einschränkungen, wodurch die Wahl von den Produktzielen und Produktionsstrategien abhängt.
Vergleich von Rinder- und Schweinezelllinien für die Produktion von kultiviertem Fleisch
Rinderzelllinien
Anwendungen in kultiviertem Fleisch
Rinderzelllinien sind besonders geeignet für die Herstellung von strukturierten Fleischprodukten wie Steaks und anderen Premiumstücken. Eine ihrer herausragenden Eigenschaften ist ihre Fähigkeit, authentische Marmorierung zu entwickeln - das intramuskuläre Fett, das für den unverwechselbaren Geschmack und die Textur von Rindfleisch verantwortlich ist. Diese Marmorierung wird durch die Rolle von Rindersatellitenzellen (BSCs) erreicht, die die Muskelkomponente bilden, und fibro-adipogene Vorläuferzellen (FAPs), die Fett mit einem Fettsäureprofil erzeugen, das nahezu identisch mit natürlichem subkutanem Rinderfett ist [2].
Die Schaffung einer ordnungsgemäßen Marmorierung erfordert eine sorgfältige Koordination während der Differenzierung. Im Gegensatz zu porcinen Systemen, die gleichzeitig Muskel und Fett differenzieren können, behandeln bovine Systeme typischerweise die Differenzierung von myogenen (muskelformenden) und adipogenen (fettformenden) Zellen separat. Diese Komponenten werden dann kombiniert, um eine präzise Kontrolle über das Fett-zu-Muskel-Verhältnis zu erreichen. Während diese Methode eine größere Anpassung ermöglicht, führt sie auch zu zusätzlicher Komplexität im Produktionsprozess [2].
Wachstumseigenschaften
Obwohl bovine Zellen effektiv sowohl Muskel als auch Fett erzeugen können, stellen ihre Wachstumsdynamiken Herausforderungen für die Massenproduktion dar. Ein zentrales Problem tritt bei bovinen Satellitenzellen auf, die ihre Fähigkeit zur Differenzierung verlieren, während sie sich weiter vermehren. Zum Beispiel können primäre bovine Myoblasten zwischen 60 und 100 Populationsverdopplungen durchlaufen, während sie einen normalen Karyotyp beibehalten.Allerdings sinkt ihre Fähigkeit, sich zu Myotuben zu fusionieren - ein wesentlicher Schritt für die Bildung von Muskelgewebe - nach etwa 25 Verdopplungen erheblich. Diese Einschränkung stellt einen Engpass für die Skalierung der Produktion dar, die etwa 2,9×10¹¹ Zellen pro Kilogramm Nassmasse erfordert [7].
Im Mai 2023 haben Forscher am Tufts University Centre for Cellular Agriculture dieses Problem angegangen, indem sie genetisch unsterbliche bovine Satellitenzellen (iBSCs) entwickelten. Durch die Einführung von bovinem Telomerase-Reverse-Transkriptase (TERT) und Cyclin-abhängiger Kinase 4 (CDK4) konnten diese Zellen über 120 Verdopplungen hinausgehen und dennoch mehrkernige Myotuben bilden. Andrew J.Stout von der Tufts University betonte die Bedeutung dieses Durchbruchs:
"Damit kultiviertes Fleisch im großen Maßstab erfolgreich ist, müssen Muskelzellen von lebensmittelrelevanten Arten in vitro schnell und zuverlässig expandiert werden, um jährlich Millionen von metrischen Tonnen Biomasse zu produzieren." [5]
Das Wachstumsverhalten wird auch stark von Faktoren wie der Aussaatdichte und der Medienformulierung beeinflusst. Zum Beispiel zeigten bovine, aus Fettgewebe gewonnene Stammzellen (bASCs) optimales Wachstum bei einer Aussaatdichte von 1.500 Zellen/cm² und erreichten eine 28-fache Expansion in Spinnerflaschen bei Verwendung einer 80%igen Medienaustauschstrategie [1]. Zusätzlich wurde gezeigt, dass chemisch definiertes serumfreies Medium das exponentielle Wachstum von bovinen Myoblasten bei Raten unterstützt, die 97% der mit traditionellem serumhaltigem Medium erreichten Raten erreichen [6] . Dies reduziert nicht nur die Kosten, sondern entspricht auch ethischen Überlegungen und macht es zu einem vielversprechenden Ansatz für die zukünftige Produktion.
Diese rinderspezifischen Wachstumseigenschaften bieten eine solide Grundlage für den Vergleich mit porcinen Zelllinien im Kontext der kultivierten Fleischproduktion.
sbb-itb-ffee270
Porcine Zelllinien
Anwendungen in kultiviertem Fleisch
Porcine Zelllinien sind entscheidend für die Produktion reifer unilokulärer Adipozyten, die natürlichem Schweinefett sehr ähnlich sind[9].
Ein herausragendes Beispiel ist die FaTTy-Zelllinie, die durch spontane Immortalisierung entstanden ist. Diese Zelllinie zeigt eine beeindruckende ~100% Adipogenese-Effizienz über 200 Verdopplungen und produziert Fettsäureprofile, die denen im nativen Schweinefett sehr nahe kommen. Kultivierte Adipozyten, die aus dieser Linie stammen, können Lipidvolumina von bis zu 96.670 μm³ erreichen.Da das FaTTy-Forschungsteam erklärt:
"FaTTy ist eine einzigartige Zelllinie von Nutztieren mit einem ausgeprägten adipogenen Phänotyp, der durch die Fähigkeit gekennzeichnet ist, sich unter verschiedenen Kulturbedingungen zuverlässig und hocheffizient zu differenzieren und reife Adipozyten zu erzeugen, die Fettsäureprofile aufweisen, die mit nativem Fett vergleichbar sind." [9]
Eine weitere bemerkenswerte Zelllinie, PK15H, gedeiht in hohen Häm-Medienkonzentrationen von bis zu 40 mM. Diese Eigenschaft hilft, die satte Farbe und den eisenreichen Geschmack zu replizieren, die typisch für traditionelles Schweinefleisch sind[3]. Darüber hinaus kann kultiviertes Schweinefett für gesündere Lipidzusammensetzungen fein abgestimmt werden, wobei Verhältnisse von einfach ungesättigten zu gesättigten Fettsäuren von 3,2 erreicht werden, verglichen mit dem Verhältnis von 1,4, das üblicherweise in nativem Gewebe vorkommt[9].
Wachstumsmerkmale
Porcine Zelllinien sind nicht nur geschickt in der Fettproduktion, sondern zeichnen sich auch durch Wachstum und Skalierbarkeit aus. Sie zeigen eine stabile und schnelle Expansion, was sie besonders für die großtechnische Produktion geeignet macht. Zum Beispiel beginnt die FaTTy-Linie mit einer Verdopplungszeit der Population von 20–24 Stunden, die sich nur leicht auf 22–36 Stunden zwischen der 140. und 190. Verdopplung verlangsamt. Diese Konsistenz ist ein Wendepunkt, da eine einzelne FaTTy-Zelle, die von 70 auf 140 Populationsverdopplungen expandiert, theoretisch innerhalb einer 11-tägigen Differenzierungsperiode 106 Tonnen Fett produzieren könnte[9] .
Ein großer Vorteil dieser Zelllinien ist ihre spontane Immortalisierung, die eine langfristige Expansion ohne genetische Modifikation ermöglicht. Dieser nicht-GVO-Status ist ein regulatorischer Gewinn.Hervorhebend stellte das University of Ulsan College of Medicine fest:
"Unsere Studie berichtet über eine porcine Zellkultur, die in hoch-hämischem Medium kultivierbar ist und unter serumfreien Bedingungen gehalten werden kann." [3]
Darüber hinaus zeigen porcine Muskelstammzellen eine bemerkenswerte Skalierbarkeit mit Expansionsraten von 10⁶ bis 10⁷-fach, die in der Lage sind, zwischen 100 g und 1 kg kultiviertes Fleisch zu produzieren[10]. Fortschritte in der Zellsortierungstechnik, unter Verwendung von Markern wie CD31, CD45, JAM1, ITGA5 und ITGA7, haben die Isolierung von hochreinen Muskelstammzellen erheblich verbessert. Diese Methoden liefern eine 20%ige Erhöhung der PAX7-Positivitätsraten im Vergleich zu älteren Techniken[11]. Diese Verbesserung stellt sicher, dass das myogene Potenzial über mehrere Passagen hinweg erhalten bleibt und das häufige Problem der verminderten Differenzierungskapazität bei längerer Expansion angegangen wird.
Diese Wachstums- und Differenzierungsvorteile machen Schweinezellen zu einer herausragenden Wahl gegenüber Rinderzellen für die Produktion von kultiviertem Fleisch.
ICAN Webinar über Zelllinien und Kulturmedien für Anwendungen in kultiviertem Fleisch
Wachstumsraten und Proliferation im Vergleich
Werfen wir einen Blick darauf, wie sich Schweine- und Rinderzelllinien in Bezug auf Wachstum und Proliferation vergleichen. Schweinezelllinien, wie die spontan immortalisierten FaTTy-Linie, sind bemerkenswert schneller. Ihre anfängliche Verdopplungszeit der Population beträgt nur 20–24 Stunden [9]. Im Gegensatz dazu benötigen Rindersatellitenzellen, selbst wenn sie in optimierten serumfreien Medien wie Beefy-9 gezüchtet werden, etwa 39 Stunden pro Verdopplung [12].
Die Unterschiede werden über mehrere Passagen noch deutlicher.Primäre bovine Satellitenzellen neigen dazu, sowohl ihre Proliferations- als auch Differenzierungsfähigkeiten nach etwa 10 Passagen zu verlieren [2]. Andererseits hat die FaTTy-Schweine-Linie fast 100% adipogene Effizienz über mehr als 200 Populationsverdopplungen beibehalten. Selbst in späteren Stadien erhöht sich ihre Verdopplungszeit nur geringfügig auf 22–36 Stunden [9]. Eine Studie der Tufts University vom Mai 2022 hob hervor, dass bovine Zellen in Beefy-9 über sieben Passagen (28 Tage) 18,2 Populationsverdopplungen erreichten, während sie über 96% Pax7⁺ Stammzellen-Eigenschaften beibehielten [12]. In der Zwischenzeit bestätigte ein Bericht der University of Edinburgh vom Januar 2025, dass die FaTTy-Linie über 200 Verdopplungen hinausging, ohne ihr Differenzierungspotential zu verlieren [9].
Es gibt auch einen deutlichen Kontrast darin, wie diese Zellen die Immortalisierung erreichen.Bovinenzellen benötigen typischerweise genetische Modifikationen - üblicherweise durch Überexpression von TERT und CDK4 - um eine langfristige Expansion über 120 Verdopplungen hinaus aufrechtzuerhalten [5]. Im Vergleich dazu erreichen Schweinezellen wie die FaTTy-Linie eine spontane Immortalisierung ohne genetische Modifikation. Dies bietet einen klaren regulatorischen Vorteil, insbesondere in Märkten, die gegenüber GVOs skeptisch sind [9].
Vergleichstabelle
| Merkmal | Rind-Satellitenzellen | Porcine MSCs (FaTTy Line) |
|---|---|---|
| Durchschnittliche Verdopplungszeit | ~39 Stunden (optimiertes serumfreies Medium) [12] | 20–24 Stunden (frühe Passagen) [9] |
| Spätpassagen-Verdopplungszeit | ~56 Stunden (bei 18 Verdopplungen) [12] | ~36 Stunden (bei 190 Verdopplungen) [9] |
| Passagenstabilität | Nimmt nach ~10 Passagen ab [2] | Stabil für >200 Verdopplungen [9] |
| Immortalisierungsmethode | Engineered (TERT/CDK4) [2] | Spontan [9] |
| Stammzellen/Differenzierung | >96% Pax7⁺ (bis Passage 6) [12] | Nahezu 100% adipogene Effizienz [9] |
Es ist erwähnenswert, dass sich in vivo Satellitenzellen in etwa 17 Stunden verdoppeln, was die Schwierigkeit unterstreicht, natürliche Wachstumsraten in vitro zu erreichen [12].
Medienanforderungen und Differenzierungseffizienz
Medienabhängigkeit im Vergleich
Medienkosten können die Produktion von kultiviertem Fleisch dominieren und machen oft 55% bis 90% der Ausgaben aus, in einigen Systemen sogar über 99% [3][12].
Für Rinderzellen ist eine häufige Anforderung 20% fötales Rinderserum, das etwa £290 pro Liter kostet [12]. Eine serumfreie Alternative, Beefy-9, verwendet ein B8-Basalmedium kombiniert mit rekombinantem humanem Albumin. Der Standardpreis für Beefy-9 beträgt etwa £217 pro Liter, aber Großbestellungen können diesen auf zwischen £46 und £74 pro Liter senken [12]. Hohe Albuminspiegel in serumfreien Medien können jedoch die Zelladhäsion behindern, daher wird rekombinantes Albumin typischerweise 24 Stunden nach dem Passagieren hinzugefügt [12].
Porcine Zelllinien verfolgen einen anderen Ansatz zur serumfreien Anpassung. PK15-Zellen nutzen beispielsweise bakterielle Häm-Extrakte von Corynebacterium [3]. Häm reduziert nicht nur die Serumabhängigkeit, sondern verbessert auch Geschmack und Farbe. Allerdings können Konzentrationen über 10 mM toxisch werden, obwohl porcine Zellen bis zu 40 mM tolerieren können, aufgrund der Hochregulierung von Entgiftungsgenen [3] . Trotz dieser Toleranz bleiben porcine Zellen, die in häm-ergänztem Medium gezüchtet werden, im Allgemeinen nur für 4–5 Passagen lebensfähig, während bovine Zellen, die in Beefy-9 kultiviert werden, das Wachstum für sieben oder mehr Passagen aufrechterhalten können [3][12].
Beide Zelltypen sind stark auf Fibroblasten-Wachstumsfaktor-2 (FGF-2) angewiesen.Bovinenzellen können beispielsweise auch dann ein kurzfristiges Wachstum aufrechterhalten, wenn die FGF-2-Werte von 40 ng/mL auf 5 ng/mL reduziert werden [12]. Darüber hinaus hilft die Verwendung von niedrigglukosehaltigem Medium (1 g/L), Stammzellmarker in Bovinenzellen zu erhalten [13].
Diese spezifischen Medienanforderungen sind entscheidend bei der Skalierung der Produktion und beeinflussen direkt die Differenzierungseffizienz.
Differenzierungseffizienz
Während die Medienkosten ein wesentlicher Faktor sind, spielt die Differenzierungseffizienz auch eine große Rolle bei der Bestimmung der Skalierbarkeit von kultiviertem Fleisch.
Bovinenzellen stehen vor Herausforderungen bei der Differenzierungseffizienz, wenn sie sich ausdehnen. Zum Beispiel erreichen bovine Myoblasten von belgischen Blau-Rindern anfangs einen Fusionsindex von etwa 55% bei 14 Populationsverdopplungen, aber dieser sinkt stark auf weniger als 10% bei 25 Verdopplungen [7].Ähnlich beginnen fötal-abgeleitete Rinderzellen mit höheren Fusionsindizes (etwa 54,6%) im Vergleich zu erwachsenen-abgeleiteten Zellen (ungefähr 38,0%), erleben jedoch beide einen Rückgang der Differenzierungskapazität von etwa 6,81% pro Passage [7].
Porcine Zellen hingegen zeigen eine stabilere Leistung. Der immortalisierten ISP-4 porzinen Präadipozyten-Stamm behält eine hohe adipogene Differenzierungseffizienz über mehr als 40 Passagen bei und erreicht eine 100-fache Zunahme der Lipidakkumulation während eines 8-tägigen Differenzierungsprotokolls [8]. Dies macht porcine Zellen besonders attraktiv für die Fettproduktion, während Rinderzellen in den frühen Passagen besser für die Muskeldifferenzierung geeignet sind, jedoch Schwierigkeiten mit der langfristigen Erhaltung haben.
| Merkmal | Rind-Satellitenzellen | Schweinezelllinien |
|---|---|---|
| Initialer Fusionsindex | 38–55% (Passage 0) [7] | Nicht spezifiziert für Muskel |
| Differenzierungslanglebigkeit | Nimmt nach ~25 Verdopplungen stark ab [7] | Behält Effizienz für über 40 Passagen bei (ISP-4 adipogen) [8] |
| Serumfreie Langlebigkeit | Erhält Wachstum für 7+ Passagen [12] | Lebensfähig für 4–5 Passagen (heme-adaptiert) [3] |
| Wichtige Ergänzungen | Rekombinantes Albumin, FGF-2 [12] | Häm-Extrakt, Insulin, Dexamethason [3][8] |
| Lipidproduktion | Minimal (Fokus auf Muskeln) | 100-fache Erhöhung (ISP-4) [8] |
Eignung für strukturierte Fleischprodukte
Die Wahl der Zelllinien spielt eine entscheidende Rolle bei der Gestaltung nicht nur der Wachstums- und Medienbedingungen, sondern auch der Struktur von kultivierten Fleischprodukten. Wenn man die Textur und das Aussehen eines Steaks oder Schweinekoteletts nachbilden möchte, ist es entscheidend, Fett- und Muskelzellen im richtigen Verhältnis auszugleichen.
Fett-Muskel-Ko-Differenzierung
Rinder- und Schweinezelllinien verhalten sich unterschiedlich, wenn es um die Ko-Differenzierung geht. Rinderzellkulturen stehen oft vor Herausforderungen wie dem Überwachsen von FAP (fibro-adipogene Vorläuferzellen), was die Muskelentwicklung durch Senkung des Fusionsindex stört. Darüber hinaus setzen Adipozyten in diesen Kulturen Signale frei, wie Myostatin und IL-6, die die Myogenin-Expression blockieren und somit die Bildung von Muskelfasern effektiv stoppen[16].
Um dies zu adressieren, haben Forscher bei Mosa Meat ein optimiertes serumfreies Wachstumsmedium (i-SFGM) entwickelt. Dieses Medium enthält Triiodthyronin (T3) und erhöhtes HGF, während PDGF-BB ausgeschlossen wird, um das Überwachsen von FAP zu kontrollieren.Sie verwenden auch modulare Adiposphären (200–400 µm), um Fett- und Muskelzellen während der frühen Wachstumsphasen physisch getrennt zu halten[4][14].
Porcine Zelllinien hingegen zeigen einen koordinierten Ansatz zur Ko-Differenzierung. Der ISP-4 Präadipozyten-Stamm funktioniert beispielsweise gut mit porcinen Muskel-Satellitenzellen und erzeugt eine Marmorierung, die konventionellem Fleisch ähnelt. Dieser Prozess umfasst eine 48-stündige adipogene Induktionsphase, gefolgt von 96 Stunden in 2% Pferdeserum, um die Myogenese auszulösen. Dies führt zu reifen Muskelfasern, die mit Adipozyten verwoben sind[8]. Allerdings neigen porcine Muskel-Satellitenzellen dazu, schwächere myogene Fähigkeiten im Vergleich zu Standardmodelllinien wie C2C12 zu haben, was ein präzises Timing erfordert, um sicherzustellen, dass Adipozyten die Kultur nicht dominieren[8].
Diese Unterschiede in der Differenzierung heben die einzigartigen Herausforderungen und Chancen hervor, die jeder Zelltyp für die Skalierung der Produktion bietet.
Skalierbarkeit und Produktionsherausforderungen
Die Skalierung der strukturierten kultivierten Fleischproduktion erfordert eine konsistente Zellleistung. Porcine Zelllinien sind tendenziell besser skalierbar. Zum Beispiel behält die spontan immortalisierten FaTTy-Linie über 200 Populationsverdopplungen hinweg nahezu 100% Adipogenese-Effizienz bei[9]. Die Erweiterung einer porzinen Zelllinie von 70 auf 140 Verdopplungen könnte theoretisch bis zu 106 Tonnen Fett produzieren[9]. Darüber hinaus hat der ISP-4-Stamm eine 40-fache Erhöhung der Zelldichte innerhalb von sechs Tagen gezeigt, wenn er auf Mikrokörpern in einem Spinnerflaskensystem gezüchtet wird[8].
"FaTTy ist eine einzigartige Nutztierzelllinie mit einem ausgeprägten adipogenen Phänotyp...diese Eigenschaften, zusammen mit ihrer nicht-GVO-Natur, machen FaTTy zu einem äußerst vielversprechenden grundlegenden Werkzeug." – Nature Food, 2025[9]
Rinderzelllinien stehen vor mehr Hürden. FAP-Kontamination verringert ihre Fähigkeit, sich effektiv in Muskelgewebe zu differenzieren[4]. Darüber hinaus machen die hohen Kosten für Wachstumsfaktoren wie FGF-2 und TGF-β - die oft über 90% der Medienkosten ausmachen - die Skalierung von Rinderzelllinien teurer[17]. Diese Zellen erfordern auch spezielle Beschichtungen, wie Laminin-521, um die Adhäsion von Satellitenzellen zu fördern und FAP-Interferenzen zu minimieren[4].
Die Produktion einer Tonne kultivierten Fleisches umfasst etwa 10¹³ Zellen, und strukturierte Produkte wie ganze Stücke erfordern fortschrittliche Produktionssysteme, wie Perfusions- oder Festbettreaktoren, um die 3D-Gerüste und Biomaterialien zu unterstützen, die für ihre Entwicklung benötigt werden[15].
htmlVergleichstabelle
| Attribut | Rinderzelllinien | Schweinezelllinien |
|---|---|---|
| Primäre Skalierbarkeitsherausforderung | FAP-Überwucherung in Muskelkulturen[4] | Anpassung an Suspensions-/serumfreie Kultur[9] |
| Stabilität der Differenzierung | Nimmt nach ~10 Passagen ab[2] | Stämme wie FaTTy stabil für >200 Verdopplungen[9] |
| Ko-Differenzierung | Adipozyten hemmen die Myogenese[16] | Erfolgreiche Marmorierungsprototypen erreicht[2][8] |
| Strukturelle Stärke | Hoch; fähig zur Integration von Muskel-Fett-Sehnen[14] | Moderat; Fokus auf ausgerichtetem Faserwachstum[14] |
| Geeignetheit für Ganzschnitt | Hohes Potenzial, begrenzt durch FAP-Interferenz[4] | Hohes Potenzial aufgrund stabiler 3D-Fettproduktion[9] |
| Texturherausforderung | Verminderte Kohäsion nach dem Kochen[14] | Neigt dazu, weicher zu sein als kommerzielles Schweinefleisch[14] |
Fazit
Die Entscheidung zwischen bovinen und porcinen Zelllinien erfordert das Abwägen ihrer unterschiedlichen Vorteile und Herausforderungen in der Produktion von kultiviertem Fleisch.Bovinen-Satellitenzellen sind ein direkter Weg zur Schaffung von Skelettmuskelgewebe und profitieren von bestehenden serumfreien Medienformulierungen wie Beefy-9 [2]. Andererseits wurden porcine Zelllinien bereits zur Entwicklung kultivierter Schweinefleischprototypen verwendet und zeigen Potenzial in der Ko-Differenzierung mit Satellitenzellen zur Schaffung von marmorierten Fleischstrukturen [2].
Die Skalierbarkeit bleibt ein großes Hindernis. Medienkosten und Bioreaktor-Skalierbarkeit machen 55%–90% der gesamten Produktionskosten aus, und die Verfügbarkeit von optimierten Zelllinien ist noch begrenzt, was den kommerziellen Fortschritt verlangsamt [3][2].
"Die in der Produktion von kultiviertem Fleisch verwendeten Zelllinien bestimmen letztendlich viele der nachgelagerten Variablen, die zu berücksichtigen sind." – GFI [2]
FAQs
Welche Zelllinie ist am besten für Produkte wie Steaks oder Koteletts geeignet?
Zelllinien, die von muskelresidierenden Vorläuferzellen wie Satellitenzellen abgeleitet sind, sind oft ideal für die Herstellung von Produkten wie Steaks oder Koteletts. Diese Zellen haben die Fähigkeit, sich zu reifem Muskelgewebe zu entwickeln und die strukturierte Textur und Form zu schaffen, die für diese Arten von Produkten benötigt werden.
Wie wähle ich zwischen genetischer Immortalisierung und spontaner Immortalisierung?
Die Wahl der Methode zur Immortalisierung von Zellen für die Produktion von kultiviertem Fleisch hängt von Ihren Prioritäten ab, einschließlich Sicherheit, Skalierbarkeit und regulatorischen Überlegungen.
Genetische Immortalisierung beinhaltet die Einführung spezifischer Gene, wie Telomerase, um eine präzise Kontrolle über die Fähigkeit der Zellen zu erreichen, sich unbegrenzt zu teilen. Während diese Methode Vorhersehbarkeit und Konsistenz bietet, können Bedenken hinsichtlich genetischer Modifikation und potenzieller Risiken, wie Tumorigenität, aufkommen.
Andererseits tritt spontane Immortalisierung im Laufe der Zeit in Langzeit-Zellkulturen natürlich auf. Dieser Ansatz vermeidet genetische Manipulation, was die behördliche Genehmigung erleichtern und die Akzeptanz bei Verbrauchern, die genetische Modifikationen skeptisch gegenüberstehen, erhöhen könnte.
Beide Methoden haben ihre Stärken und Herausforderungen und bieten unterschiedliche Wege zur skalierbaren Produktion von kultiviertem Fleisch. Die Wahl hängt letztendlich davon ab, Kontrolle, regulatorische Hürden und Verbrauchervertrauen in Einklang zu bringen.
Was ist der größte Kostentreiber in Medien für bovine vs. porcine Zellen?
Der größte Kostenfaktor bei der Herstellung von Medien für bovine und porcine Zellen liegt in den Kosten und der Komplexität ihrer Komponenten.Die Entwicklung und Feinabstimmung von Medienformulierungen ist ein großes Hindernis, insbesondere da Medien mindestens 50 % der variablen Betriebskosten ausmachen. Darüber hinaus fügen Anpassungen, die auf jede Spezies zugeschnitten sind, eine weitere Komplexitätsebene hinzu. Diese Aspekte spielen eine wichtige Rolle bei der Gestaltung der Gesamtherstellungskosten von kultiviertem Fleisch.











