Die Reinraumzertifizierung ist entscheidend für die Produktion von kultiviertem Fleisch, um Sicherheit und die Einhaltung von britischen Vorschriften wie der Verordnung (EG) 853/2004 zu gewährleisten. Ohne Zertifizierung riskieren Einrichtungen Kontamination, Nichteinhaltung und Qualitätsprobleme der Produkte. Hier ist ein kurzer Überblick über den Prozess:
- Warum Zertifizierung wichtig ist: Verhindert mikrobielle Kontamination, stimmt mit HACCP-Prinzipien überein und gewährleistet eine konsistente Produktion.
- Wichtige Standards: ISO 14644-1 (Luftreinheit), EU GMP Anhang 1 (sterile Herstellung) und EN 17141 (mikrobielle Kontrolle).
-
Schritte zur Zertifizierung:
- Design und Bau: Installation von HEPA-Filtern, Luftstromsystemen und Aufrechterhaltung der richtigen Druckdifferenzen.
- Installationsqualifizierung (IQ): Überprüfen, ob der Reinraum den Designvorgaben entspricht.
- Betriebsqualifizierung (OQ): Testen der Leistung unter kontrollierten Bedingungen.
- Leistungsqualifikation (PQ): Validieren Sie die Funktionalität während des tatsächlichen Betriebs.
- Kontinuierliche Überwachung: Regelmäßige Kontrollen von Partikeln, Druck, Temperatur und Feuchtigkeit.
- Laufende Einhaltung: Requalifikation alle 6–12 Monate oder nach größeren Änderungen.
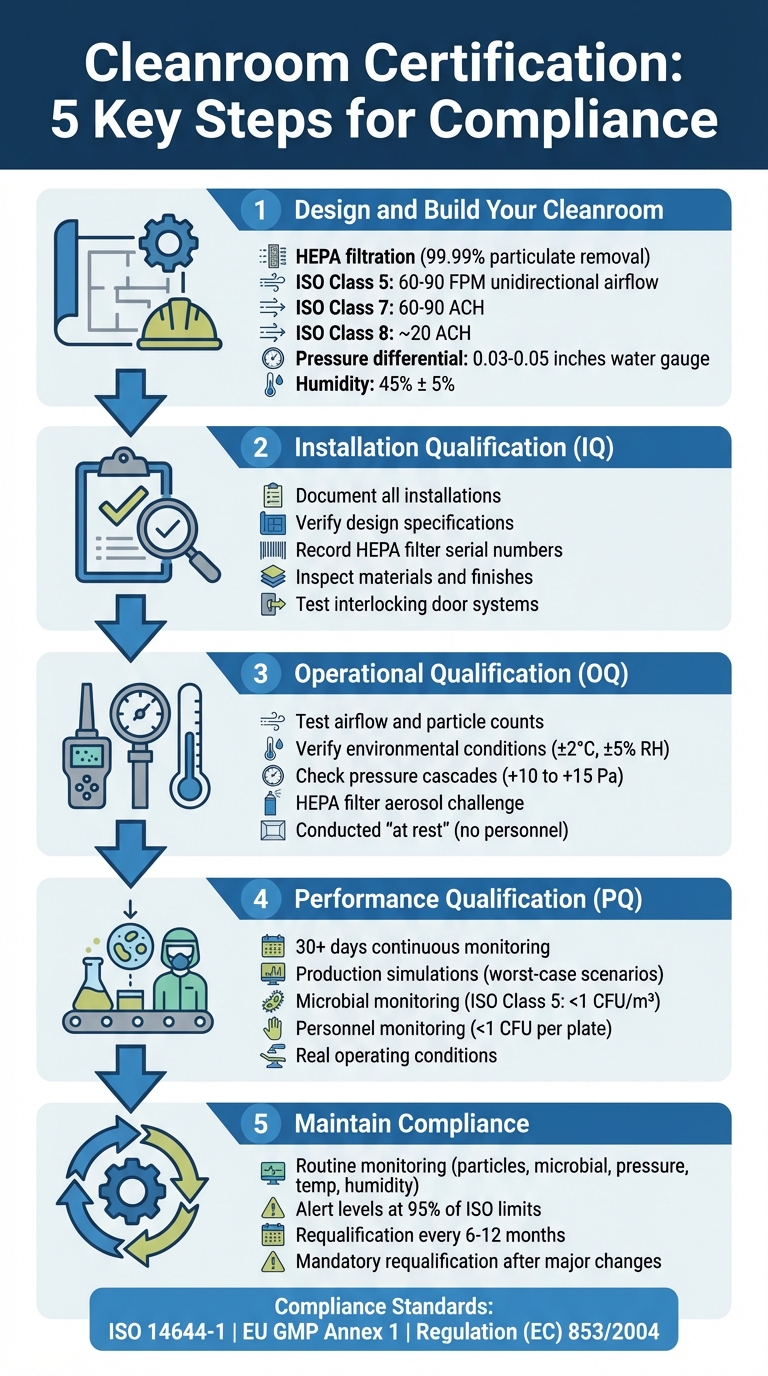
5-Schritte-Zertifizierungsprozess für Reinräume in Anlagen zur Herstellung von kultiviertem Fleisch
Reinraumdesign und -zertifizierung
Schritt 1: Entwerfen und Bauen Sie Ihren Reinraum
Der Bau eines Reinraums für die Produktion von kultiviertem Fleisch erfordert eine sorgfältige Planung in Bezug auf drei Hauptsysteme: HEPA-Filtration, Umweltkontrollen und Arbeitsablauftrennung. Diese Elemente gewährleisten sterile Bedingungen und helfen Ihnen, kostspielige Änderungen später zu vermeiden.Sobald diese Systeme installiert sind, konzentrieren Sie sich darauf, ihre Leistung während der Installation zu optimieren.
HEPA-Filtration und Luftstromanforderungen
Das Luftbehandlungssystem ist das Rückgrat Ihres Reinraums und bestimmt, ob es die erforderliche ISO-Klassifizierung erfüllt. HEPA-Filter entfernen 99,99 % der Partikel[5], aber ihre Wirksamkeit hängt davon ab, dass die Luft mit spezifischen Raten und Mustern geliefert wird, die auf jede Produktionszone zugeschnitten sind.
Für ISO-Klasse 5 Bereiche - wo aseptische Prozesse wie die Fleischernte stattfinden - benötigen Sie unidirektionalen (laminaren) Luftstrom mit 60 bis 90 Fuß pro Minute (FPM) [5]. Dies beinhaltet deckenmontierte Ventilator-Filter-Einheiten (FFUs), die den Luftstrom durch Wandöffnungen mit einem engen Auslasswinkel leiten.
In ISO-Klasse 7 und 8 Zonen wird ein gemischtes Luftstromdesign verwendet. Hier mischt sich die Frischluft mit der internen Luft, was weniger Luftwechsel pro Stunde (ACH) erfordert.ISO-Klasse 7 Zonen benötigen 60–90 ACH, während ISO-Klasse 8 Zonen etwa 20 ACH erfordern[1][6]. Um ACH zu berechnen, teilen Sie das Zuluftvolumen (pro Stunde) durch das Raumvolumen. Beachten Sie, dass höhere Decken sowohl den Luftstrombedarf als auch die Kosten erhöhen[3].
Druckdifferenzen sind entscheidend, um Verunreinigungen fernzuhalten. Halten Sie eine positive Druckdifferenz von 0,03–0,05 Zoll Wassersäule zwischen Reinräumen und angrenzenden Bereichen aufrecht [7]. Überschreiten Sie jedoch nicht 0,1 Zoll Wassersäule über Türen, da dies das Öffnen erschweren kann - es sind bis zu 11 Pfund Kraft erforderlich, um eine Standardtür von 3×7 Fuß zu öffnen[7].
Nach der Installation testen Sie das Filtersystem auf Integrität mit Aerosol-Herausforderungstests wie DOP- oder PAO-Tests, um sicherzustellen, dass es keine Lecks oder schwache Dichtungen in den HEPA-Filtergehäusen gibt[1].Rauchvisualisierungsstudien können auch helfen, den laminaren Luftstrom zu überprüfen und sicherzustellen, dass es in sensiblen Bereichen keine Turbulenzen oder Rückströmungen gibt.
Mit vorhandener Filtration ist der nächste Schritt, konsistente Umweltbedingungen sicherzustellen.
Umweltkontrollen für die Produktion
Die Aufrechterhaltung stabiler Temperatur, Luftfeuchtigkeit und Druck ist entscheidend, um mikrobielle Risiken zu minimieren[9]. Ihr HVAC-System muss diese Parameter kontinuierlich aufrechterhalten und gleichzeitig die hohen Luftwechselraten unterstützen, die für die ISO-Klassifizierung Ihres Reinraums erforderlich sind.
Die Temperaturkontrolle ist besonders wichtig. Das System muss die Wärme von Bioreaktoren, Beleuchtung und Personal ausgleichen, ohne die Luftströmungsmuster zu stören. Die relative Luftfeuchtigkeit sollte bei 45% ± 5% bleiben, was hilft, elektrostatische Aufladungen zu verhindern, die Partikel anziehen, und Kondensationsprobleme zu vermeiden. Diese Produktreihe sorgt auch für ein komfortables Arbeitsumfeld für bekleidetes Personal[7].
Echtzeitüberwachung von Umweltparametern wie pH-Wert und gelöstem Sauerstoff kann helfen, frühe Anzeichen von mikrobiellen Wachstum zu erkennen[9]. Die kontinuierliche Überwachung von Luft, Oberflächen und Wasser ist eine weitere wesentliche Praxis, um Kontaminationen zu erkennen, bevor sie sich ausbreiten. Darüber hinaus sollten Sie Ihr HVAC-System für eine kurze Erholungszeit auslegen - dies stellt sicher, dass der Reinraum nach einem Kontaminationsereignis schnell wieder auf das spezifizierte Sauberkeitsniveau zurückkehrt und die Ausfallzeit reduziert[1].
Sobald die Umweltkontrollen eingerichtet sind, konzentrieren Sie sich darauf, wie Materialien und Personen durch den Raum bewegt werden, um Kontaminationsrisiken zu minimieren.
Verwaltung des Material- und Personalflusses
"Reinraummitarbeiter sind die größte Kontaminationsquelle eines Reinraums, und alle kritischen Prozesse sollten von Personaleingängen und -wegen isoliert werden." - Vincent A. Sakraida, Ingenieur[7]
Personal stellt das größte Kontaminationsrisiko in Reinräumen dar, da sie Hautpartikel, Haare und andere Ablagerungen abgeben[7][6]. Um dies zu adressieren, sollte Ihr Reinraumlayout kritische Prozesse physisch von stark frequentierten Bereichen und Zugangspunkten trennen.
Materialien sollten in eine Richtung bewegt werden - von niedrigeren zu höheren Reinheitszonen - unter Verwendung validierter Desinfektions- oder Sterilisationsprozesse auf dem Weg[8].Doppelendige Sterilisatoren, wie Doppeltür-Autoklaven oder Depyrogenisierungstunnel, sind ideal, um Gegenstände in aseptische Verarbeitungsbereiche zu transferieren, ohne die Luftqualität zu beeinträchtigen[8].
Schleusen fungieren als Puffer zwischen Bereichen mit unterschiedlichen Sauberkeitsstufen. ISO-Klasse 7 oder sauberere Zonen sollten einen Vorraum für das Ankleiden enthalten, der verhindert, dass Außenkontaminanten in Produktionsbereiche gelangen[6]. Für Zonen der Grade A und B sorgen verriegelte Türsysteme dafür, dass immer nur eine Tür gleichzeitig geöffnet werden kann[8]. Wenn separate Schleusen für Personal und Materialien nicht machbar sind, kann eine zeitbasierte Trennung durch Verfahren helfen, gleichzeitige Bewegungen zwischen den Zonen zu vermeiden[8].
Begrenzen Sie kritische Bereiche auf einen einzigen Zugangspunkt, um das Risiko von Kreuzkontaminationen zu reduzieren[7]. Beobachtungsfenster oder Fernkameras ermöglichen es den Aufsichtspersonen, Aktivitäten zu überwachen, ohne den Reinraum zu betreten, und reduzieren so unnötigen Zugang[8].
Jede dieser Maßnahmen spielt eine entscheidende Rolle bei der Erlangung der Reinraumzertifizierung und stellt sicher, dass Ihre Einrichtung die strengen Standards für eine sichere und konforme Produktion von kultiviertem Fleisch erfüllt.
Schritt 2: Abschluss der Installationsqualifikation (IQ)
Sobald der Bau abgeschlossen ist, besteht der nächste Schritt in der Installationsqualifikation (IQ). Dieser Prozess stellt sicher, dass jede Komponente des Reinraums korrekt installiert wurde, bevor mit den Betriebstests fortgefahren wird. Im Wesentlichen fungiert IQ als Brücke zwischen dem Abschluss der physischen Konstruktion und dem Beginn des HVAC-Ausgleichs und bestätigt, dass alles für die nächste Phase bereit ist.
"Installationsqualifikation (IQ) Prüfungen stellen sicher, dass die Ausrüstung, Komponenten und der Reinraumaufbau den Spezifikationen des Herstellers entsprechen und alles korrekt installiert wurde." - Kjeld Lund, Reinraumspezialist [11]
IQ konzentriert sich auf den "as-built" Zustand - wenn die Reinraumstruktur fertiggestellt ist, aber die Produktionseinrichtungen noch nicht vorhanden sind. Das Hauptziel besteht darin sicherzustellen, dass das Gebaute dem ursprünglichen Design entspricht, wobei alle Abweichungen ordnungsgemäß dokumentiert und behandelt werden.
Alle Installationsschritte dokumentieren
Gründliche Dokumentation ist in dieser Phase entscheidend. Sie benötigen detaillierte as-built Aufzeichnungen, die aktualisierte Architekturzeichnungen, Listen der HLK-Ausrüstung, Steuersequenzen und elektrische Schaltpläne umfassen. Diese Aufzeichnungen sollten widerspiegeln, wie der Reinraum tatsächlich gebaut wurde, nicht nur, wie er geplant war.
Für jeden HEPA- oder ULPA-Filter notieren Sie die Seriennummer, den genauen Standort und das Installationsdatum. Es ist entscheidend, die Filter sofort nach der Installation auf Transportschäden zu überprüfen, da selbst kleine Lecks die Integrität des Reinraums beeinträchtigen können. Markieren Sie jedes Gerät und jeden Sensor mit einer eindeutigen ID, die mit Ihrer Geräteliste übereinstimmt, um zukünftige Prüfungen und Wartungen zu vereinfachen.
Kalibrierungszertifikate für alle Überwachungsinstrumente müssen ebenfalls abgelegt werden. Dazu gehören Partikelzähler, Differenzdrucksensoren, Temperatur- und Feuchtigkeitssonden sowie Luftstromgeräte. Wie Toni Horsfield von ISO Cleanroom erklärt, "Das Kalibrierungszertifikat [für Partikelzähler] ist in Ihrem Reinraumvalidierungsbericht enthalten." [10]
Inspektionen von Materialien und Oberflächen sind ebenso wichtig. Überprüfen Sie, ob Wandpaneele, Bodenbeläge, Türen, Durchreichen und Dichtstoffe den GMP-Standards entsprechen.Oberflächen sollten nicht abblättern, VOC-arm und ordnungsgemäß versiegelt sein. Türen und Fenster müssen bündig mit den Wänden abschließen, um die Druckintegrität zu gewährleisten.
Führen Sie ein Abweichungsprotokoll für alle Designabweichungen, in dem die Bewertungen und ergriffenen Korrekturmaßnahmen vermerkt sind. Dieses Protokoll wird später Teil Ihres endgültigen Validierungsberichts, der alle Ergebnisse aus der Installationsphase konsolidiert.
Designspezifikationen überprüfen
Sobald Ihre Installationsaufzeichnungen vollständig sind, besteht der nächste Schritt darin, sicherzustellen, dass jedes System mit dem genehmigten Design übereinstimmt. Vergleichen Sie die Benutzeranforderungsspezifikation (URS) mit den physischen Installationen, um zu bestätigen, dass während des Versands oder der Montage nichts übersehen wurde.
Für HVAC- und Filtersysteme überprüfen Sie, ob die Luftbehandlungseinheiten, die Verbindungen der Luftkanäle und die Positionen der Diffusoren mit den Konstruktionszeichnungen übereinstimmen. Bestätigen Sie, dass HEPA-Filter ordnungsgemäß in ihren Gehäusen sitzen und dass alle Drucktests der Rohrleitungen erfolgreich abgeschlossen wurden. Zeichnen Sie die Spezifikationen und Datenblätter für jede Lüfterfiltereinheit auf.
Die strukturelle Überprüfung umfasst die Inspektion von Verriegelungen, Schleusen und Durchreichen, um sicherzustellen, dass sie wie vorgesehen funktionieren. Testen Sie die Verriegelungssysteme der Türen, um sicherzustellen, dass beide Türen nicht gleichzeitig geöffnet werden können. Überprüfen Sie, ob alle Dichtungen intakt sind und ob der Reinraum die erforderlichen Druckdifferenzen aufrechterhalten kann.
Betreiben Sie das HLK-System, um stationäre Bedingungen zu erreichen, bevor Sie mit der nächsten Testphase fortfahren.
Die Durchführung der IQ mit Präzision ist entscheidend, da sie die Grundlage für alle nachfolgenden Qualifikationsstufen bildet. Das Überspringen von Schritten oder das Überstürzen der Dokumentation kann zu Komplikationen während der Betriebstests und behördlichen Prüfungen führen. Durch das gründliche Abschließen dieser Überprüfungen stellen Sie einen reibungslosen Übergang zur Betriebsqualifikation sicher.
Schritt 3: Durchführung der Betriebsqualifizierung (OQ)
Sobald die Installationsqualifizierung bestätigt, dass alles korrekt installiert ist, ist der nächste Schritt die Betriebsqualifizierung (OQ). Diese Phase stellt sicher, dass Ihr Reinraum unter definierten Bedingungen wie vorgesehen funktioniert. Typischerweise werden diese Tests "im Ruhezustand" durchgeführt, was bedeutet, dass das HVAC-System läuft, aber keine Mitarbeiter- oder Produktionsaktivitäten stattfinden.
"Die Validierung liefert objektive Beweise dafür, dass der Reinraum das tut, wofür er entworfen wurde: eine stabile, kontaminationsfreie Atmosphäre sowohl unter statischen (im Ruhezustand) als auch unter Betriebsbedingungen aufrechtzuerhalten." - Standard Tech [12]
OQ-Tests sind entscheidend für den Nachweis der Einhaltung von ISO 14644-1 und GMP-Standards. Für Anlagen zur Herstellung von kultiviertem Fleisch ist dieser Schritt besonders wichtig, da biologische Prozesse auf strikte Partikel- und mikrobiologische Kontrolle angewiesen sind.Um genaue Ergebnisse zu gewährleisten, stabilisieren Sie den Reinraum mindestens 30 Minuten vor Beginn der Tests, um verzerrte Partikelzählungen zu vermeiden [12]. Diese Überprüfungen bauen auf der Installationsphase auf und legen den Grundstein für die Feinabstimmung Ihrer Umweltkontrollen.
Testen Sie den Luftstrom und die Partikelzählungen
Die Zählung von luftgetragenen Partikeln ist das Fundament der ISO-Klassifizierung. Verwenden Sie einen kalibrierten Laserpartikelzähler, um die Konzentration von Partikeln in der Luft zu messen und die Einhaltung der erforderlichen ISO-Klasse zu bestätigen. Für ISO-Klasse 5 beziehen Sie sich auf die in der Normtabelle angegebenen Partikelgrenzen.
Die Anzahl der Probenahmestellen hängt von der Größe des Reinraums ab. ISO 14644-1 bietet klare Richtlinien: Größere Räume erfordern mehr Probenahmepunkte, die in einem Rastermuster angeordnet sind [16]. Wenn Sie zwei bis neun Standorte testen, müssen Sie das 95%ige obere Konfidenzintervall (UCL) berechnen, um die Einhaltung zu bestimmen.Für zehn oder mehr Messpunkte ist diese Berechnung unnötig [15].
Luftstromgeschwindigkeit und Volumenmessungen stellen sicher, dass Ihre Luftwechselrate den Entwurfsspezifikationen entspricht. Verwenden Sie ein Anemometer, um die Geschwindigkeit an verschiedenen Punkten zu messen, insbesondere in der Nähe kritischer Prozessbereiche, und bestätigen Sie, dass diese Werte Ihren Entwurfszielen entsprechen.
Rauchstudien bieten eine visuelle Möglichkeit, die Luftstromrichtung zu überprüfen und sicherzustellen, dass sie sich von saubereren zu weniger sauberen Zonen bewegt. Erzeugen Sie Rauch in der Nähe von Türen, Durchreichen und anderen gefährdeten Bereichen, um Lecks oder Turbulenzen zu erkennen, die den Luftstrom stören könnten [12]. Während Partikelzähler präzise sind, können Rauchstudien Probleme wie stagnierende Zonen aufdecken, die sonst unbemerkt bleiben könnten.
HEPA- und ULPA-Filter müssen während der OQ ebenfalls erneut validiert werden. Verwenden Sie eine Aerosolprüfung, um Lecks in den Filtern oder deren Dichtungen zu überprüfen.Selbst geringfügige Installationsfehler können die Leistung beeinträchtigen, daher sollten Sie nach jeder Wartung oder Filterwechsel immer erneut testen [12].
Sobald die Luftstromleistung bestätigt ist, liegt der Fokus auf den Umweltbedingungen, die sowohl die Produktqualität als auch den Komfort der Bediener beeinflussen.
Umweltbedingungen überprüfen
Temperatur und Luftfeuchtigkeit spielen eine bedeutende Rolle bei der Aufrechterhaltung der Produktqualität und der Sicherstellung eines komfortablen Arbeitsumfelds. Für Anlagen zur Herstellung von kultiviertem Fleisch liegen die Validierungsziele typischerweise bei ±2°C für die Temperatur und ±5% für die relative Luftfeuchtigkeit [12]. Eine kontinuierliche Überwachung über mindestens 24 Stunden wird empfohlen, da Stichproben Schwankungen übersehen könnten, die die Validierung beeinflussen könnten [12].
Reinräume für kultiviertes Fleisch halten normalerweise einen Temperaturbereich von 18–22°C und eine relative Luftfeuchtigkeit zwischen 30–60% aufrecht [14]. Diese Bedingungen unterstützen Zellkulturprozesse, während sie Kondensation verhindern, die das Wachstum von Mikroben fördern könnte. Verwenden Sie kalibrierte Temperatursensoren und RH-Sonden, die im gesamten Reinraum platziert sind, um Variationen in den Bedingungen zu identifizieren.
Druckkaskaden sind ein weiterer kritischer Faktor. Diese gewährleisten, dass die Luft von saubereren zu weniger sauberen Bereichen strömt, wodurch das Kontaminationsrisiko verringert wird. Überprüfen Sie die Druckdifferenzen - üblicherweise +10 bis +15 Pa zwischen benachbarten klassifizierten Räumen - mit kalibrierten Messgeräten. Nehmen Sie Messungen an Türen und Durchreichen unter stationären Bedingungen vor, um die richtigen Druckverhältnisse zu bestätigen [12].
Die Erholungszeitprüfung misst, wie schnell der Reinraum nach einem Kontaminationsereignis wieder den Vorschriften entspricht. Führen Sie eine kontrollierte Partikelquelle ein und überwachen Sie dann, wie lange es dauert, bis die Partikelanzahl wieder auf den Ausgangswert zurückkehrt. Schnellere Erholungszeiten deuten auf ein besseres Luftstromdesign und eine effektivere Kontaminationskontrolle hin [1].
Um Verzögerungen oder kostspielige Wiederholungen zu vermeiden, kalibrieren Sie alle Instrumente unmittelbar vor dem OQ-Test. Zeichnen Sie alle relevanten Details auf, einschließlich Datum, Uhrzeit, Ort, Instrumenten-ID und Umweltbedingungen für jeden Test. Diese Dokumentation ist für Ihren Validierungsbericht unerlässlich und wird bei behördlichen Prüfungen erforderlich sein [12].
sbb-itb-ffee270
Schritt 4: Durchführung der Leistungsqualifizierung (PQ)
Die Leistungsqualifizierung (PQ) bewertet die Leistung Ihres Reinraums unter realen Produktionsbedingungen, mit laufenden Geräten und aktiv arbeitendem Personal [1][12].Der Aufbau auf Installations- und Betriebsqualifikationen, PQ bietet die Bestätigung, dass der Reinraum während des tatsächlichen Betriebs konsistent und zuverlässig arbeitet.
"PQ validiert die Leistung des Reinraums unter tatsächlichen Betriebsbedingungen, einschließlich des Betriebs von Geräten und der Aktivität des Personals." - G-CON [1]
Um eine gründliche Prüfung sicherzustellen, sollte die PQ-Phase mindestens 30 Tage kontinuierliche Überwachung umfassen. Dieser erweiterte Zeitraum hilft, Abweichungen zu identifizieren, wie z.B. Temperaturschwankungen während Produktionszyklen oder Verschiebungen in der mikrobiellen Kontamination aufgrund von Personalbewegungen, die kürzere Tests möglicherweise übersehen. Für Anlagen zur Herstellung von kultiviertem Fleisch, bei denen strenge Kontaminationskontrolle entscheidend ist, bietet PQ dokumentierten Nachweis, dass der Reinraum während des Routinebetriebs konform bleibt.
Produktionssimulationen durchführen
Produktionssimulationen sollten Worst-Case-Szenarien nachbilden.Diese könnten die maximale Belegung, den gleichzeitigen Betrieb aller Geräte und temporäre Kontaminationsrisiken wie häufiges Türöffnen oder intensive Bewegungen umfassen [1][13]. Ein risikobasierter Ansatz, wie die Verwendung von Fehlermöglichkeits- und Einflussanalyse (FMEA), kann helfen, Probenahmestellen basierend auf Kontaminationsrisiken, Materialfluss und stark frequentierten Bereichen zu identifizieren [16].
Mikrobielles Monitoring während dieser Simulationen ist entscheidend. Koloniebildende Einheiten (KBE) sollten sowohl mit aktiven als auch passiven Probenahmemethoden überwacht werden [14][17]. Für ISO Klasse 5 Reinräume liegt das Aktionslimit für mikrobielle Kontaminationen in der Regel bei 1 KBE/m³ [14].
Da Menschen die größte Quelle von Partikeln in Reinräumen sind, ist die Überwachung des Personals ebenso wichtig.Die Probenahme mit behandschuhten Fingerspitzen kann ordnungsgemäße aseptische Techniken bestätigen, mit einem akzeptablen Grenzwert von weniger als 1 KBE pro Platte [17]. Die Bediener sollten im Voraus über Bekleidungs- und Bewegungsprotokolle informiert werden, um künstliche Spitzen in den Kontaminationsniveaus zu verhindern [12].
Zusätzlich testen Sie, wie schnell der Reinraum sich nach einer kontrollierten Partikelherausforderung erholt. Führen Sie eine Partikelquelle ein und messen Sie die Zeit, die benötigt wird, um die Bedingungen auf den Ausgangswert zurückzubringen. Dieser Prozess bewertet den Luftstrom und die Wirksamkeit der Kontaminationskontrollsysteme [1][12].
Umweltüberwachung Einrichten
Nach Simulationstests stellt die kontinuierliche Umweltüberwachung eine konsistente Leistung sicher.Diese Systeme liefern Echtzeitdaten zu kritischen Parametern wie luftgetragenen Partikeln, mikrobieller Kontamination, Temperatur, Feuchtigkeit und Druckdifferenzen. Dies ist entscheidend, um Leistungsänderungen zu erkennen, bevor sie zu Compliance-Problemen führen [1]. Für die Produktion von kultiviertem Fleisch ist eine kontinuierliche Überwachung unerlässlich.
Während der Qualifikationsphase führen Sie alle 1–2 Stunden mikrobiologische Luftproben in kritischen Zonen durch, um eine effektive Kontaminationskontrolle zu bestätigen [14]. Verwenden Sie Tryptic Soy Agar (TSA), um Bakterien zu erkennen, und inkubieren Sie die Proben bei 30–35°C für mindestens drei Tage, sowie Sabouraud Dextrose Agar (SAB) für Pilze und Schimmel, inkubiert bei 20–25°C für mindestens sieben Tage [17]. Vermeiden Sie die Verwendung von Aerosolsprays oder Desinfektionsmitteln in der Nähe von Luftprobenahmegeräten während der Tests.Wenn rotierende Desinfektionsmittel oder 70% Isopropylalkohol angewendet wurden, warten Sie mindestens fünf Minuten, bevor Sie mit der Luftprobenahme beginnen [17].
Richten Sie klare Alarm- und Aktionsgrenzen für alle überwachten Parameter ein. Alarmstufen signalisieren die Notwendigkeit einer Untersuchung, wenn Werte beginnen abzuweichen, während Aktionsgrenzen sofortige Korrekturmaßnahmen erfordern, wenn Parameter akzeptable Bereiche überschreiten [14]. Führen Sie detaillierte Aufzeichnungen über jede Messung, einschließlich Datum, Uhrzeit, Ort, Instrumentendetails und Umweltbedingungen. Dies stellt sicher, dass Sie immer auf Audits vorbereitet sind und die Einhaltung der ISO 14644 und GMP-Standards nachweisen können.
Schritt 5: Einhaltung durch Überwachung aufrechterhalten
Sobald Sie die Leistungsqualifikation abgeschlossen haben, hört die Arbeit dort nicht auf. Die Aufrechterhaltung der Compliance erfordert kontinuierliche Überwachung und periodische Requalifikation.Die Reinraumzertifizierung ist kein einmaliger Meilenstein - sie erfordert kontinuierliche Anstrengungen, um Ihre Einrichtung in einem "kontrollierten Zustand" zu halten. Für Anlagen zur Herstellung von kultiviertem Fleisch stellt dieser fortlaufende Prozess sicher, dass Sie sowohl regulatorische als auch betriebliche Standards erfüllen und die akribischen Praktiken der Qualifikationsphasen in den täglichen Betrieb überführen.
Regelmäßige Überwachung implementieren
Um sicherzustellen, dass Ihr Reinraum den ISO 14644- und GMP-Standards entspricht, müssen Sie regelmäßig auf mikrobielle und partikuläre Verunreinigungen überwachen. Wichtige Parameter, die Sie im Auge behalten sollten, sind:
- Partikelanzahl
- Mikrobielle Werte
- Druck
- Temperatur
- Luftfeuchtigkeit
- Luftstrom
Die Häufigkeit der Überwachung sollte mit der Klassifizierung Ihres Reinraums und einer gründlichen Risikobewertung übereinstimmen.Zum Beispiel erfordern ISO-Klasse-5-Zonen oft eine kontinuierliche oder stündliche Partikelüberwachung während der Produktion, während weniger kritische Bereiche möglicherweise nur tägliche oder wöchentliche Kontrollen benötigen.
Setzen Sie Alarmstufen auf 95 % der ISO-Grenzwerte, um potenzielle Probleme frühzeitig zu erkennen. Diese Stufen dienen als Warnung, wenn Parameter beginnen abzuweichen, und veranlassen Untersuchungen, bevor sie eskalieren. Andererseits erfordern Aktionsgrenzen sofortige Korrekturmaßnahmen, wenn Parameter akzeptable Bereiche überschreiten [14] .
Ein weiterer wesentlicher Bestandteil der Überwachung ist die Probenahme von behandschuhten Fingerspitzen (GFS). Diese Methode stellt sicher, dass das Personal die richtigen aseptischen Techniken beibehält. Das Standardkriterium ist typischerweise weniger als 1 KBE pro Platte [17]. Die Durchführung von GFS nach kritischen aseptischen Aufgaben oder am Ende jeder Schicht hilft, Technikfehler frühzeitig zu erkennen und zu beheben.
Während die routinemäßige Überwachung hilft, die tägliche Kontrolle aufrechtzuerhalten, stellt die Requalifizierung sicher, dass Ihre Reinraumsysteme langfristig effektiv bleiben.
Requalifizierung planen
Die Requalifizierung sollte alle 6 bis 12 Monate durchgeführt werden. Bestimmte Ereignisse machen jedoch eine Requalifizierung zwingend erforderlich, wie z.B. strukturelle Renovierungen, die Installation neuer Geräte, der Austausch von HEPA-Filtern oder wesentliche Änderungen am HLK-System [1][14].
Während der Requalifizierung müssen viele der Tests aus der Betriebsqualifikationsphase wiederholt werden. Dazu gehören:
- Partikelzählung in der Luft
- HEPA-Filter-Integritätstest (Nachweis von 99,99% Effizienz für Partikel ≥0.3 Mikrometer)
- Luftstromgeschwindigkeitsmessungen
- Druckdifferenzprüfungen
Ein besonders kritischer Test ist der Wiederherstellungszeit-Test, der misst, wie schnell der Reinraum nach einem Kontaminationsereignis wieder sein Zielsauberkeitsniveau erreicht. Dieser Test überprüft die Fähigkeit Ihres HLK-Systems, Stress effektiv zu bewältigen [1].
Führen Sie einen Validierungsmasterplan (VMP), um alle Qualifikationsstufen (IQ, OQ, PQ) und Ihren Requalifikationsplan zu dokumentieren. Stellen Sie sicher, dass alle für Tests verwendeten Instrumente - wie Partikelzähler und Anemometer - kalibriert sind und Zertifikate haben, die auf nationale Standards rückführbar sind [1] [14]. Dies gewährleistet Genauigkeit und Zuverlässigkeit in Ihren Compliance-Bemühungen.
Quellen Sie Reinraumausrüstung für die Einhaltung von Vorschriften
Finden Sie verifizierte Lieferanten auf Cellbase
Sobald die Betriebs- und Leistungsstandards Ihres Reinraums festgelegt und validiert sind, besteht der nächste Schritt darin, die richtige Ausrüstung zu beschaffen, um die Einhaltung der Vorschriften zu gewährleisten. Für die Produktion von kultiviertem Fleisch bedeutet dies, mit Lieferanten zusammenzuarbeiten, die die einzigartigen Anforderungen der Branche verstehen.
Sicherstellen GMP-konformer Beschaffung
Nach der Überprüfung der Ausrüstung muss auch der Beschaffungsprozess strenge GMP-Standards erfüllen.
Darüber hinaus priorisiert die Plattform Materialien, die den GMP-Anforderungen entsprechen. Zum Beispiel werden Baumaterialien wie 316L Edelstahl mit polierten, nicht abblätternden Oberflächen hervorgehoben. Diese Materialien sind beständig gegen wiederholte chemische Desinfektion und unterstützen validierte Cleaning-in-Place (CIP) und Sterilisation-in-Place (SIP) Protokolle [4]. Durch die Überprüfung der Materialkompatibilität von Anfang an können teure Nachrüstungen oder Requalifikationszyklen später vermieden werden. Dieser proaktive Ansatz hilft, die Einhaltung der Vorschriften zu gewährleisten und gleichzeitig Zeit und Ressourcen zu sparen.
Fazit
Wichtige Erkenntnisse
Die Erlangung der Reinraumzertifizierung ist entscheidend für die Aufrechterhaltung der Produktqualität und die Einhaltung von behördlichen Standards. Es beginnt mit der Gestaltung eines Reinraums, der mit HEPA-Filtration, kontrolliertem Luftstrom und effizientem Materialfluss ausgestattet ist. Der Prozess setzt sich mit einem dreistufigen Qualifikationsansatz fort: Installationsqualifikation (IQ), Betriebsqualifikation (OQ) und Leistungsqualifikation (PQ). Diese Phasen stellen sicher, dass alle Systeme unter tatsächlichen Arbeitsbedingungen effektiv arbeiten.
Die Zertifizierung endet nicht dort. Die laufende Überwachung von Faktoren wie Temperatur, Luftfeuchtigkeit, Druck und Partikelanzahl ist entscheidend, um Leistungsprobleme zu identifizieren. Regelmäßige Revalidierung stellt die Einhaltung der ISO 14644-1 und GMP-Standards sicher und schafft ein solides Fundament für zukünftige Verbesserungen.
Nächste Schritte für Ihre Einrichtung
Um Ihre Einrichtung mit diesen Standards in Einklang zu bringen, sollten Sie die Entwicklung eines Validierungsmasterplans (VMP) in Betracht ziehen. Dieser Plan integriert Qualifizierungsprozesse mit den täglichen Betriebsanforderungen und hilft Ihnen, den regulatorischen Anforderungen voraus zu sein [1]. Darüber hinaus ist die Implementierung eines HACCP-basierten Lebensmittelsicherheitsmanagementsystems entscheidend. Mindestens ein Teammitglied sollte in HACCP-Prinzipien auf Stufe 4 geschult sein, um die Einhaltung sicherzustellen [2].
Für Geräteanforderungen wenden Sie sich an
FAQs
Welche Vorteile bietet die Reinraumzertifizierung für die Produktion von kultiviertem Fleisch?
Die Reinraumzertifizierung spielt eine entscheidende Rolle in der Produktion von kultiviertem Fleisch, indem sie die Einhaltung strenger Sicherheits- und Umweltstandards gewährleistet. Zertifizierte Reinräume sind darauf ausgelegt, Kontaminationsrisiken durch Mikroben und Partikel zu minimieren und die sterilen Bedingungen aufrechtzuerhalten, die für die Zellkultivierung unerlässlich sind. Dies schützt nicht nur die Qualität und Sicherheit des Endprodukts, sondern stellt auch die Einhaltung international anerkannter Standards wie ISO-Klassifikationen und GMP-Graden sicher - wesentliche Anforderungen für die behördliche Zulassung und Marktakzeptanz.
Über die Einhaltung hinaus verbessert die Zertifizierung die betriebliche Zuverlässigkeit, indem sie kritische Systeme wie Luftstrom, Filtration und Umweltüberwachung validiert. Diese Systeme arbeiten zusammen, um Kontaminationsrisiken zu reduzieren, eine konsistente Produktion zu ermöglichen und die Gesamteffizienz des Prozesses zu verbessern.Ein zertifizierter Reinraum stärkt auch das Vertrauen der Stakeholder, vereinfacht behördliche Inspektionen und unterstützt Skalierungsbemühungen, indem er die Einhaltung bewährter Praktiken im Umgang mit kontrollierten Umgebungen demonstriert.
Wie oft sollten Reinräume neu qualifiziert werden, um die Einhaltung der Vorschriften sicherzustellen?
Reinräume müssen regelmäßig neu qualifiziert werden, um sicherzustellen, dass sie den Industriestandards entsprechen. Wie oft dies geschieht, hängt von mehreren Faktoren ab, einschließlich der Klassifizierung des Reinraums, seiner Nutzung und den Ergebnissen von Risikobewertungen oder Umweltüberwachungsplänen.
Typischerweise erfolgt die Neuzertifizierung einmal im Jahr. Hochrisiko-Umgebungen oder Situationen, die größere Änderungen beinhalten - wie Geräteaufrüstungen oder Layoutanpassungen - könnten jedoch häufigere Überprüfungen erfordern. Eine kontinuierliche Leistungsüberwachung ist ebenfalls entscheidend, um zu überprüfen, dass Luftstrom, Filtration und Umweltkontrollen weiterhin den erforderlichen Standards entsprechen.
Welche Umweltfaktoren müssen in einem Reinraum für die Produktion von kultiviertem Fleisch überwacht werden?
Um die Einhaltung der Vorschriften sicherzustellen und das Kontaminationsrisiko in Anlagen für kultiviertes Fleisch zu reduzieren, ist es entscheidend, mehrere Umweltfaktoren genau zu überwachen. Dazu gehören Partikelzählungen, mikrobielle Kontamination, Luftströmungsmuster, Luftdruckdifferenzen, Temperatur und Luftfeuchtigkeitsniveaus. Die regelmäßige Überwachung dieser Elemente hilft, GMP-Standards aufrechtzuerhalten und eine kontrollierte Umgebung zu schaffen, die für die Produktion unerlässlich ist.
Durch die sorgfältige Verwaltung dieser Bedingungen können Einrichtungen die Produktqualität schützen und gleichzeitig die strengen Kriterien für die Reinraumzertifizierung erfüllen.











