無菌試験は培養肉の生産において重要であり、わずかな汚染でも高価なバッチの失敗につながる可能性があります。このプロセスは、有害な微生物がバイオリアクターの運転を妨げないようにし、製品の品質と財務の健全性を保護します。汚染率は平均11.2%で、大規模生産では19.5%に上昇しており、生産者は無菌環境を維持する上で大きな課題に直面しています。
主なポイントは以下の通りです:
- 主な汚染源: 人員、原材料、バイオリアクターの運転は、微生物の一般的な侵入経路です。
- 試験方法: 大容量には膜ろ過、小容量には直接接種、製造中のバイオバーデン試験が広く使用されています。
- リアルタイムモニタリング: 溶存酸素センサーや排ガス分析などのツールは、微生物活動の早期検出を可能にします。
- 新興技術: AI駆動のモニタリング、コールドプラズマ滅菌、そして自動化されたイメージングシステムは、より迅速で正確な汚染管理を提供します。
培養肉の生産者にとって、従来の無菌試験と先進的なモニタリングソリューションを組み合わせることは、リスクを軽減し生産効率を向上させるために不可欠です。
Rocker Discover - 無菌試験の実施方法
sbb-itb-ffee270
バイオリアクターシステムにおける汚染源
バイオリアクターシステムでのバッチ失敗を防ぐためには、汚染がどこから発生するかを特定することが重要です。汚染物質は通常、微生物、粒子状物質、エンドトキシンの3つの主要なカテゴリーに分類されます。各タイプは培養肉生産において独自の課題を提示するため、特定の予防戦略を開発することが不可欠です。
人員は汚染の主な原因です。皮膚の剥離、不適切なガウンの着用、または不十分な手指衛生を通じて汚染物質を持ち込むことがよくあります[4][7]。厳格なプロトコルがあっても、単純な動きが気流を乱し、汚染物質が蓄積する乱流や停滞した領域を生じさせる可能性があります[4][9]。U.S。食品医薬品局は、滅菌された薬剤、成分、容器、または閉鎖部を無菌組立の前または中に手動または機械的に操作することは汚染のリスクを伴うため、慎重な管理が必要であると述べています[4]。
環境要因も重要な役割を果たします。例えば、10~15パスカルの正圧を維持できないと、未ろ過の空気が無菌ゾーンに入る可能性があります[3][4]。さらに、粒子保持率が99.97%を下回るHEPAフィルターの非効率性や、圧縮ガスフィルターの不具合などの問題は、迅速に無菌性を損なう可能性があります[4]。
原材料および細胞株の汚染
バイオリアクターシステムに入る原材料は、主要な汚染リスクです。未確認の成分、培養基成分、および細胞株(専門のB2Bマーケットプレイスを通じて入手可能)は、日和見病原体を持ち込む可能性があります[2]。細胞培養培地の栄養豊富な環境は特に汚染に対して脆弱であり、培養肉プロセスは微生物バイオプロセスと比較してより脆弱です[8]。
オートクレーブ処理ができない熱感受性の成分は特にリスクが高く、ろ過のような代替の滅菌方法が必要です[1][8]。さらに、接種プロセス自体にも固有のリスクがあります。膜をアルコールで消毒したり、開放炎の近くで手順を実行したりしても、細胞株導入中の汚染を完全に防ぐ保証はありません[8]。これらのリスクは、システムに導入される前に原材料を徹底的に検証することの重要性を強調しています。
バイオリアクターの運用リスク
バイオリアクター内の日常業務は、多くの汚染の機会を提供します。手動サンプリングは特に高リスクです。アクセスポイントが増えるたびに、汚染物質を導入する可能性が高まります[1]。シールの損傷、Oリングの破損、または未滅菌の閉鎖などの問題は、リスクをさらに高めます[4][8]。さらに、適切な除染を行わずに低分類エリアから高分類ゾーンに材料を移すことも、もう一つの重大な脆弱性です[7]。
厳格な環境管理の維持は譲れません。クリーンルームエリア間の圧力差は継続的に監視され、異常な変化があれば直ちに調査されるべきです[4]。クラス100(ISO 5)の重要エリアでは、0.5 μm以上の粒子数は、作業中に1立方メートルあたり3,520粒子未満でなければなりません[4]。さらに、エアロゾル化された消毒剤や70%イソプロピルアルコールをエアサンプラーの近くで使用すると、粒子の測定値が増加する可能性があり、ガスフィルターに凝縮液が付着すると詰まりを引き起こしたり、微生物の成長を促進したりする可能性があります[4][7].
これらの運用リスクは、バイオリアクターのプロセスを保護するために厳格な無菌試験方法を実施することの重要性を強調しています。
バイオリアクターの無菌試験方法
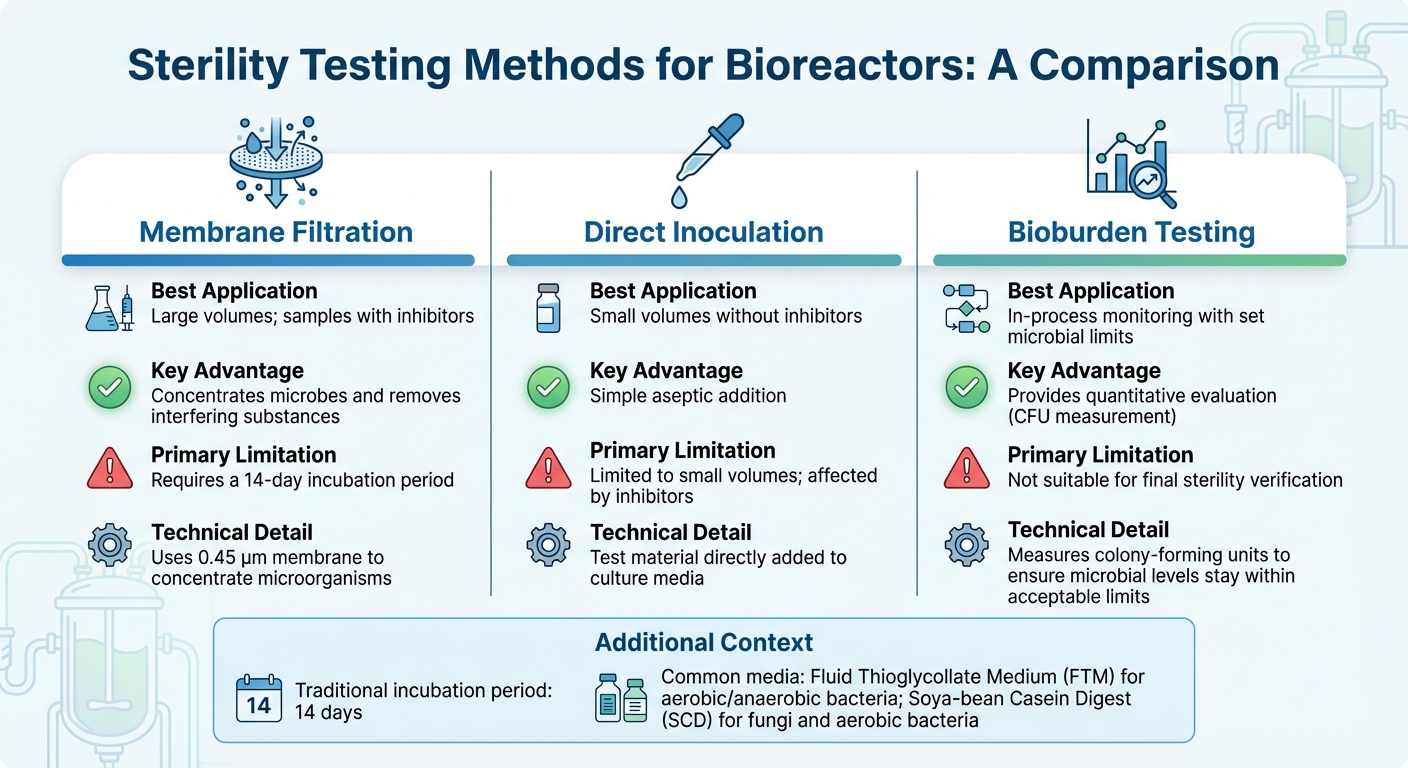
バイオリアクターの無菌試験方法の比較
バイオリアクターに適した無菌試験を選択するには、バイオリアクターのサイズ、生産段階とスケーリングの課題、およびサンプルの組成(特に阻害剤が存在する場合)が重要です。ほとんどの産業用途では、メンブレンフィルトレーションが一般的な方法です[3]。一方、PCRのような分子技術は、特定の汚染物質の迅速な検出を提供します。以下では、培養肉生産に特化した方法を探り、大規模および小規模サンプルテストのユニークな課題に対処します。
産業規模のバイオリアクターで一般的な大容量サンプルの場合、膜ろ過は0.45 µmの膜を使用して微生物を濃縮し、検出感度を向上させます[10]。この方法は、抗生物質を含むサンプルに特に効果的で、洗浄によりインキュベーション前に阻害物質を除去できます。一方、直接接種は、試験材料を培地に直接添加する方法で、小規模サンプル量に対しては効果的ですが、阻害物質の処理には苦労します。サンプルを濃縮し、阻害物質を除去した後、インキュベーションと検証により結果の正確性を確保します。
従来の無菌試験は、微生物の成長を視覚的に確認するために14日間の培養期間に依存しています[3]。一般的に使用される培地には、好気性および嫌気性細菌用のFluid Thioglycollate Medium (FTM)、および真菌と好気性細菌用のSoya-bean Casein Digest (SCD)が含まれます。無菌試験を行う前に、製品が細菌静止および真菌静止試験を通じて微生物の成長を阻害しないことを検証することが重要です。
継続的なプロセスモニタリングのために、定量的生菌数試験は、特に培養肉の生産において、二元的な無菌試験よりも実用的な解決策を提供します。無菌試験が単純な合格/不合格の結果を提供するのとは異なり、生菌数試験はコロニー形成単位 (CFU) を測定して、微生物レベルが許容範囲内に収まるようにします。この方法は、新たな食品グレードの基準に沿っており、厳格な製薬管理と大規模な食品生産の経済的現実とのバランスを取っています。
無菌試験用品やバイオリアクターソリューションについては、培養肉の専門家は
| 方法 | 最適な用途 | 主な利点 | 主な制限 |
|---|---|---|---|
| 膜ろ過 | 大量; 阻害物質を含むサンプル | 微生物を濃縮し、干渉物質を除去[3] | 14日間の培養期間が必要[3] |
| 直接接種 | 阻害物質のない少量 | 簡単な無菌添加 | 少量に限定; 阻害物質の影響を受ける[3] |
| 微生物負荷試験 | 設定された微生物限界でのプロセス中モニタリング | 定量的評価を提供 | 最終滅菌確認には適していません [3] |
リアルタイムモニタリングと滅菌保証
従来の14日間の滅菌試験に依存すると、汚染が遅れて発見された場合にバッチ全体を失うリスクがあります。リアルタイムモニタリングは、重要なプロセスパラメータを発生時に監視することで、プロアクティブなソリューションを提供します。これにより、問題が発生した場合に即座に対応することが可能です。培養肉の生産では、バイオリアクターの運転が数週間続き、高価な成長培地を使用するため、汚染の早期発見は数千ポンドを節約し、生産の遅延を回避することができます。リアルタイムデータと従来の無菌試験を組み合わせることで、生産者は遅延確認と迅速な介入のギャップを埋めることができます。
センサーに基づくモニタリング
溶存酸素(DO)やpHレベルなどの主要指標は、汚染を早期に示すことができます。バイオリアクターに細菌や真菌が侵入すると、酸素を急速に消費し、DOレベルが低下し、代謝酸を放出してpHを大幅に低下させます[12]。これらの変化は、汚染が視覚的に明らかになる数時間前に検出することができます。 従来の無菌試験がプロセス後に結果を確認するのに対し、リアルタイムモニタリングは安全策として機能し、プロセスが順調に進むことを保証し、汚染リスクに早期に対処します。
オフガス分析は、磁気セクタ質量分析法を使用して、バイオリアクターの排気ガス中の酸素と二酸化炭素のレベルを継続的に測定します。制御された汚染研究では、この方法は酸素の変化を通じて22.4時間以内に微生物の成長を特定しましたが、pHベースの検出は25.8時間遅れました[13]。磁気セクタシステムは、7日間にわたり最大0.003% (v/v) の精度で正確な酸素測定を提供し、従来の常磁性検出器を上回ります。従来の常磁性検出器は±0.2% (v/v) の精度しかありません[13]。
分光センサーは、使い捨てバイオリアクターの壁を通して非侵襲的なモニタリングを提供し、無菌性の維持に不可欠です。UV-vis分光法は、350–400 nmでの光吸収を測定することにより膜損傷を検出でき、漏れた細胞内物質は800–900 nmで現れます[14]。市販されている唯一の生細胞密度測定用センサーである静電容量プローブは、膜の分極変化を検出することによりこれを達成します[14]。複数のバイオリアクターを管理する施設では、Rapid Multi-Stream Samplerのようなツールが最大16のガス流を同時に監視できます[13]。
これらのセンサーシステムは、HVAC汚染防止などの環境制御と組み合わせることで、汚染に対する強力な防御を構築します。
環境および圧力制御
クリーンルームゾーン間の正圧を維持することは、汚染物質の侵入を防ぐために重要です[3]。陽圧システムは、HEPAフィルターと組み合わせることで、微生物の侵入に対する物理的な障壁として機能します。HEPAフィルターの可聴または視覚アラームは、圧力が許容レベルを下回った場合にスタッフに即座に通知できます[3].
非生存粒子のカウントは、もう一つの防御層です。レーザー粒子カウンターは、運転中に環境がISOの空気清浄度基準を満たしていることを継続的に確認します。0.5 µmおよび5.0 µmの粒子を監視することで、これらのデバイスは空気の質が必要な限界内にあることを保証します[7]。予期しない逸脱が発生した場合 - 例えば、DOの急激な低下やpHの変動など - 影響を受けたバイオリアクターを即座に隔離し、供給の追加を停止することで、汚染の拡散を防ぐことができます[12]。
培養肉の運用に特化したセンサーや機器の調達には、
無菌試験における新技術
従来の無菌試験方法は、14日間の長い培養期間と手動サンプリングに依存しているため、検出のギャップが生じる可能性があります。新しい技術はこれらの課題に対処し、より迅速で正確な汚染検出を提供します。これは、培養肉の生産において特に重要であり、成長培地の高コストと長期間の培養時間が、後期段階での汚染を財政的な悪夢にする可能性があるためです。
AI駆動の監視システム
人工知能は、リアルタイムデータを分析して微生物の侵入を特定することで、汚染検出を再構築しています。細菌がバイオリアクターに侵入すると、酸素を消費し代謝酸を生成し、溶存酸素とpHレベルの顕著な低下を引き起こします。AIシステムは、酸素と栄養素の消費におけるこれらの逸脱を検出し、従来の微生物負荷試験および無菌プロトコルが結果を提供するよりもはるかに早く潜在的な汚染を警告します[12]。
これらのAIプラットフォームはまた、数学的モデルを組み込んで汚染が発生した正確な時間を特定し、微生物集団が時間とともにどのように成長するかをシミュレートします。これにより、オペレーターは汚染をその原因に遡ることができ、故障した供給源、操作ミス、または機器の問題であるかどうかを特定できます。ポアソン確率分析のような技術は、微生物負荷試験の精度をさらに向上させ、偽陰性の可能性を減少させます[12]。
"数学モデルは、汚染の導入時間と微生物の成長動態を推定するのに役立ち、汚染の追跡可能性を向上させます。" - Naveenganesh Muralidharan, シニアマネージャー, MSAT, AGC Biologics [12]
異常が検出された場合、バイオリアクターの隔離やすべての供給追加の停止などの即時対応が問題の拡散を防ぐことができます[12]。バイオバーデンテスト、分子識別、成長率分析を含む体系的なアプローチは、根本原因の特定と是正措置の実施に不可欠です。これらのAIツールは、従来の方法と積極的な汚染管理の間のギャップを埋めます。
コールドプラズマ滅菌
コールドプラズマ技術は、特に培養肉の生産に適した非熱滅菌オプションを提供します。室温またはそれに近い温度で動作し、従来のオートクレーブの熱に耐えられないバイオリアクター部品、センサー、プラスチックなどの敏感な部品の滅菌に最適です。この方法は、微生物の膜やDNAを破壊するために、反応性酸素および窒素種とUV光を使用します。細菌胞子(Bacillus、Clostridium)、真菌、ウイルス、さらにはプリオンを含む広範囲の汚染物質に対して効果的です。[15][17].
コールドプラズマの際立った特徴の一つは、有毒な残留物を残さないことです。電源を切ると、反応性種はすぐに酸素に戻り、脱着フェーズが不要になります。[16][18]。また、エネルギー効率が高く、化石燃料ベースの熱源ではなく、標準的な電源コンセントのみを必要とします[15][16]。例えば、研究によれば、コールドプラズマは300Wの電力で25分以内に>5ログの削減をBacillus cereus胞子に対して達成できることが示されています[15]。
しかし、この技術には限界もあります。滅菌効果は主に表面レベルであるため、微生物が亀裂や溝に隠れる複雑な形状に浸透するのが難しいです[15][16]。バイオリアクター環境での高タンパク質または脂肪含有量も、反応性種を捕捉することで微生物を保護し、滅菌の効率を低下させる可能性があります[15][18]。
| 特徴 | コールドプラズマ |
|---|---|
| 利点 | 非熱、非毒性、省エネルギー、残留物なし、迅速[16] |
| 制限事項 | 浸透が限定的、複雑な形状での効果が低下[15][16] |
自動画像ベース検出システム
さらに、自動画像システムはリアルタイムの汚染検出に強力なツールを提供します。これらのシステムは、細胞成長の詳細な形態学的洞察を提供し、汚染パターンが発生する際にそれを特定するために重要です[19]。従来のオフライン顕微鏡法とは異なり、手動でのサンプリングや染色が必要なところを、自動化されたイメージングはオンラインまたはアットラインのモニタリング設定にシームレスに統合されます。これにより、オペレーターは無菌性を損なうことなくバイオマスと細胞の健康を監視することができます[19]。
手動介入を減らすことで、これらのシステムは人的エラーを削減し、培養プロセス全体の再現性を向上させます[19]。高度な画像処理アルゴリズムは、発酵の進行を追跡し、代謝産物の生産を最適化し、一貫性を確保します。これは、バイオプロセスをスケールアップする際に重要な要素です[19]。
"高度なサンプリング技術の利用可能性と自動測定ツールの組み合わせ...生産/培養プロセスのステップ数を減らし、特に手動ステップを減らし、エラーの伝播を削減することで、菌株選択、プロセス開発、およびプロセス制御に必要な時間を大幅に短縮することができます。" - A.C. Veloso と E.C. Ferreira、ミーニョ大学 [19]
これらのシステムの利点にもかかわらず、統合は必ずしも簡単ではありません。細胞培養は複雑で、原材料は異なり、センサーは蒸気やガンマ線照射のような過酷な滅菌方法に耐えなければなりません [19]。これらの技術を採用しようとする企業にとって、
結論
培養肉生産におけるバイオリアクターの無菌性を確保することは容易ではありませんが、統合された無菌性試験戦略により達成可能になります。この戦略は、従来の方法(大容量サンプル用の膜ろ過や小容量サンプル用の直接接種)と、PCRやqPCRなどの現代的な分子ツールを組み合わせて、迅速な病原体スクリーニングを行います。さらに、空気サンプリングや表面スワブによる環境モニタリングが追加の安全策となり、HVACシステムにおける汚染リスクに対処し、生産容器に影響を与える前に潜在的な汚染を捕捉します[11]。
テストアプローチの選択は、サンプルサイズ、結果に干渉する可能性のある物質の存在、完全な無菌性の検証に焦点を当てるか、単にバイオバーデンを監視するかなどの要因に依存します。バイオリアクターの複数のポイント(上部、中部、下部)からのサンプリングは、徹底した微生物プロファイルを作成し、局所的な汚染を見逃す可能性を減らします[1]。これは、培養肉の生産における汚染リスクがバイオ医薬品製造よりも著しく高いことを考えると特に重要であり、厳格な無菌プロトコルの必要性を強調しています[6].
バイオリアクター内の培地の無菌性を維持するための鍵は、適切な機器を調達することです。事前に滅菌されたセプタを備えた無菌サンプリングシステムや、0.3 μmより大きい粒子を99.97%捕捉できるHEPAフィルターのようなツールが不可欠です[4]。
業界が成長するにつれて、ハイブリッド無菌アプローチがますます重要になっています。初期のシードトレイン段階で医薬品グレードの管理を適用し、大規模生産には食品グレードの基準を採用することは、安全性とコスト効率のバランスを取ることになります[5][6]。これらの統合された対策は、分野が進化し続ける中で、安全で効率的な培養肉生産の基盤となるでしょう。
よくある質問
培養肉生産に使用されるバイオリアクターシステムでの汚染の主な原因は何ですか?
バイオリアクターシステムでの汚染は、無菌環境が破壊されたり、栄養豊富な培地が微生物の繁殖に理想的な環境を提供したりする場合に発生します。これには、サンプリング、メンテナンス、または細胞収穫中の侵入、損傷または詰まったガスフィルター、成長培地に既に存在する汚染、センサーの設置やサービス時に作成される一時的な開口部など、いくつかの要因が原因となる可能性があります。その上、使い古された機器は微細なプラスチック粒子を放出する可能性があり、微生物の住処となることがあります。
培養肉の生産において、わずかな汚染でもバッチの安全性と収量を損なう可能性があります。これらのリスクを軽減するためには、厳格な無菌基準に準拠した無菌フィルター、バイオリアクター、センサーキットなどの高品質な機器に投資することが重要です。
人工知能はバイオリアクターの無菌試験をどのように強化しますか?
AIを活用したシステムは、継続的なモニタリングを通じてリアルタイムの洞察を提供することで、培養肉バイオリアクターの無菌試験を変革しています。 高度なバイオセンサーを使用して、これらのシステムはpH、溶存酸素、およびグルコースやアミノ酸などの重要な代謝物を追跡します。これらはすべて手動チェックを必要とせずに行われ、汚染のリスクを劇的に削減します。
これらのシステムを際立たせるのは、確立された無菌基準と比較して読み取り値を分析するアルゴリズムを使用する能力です。これにより、従来の方法よりもはるかに早く微生物の成長の最小の兆候を検出できます。検出だけでなく、予測分析が行われ、センサーの設置中の問題やポートを通じた侵入などの潜在的なリスクを特定します。これらのシステムは、製造者が高価なバッチ損失を回避するための是正措置を提案することさえあります。
AI駆動の顕微鏡検査は、健康な細胞と汚染物質を瞬時に区別することで、無菌性確認プロセスを迅速化し、効率性をさらに高めます。生産者にとって、
もう一つの懸念は、微生物の不活性化に重要な役割を果たす反応性酸素および窒素種(RONS)による損傷の可能性です。これらの反応性種は、敏感な哺乳類細胞を傷つけたり、培地成分を劣化させたりする可能性があるため、細胞の生存率を維持するために慎重な最適化が必要です。その結果、コールドプラズマは単独の解決策としてではなく、他の滅菌技術と組み合わせて使用されることが多いです。











