培養肉の生産において、ウシ細胞株とブタ細胞株のどちらを選ぶかは重要な決定です。各細胞タイプは、スケーラビリティ、培地の要件、構造化された肉製品の作成能力に影響を与える独自の利点と課題を提供します。以下はその概要です:
- ウシ細胞株は、特にステーキのような製品の筋肉組織の生産に適しています。霜降りに優れていますが、長期的な分化に課題があり、スケーラビリティのために遺伝子改変が必要です。
- ブタ細胞株は脂肪生産に理想的で、自発的な不死化と数百回の倍加にわたる安定した成長を示します。大規模生産においてコスト効果が高いですが、筋肉細胞との共分化には正確なタイミングが必要な場合があります。
クイック比較
| 属性 | ウシ細胞株 | ブタ細胞株 |
|---|---|---|
| 倍加時間 | 約39時間(初期継代) | 20–24時間(初期継代) |
| 不死化 | 遺伝子改変が必要 | 自然発生的 |
| 分化 | 初期は強いが、約25倍加後に低下 | 安定した脂肪生成効率(>200倍加) |
| 培地コスト | 組換え成長因子により高い | ヘム補充培地で低コスト |
| 構造化肉の適合性 | 霜降りと筋肉-脂肪分離に適している | 脂肪-筋肉の共分化に効果的 |
両方の細胞株には独自の強みと制限があり、選択は製品の目標と生産戦略に依存します。
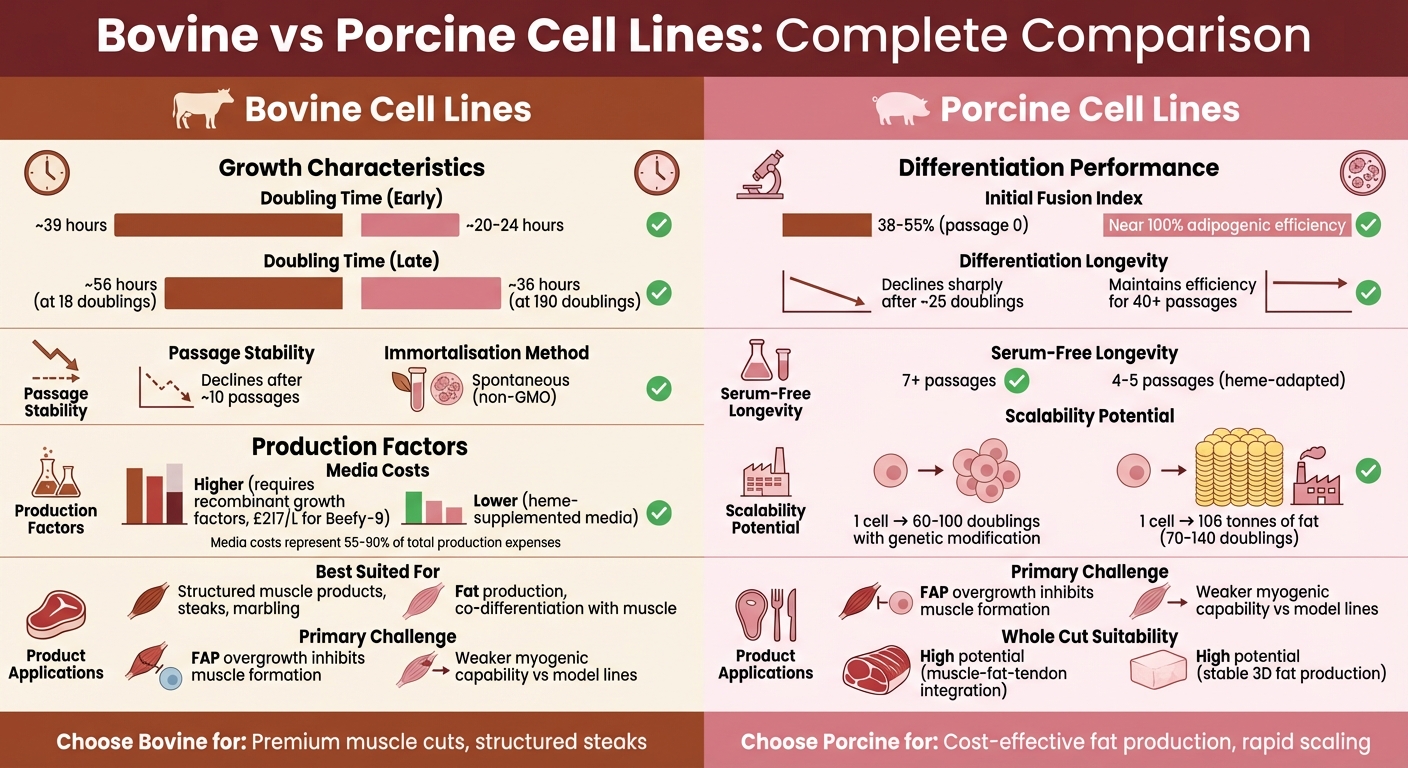
培養肉生産のためのウシ対ブタ細胞株の比較
ウシ細胞株
培養肉への応用
ウシ細胞株は、ステーキやその他の高級カットのような構造化された肉製品の生産に特に適しています。彼らの際立った特徴の一つは、本物の霜降りを発達させる能力です - 牛肉の独特の風味と食感の原因となる筋肉内脂肪。この霜降りは、筋肉成分を形成するウシ衛星細胞(BSCs)と、天然のウシ皮下脂肪とほぼ同一の脂肪酸プロファイルを持つ脂肪を生成する 線維脂肪前駆細胞(FAPs)の役割を通じて達成されます[2].
適切な霜降りを作成するには、分化中の慎重な調整が必要です。豚のシステムとは異なり、筋肉と脂肪を同時に分化させることができるのに対し、牛のシステムは通常、筋原性(筋肉形成)細胞と脂肪原性(脂肪形成)細胞の分化を別々に処理します。これらの成分は、脂肪と筋肉の比率を正確に制御するために組み合わされます。この方法はより高いカスタマイズを可能にしますが、生産プロセスに追加の複雑さをもたらします[2].
成長特性
牛の細胞は筋肉と脂肪の両方を生成するのに効果的ですが、その成長動態は大規模生産において課題を呈します。主要な問題は、牛の衛星細胞が増殖を続けるにつれて分化能力を失うことです。例えば、一次牛筋芽細胞は、正常な核型を維持しながら60から100の集団倍加を行うことができます。しかし、筋組織形成に不可欠なステップである筋管への融合能力は、約25回の倍加後に大幅に低下します。この制限は、生産を拡大するためのボトルネックを作り出し、湿潤質量1キログラムあたり約2.9×10¹¹個の細胞が必要です[7]。
2023年5月、タフツ大学細胞農業センターの研究者たちは、この問題に取り組むために遺伝的に不死化したウシ衛星細胞(iBSCs)を開発しました。ウシテロメラーゼ逆転写酵素(TERT)とサイクリン依存性キナーゼ4(CDK4)を導入することにより、これらの細胞は120回以上の倍加を超えながら、多核筋管を形成することができました。Andrew J.タフツ大学のStoutはこの画期的な成果の重要性を強調しました:
"培養肉が大規模に成功するためには、食用に適した種の筋肉細胞を迅速かつ信頼性の高い方法で体外で増殖させ、年間数百万トンのバイオマスを生産する必要があります。" [5]
成長性能は、播種密度や培地の配合などの要因にも大きく影響されます。例えば、ウシ脂肪由来幹細胞(bASCs)は、1,500細胞/cm²の播種密度で最適な成長を示し、80%の培地交換戦略を使用した場合、スピナーフラスコで28倍の増殖を達成しました [1]。さらに、化学的に定義された無血清培地は、従来の血清含有培地で達成された成長率の97%に達する速度でウシ筋芽細胞の指数関数的成長をサポートすることが示されています [6] 。これはコストを削減するだけでなく、倫理的な考慮とも一致しており、将来の生産に向けた有望なアプローチです。
これらのウシ特有の成長特性は、培養肉生産の文脈でブタ細胞株と比較するための堅実な基盤を提供します。
sbb-itb-ffee270
ブタ細胞株
培養肉における応用
ブタ細胞株は、自然の豚脂肪に非常に似た成熟した単胞性脂肪細胞を生産するのに役立ちます[9].
注目すべき例の一つは、自然発生的な不死化を通じて作成されたFaTTy細胞株です。この細胞株は、200回の倍加にわたって約100%の脂肪生成効率を示し、天然の豚脂肪に非常に近い脂肪酸プロファイルを生成します。この株から派生した培養脂肪細胞は、96,670 μm³もの脂質体積を達成できます。FaTTy研究チームが説明するように:
"FaTTyは、さまざまな培養条件下で高効率で確実に分化し、ネイティブの脂肪に匹敵する脂肪酸プロファイルを示す成熟脂肪細胞を生成する能力を特徴とする、独自の脂肪生成表現型を持つ家畜細胞株です。" [9]
もう一つの注目すべき細胞株であるPK15Hは、最大40 mMの高ヘムメディア濃度で繁栄します。この特徴は、伝統的な豚肉に典型的な豊かな色と鉄分の多い風味を再現するのに役立ちます[3]。さらに、培養された豚脂肪は、より健康的な脂質組成に微調整することができ、ネイティブ組織で一般的に見られる1.4の比率と比較して、一価不飽和脂肪酸と飽和脂肪酸の比率を3.2に達成します[9]。
成長特性
ブタ細胞株は脂肪生産に優れているだけでなく、成長とスケーラビリティの面でも卓越しています。これらは安定して迅速に拡大し、大規模生産に特に適しています。例えば、FaTTyラインは20~24時間の倍加時間で始まり、140回から190回の倍加の間にわずかに22~36時間に遅くなるだけです。この一貫性は画期的であり、70から140回の倍加から拡大された単一のFaTTy細胞は、11日間の分化期間内に理論的には106トンの脂肪を生産することができます[9]。
これらの細胞株の大きな利点の一つは、遺伝子改変を必要とせずに長期的な拡大を可能にする自発的な不死化です。この非GMOステータスは、規制上の勝利です。これを強調して、蔚山大学医科大学は次のように述べました:
"我々の研究は、高ヘム培地で培養可能で、無血清条件で維持できるブタ細胞を報告しています。" [3]
さらに、ブタの筋肉幹細胞は、10⁶から10⁷倍の拡張率を示し、100gから1kgの培養肉を生産することができます[10]。CD31、CD45、JAM1、ITGA5、ITGA7のようなマーカーを使用した細胞選別技術の進歩により、高純度の筋肉幹細胞の分離が大幅に改善されました。これらの方法は、古い技術と比較してPAX7陽性率を20%向上させます[11]。この改善により、長期間の拡張中に一般的な問題である分化能力の低下に対処しながら、筋原性の可能性が複数の継代にわたって保持されます。
これらの成長と分化の利点により、豚細胞は培養肉生産において牛細胞よりも際立った選択肢となります。
ICAN 培養肉用途のための細胞株と培地に関するウェビナー
成長率と増殖の比較
豚と牛の細胞株が成長と増殖においてどのように比較されるかを見てみましょう。豚細胞株、例えば自発的に不死化されたFaTTyラインは、特に速いです。初期の集団倍加時間はわずか20~24時間です [9]。対照的に、牛の衛星細胞は、Beefy-9のような最適化された無血清培地で育てられても、倍加に約39時間かかります [12]。
複数の継代を経ると、違いはさらに明確になります。初代ウシ衛星細胞は、約10回の継代後に増殖および分化能力を失う傾向があります[2]。一方、FaTTyブタ系統は、200回以上の集団倍加にわたってほぼ100%の脂肪生成効率を維持しています。後期段階でも、倍加時間はわずかに22~36時間に増加するだけです[9]。2022年5月のタフツ大学の研究では、Beefy-9のウシ細胞が7回の継代(28日間)で18.2回の集団倍加を達成し、96%以上のPax7⁺幹細胞性を保持していることが強調されました[12]。一方、エディンバラ大学の2025年1月の報告書では、FaTTy系統が分化能力を失うことなく200回以上の倍加を超えたことが確認されました[9]。
これらの細胞が不死化を達成する方法には、顕著な対照があります。ウシ細胞は通常、120倍以上の長期増殖を維持するために、TERTおよびCDK4の過剰発現を通じた遺伝子工学を必要とします[5]。これに対し、FaTTyラインのようなブタ細胞は、遺伝子改変なしで自発的に不死化を達成します。これは、特にGMOを警戒する市場において明確な規制上の優位性を提供します[9]。
比較表
| 特徴 | ウシ衛星細胞 | ブタMSC(FaTTyライン) |
|---|---|---|
| 平均倍加時間 | 約39時間(最適化された無血清)[12] | 20–24時間(初期継代)[9] |
| 後期継代倍加時間 | 約56時間(18倍加時)[12] | 約36時間(190倍加時)[9] |
| 継代安定性 | 約10継代後に低下[2] | 200倍加まで安定[9] |
| 不死化方法 | エンジニアード (TERT/CDK4) [2] | 自発的 [9] |
| 幹細胞性/分化 | >96% Pax7⁺ (最大6パッセージまで) [12] | ほぼ100%の脂肪生成効率 [9] |
生体内の衛星細胞は約17時間で倍増することに注意する価値があり、これはin vitroで自然な成長速度に匹敵することの難しさを強調しています[12]。
メディア要件と分化効率
メディア依存性の比較
メディアコストは培養肉の生産において支配的であり、しばしば費用の55%から90%を占め、システムによっては99%を超えることもあります[3][12]。
ウシ細胞の場合、一般的な要件は20%の胎児ウシ血清で、1リットルあたり約£290のコストがかかります[12]。血清を使用しない代替品であるBeefy-9は、B8基礎培地と組み合わせた組換えヒトアルブミンを使用します。Beefy-9の標準価格は1リットルあたり約£217ですが、大量注文により1リットルあたり£46から£74に削減できます[12]。しかし、血清を使用しないメディアでの高アルブミンレベルは細胞接着を妨げる可能性があるため、通常、組換えアルブミンは継代後24時間後に追加されます[12]。
ブタ細胞株は、無血清適応に対して異なるアプローチを取ります。例えば、PK15細胞は、Corynebacterium由来の細菌性ヘム抽出物を利用します[3]。ヘムは血清依存性を低減するだけでなく、風味と色を向上させます。とはいえ、10 mMを超える濃度は毒性を持つ可能性がありますが、ブタ細胞は解毒遺伝子のアップレギュレーションにより40 mMまで耐えることができます[3]。この耐性にもかかわらず、ヘム補充培地で育てられたブタ細胞は通常4〜5継代しか生存できませんが、Beefy-9で培養されたウシ細胞は7継代以上の成長を維持できます [3][12]。
両方の細胞タイプは、線維芽細胞増殖因子-2(FGF-2)に大きく依存しています。ウシ細胞は、例えば、FGF-2の濃度が40 ng/mLから5 ng/mLに減少しても短期間の成長を維持することができます[12]。さらに、低グルコース培地(1 g/L)を使用することで、ウシ細胞の幹細胞性マーカーを保持するのに役立ちます[13]。
これらの特定の培地要件は、生産を拡大する際に重要であり、分化効率に直接影響を与えます。
分化効率
培地コストが重要な要因である一方で、分化効率も培養肉のスケーラビリティを決定する上で大きな役割を果たします。
ウシ細胞は、拡大するにつれて分化効率に課題を抱えています。例えば、ベルギーブルー牛のウシ筋芽細胞は、最初は14回の人口倍加で約55%の融合指数を達成しますが、25回の倍加では10%未満に急落します[7]。同様に、胎児由来のウシ細胞は成人由来の細胞(約38.0%)と比較して高い融合指数(約54.6%)で始まりますが、どちらも継代ごとに約6.81%の分化能力の低下を経験します[7].
一方、ブタ細胞はより安定した性能を示します。不死化ISP-4ブタ前脂肪細胞株は、40回以上の継代にわたって高い脂肪分化効率を維持し、8日間の分化プロトコル中に脂質蓄積が100倍に増加します[8]。これにより、ブタ細胞は脂肪生産に特に魅力的であり、ウシ細胞は初期継代での筋肉分化に適していますが、長期維持には苦労します。| 特徴 | ウシ衛星細胞 | ブタ細胞株 |
|---|---|---|
| 初期融合指数 | 38–55% (継代 0) [7] | 筋肉に関しては指定されていません |
| 分化持続性 | 約25倍の倍加後に急激に低下 [7] | 40回以上の継代で効率を維持 (ISP-4 脂肪生成) [8] |
| 無血清持続性 | 7回以上の継代で成長を維持 [12] | 4–5回の継代で生存可能 (ヘム適応) [3] |
| 主要サプリメント | 組換えアルブミン、FGF-2 [12] | ヘム抽出物、インスリン、デキサメタゾン [3][8] |
| 脂質生産 | 最小限(筋肉重視) | 100倍増加(ISP-4)[8] |
構造化肉製品への適合性
細胞株の選択は、成長と培地条件だけでなく、培養肉製品の構造を形成する上で重要な役割を果たします。 ステーキやポークチョップの食感と外観を再現することを目指す際には、脂肪と筋肉細胞を適切な割合でバランスさせることが重要です。
脂肪-筋肉共分化
ウシおよびブタの細胞株は、共分化に関して異なる挙動を示します。ウシの細胞培養では、FAP(線維芽細胞-脂肪前駆細胞)の過剰増殖のような課題に直面することが多く、融合指数を低下させることで筋肉の発達を妨げます。さらに、これらの培養における脂肪細胞は、ミオスタチンやIL-6のようなシグナルを放出し、ミオゲニンの発現を阻害し、筋繊維の形成を実質的に停止させます[16]。
これに対処するために、Mosa Meatの研究者たちは、最適化された血清不使用の成長培地(i-SFGM)を作成しました。この培地には、トリヨードサイロニン(T3)と増加したHGFが含まれており、PDGF-BBを除外することでFAPの過剰増殖を制御します。彼らはまた、初期成長段階で脂肪細胞と筋肉細胞を物理的に分離するために、モジュラーアディポスフィア(200–400 µm)を使用します[4][14].
一方、ブタの細胞株は、共分化に対してより調整されたアプローチを示します。例えば、ISP-4前脂肪細胞株は、ブタの筋肉衛星細胞とよく連携し、従来の肉に似た霜降りを生成します。このプロセスは、48時間の脂肪生成誘導段階の後、筋形成を引き起こすために2%の馬血清で96時間続きます。これにより、脂肪細胞と織り交ぜられた成熟した筋繊維が得られます[8] 。しかし、ブタの筋肉衛星細胞は、C2C12のような標準的なモデルラインと比較して筋形成能力が弱い傾向があり、脂肪細胞が培養を支配しないようにするために正確なタイミングが必要です[8]。これらの分化の違いは、各細胞タイプが生産拡大において直面する独自の課題と機会を浮き彫りにしています。
スケーラビリティと生産の課題
構造化された培養肉の生産を拡大するには、一貫した細胞性能が必要です。ブタの細胞株はよりスケーラブルである傾向があります。例えば、自発的に不死化されたFaTTyラインは、200回の集団倍加にわたってほぼ100%の脂肪生成効率を維持します[9]。ブタの細胞株を70倍から140倍に拡大することで、理論的には最大106トンの脂肪を生産できる可能性があります[9]。さらに、ISP-4株は、スピナーフラスコシステムでマイクロキャリア上で培養された場合、6日間で細胞密度が40倍に増加することが示されています[8]。
「FaTTyは、独特の脂肪生成表現型を持つユニークな家畜細胞株です...これらの特徴は、非GMOの性質と相まって、FaTTyを非常に有望な基盤ツールにしています。」– Nature Food, 2025[9]
ウシ細胞株はより多くの障害に直面しています。FAP汚染は、筋肉組織への分化能力を効果的に低下させます[4]。さらに、FGF-2やTGF-βのような成長因子の高コストは、メディア費用の90%以上を占めることが多く、ウシ細胞株のスケーリングをより高価にします[17]。これらの細胞はまた、衛星細胞の接着を促進し、FAPの干渉を最小限に抑えるために、Laminin-521のような特殊なコーティングを必要とします[4]。
培養肉1トンの生産には約10¹³個の細胞が関与しており、全体のカットのような構造化製品には、3D足場とバイオマテリアルをサポートするために、灌流や充填床反応器などの高度な生産システムが必要です[15]。
比較表
| 属性 | ウシ細胞株 | ブタ細胞株 |
|---|---|---|
| 主なスケーラビリティの課題 | 筋肉培養におけるFAPの過剰増殖[4] | 懸濁/無血清培養への適応[9] |
| 分化の安定性 | 約10回の継代後に低下[2] | FaTTyのような株は>200倍増[9] |
| 共分化 | 脂肪細胞が筋形成を抑制[16] | 成功した霜降りプロトタイプを達成[2][8] |
| 構造強度 | 高い; 筋肉-脂肪-腱の統合が可能[14] | 中程度; 繊維の整列成長に焦点を当てる[14] |
| ホールカットの適性 | 高い可能性、FAP干渉によって制限される[4] | 安定した3D脂肪生産による高い可能性[9] |
| テクスチャの課題 | 調理後の凝集性の低下[14] | 市販の豚肉よりも柔らかくなる傾向[14] |
結論
培養肉生産において、ウシとブタの細胞株の選択は、それぞれの特有の利点と課題のバランスを取ることを含む。ウシの衛星細胞は骨格筋組織を作成するための直接的な経路であり、Beefy-9のような既存の無血清培地の処方から恩恵を受けます[2]。一方、ブタの細胞株はすでに培養豚肉のプロトタイプを開発するために使用されており、衛星細胞と共に分化して霜降り肉の構造を作成する可能性を示しています[2]。
スケーラビリティは依然として大きな障害です。培地コストとバイオリアクターのスケーラビリティは総生産費用の55%〜90%を占めており、最適化された細胞株の入手可能性は依然として限られており、商業的な進展を遅らせています [3][2]。
「培養肉の生産に使用される細胞株は、最終的に考慮すべき多くの下流変数を決定します。" – GFI [2]
FAQs
ステーキやチョップのようなホールカット製品に最適な細胞株はどれですか?
筋肉に存在する前駆細胞、例えば衛星細胞から派生した細胞株は、ステーキやチョップのようなホールカット製品の生産に理想的です。これらの細胞は成熟した筋肉組織に発展する能力を持ち、これらのタイプの製品に必要な構造化された食感と形を作り出します。
遺伝的不死化と自然発生的な不死化のどちらを選ぶべきですか?
培養肉生産のために細胞を不死化する方法を選ぶ際は、安全性、スケーラビリティ、規制上の考慮事項など、優先事項に依存します。
遺伝的不死化は、テロメラーゼのような特定の遺伝子を導入して、細胞が無限に分裂する能力を正確に制御することを含みます。この方法は予測可能性と一貫性を提供しますが、遺伝子改変や腫瘍形成のような潜在的なリスクに関する懸念を引き起こす可能性があります。
一方で、自然発生的な不死化は、長期的な細胞培養で自然に発生します。このアプローチは遺伝子工学を避けるため、規制承認がスムーズになり、遺伝子改変を懸念する消費者の受け入れを高める可能性があります。
どちらの方法にも強みと課題があり、スケーラブルな培養肉生産への異なる道を提供します。最終的な選択は、制御、規制上の障害、消費者の信頼のバランスに依存します。
牛と豚の細胞における培地の最大のコスト要因は何ですか?
牛と豚の細胞の培地を生産する際の最大の費用は、その成分のコストと複雑さに帰着します。培地の開発と微調整は大きな障害であり、特に培地が変動する運用コストの少なくとも50%を占めるためです。それに加えて、各種に合わせた調整がさらなる複雑さを加えます。これらの要素は、培養肉の全体的な生産コストを形成する上で重要な役割を果たします。











