Sterilitetstestning er afgørende for produktion af dyrket kød, hvor selv mindre forurening kan føre til dyre batchfejl. Denne proces sikrer, at ingen skadelige mikroorganismer forstyrrer bioreaktoroperationer, hvilket beskytter både produktkvalitet og økonomisk levedygtighed. Med forureningsrater, der i gennemsnit er 11,2% - og stiger til 19,5% for storskalaproduktion - står producenter over for betydelige udfordringer med at opretholde sterile miljøer.
Vigtige punkter inkluderer:
- Hovedkilder til forurening: Personale, råmaterialer og bioreaktoroperationer er almindelige indgangspunkter for mikrober.
- Testmetoder: Membranfiltrering for store volumener, direkte inokulation for mindre prøver og bioburden-testning under produktion er almindeligt anvendt.
- Realtidsovervågning: Værktøjer som opløst iltsensorer og off-gas-analyse muliggør tidlig detektion af mikrobiel aktivitet.
- Fremspirende Teknologier: AI-drevet overvågning, koldplasma sterilisering og automatiserede billedsystemer tilbyder hurtigere og mere præcis kontaminationsstyring.
For producenter af dyrket kød er det afgørende at kombinere traditionelle sterilitetstests med avancerede overvågningsløsninger for at reducere risici og forbedre produktionseffektiviteten.
Rocker Discover - Hvordan udfører man en sterilitetstest?
sbb-itb-ffee270
Kontaminationskilder i Bioreaktorsystemer
For at forhindre batchfejl i bioreaktorsystemer er det afgørende at identificere, hvor kontaminationen stammer fra. Kontaminanter falder typisk i tre hovedkategorier: mikrobiel, partikulær og endotoksin. Hver type præsenterer unikke udfordringer for produktion af dyrket kød, hvilket gør det essentielt at udvikle specifikke forebyggelsesstrategier.
Personale er den primære kilde til forurening, ofte ved at introducere forurenende stoffer gennem hudafskalning, forkert påklædning eller dårlig håndhygiejne [4][7]. Selv med strenge protokoller kan simple bevægelser forstyrre luftstrømmen, hvilket fører til turbulens eller stillestående områder, hvor forurenende stoffer kan ophobes [4][9]. The U.S. Food and Drug Administration fremhæver de involverede risici og udtaler, "enhver manuel eller mekanisk manipulation af det steriliserede lægemiddel, komponenter, beholdere eller lukninger før eller under aseptisk samling udgør en risiko for forurening og kræver derfor omhyggelig kontrol" [4].
Miljøfaktorer spiller også en betydelig rolle.For eksempel kan manglende opretholdelse af et positivt tryk på 10–15 Pascal tillade ufiltreret luft at trænge ind i sterile zoner [3][4]. Derudover kan problemer som ineffektivitet i HEPA-filtre - hvor partikeltilbageholdelsen falder under 99,97% - eller kompromitterede komprimerede gasfiltre hurtigt kompromittere steriliteten [4].
Råmateriale- og cellelinjekontaminering
Råmaterialer, der kommer ind i bioreaktorsystemet, udgør en stor kontaminationsrisiko. Uverificerede ingredienser, vækstmediekomponenter og cellelinjer (tilgængelige gennem specialiserede B2B-markedspladser) kan introducere opportunistiske patogener [2]. Det næringsrige miljø i cellekulturmedier er særligt modtageligt for kontaminering, hvilket gør dyrkede kødprocesser mere sårbare sammenlignet med mikrobielle bioprocesser [8].
Varmefølsomme ingredienser, der ikke kan autoklaveres, er særligt risikable, da de kræver alternative steriliseringsmetoder som filtrering [1][8]. Desuden indebærer inokulationsprocessen i sig selv iboende risici. Selv når membraner desinficeres med alkohol, eller procedurer udføres nær en åben flamme, er der ingen absolut garanti mod kontaminering under introduktionen af cellelinjer [8]. Disse risici understreger vigtigheden af grundig verifikation af råmaterialer, før de introduceres i systemet.
Bioreaktorens operationelle risici
Daglige operationer inden for bioreaktorer præsenterer adskillige muligheder for kontaminering. Manuel prøvetagning er særligt højrisiko, da hvert adgangspunkt øger chancen for at introducere kontaminanter [1].Problemer som kompromitterede forseglinger, beskadigede O-ringe eller usteriliserede lukninger øger yderligere risikoen [4][8]. Derudover er overførsel af materialer fra lavere klassificerede områder til højere klassificerede zoner uden korrekt dekontaminering en anden kritisk sårbarhed [7].
At opretholde strenge miljøkontroller er ufravigeligt. Trykdifferentialer mellem renrumområder bør overvåges kontinuerligt, og enhver usædvanlig ændring skal undersøges med det samme [4]. I klasse 100 (ISO 5) kritiske områder skal partikelantal for størrelser ≥0,5 μm forblive under 3.520 partikler pr. kubikmeter under operationer [4].Desuden kan aerosoliserende desinfektionsmidler eller 70% isopropylalkohol nær luftprøvetagere øge partikelaflæsningerne, mens kondensat på gasfiltre kan forårsage blokeringer eller fremme mikrobiel vækst [4][7].
Disse operationelle risici fremhæver vigtigheden af at implementere strenge sterilitetstestmetoder for at beskytte bioreaktorprocesser.
Sterilitetstestmetoder for bioreaktorer
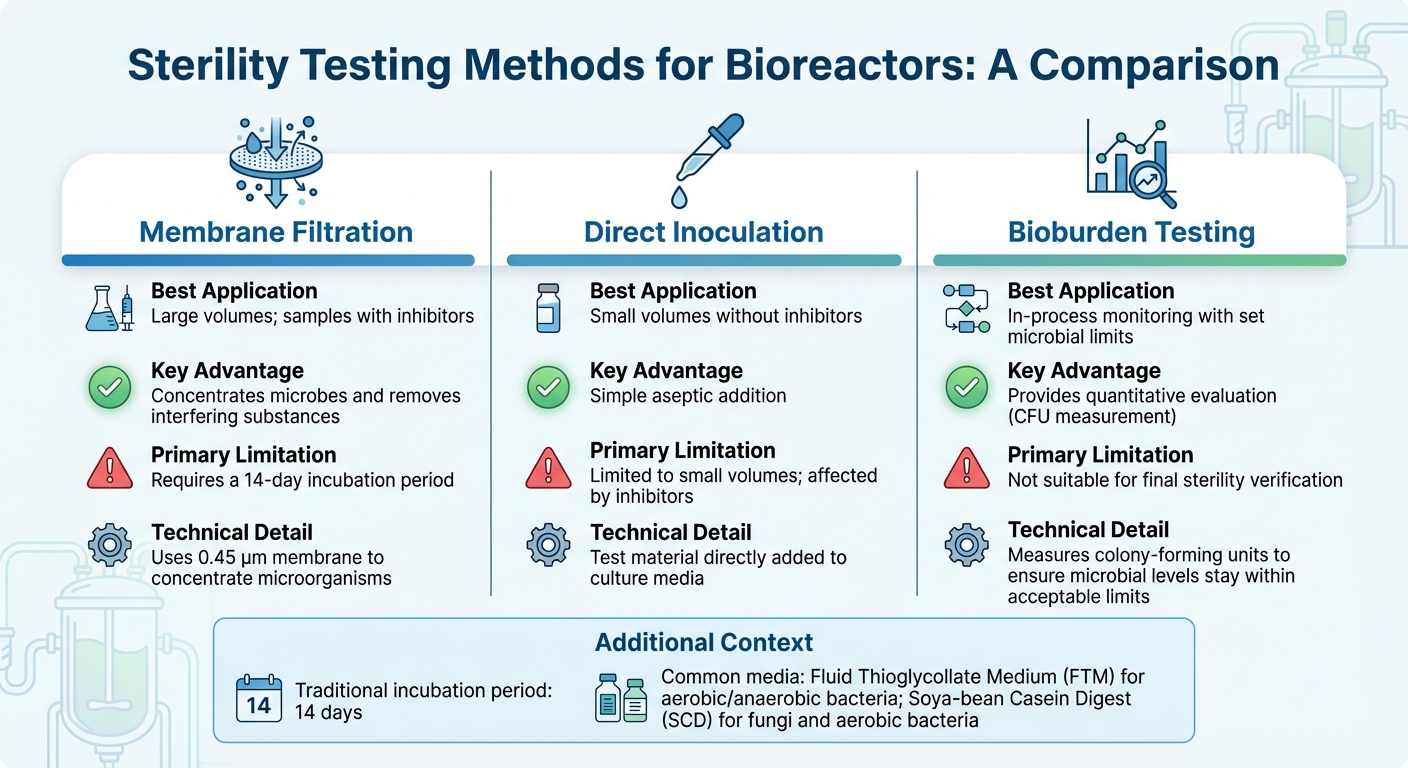
Sammenligning af sterilitetstestmetoder for bioreaktorer
Valg af den rette sterilitetstest for bioreaktorer afhænger af faktorer som bioreaktorens størrelse, produktionsstadie og skaleringsudfordringer, og prøvens sammensætning - især når der er tilstedeværelse af inhibitorer. For de fleste industrielle anvendelser er membranfiltrering den foretrukne metode [3].I mellemtiden tilbyder molekylære teknikker som PCR hurtigere detektion af specifikke forurenende stoffer. Nedenfor vil vi udforske metoder skræddersyet til produktion af dyrket kød, der adresserer de unikke udfordringer ved både store og små prøveanalyser.
For store prøvemængder, almindelige i industrielle bioreaktorer, membranfiltrering anvender en 0,45 µm membran til at koncentrere mikroorganismer, hvilket forbedrer detektionsfølsomheden [10]. Denne metode er særligt effektiv for prøver, der indeholder antibiotika, da skylning kan eliminere hæmmere før inkubation. På den anden side fungerer direkte inokulation, hvor testmaterialet direkte tilsættes til kulturmediet, bedre for mindre prøvevolumener, men har svært ved at håndtere hæmmende stoffer. Efter koncentrering af prøver og fjernelse af hæmmere sikrer inkubation og validering nøjagtigheden af resultaterne.
Traditionelle sterilitetstests er afhængige af en 14-dages inkubationsperiode for visuelt at bekræfte mikrobiel vækst [3]. Almindeligt anvendte medier inkluderer Fluid Thioglycollate Medium (FTM) til aerobe og anaerobe bakterier, og Soya-bean Casein Digest (SCD) til svampe og aerobe bakterier. Før der udføres nogen sterilitetstest, er det afgørende at validere, at produktet ikke hæmmer mikrobiel vækst gennem bakteriostase- og fungistasetestning.
Til løbende procesovervågning tilbyder kvantitativ bioburden-testning en mere praktisk løsning end binære sterilitetstests, især i produktion af dyrket kød. I modsætning til sterilitetstests, der giver et simpelt bestået/ikke-bestået resultat, måler bioburden-testning kolonidannende enheder (CFU) for at sikre, at mikrobielle niveauer forbliver inden for acceptable grænser.Denne metode er i overensstemmelse med nye fødevarestandarder og balancerer mellem strenge farmaceutiske kontroller og de økonomiske realiteter ved storskalaproduktion af fødevarer.
For forsyninger til sterilitetstest og bioreaktorløsninger kan fagfolk inden for dyrket kød henvende sig til betroede leverandører som
| Metode | Bedste Anvendelse | Vigtigste Fordel | Primær Begrænsning |
|---|---|---|---|
| Membranfiltrering | Store volumener; prøver med hæmmere | Koncentrerer mikrober og fjerner forstyrrende stoffer[3] | Kræver en 14-dages inkubationsperiode[3] |
| Direkte Inokulation | Små volumener uden hæmmere | Enkel aseptisk tilsætning | Begrænset til små volumener; påvirket af hæmmere[3] |
| Bioburden Testning | Overvågning under processen med fastsatte mikrobielle grænser | Giver en kvantitativ evaluering | Ikke egnet til endelig sterilitet verifikation [3] |
Realtidsmonitorering og sterilitetssikring
At stole på traditionelle 14-dages sterilitetstests indebærer risikoen for at miste hele partier, hvis forurening opdages for sent.Real-time overvågning tilbyder en proaktiv løsning ved at holde øje med kritiske procesparametre, mens de opstår. Dette muliggør øjeblikkelig handling, hvis noget går galt. I produktionen af dyrket kød, hvor bioreaktorforløb varer i uger og bruger kostbare vækstmedier, kan tidlig opdagelse af kontaminering spare tusindvis af pund og undgå produktionsforsinkelser. Ved at kombinere realtidsdata med konventionelle sterilitetstests kan producenterne bygge bro mellem forsinket bekræftelse og hurtig indgriben.
Sensorbaseret overvågning
Nøgleindikatorer som opløst ilt (DO) og pH-niveauer kan tidligt signalere kontaminering. Når bakterier eller svampe infiltrerer en bioreaktor, forbruger de hurtigt ilt - hvilket får DO-niveauerne til at falde - og frigiver metaboliske syrer, der sænker pH betydeligt [12]. Disse ændringer kan detekteres timer før kontaminering bliver synligt åbenbar.Mens traditionelle sterilitetstests bekræfter resultater efter processen, fungerer realtidsmonitorering som en sikkerhedsforanstaltning, der sikrer, at processen forbliver på rette spor og adresserer kontaminationsrisici tidligere.
Off-gas analyse, ved hjælp af magnetisk sektor massespektrometri, måler kontinuerligt ilt- og kuldioxidniveauer i en bioreaktors udstødningsgas. I kontrollerede kontaminationsstudier identificerede denne metode mikrobiel vækst inden for 22,4 timer gennem iltændringer, mens pH-baseret detektion haltede bagefter ved 25,8 timer [13]. Magnetiske sektorsystemer leverer præcise iltmålinger med en nøjagtighed på op til 0,003% (v/v) over syv dage, hvilket overgår traditionelle paramagnetiske detektorer, som kun er nøjagtige til ±0,2% (v/v) [13].
Spektroskopiske sensorer giver ikke-invasiv overvågning gennem væggene af engangsbioreaktorer, hvilket er afgørende for at opretholde sterilitet.UV-vis spektroskopi kan detektere membranskader ved at måle lysabsorption ved 350–400 nm, mens lækkede intracellulære materialer vises ved 800–900 nm [14]. Kapacitansprober, de eneste kommercielt tilgængelige sensorer designet til at måle levedygtig celletæthed, opnår dette ved at detektere ændringer i membranpolarisering [14]. For faciliteter, der håndterer flere bioreaktorer, kan værktøjer som Rapid Multi-Stream Sampler overvåge op til 16 gasstrømme samtidigt [13].
Disse sensorbaserede systemer, kombineret med miljøkontroller, såsom HVAC forureningsforebyggelse, skaber et robust forsvar mod forurening.
Miljø- og trykkontroller
At opretholde positivt tryk mellem renrumszoner er afgørende for at forhindre, at forurenende stoffer trænger ind [3].Positive pressure systems, when paired with HEPA filtration, act as physical barriers to microbial intrusion. Audible or visual alarms on HEPA filters can immediately notify staff if pressure drops below acceptable levels [3].
Ikke-levende partikeloptælling is another layer of defence. Laser particle counters continuously verify that the environment meets ISO air cleanliness standards during operation. By monitoring both 0.5 µm and 5.0 µm particles, these devices ensure air quality remains within required limits [7]. If unexpected deviations occur - such as a sudden drop in DO or a pH fluctuation - immediate isolation of the affected bioreactor and halting feed additions can prevent contamination from spreading [12].
For at skaffe specialiserede sensorer og udstyr skræddersyet til dyrket kødproduktion, forbinder virksomheder som
Ny Teknologi i Sterilitetstestning
Traditionelle metoder til sterilitetstestning er ofte utilstrækkelige på grund af deres lange 14-dages inkubationsperioder og afhængighed af manuel prøvetagning, hvilket kan efterlade plads til detektionshuller. Nyere teknologier træder til for at imødegå disse udfordringer og tilbyder hurtigere og mere præcis detektion af kontaminering. Dette er især vigtigt i produktionen af dyrket kød, hvor de høje omkostninger ved vækstmedier og forlængede dyrkningstider gør senfasekontaminering til et økonomisk mareridt.
AI-drevne Overvågningssystemer
Kunstig intelligens omformer detektion af kontaminering ved at analysere realtidsdata for at identificere mikrobielle indtrængen.Når bakterier invaderer en bioreaktor, forbruger de ilt og producerer metaboliske syrer, hvilket fører til mærkbare fald i opløst ilt og pH-niveauer. AI-systemer kan opdage disse afvigelser i ilt- og næringsforbrug, hvilket markerer potentiel forurening langt tidligere end traditionelle bioburden-test og sterilitet-protokoller kan levere resultater [12].
Disse AI-platforme inkorporerer også matematiske modeller til at fastslå det præcise tidspunkt, hvor forureningen opstod og simulere, hvordan mikrobielle populationer vokser over tid. Dette hjælper operatører med at spore forureningen tilbage til dens kilde, hvad enten det er en defekt fødekilde, en driftsfejl eller et udstyrsproblem. Teknikker som Poisson sandsynlighedsanalyse forbedrer yderligere nøjagtigheden af bioburden-test, hvilket reducerer sandsynligheden for falske negativer [12].
"Matematiske modeller hjælper med at estimere tidspunktet for kontaminationsintroduktion og mikrobiel vækstdynamik, hvilket forbedrer sporbarheden af kontaminering." - Naveenganesh Muralidharan, Senior Manager, MSAT, AGC Biologics [12]
Når anomalier opdages, kan øjeblikkelig handling - såsom at isolere bioreaktoren og standse alle fodertilsætninger - forhindre problemet i at sprede sig [12]. En systematisk tilgang, der involverer bioburden-testning, molekylær identifikation og vækstanalyse, er essentiel for at identificere årsagen og implementere korrigerende foranstaltninger. Disse AI-værktøjer bygger bro mellem traditionelle metoder og proaktiv kontaminationsstyring.
Koldplasma Sterilisering
Koldplasmateknologi tilbyder en ikke-termisk steriliseringsmulighed, der er særligt velegnet til produktion af dyrket kød.Drift ved eller nær stuetemperatur, det er ideelt til sterilisering af sensitive komponenter som bioreaktor dele, sensorer og plast, der ikke kan tåle varmen fra traditionel autoklavering [15][16][17]. Denne metode bruger reaktive ilt- og kvælstofarter sammen med UV-lys til at forstyrre mikrobielle membraner og DNA. Det er effektivt mod en bred vifte af forurenende stoffer, herunder bakteriesporer (Bacillus, Clostridium), svampe, vira og endda prioner [15][17].
En af koldplasmas fremtrædende egenskaber er, at det efterlader ingen giftige rester. Når strømmen slukkes, vender reaktive arter hurtigt tilbage til ilt, hvilket eliminerer behovet for en desorptionsfase [16][18].Det er også energieffektivt, da det kun kræver en standard elektrisk stikkontakt i stedet for varmekilder baseret på fossile brændstoffer [15][16]. For eksempel viser undersøgelser, at kold plasma kan opnå en >5 log reduktion i Bacillus cereus sporer inden for 25 minutter ved 300W effekt [15].
Men teknologien er ikke uden sine begrænsninger. Dens steriliseringseffekter er primært overfladeniveau, hvilket betyder, at den har svært ved at trænge ind i komplekse geometrier, hvor mikrober kan gemme sig i revner eller riller [15][16]. Højt protein- eller fedtindhold i bioreaktormiljøer kan også beskytte mikrober ved at opsamle reaktive arter, hvilket reducerer steriliseringens effektivitet [15][18].
| Funktion | Kold Plasma |
|---|---|
| Fordele | Ikke-termisk, ikke-giftig, energieffektiv, ingen rester, hurtig [16] |
| Begrænsninger | Begrænset penetration, reduceret effektivitet i komplekse geometriske former [15][16] |
Automatiserede billedbaserede detektionssystemer
Som et supplement til blandingen giver automatiserede billedsystemer et kraftfuldt værktøj til realtidsdetektion af kontaminering. Disse systemer tilbyder detaljeret morfologisk indsigt i cellevækst, hvilket er afgørende for at opdage kontamineringsmønstre, når de opstår [19].I modsætning til traditionel offline mikroskopi - som kræver manuel prøvetagning og farvning - integreres automatiseret billeddannelse problemfrit i online eller at-line overvågningsopsætninger. Dette giver operatører mulighed for at overvåge biomasse og cellehelbred uden at gå på kompromis med steriliteten [19].
Ved at reducere manuelle indgreb mindsker disse systemer menneskelige fejl og forbedrer reproducerbarheden på tværs af dyrkningsprocesser [19]. Avancerede billedbehandlingsalgoritmer kan spore fermenteringsfremskridt, optimere metabolitproduktion og sikre konsistens - en kritisk faktor ved opskalering af bioprocesser [19].
"Tilgængeligheden af avancerede prøvetagningsteknikker kombineret med automatiserede måleværktøjer...kan i høj grad reducere den tid, der kræves til stammeudvælgelse, procesudvikling og proceskontrol ved at mindske antallet af trin i produktions-/dyrkningsprocessen, især manuelle trin, og reducere fejludbredelse." - A.C. Veloso og E.C. Ferreira, University of Minho [19]
På trods af deres fordele er det ikke altid ligetil at integrere disse systemer. Cellekulturer er komplekse, råmaterialer varierer, og sensorer skal kunne modstå barske steriliseringsmetoder som damp eller gamma-bestråling [19]. For virksomheder, der ønsker at adoptere disse teknologier, kan platforme som
Konklusion
Sikring af bioreaktorens sterilitet i produktionen af dyrket kød er ikke en lille opgave, men en integreret sterilitetsteststrategi kan gøre det opnåeligt.Denne strategi blander traditionelle metoder, såsom membranfiltrering for større prøvevolumener og direkte inokulation for mindre, med moderne molekylære værktøjer som PCR og qPCR til hurtig patogen screening. Derudover tilføjer miljøovervågning - via luftprøvetagning og overfladesvabning - en ekstra sikkerhedsforanstaltning, der adresserer forureningsrisici i HVAC systemer, og fanger potentiel forurening, før det kan påvirke produktionsbeholdere [11].
Valget af testmetode afhænger af faktorer som prøve størrelse, tilstedeværelsen af stoffer, der kan forstyrre resultaterne, og om fokus er på fuld sterilitet validering eller blot overvågning af bioburden. Prøvetagning fra flere punkter i bioreaktoren - top, midte og bund - hjælper med at skabe en grundig mikrobiel profil og reducerer chancen for at overse lokaliseret forurening [1]. Dette er særligt kritisk, da risikoen for kontaminering i produktionen af dyrket kød er betydeligt højere end i biofarmaceutisk fremstilling, hvilket understreger behovet for strenge sterilitet protokoller [6].
Nøglen til at opretholde medie sterilitet i bioreaktorer er at anskaffe det rigtige udstyr. Værktøjer som aseptiske prøvetagningssystemer med forsteriliserede septa og HEPA-filtre, der er i stand til at fange 99,97% af partikler større end 0,3 μm, er essentielle [4]. Platforme som
Efterhånden som industrien vokser, bliver hybride sterilitetstilgange stadig vigtigere. Anvendelse af farmaceutiske kvalitetskontroller under de tidlige frøtrinsfaser, mens der anvendes fødevarestandarder til storskalaproduktion, skaber en balance mellem sikkerhed og omkostningseffektivitet [5][6]. Disse integrerede foranstaltninger vil være hjørnestenen i sikker og effektiv produktion af dyrket kød, efterhånden som området fortsætter med at udvikle sig.
Ofte stillede spørgsmål
Hvad er de vigtigste årsager til forurening i bioreaktorsystemer, der anvendes til produktion af dyrket kød?
Forurening i bioreaktorsystemer opstår, når det sterile miljø forstyrres, eller når næringsrige medier giver en ideel ramme for mikrober at trives i. Dette kan skyldes flere faktorer, såsom brud under prøvetagning, vedligeholdelse eller cellehøst; beskadigede eller blokerede gasfiltre; forurening, der allerede er til stede i vækstmediet; eller midlertidige åbninger skabt ved installation eller service af sensorer.Ud over det kan slidt udstyr afgive mikroplastpartikler, som kan tjene som hjem for mikroorganismer.
I produktionen af dyrket kød kan selv den mindste forurening kompromittere både sikkerheden og udbyttet af en batch. For at reducere disse risici er det afgørende at investere i udstyr af høj kvalitet som sterile filtre, bioreaktorer og sensorkits, der overholder strenge aseptiske standarder. Platforme som
Hvordan forbedrer kunstig intelligens sterilitetstest i bioreaktorer?
AI-drevne systemer transformerer sterilitetstest i dyrkede kød bioreaktorer ved at tilbyde realtidsindsigt gennem kontinuerlig overvågning.Ved hjælp af avancerede biosensorer holder disse systemer styr på kritiske faktorer som pH, opløst ilt og essentielle metabolitter som glukose og aminosyrer. Alt dette sker uden behov for manuelle kontrol, hvilket dramatisk reducerer risikoen for kontaminering.
Det, der adskiller disse systemer, er deres evne til at analysere data ved hjælp af algoritmer, der sammenligner målinger med etablerede sterilitetstandarder. Dette betyder, at de kan opdage selv de mindste tegn på mikrobiel vækst langt tidligere end traditionelle metoder. Udover blot detektion kommer prædiktiv analyse i spil, der identificerer potentielle risici som problemer under sensorinstallation eller indgang gennem porte. Disse systemer foreslår endda korrigerende foranstaltninger for at hjælpe producenter med at undgå dyre batchtab.
AI-drevet mikroskopi tilføjer et ekstra lag af effektivitet ved øjeblikkeligt at skelne mellem sunde celler og kontaminanter, hvilket fremskynder sterilitetverifikationsprocesserne.For producenter gør platforme som
Hvilke udfordringer begrænser brugen af koldplasma-sterilisering i bioreaktorer til produktion af dyrket kød?
Koldplasma-sterilisering er effektiv til at neutralisere mikrober, men det kommer med en række udfordringer, når det anvendes på bioreaktorer i produktion af dyrket kød. Et stort problem er den begrænsede indtrængningsdybde af de reaktive arter, der produceres af plasma. Dette gør det svært at sterilisere store volumener eller tæt pakkede medier grundigt. Derudover bliver det stadig sværere at opnå jævn plasma-dækning over en hel reaktor, efterhånden som systemets størrelse vokser.
Opskalering af koldplasma-systemer fra laboratorieindstillinger til kommercielle bioreaktorer introducerer yderligere forhindringer.Større reaktorer kræver højere effekt-til-volumen-forhold, hvilket kan resultere i steriliseringstider, der er langt fra praktiske. Mange koldplasma-systemer opererer også under vakuumforhold eller er afhængige af reaktive gasser, hvilket tilføjer lag af kompleksitet i forhold til sikkerhed, lovgivningsmæssig overholdelse og udstyrsdesign. Disse faktorer gør metoden mindre ideel til de storskala bioreaktorer, der typisk kræves i kommerciel produktion af dyrket kød.
En anden bekymring er potentialet for skader forårsaget af reaktive ilt- og kvælstofarter (RONS), som er nøglen til mikrobiel inaktivering. Disse reaktive arter kan skade følsomme pattedyrsceller eller nedbryde mediekomponenter, hvilket nødvendiggør omhyggelig optimering for at opretholde cellelevedygtighed. Som et resultat anvendes koldplasma ofte i kombination med andre steriliseringsteknikker frem for som en selvstændig løsning.











