Cryopbevaring er processen med at fryse og opbevare levende celler ved ultralave temperaturer for at opretholde deres levedygtighed over tid. Denne metode er afgørende for produktion af dyrket kød, da den sikrer konsistente, stabile cellelinjer og beskytter mod tab fra kontaminering eller udstyrsfejl. Nøgletrin inkluderer:
- Forberedelse: Høst celler under deres vækstfase, tjek levedygtighed (sigte efter ≥90%), og forbered dem i frysemedier med kryobeskyttelsesmidler som DMSO eller glycerol.
- Frysning: Brug en kontrolleret afkølingshastighed (-1°C til -3°C pr. minut) for at forhindre skader fra iskrystaller. Opbevar celler i flydende nitrogen damp (-135°C til -190°C) for langvarig opbevaring.
- Optøning: Optø celler hurtigt i et 37°C vandbad for at minimere toksicitet fra kryobeskyttelsesmidler, og overfør dem derefter til vækstmedier for genopretning.
- Kvalitetskontrol: Mærk reagensglas nøjagtigt, overvåg opbevaringsforholdene, og test levedygtigheden efter optøning for at sikre en vellykket opbevaring.
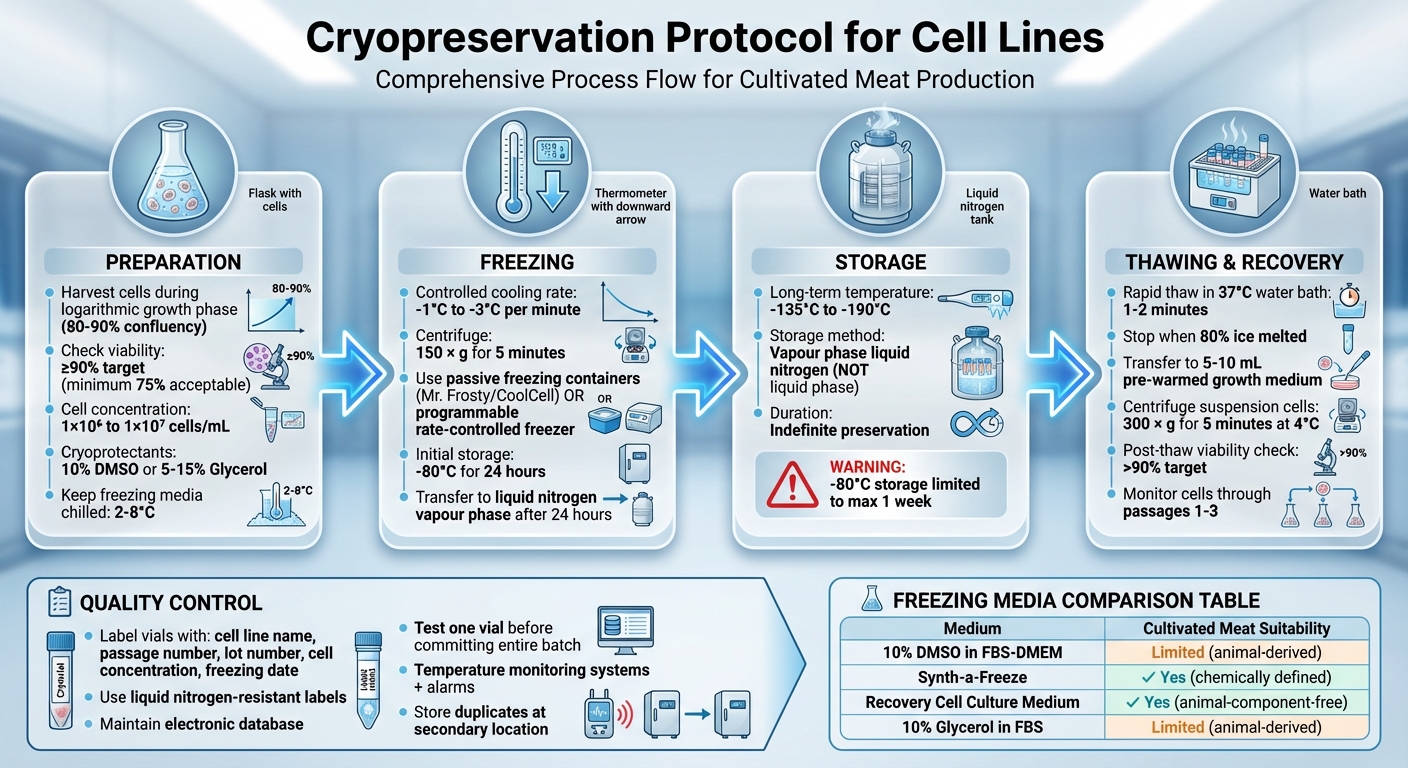
Komplet Kryopreservationsprotokol for Cellelinjer: 4-trins proces fra forberedelse til opbevaring
Forberedelse af celler til kryopreservation
Cellehøst og levedygtighedstjek
For at sikre den bedste genvinding efter optøning, høst celler under deres logaritmiske (log) vækstfase. For adherente cellelinjer er dette typisk, når de når 80–90% konfluens [2][3][6].
Kontroller levedygtigheden af cellerne ved hjælp af Trypan Blue eksklusionsmetoden. Bland lige dele (1:1) af 0,4% Trypan Blue med celleopslaget, og tæll derefter cellerne ved hjælp af en hæmocytometer.Levedygtige celler vil udelukke farvestoffet og fremstå lyse under mikroskopet, mens ikke-levedygtige celler vil farves blå [4]. Ideelt set sigt efter en levedygtighed på mindst 90% for de bedste genvindingsrater, selvom nogle protokoller kan acceptere et minimum på 75% [1][2][3][5].
Før høstning, brug et mikroskop til at kontrollere for bakteriel eller svampeforurening. Sund suspensionsceller bør fremstå lyse, runde og refraktive under et inverteret fasekontrastmikroskop [2][3].
Når cellerne opfylder de krævede levedygtighedsstandarder, gå videre til for-frysningstrinene.
Forberedelser før fryseprocessen
For adhærente celler, brug milde dissociationsmetoder, såsom trypsin eller TrypLE Express, og begræns inkubationstiden for at undgå at beskadige cellemembranerne [5]. Forbered cellerne ved en koncentration på 1 × 10⁶ til 1 × 10⁷ celler/mL, afhængigt af cellelinjen [1][6]. Når du aliquoterer, skal du sikre dig, at cellesuspensionen blandes ofte for at opretholde en ensartet fordeling i frysebeholdere [5].
Hold frysemediet køligt mellem 2°C og 8°C under resuspension for at reducere toksiciteten af cryobeskyttelsesmidlet, før fryseprocessen begynder [5]. Når cellerne er suspenderet i frysemediet, skal du hurtigt gå videre til fryseprotokollen [1].Opbevar altid celler ved den lavest mulige passage nummer for at reducere risikoen for genetisk drift eller morfologiske ændringer [5][7].
Valg af kryobeskyttelsesmidler og frysemedier
Kryobeskyttelsesmidler og deres funktioner
Dimethylsulfoxid (DMSO) anvendes bredt som kryobeskyttelsesmiddel, typisk ved en koncentration på 10% [2]. Det virker ved at trænge ind i cellemembraner og reducere isdannelse under fryseprocessen. Dog kan DMSO være giftigt for celler ved stuetemperatur, så hurtig optøning er afgørende for at minimere eksponering og hurtigt fortynde det [1].
Glycerol fungerer som et nyttigt alternativ for cellelinjer, der er følsomme over for DMSO, og anvendes generelt i koncentrationer fra 5% til 15% [8].Det er særligt effektivt for celletyper, hvor DMSO kan forårsage uønsket differentiering [3], og det har tendens til at have lavere toksicitet sammenlignet med DMSO.
I anvendelser af dyrket kød bruger traditionelle fryseprotokoller ofte en blanding af 90% Fetal Bovine Serum (FBS) og 10% DMSO [1]. Dog begrænser afhængigheden af animalske komponenter disse metoder med hensyn til skalerbarhed og regulatorisk godkendelse [9]. For at tackle disse problemer, kemisk definerede medier - som Synth-a-Freeze eller Recovery Cell Culture Medium - tilbyder et alternativ uden animalske komponenter. Disse medier opretholder høj celleviabilitet efter optøning, samtidig med at de overvinder de udfordringer, der er forbundet med komponenter af animalsk oprindelse [9].
Sammenligning af frysemedier
Her er en oversigt over fordelene og begrænsningerne ved forskellige frysemedier, der anvendes i produktionen af kultiveret kød:
| Medium | Fordele | Ulemper | Egnethed til kultiveret kød |
|---|---|---|---|
| 10% DMSO i FBS-DMEM | Etablerede protokoller [1] | Indeholder animalske komponenter; batchvariabilitet [9] | Begrænset skalerbarhed |
| Synth-a-Freeze | Kemisk defineret; ensartet kvalitet; fri for animalske komponenter [9] | Højere initialomkostning [9] | Ja |
| Recovery Cell Culture Medium | Nem at bruge; designet til hurtig genopretning [9] | Kan kræve optimering for specifikke cellelinjer | Ja |
| 10% Glycerol i FBS | Alternativ for DMSO-følsomme celler [1] | Afhænger af serum af animalsk oprindelse [9] | Begrænset skalerbarhed |
I februar 2023 demonstrerede forskere ved Tokyo Women's Medical University, ledet af Hironobu Takahashi, vigtigheden af at vælge det rigtige frysemedie.Ved at bruge kommercielle muligheder som CELLBANKER 1 og 2, lykkedes det dem at kryopbevare primære bovine myogene celler ved –80°C i op til et år. Bemærkelsesværdigt bevarede disse celler deres evne til at proliferere og differentiere sig til kontraktil muskelvæv med intakte sarkomerestrukturer efter optøning [10].
Til produktion af dyrket kød foretrækkes kemisk definerede og GMP-kompatible medier i stigende grad. Som STEMCELL Technologies fremhæver:
I stærkt regulerede områder som celle- og genterapi anbefales det at bruge et GMP-fremstillet, fuldt defineret kryopbevaringsmedium for at sikre, at produkterne konsekvent produceres og kontrolleres i henhold til kvalitetsstandarder [9].
Platforme som
Cryopreservationsprocedure og kølehastigheder
Trin-for-trin fryseprotokol
Nøglen til succesfuld cryopreservation ligger i at opretholde en stabil kølehastighed på -1°C til -3°C pr. minut[2]. Denne gradvise proces tillader vand at forlade cellerne langsomt, hvilket forhindrer dannelsen af skadelige intracellulære iskrystaller, der kan sprænge cellemembraner[1].
Begynd med at centrifugere cellerne ved 150 x g i 5 minutter[3]. Når de er centrifugeret, genopslus cellen pellet i et koldt frysemedium, der indeholder 10% DMSO ved en koncentration af 2–4×10⁶ celler/mL[3].For at reducere DMSO-eksponeringen, bevæg dig hurtigt til næste trin - fryse.
Fordel celleopslaget i forudmærkede kryogene rør. Hvert rør skal tydeligt angive væsentlige oplysninger såsom cellelinjens navn, passage nummer, batch nummer, cellekoncentration og dato for fryse[3]. Når rørene er forberedt, er det tid til at vælge og anvende det passende køleudstyr.
Køleudstyr og teknikker
Placer rørene straks i en kontrolleret kølehastighedsenhed. Passive frysebeholdere, som Nalgene "Mr Frosty" (som bruger isopropanol) eller Corning "CoolCell", er populære valg. Disse værktøjer kan opnå en kølehastighed på cirka 1°C pr. minut når de placeres i en -80°C fryser[2].
For større operationer, hvor konsistens er kritisk, er en programmerbar hastighedskontrolleret fryser den bedste mulighed. Som angivet af Sigma-Aldrich:
ECACC bruger rutinemæssigt en programmerbar hastighedskontrolleret fryser. Dette er den mest pålidelige og reproducerbare måde at fryse celler på[3].
Efter omkring 24 timer ved -80°C, overfør flaskerne til dampfasen af flydende nitrogen, hvor temperaturerne ligger mellem -135°C og -190°C, til langtidsopbevaring[4]. Undgå at opbevare celler ved -80°C i længere tid end en uge, da dette kan kompromittere deres levedygtighed. Temperaturer under -135°C er essentielle for ubegribelig bevarelse[2]. Brug af dampfasen i stedet for væskefasen reducerer risikoen for krydskontaminering, mens der opretholdes tilstrækkeligt lave temperaturer.
Optøning og Genopretningsprotokoller
Optøningsproces
At optø celler hurtigt er afgørende for at begrænse eksponeringen for toksiske kryobeskyttelsesmidler og forhindre, at iskrystaller forårsager skader. Sørg for at bære en ansigtsskærm og isolerede handsker for sikkerhed. Start med at fjerne kryovialen fra flydende nitrogen og løsne låget lidt for at frigive eventuelt opbygget tryk. Stram derefter låget igen.
Placer vials i et vandbad ved 37°C, og sørg for, at låget forbliver over vandlinjen. Lad det optø i 1–2 minutter, eller indtil kun få iskrystaller er tilbage. Når det er optøet, tør vials yderside med 70% alkohol for at opretholde steriliteten.
Overfør indholdet af vials til et rør, der indeholder 5–10 mL forvarmet vækstmedium. Tilsæt mediet langsomt for at hjælpe med at reducere osmotisk chok. Hvis du arbejder med suspensionscellelinjer, centrifuger straks celleopslaget ved 300 × g i 5 minutter ved 4°C.Dette trin hjælper med at pelletisere cellerne og fjerner kryobeskyttelsen. Efter centrifugering, genopslus cellerne i frisk medium. For adhærente celler er centrifugering normalt unødvendig. I stedet, så direkte cellerne i et passende kulturkar og fjern eventuelt resterende DMSO under den første medieskift, typisk efter 24 timer.
Post-Tømningsvurderinger
Straks efter tørring, kontroller celleviabilitet for at sikre, at genopretningen har været vellykket. Brug Trypan Blue eksklusionsmetoden til denne vurdering. Ideelt set bør celleviabiliteten overstige 90% [11], men et minimum på 75% er acceptabelt. Efter 24 timer, inspicer cellerne under et fasekontrastmikroskop for at bekræfte adhæsion, evaluere celledensitet og kontrollere for tegn på kontaminering.
Fortsæt med at overvåge cellerne gennem passage 1–3 for at sikre normal proliferation og at de bevarer deres forventede egenskaber.For cellelinjer, der kommer sig langsommere, kan du forbedre overlevelsen ved at øge den indledende koncentration af fosterkalveserum til omkring 20% v/v.
sbb-itb-ffee270
Lagring og Langtidslevedygtighed
Lagringsbetingelser og Varighed
For at opretholde cellelinjers levedygtighed på lang sigt er det essentielt at opbevare dem ved temperaturer under -135°C [7][2]. Dette sikrer, at de forbliver bevaret på ubestemt tid.Den foretrukne metode til opbevaring af dyrkede kød cellelinjer er dampfase flydende nitrogen. Denne teknik holder temperaturer mellem -135°C og -190°C, hvilket gør den ideel til langtidsbevaring, samtidig med at den tilbyder forbedret sikkerhed sammenlignet med opbevaring i væskefase.
Hvis du har brug for at opbevare celler ved -80°C, skal du begrænse dette til en periode på 24 timer til en uge. Udover dette kan cellelevedygtigheden falde.For midlertidig opbevaring ved denne temperatur, overfør cellerne til flydende nitrogen opbevaring så hurtigt som muligt.
Brug standard sterile kryogene vials (1–2 mL) med indvendig gevind og en O-ring for sikker opbevaring [4][5]. Placer altid forseglede kryovials i gasfasen snarere end i væskefasen af nitrogen for at reducere risikoen for vial eksplosioner under optøning [5]. Derudover skal du sikre, at bulk flydende nitrogen beholdere holdes mindst halvt fyldt for at opretholde en sikkerhedspuffer.
Endelig er strenge kvalitetskontrolforanstaltninger afgørende for at sikre cellernes langsigtede levedygtighed.
Kvalitetskontrol Tjek
For at sikre pålideligheden af opbevarede cellelinjer, følg strenge protokoller for kvalitetskontrol. Begynd med nøjagtigt at mærke hver vial med flydende nitrogen-resistente etiketter.Inkluder essentielle detaljer såsom cellelinjeidentitet, partinummer, passagesnummer og frysedato. Oprethold en elektronisk database for at registrere den nøjagtige placering af hver ampul, hvilket reducerer den tid, opbevaringsbeholdere skal forblive åbne [7][2].
Før du forpligter hele partier til langtidsopbevaring, skal du teste en ampuls levedygtighed efter kortvarig gasfaseopbevaring. Dette trin hjælper med at bekræfte, at fryseprocessen var vellykket og identificerer eventuelle potentielle problemer [4][7][2]. For meget værdifulde cellelagre er det klogt at opbevare duplikater på en sekundær placering for at beskytte mod udstyrsfejl eller lokale katastrofer [7][2].
Udstyr alle opbevaringsbeholdere med temperaturovervågningssystemer og alarmer for at opdage lave niveauer af flydende nitrogen [7]. Derudover skal der installeres iltalarmer i opbevaringsområder, indstillet til at udløse ved 18% ilt (v/v), for at minimere kvælningsrisici for personale, der arbejder med flydende nitrogen [7][2].
Kryopbevaring af pattedyrcellelinjer video protokol
Konklusion og Nøglepunkter
Her er en hurtig opsummering af de væsentlige trin og anbefalinger for effektiv kryopbevaring i produktionen af kultiveret kød:
- Cellehøst: Indsaml celler under deres logaritmiske vækstfase, og sørg for, at levedygtigheden overstiger 90%. Brug 10% DMSO som kryobeskyttelsesmiddel, selvom glycerol kan være et alternativ for mere delikate cellelinjer [11][1].
- Køling og Opbevaring: Oprethold en kontrolleret kølehastighed og overfør hurtigt reagensglas til dampfase flydende nitrogen opbevaring for at beskytte celleintegriteten [11]
En undersøgelse af Roka Kakehi et al. fremhæver vigtigheden af præcision i kryopbevaring [10]:
"At sikre en pålidelig og konsekvent kilde til celler ved at bruge kryopbevaring vil gøre det muligt for os at øge den stabile forsyning af lovende celler til produktion af kultiveret kød." - Roka Kakehi et al., Tokyo Women's Medical University
- Optøningsproces: Optø celler i et 37°C vandbad i cirka to minutter, og stop når 80% af isen er smeltet. Dette reducerer DMSO toksicitet og forbedrer cellegenopretning [1]. Følg op med livbarhedstjek efter optøning for at sikre succes og finjustere fremtidige procedurer.
Disse metoder arbejder hånd i hånd med strenge kvalitetskontrolpraksisser. Mærk altid flasker nøjagtigt, oprethold organiserede optegnelser, og implementer grundige kontroller før langtidsopbevaring [11]. For specialiserede kryopbevaringsbehov forbinder platforme som
Ofte stillede spørgsmål
Hvad er fordelene ved at bruge kemisk definerede medier til kryopbevaring af cellelinjer i produktion af kultiveret kød?
Kemisk definerede medier bringer flere fordele, når det kommer til kryopbevaring af cellelinjer til produktion af kultiveret kød. Ved at fjerne udefinerede komponenter, som animalsk serum, sikrer de ensartede og forudsigelige resultater - en afgørende faktor for at opretholde den langsigtede pålidelighed af cellelinjer.
En anden vigtig fordel er den reducerede risiko for kontaminering og variabilitet. Dette understøtter ikke kun højere kvalitets- og sikkerhedsstandarder, men stemmer også perfekt overens med den præcision og skalerbarhed, der kræves for at imødekomme både regulatoriske krav og forbrugerforventninger i den dyrkede kødindustri.
Hvordan påvirker valget af kryobeskytter celleoverlevelse under fryse- og optøningsprocessen?
Valget af kryobeskytter er en nøglefaktor i bevarelsen af cellehelse under fryse- og optøningsprocessen. To almindeligt anvendte muligheder er dimethylsulfoxid (DMSO) og glycerol, hver med distinkte egenskaber. DMSO er kendt for sin evne til hurtigt at trænge ind i celler og give stærk beskyttelse. Dog kommer det med en advarsel: ved høje koncentrationer eller ved langvarig eksponering kan det blive giftigt, hvilket potentielt kan sænke celleviabiliteten.
Glycerol er derimod mindre giftigt og kan anvendes direkte.Ulempen ligger i dens langsommere hastighed af cellepenetration, hvilket kan resultere i mindre øjeblikkelig beskyttelse sammenlignet med DMSO.
At opnå den rette balance er afgørende. Korrekt justering af koncentrationen og eksponeringstiden for kryobeskyttelsesmidlet hjælper med at beskytte celler, samtidig med at risikoen for toksicitet minimeres. Derudover er det essentielt at overholde bedste praksis for kølehastigheder og opbevaringsforhold for at sikre de højeste mulige genopretningsrater efter optøning.
Hvorfor er det vigtigt at kontrollere kølehastigheden under kryopbevaring?
At opretholde en stabil kølehastighed, normalt mellem –1°C og –3°C pr. minut, er nøglen til at holde celler levedygtige. Gradvis nedkøling tillader celler at dehydrere i et kontrolleret tempo, hvilket reducerer chancen for dannelse af skadelige iskrystaller, som kan rive eller beskadige cellemembraner.
Denne målte tilgang beskytter cellernes struktur, hvilket øger deres overlevelse og funktionalitet, når de er optøet.At følge præcise køleprotokoller er essentielt for at sikre en vellykket langtidsopbevaring og genopretning af cellelinjer.











