Die Skalierung von Zelllinien für die Produktion von kultiviertem Fleisch hängt von der Wahl des richtigen Bioreaktorsystems ab. Die Kosten variieren erheblich zwischen Rührkessel-, Wellen- und Festbett-Bioreaktoren aufgrund von Unterschieden in Kapitalinvestitionen, Betriebskosten und Skalierbarkeit. Hier ist, was Sie wissen müssen:
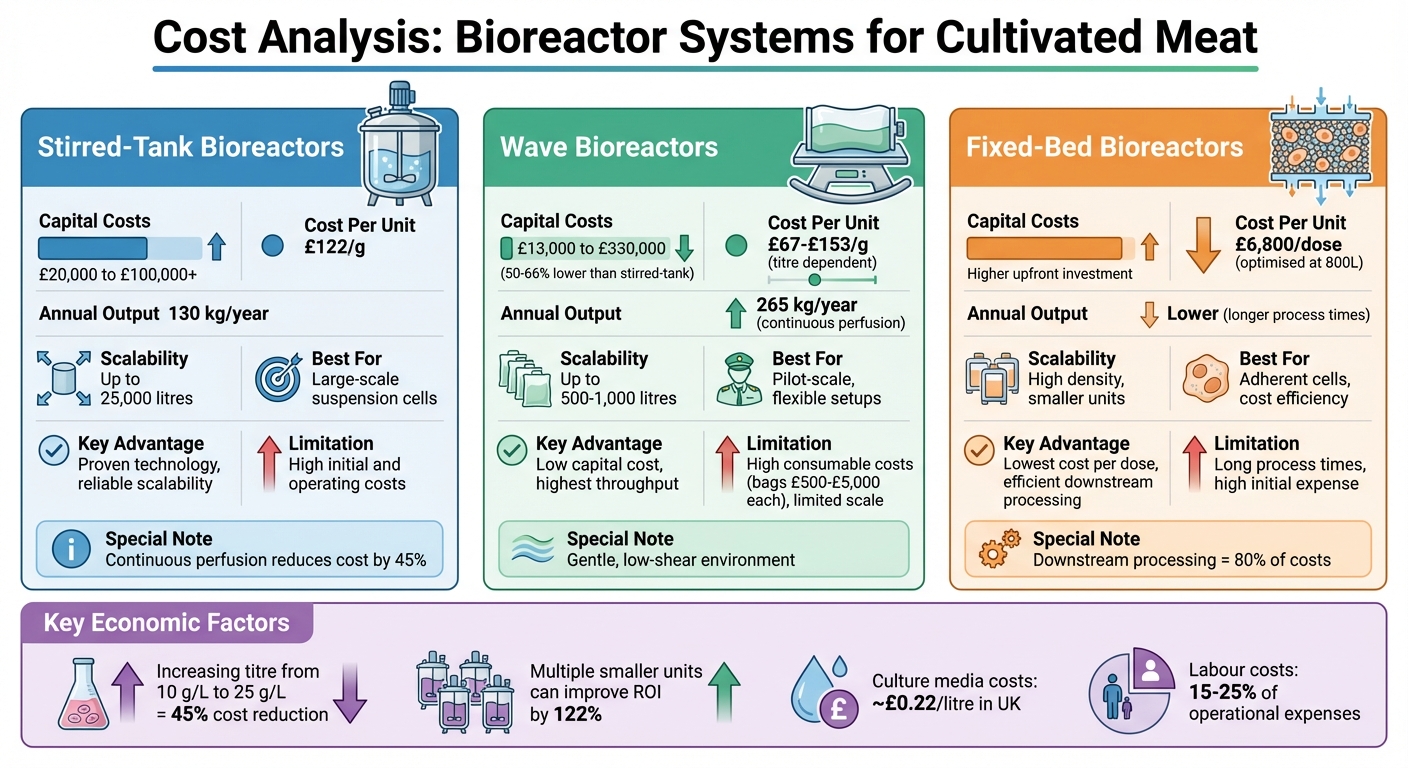
- Rührkessel-Bioreaktoren: Am besten für die Großproduktion mit Suspensionszelllinien geeignet. Hohe Anfangskosten (£20.000 bis Hunderttausende), aber bewährte Skalierbarkeit (bis zu 25.000 Liter). Kontinuierliche Perfusionsmethoden können die Kosten pro Gramm um 45% senken.
- Wellen-Bioreaktoren: Erschwinglicher Ausgangspunkt (50–66% niedrigere Anfangskosten als Rührkesselsysteme). Ideal für kleine bis mittlere Maßstäbe, aber begrenzt über 1.000 Liter hinaus. Verbrauchskosten (e.g., Einwegbeutel zu je £500–£5.000) erhöhen die langfristigen Ausgaben.
- Festbett-Bioreaktoren: Geeignet für adhärente Zellen, bieten die niedrigsten Kosten pro Dosis im großen Maßstab (6.800 £ pro Dosis bei 800 Litern). Hohe Anfangsinvestition, aber effizient zur Reduzierung der nachgelagerten Verarbeitungskosten.
Schneller Vergleich
| Bioreaktortyp | Kapitalaufwand | Kosten pro Einheit | Skalierbarkeit | Am besten geeignet für | Einschränkungen |
|---|---|---|---|---|---|
| Rührkessel | £20,000+ | £122/g | Bis zu 25.000 Liter | Großmaßstäbliche Suspensionszellen | Hohe Anfangs- und Betriebskosten |
| Wave | £13,000–£330,000 | £67–£153/g | Bis zu 1.000 Liter | Pilotmaßstab, flexible Aufbauten | Hohe Verbrauchskosten, begrenzter Maßstab |
| Festbett | Höhere Anfangskosten | £6,800/Dosis | Kleinere Einheiten, hohe Dichte | Adhärente Zellen, Kosteneffizienz | Lange Prozesszeiten, hohe Anfangskosten |
Wichtigste Erkenntnis: Rührkesselsysteme dominieren die Großproduktion, während Wellenbioreaktoren ideal für frühe Entwicklungsphasen sind.Festbett-Systeme zeichnen sich durch Kosteneffizienz für adhärente Zelllinien aus. Die Wahl hängt von der Produktionsskala, den Eigenschaften der Zelllinie und den Budgetbeschränkungen ab.
Bioreaktorkostenvergleich für die Produktion von kultiviertem Fleisch: Kapital-, Betriebskosten und Skalierbarkeit
1. Rührkessel-Bioreaktoren
Kapitalaufwendungen
In Rührkessel-Bioreaktoren zu investieren, ist keine kleine Aufgabe, mit Preisen von £20,000 für kleinere Tischgeräte bis zu mehreren hunderttausend Pfund für größere Systeme.[8] Die Wahl des Materials spielt hier eine große Rolle. Edelstahl-Systeme, die wiederverwendbar sind, kosten tendenziell 2–3 Mal mehr als Einweg-Alternativen. Dies liegt hauptsächlich an den zusätzlichen Kosten für Stahlbehälter und die integrierten Clean-in-Place (CIP) und Sterilise-in-Place (SIP) Systeme.[1] Aber der Reaktor selbst ist nicht der einzige große Kostenfaktor.Facility-bezogene Kosten - wie Reinräume, HVAC-Systeme, Wasser zur Injektion und Versorgungsleistungen - können mehr als die Hälfte des gesamten Projektbudgets ausmachen.[4] In Großbritannien fügt die Erfüllung der Anforderungen der Food Standards Agency für lebensmitteltaugliche Einrichtungen eine weitere Kostenschicht hinzu. Tools wie
Betriebskosten
Nach der anfänglichen Investition werden die täglichen Betriebskosten zu einem entscheidenden Faktor. Bei Rührkesselsystemen sind die größten wiederkehrenden Ausgaben Wachstumsmedien, Verbrauchsmaterialien und Arbeitskräfte. In Großbritannien werden die Kosten für Kulturmedien auf etwa £0.22 pro Liter geschätzt.[6] Wiederverwendbare Systeme bieten hier einen Kostenvorteil, mit Betriebskosten 20–40% niedriger als Einwegformate, da es nicht notwendig ist, ständig Einwegbeutel zu kaufen.[1] Rührkesselsysteme profitieren auch von gut etablierten Protokollen, die den Arbeitsaufwand pro Charge im Vergleich zu weniger automatisierten Setups reduzieren können. Prozessintensivierung, wie kontinuierliche Perfusionstechniken, kann die Kosten erheblich senken. Studien zeigen beispielsweise, dass kontinuierliche Perfusionsprozesse in Rührkesseln die Kosten pro Gramm um etwa 45% im Vergleich zu traditionellen Fed-Batch-Methoden senken können, dank erhöhter Produktivität und reduziertem Medienverbrauch pro Biomasseeinheit.[4]
Skalierbarkeit
Wenn es um Skalierbarkeit geht, sind Rührkessel-Bioreaktoren der Goldstandard.Sie sind in Größen erhältlich, die von kleinen Bankmaßstabsystemen (1–5 Liter) bis hin zu industriellen Einheiten reichen, die 10.000–25.000 Liter überschreiten.[4][7] Eine Kostenmodellierungsstudie ergab, dass bei 1.000 Litern Rührkesselsysteme Kosten pro Dosis von etwa US$12.000 erreichen, was sie wirtschaftlicher macht als Multi-Tray-Adhärentsysteme.[3] Intensivierte Prozesse verbessern die Skalierbarkeit weiter. Beispielsweise wurde gezeigt, dass kontinuierliche Perfusionsprozesse die jährlichen Produkterträge nahezu verdoppeln (265 kg im Vergleich zu 130 kg) im Vergleich zur Fed-Batch-Verarbeitung, während auch die Investitionskosten um 32% gesenkt werden.[4]
Zelllinienkompatibilität
Rührkessel-Bioreaktoren sind hervorragend geeignet für suspensionsangepasste Zelllinien, die hydrodynamische Scherkräfte bewältigen können und in gut durchmischten Umgebungen bei hoher Dichte gedeihen.[7] Für die Produktion von kultiviertem Fleisch umfasst dies in Suspension angepasste Myoblasten, Satellitenzellen oder pluripotente Stammzellen, die in serumfreiem Medium gezüchtet werden. Schersensitive Zelllinien erfordern jedoch eine sanftere Durchmischung, was den Sauerstofftransfer und die Zelldichten begrenzen kann, was letztendlich den Medienbedarf und die Betriebskosten pro Kilogramm Biomasse erhöht.[7] Anheftungsabhängige Zelllinien können auch in Rührkesseln unter Verwendung von Mikrokörpern kultiviert werden, aber dies erhöht die Komplexität und die Verbrauchskosten, was sie im Vergleich zu Festbettsystemen weniger kosteneffektiv macht. Zelllinien mit schnellen Verdopplungszeiten und hoher spezifischer Produktivität können die Reaktorverweilzeiten und den Medienverbrauch reduzieren, was in wirtschaftlichen Modellen wiederholt als Schlüsselfaktoren zur Senkung der Produktionskosten hervorgehoben wird.[4] [7]
2.Wave-Bioreaktoren
Kapitalaufwendungen
Wave-Bioreaktoren bieten einen erschwinglicheren Einstiegspunkt für Produzenten von kultiviertem Fleisch, mit anfänglichen Kosten, die etwa 50–66 % niedriger sind als die von wiederverwendbaren Rührkesselsystemen [1]. Dieser Kostenvorteil ist hauptsächlich auf ihr einfacheres mechanisches Design zurückzuführen - es besteht keine Notwendigkeit für komplexe Rührwerke, Antriebsmotoren oder integrierte Reinigungssysteme. In Großbritannien liegen die Preise für Wave-Bioreaktor-Einheiten je nach Größe und Automatisierungsgrad zwischen £13,000 und £330,000 [8]. Ein weiterer wichtiger Faktor, der diese Einsparungen vorantreibt, ist die Verwendung von Einwegbeuteln, die die Notwendigkeit für kostspielige Reinigungs- und Sterilisationsinfrastrukturen beseitigen. Für Startups oder Forschungsteams mit begrenztem Budget macht diese geringere Anfangsinvestition Wave-Bioreaktoren zu einer attraktiven Wahl für die Prozessentwicklung und die Produktion im Pilotmaßstab.Zusätzlich ermöglichen Plattformen wie
Betriebskosten
Wenn es um Betriebskosten geht, erzählen Wellenbioreaktoren eine andere Geschichte. Verbrauchskosten, insbesondere die Einwegbeutel, die zwischen £500 und £5.000 kosten, tragen zu höheren langfristigen Kosten bei [5]. Dennoch bieten Wellensysteme einige betriebliche Vorteile. Ihre sanfte Schaukelbewegung verbraucht weniger Energie im Vergleich zum mechanischen Rühren anderer Systeme und erfordert in der Regel weniger qualifiziertes Personal zur Überwachung. Allerdings bedeuten die höheren Kosten für Verbrauchsmaterialien pro Charge, dass die langfristigen Betriebskosten tendenziell die von wiederverwendbaren Systemen übersteigen.
Skalierbarkeit
Skalierbarkeit ist ein weiterer Bereich, in dem Wellen-Bioreaktoren hervorstechen - jedoch mit einigen Einschränkungen. Sie funktionieren außergewöhnlich gut im kleinen bis mittleren Maßstab, haben jedoch Schwierigkeiten über 500–1.000 Liter hinaus, da die Schaukelbewegung bei größeren Volumina ineffizient wird. Dies macht Wellensysteme ideal für die Prozessentwicklung, die Produktion im Pilotmaßstab und die Fertigung in frühen Stadien, jedoch nicht für groß angelegte kommerzielle Operationen. Ein modularer "Scale-out"-Ansatz - bei dem mehrere kleinere Einheiten parallel anstelle eines großen Gefäßes verwendet werden - kann die Kapitalrendite um bis zu 122% im Vergleich zu traditionellen Strategien mit einem großen Bioreaktor verbessern [2]. Da die nachgelagerte Verarbeitung typischerweise etwa 80% der gesamten Produktionskosten ausmacht [2], kann das Teilen von nachgelagerten Geräten über mehrere Einheiten hinweg zu weiteren Kostensenkungen führen.Für die Produktion von kultiviertem Fleisch unterstützt dieses Skalierbarkeitsprofil ein verteiltes Fertigungsmodell, bei dem mehrere kleinere Anlagen die Baukosten senken und die Widerstandsfähigkeit der Lieferkette verbessern.
Zelllinienkompatibilität
Wave-Bioreaktoren sind besonders gut geeignet für in Suspension angepasste Zelllinien und semi-adhärente Kulturen. Ihre sanfte, scherarme Umgebung erhält die hohe Zellviabilität für Zelltypen wie immortalisierten Muskelzellen, Fibroblasten und pluripotente Stammzellen [3]. Die Wahl der Zelllinie kann die Produktionskosten erheblich beeinflussen; zum Beispiel kann die Erhöhung des Produkttitres von 10 Gramm pro Liter auf 25 Gramm pro Liter die Kosten der verkauften Waren um etwa 45 % senken [4].Die sanfte Mischwirkung von Wellensystemen ist besonders vorteilhaft für Zelllinien, die längere Kulturperioden erfordern, da sie Zellschäden reduziert und die Notwendigkeit häufiger Mediumwechsel oder teurer Wachstumsfaktorzusätze begrenzt. Obwohl adhärente Zelllinien auch in Wellenbioreaktoren mit Mikrokügelchen kultiviert werden können, sind Festbett-Systeme für diese Zelltypen im Allgemeinen eine wirtschaftlichere Option.
3. Festbett-Bioreaktoren
Kapitalaufwendungen
Festbett-Bioreaktoren erfordern eine erhebliche Anfangsinvestition aufgrund der Kosten für spezialisierte Ausrüstung und Einwegbehälter. Ein gutes Beispiel dafür ist das iCELLis®-System, eine bekannte Festbett-Technologie. Bei einem klinischen Maßstab von 200 Litern betrugen die anfänglichen Kosten pro Dosis £17.000. Diese sanken auf £8.500 pro Dosis bei 800 Litern und reduzierten sich weiter auf £6.800 pro Dosis nach der Optimierung des Produktionsprotokolls [3].Während diese Investitionskosten hoch erscheinen mögen, werden sie bei größeren Produktionsmengen dank der Effizienz des Systems bei der Verarbeitung des Durchsatzes besser handhabbar. Für Produzenten von kultiviertem Fleisch bieten Plattformen wie
Betriebskosten
Trotz ihres höheren Anfangspreises liefern Festbett-Bioreaktoren die niedrigsten Kosten pro Dosis im Vergleich zu anderen Systemen. Zum Beispiel produzierte das iCELLis®-System bei einem Maßstab von 800 Litern Dosen zu je £8,500, deutlich weniger als die £10,200 pro Dosis für Suspensionsbioreaktoren [3] . Dieser Kostenvorteil ergibt sich aus einer besseren Materialnutzung und einem reduzierten Bedarf an nachgelagerter Verarbeitung.In der Proteinproduktion erreichten Festbettsysteme Kosten von £134 pro Gramm, während kontinuierliche Festbettprozesse diese auf £100 pro Gramm senkten [4]. Die Kosten sind jedoch stark vom Produkttiter abhängig. Zum Beispiel, wenn der Titer auf 25 Gramm pro Liter anstieg, sanken die Kosten um etwa 45%. Umgekehrt stiegen die Kosten bei einem Rückgang auf 10 Gramm pro Liter auf £156 pro Gramm [4]. Die Arbeitskosten, die typischerweise 15–25% der Betriebsausgaben in der Produktion von kultiviertem Fleisch ausmachen, werden ebenfalls durch die geringeren Handhabungsanforderungen von Festbettsystemen reduziert [1].
Skalierbarkeit
Skalierbarkeit ist ein weiterer Bereich, in dem Festbettsysteme glänzen, indem sie wirtschaftliche Vorteile durch Produktivitätssteigerungen bieten, anstatt lediglich die Behältergröße zu erhöhen.Obwohl das iCELLis®-System aufgrund längerer Prozesszeiten und Immobilisierung nach der Aussaat jährlich weniger Dosen produziert als Suspensionsbioreaktoren, erweist es sich dennoch als die kostengünstigste Option, gemessen an den Kosten pro Dosis [3] . Seine hohe Oberflächendichte ermöglicht eine effiziente Kultivierung im großen Maßstab, ohne dass riesige Gefäße erforderlich sind. Darüber hinaus kann die Verwendung mehrerer kleinerer Festbett-Einheiten, die sich die nachgelagerte Ausrüstung teilen, die Kapitalrendite um 122 % steigern, verglichen mit der Verwendung eines einzelnen großen Bioreaktors [2]. Diese Skalierbarkeit unterstützt verteilte Fertigungsanlagen, die nicht nur die Baukosten senken, sondern auch die Flexibilität der Lieferkette verbessern.
Zelllinienkompatibilität
Festbett-Bioreaktoren sind besonders gut geeignet für adhärente Zelllinien, die eine Oberfläche für das Wachstum benötigen.Ihr Packed-Bed-Design schafft eine hochdichte Umgebung, die ideal für Säugetierzellen ist, einschließlich Primärzellen und Stammzelllinien, die häufig in der Produktion von kultiviertem Fleisch verwendet werden [3] . Die geringe Scherumgebung innerhalb der Bettmatrix schützt die Zellen vor mechanischen Schäden, was diese Systeme zu einer e
sbb-itb-ffee270
Kostentreiber der Produktion von kultiviertem Fleisch
Vorteile und Nachteile
Die Wahl des richtigen Bioreaktorsystems erfordert ein Gleichgewicht zwischen Anfangsinvestition, Betriebseffizienz und Produktionskosten. Hier ist ein genauerer Blick auf die Stärken und Schwächen verschiedener Systeme, um die Entscheidungsfindung zu unterstützen.
Rührkessel-Bioreaktoren sind eine gut etablierte Option mit nachgewiesener Skalierbarkeit, was sie zu einer zuverlässigen Wahl für viele Branchen macht. Sie haben jedoch die höchsten Anschaffungskosten (£41,2M) und die höchsten Kosten pro Gramm (£122) [4] . Während ihre Steuerungsparameter gut verstanden werden, erfordern sie längere Saatfermentationstrainings und haben eine geringere jährliche Produktionskapazität (130 kg pro Jahr) [4].
Festbett-Bioreaktoren zeichnen sich durch ihre Kosteneffizienz pro Dosis aus, mit optimierten Kosten von etwa £6.800 [3]. Sie glänzen in der Downstream-Verarbeitung, ein kritischer Faktor, da die Downstream-Kosten etwa 80% der gesamten Produktionskosten für hochwertige Produkte ausmachen können [2]. Auf der anderen Seite begrenzen ihre längeren Verarbeitungszeiten die Anzahl der jährlich produzierten Chargen [3].
Wave-Bioreaktoren und kontinuierliche Perfusionssysteme finden ein Gleichgewicht mit einem geringeren Kapitalbedarf (£28M) und den niedrigsten Kosten pro Gramm (£67/g), während sie den höchsten Durchsatz (265 kg/Jahr) erreichen [4]. Ihre betriebliche Komplexität und Empfindlichkeit gegenüber dem Produkttiter können jedoch Herausforderungen darstellen. Beispielsweise kann ein Rückgang des Titers von 25 g/L auf 10 g/L die Kosten auf etwa £153/g erhöhen [4].
Die Wahl des Bioreaktors hängt letztendlich von Faktoren wie Produktionsmaßstab, den Eigenschaften der Zelllinie und dem erreichbaren Titer ab.
Hier ist ein schneller Vergleich der wichtigsten Kennzahlen:
| Bioreaktortyp | Investitionsausgaben | Kosten pro Einheit | Jährlicher Durchsatz | Hauptvorteil | Hauptbeschränkung |
|---|---|---|---|---|---|
| Rührkessel | £41.2M | £122/g | 130 kg/Jahr | Zuverlässig und skalierbar mit bewährter Technologie | Hohe Kapital- und Betriebskosten |
| Festbett | Höhere CAPEX | ~£8,000/Dosis (optimiert) | Niedriger (aufgrund längerer Prozesse) | Effiziente Downstream-Verarbeitung, niedrige Dosis-Kosten | Lange Prozesszeit, hohe Anfangsinvestition |
| Kontinuierliche Perfusion | £28M | £67/g | 265 kg/Jahr | Niedrige Kosten pro Gramm, höchste Durchsatzrate | Komplex zu betreiben, empfindlich gegenüber Titeränderungen |
Fazit
Die Kosteneffizienz von Bioreaktoren hängt stark vom Produktionsmaßstab ab.Für die großtechnische kommerzielle Herstellung heben sich kontinuierliche Perfusionsrührkesselsysteme hervor, die Produktionskosten von etwa £68 pro Gramm im Vergleich zu £124 pro Gramm in Fed-Batch-Systemen bieten, mit einer beeindruckenden Jahresproduktion von 265 kg [4].
Für Einrichtungen in der frühen F&E-Phase und im Pilotmaßstab bieten Wellenbioreaktoren eine praktische Lösung. Ihre geringeren Anschaffungskosten und die schnelle Einrichtung machen sie ideal für Start-ups im Vereinigten Königreich, die mit begrenzten Budgets arbeiten. Ebenso können optimierte Festbettsysteme die Kosten pro Einheit senken, indem sie hohe Zelldichten unterstützen und die nachgelagerte Verarbeitung rationalisieren [3]. Diese Ansätze ermöglichen es kleineren Unternehmen, finanzielle Risiken zu minimieren, während sie ihre Zelllinien und Prozesse perfektionieren.
Beim Hochskalieren kann die Verwendung mehrerer kleinerer Bioreaktoren die Rendite erheblich verbessern.Zum Beispiel steigt der ROI um 122 %, wenn die nachgelagerten Kosten bis zu 80 % der gesamten Produktionskosten ausmachen [2]. Diese Strategie hilft auch, die Investitionsausgaben und den gesamten Anlagenbedarf zu reduzieren.
In allen Systemen spielen Fortschritte wie höhere Zelldichten, verbesserte Titer und kürzere Prozesszeiten eine entscheidende Rolle bei der Kostensenkung. Zum Beispiel kann die Erhöhung des Titers von 10 g/L auf 25 g/L die Produktionskosten effektiv halbieren [4]. Diese wirtschaftlichen Überlegungen sind entscheidend für Produzenten, die das am besten geeignete System für ihre Bedürfnisse auswählen möchten.
FAQs
Was sollte ich bei der Auswahl eines Bioreaktors für die Produktion von kultiviertem Fleisch beachten?
Bei der Auswahl eines Bioreaktors für die Produktion von kultiviertem Fleisch sind mehrere Schlüsselfaktoren zu berücksichtigen. Diese umfassen die spezifischen Bedürfnisse Ihrer Zelllinie, den beabsichtigten Produktionsmaßstab und die damit verbundenen Kosten. Jeder Bioreaktortyp bietet unterschiedliche Effizienz-, Skalierbarkeits- und Kompatibilitätsstufen, daher ist es wichtig, die Ausrüstung an die einzigartigen Anforderungen Ihres Projekts anzupassen.
Ebenso wichtig ist die Beschaffung zuverlässiger Ausrüstung.
Was sind die Unterschiede in den Betriebskosten zwischen Rührkessel-, Wellen- und Festbett-Bioreaktoren?
Die Betriebskosten unterscheiden sich erheblich zwischen Rührkessel-, Wellen- und Festbett-Bioreaktoren aufgrund von Unterschieden in ihrem Design, ihrer Skalierbarkeit und ihrer Ressourcennutzung.Rührkessel-Bioreaktoren werden häufig verwendet und sind in der Regel wirtschaftlich für die Großproduktion. Sie erfordern jedoch oft einen höheren Energieverbrauch für das Mischen und die Temperaturerhaltung. Wellenbioreaktoren hingegen sind einfacher zu bedienen und verbrauchen tendenziell weniger Energie, was sie zu einer guten Wahl für kleinere Setups oder die frühe Entwicklungsphase macht. Festbett-Bioreaktoren, obwohl sie aufgrund spezieller Materialien höhere Anschaffungskosten haben, können eine effiziente Ressourcennutzung und geringeren Wartungsaufwand im Laufe der Zeit bieten.
Beim Einrichten von Kultivierungsprozessen ist es entscheidend, diese Kostenüberlegungen gegen die einzigartigen Anforderungen Ihrer Zelllinie und Produktionsziele abzuwägen. Tools wie
Was sind die Skalierungsherausforderungen von Wellenbioreaktoren im Vergleich zu anderen Systemen?
Wellenbioreaktoren sind aufgrund ihres einfachen Designs und ihrer Erschwinglichkeit, insbesondere in kleineren Maßstäben, beliebt. Dennoch können sie beim Hochskalieren auf Hürden stoßen. Mit zunehmendem Volumen können Probleme wie verminderte Mischeffizienz und begrenzter Sauerstofftransfer auftreten. Diese Herausforderungen können das Zellwachstum und die Gesamtproduktivität beeinträchtigen, wenn auf größere Bioreaktorsysteme umgestellt wird.
Im Fall der Produktion von kultiviertem Fleisch geht es bei der Auswahl des idealen Bioreaktorsystems darum, das richtige Gleichgewicht zwischen Skalierbarkeit, Kosten und den einzigartigen Bedürfnissen Ihrer Zelllinien zu finden. Eine gründliche Bewertung dieser Elemente ist entscheidend, um eine zuverlässige Leistung bei größeren Produktionsmaßstäben zu erreichen.











