Die Skalierung von Bioreaktoren für die Produktion von kultiviertem Fleisch ist komplex, insbesondere bei der Bewältigung von Schubspannung, einer mechanischen Kraft, die Säugetierzellen während der Hochskalierung schädigen kann. Im Gegensatz zu mikrobiellen Zellen sind Säugetierzellen zerbrechlich und empfindlich gegenüber Turbulenzen und Belüftungskräften. Wenn die Schubspannung 3 Pa überschreitet, können Zellen platzen, was die Lebensfähigkeit und Produktivität verringert.
Um diese Herausforderungen zu bewältigen, verlassen sich Ingenieure auf Computational Fluid Dynamics (CFD) und Scale-Down-Modelle, um Schubspannung vorherzusagen und zu steuern, bevor die Produktion im vollen Maßstab beginnt. CFD analysiert Strömungsmuster, Scherzonen und Mischeffizienz in Bioreaktoren, während Scale-Down-Modelle diese Vorhersagen experimentell validieren und Risiken während der Hochskalierung minimieren.
Wichtige Erkenntnisse:
- Schubspannungsgrenzen: Säugetierzellen tolerieren bis zu 3 Pa; eine Überschreitung schädigt die Zellen.
- CFD-Tools: Fortschrittliche Methoden wie Large Eddy Simulations (LES) und Lattice-Boltzmann-Simulationen (LB-LES) ermöglichen eine präzise Modellierung von Strömung und Turbulenz.
- Scale-Down-Modelle: Diese replizieren die Bedingungen großer Bioreaktoren in kleineren Aufbauten, um CFD-Vorhersagen zu validieren.
-
Konstruktionsüberlegungen:
- Verwenden Sie Schaufelrührer mit geneigten Blättern für geringere Scherung.
- Halten Sie Kolmogorov-Wirbellängen über 20 μm, um Zellschäden zu vermeiden.
- Halten Sie die Rührerspitzen-Geschwindigkeiten unter 1,5 m/s.
Durch die Kombination von CFD-Erkenntnissen mit experimenteller Validierung können Teams Bioreaktordesigns für die Produktion von kultiviertem Fleisch optimieren, um das Überleben der Zellen und eine effiziente Skalierung sicherzustellen.
CFD Kompass | Best Practices für Bioreaktor-CFD
Verwendung von Computational Fluid Dynamics (CFD) zur Modellierung von Scherstress
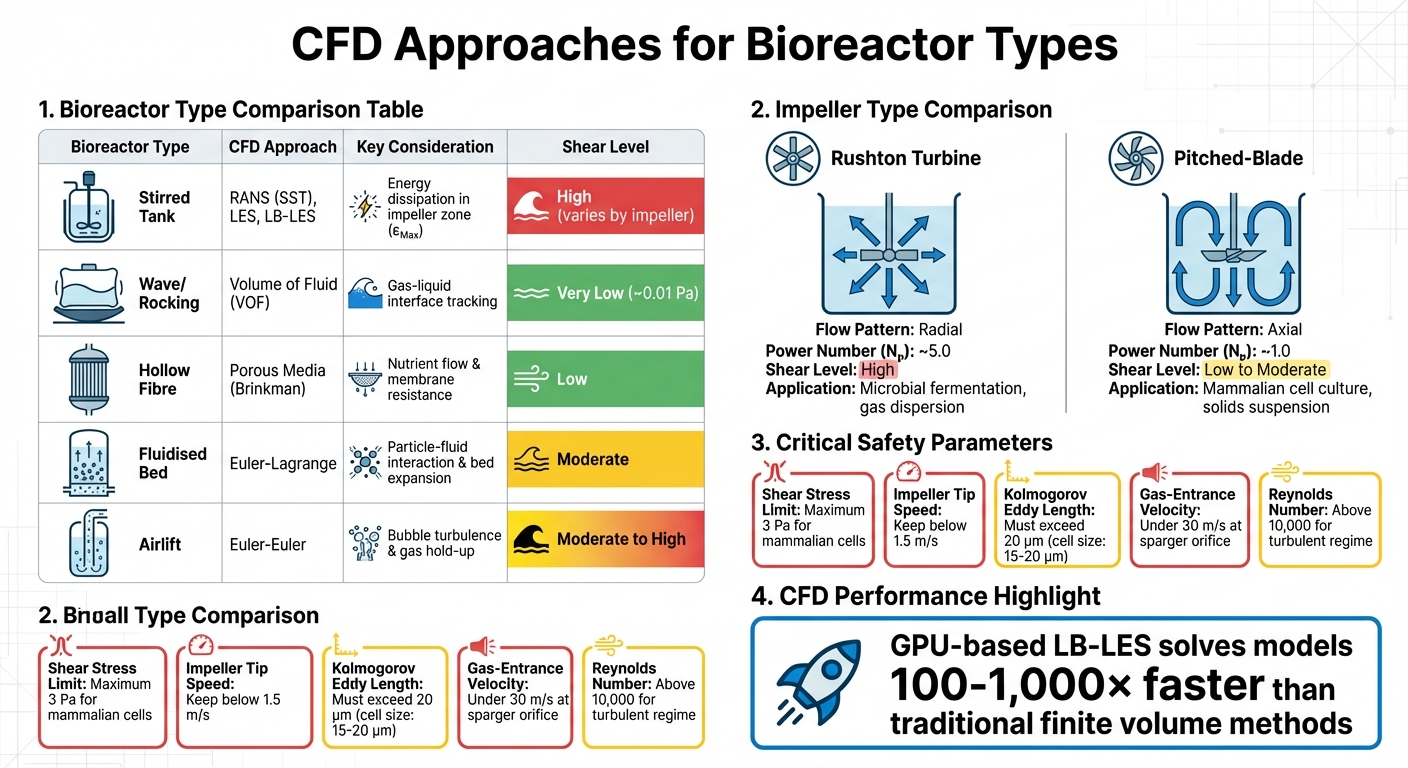
CFD-Ansätze und Schlüsselparameter für verschiedene Bioreaktortypen in der Produktion von kultiviertem Fleisch
CFD-Simulationen geben Ingenieuren die Werkzeuge, um Strömungsdynamik und Scherkräfte innerhalb von Bioreaktoren zu kartieren, bevor sie physisch gebaut werden. Anstatt sich auf Versuch-und-Irrtum-Methoden im Produktionsmaßstab zu verlassen, hilft CFD, kritische Faktoren wie Hochscherzonen, turbulente Wirbel und Zellviabilität in bestimmten Teilen des Gefäßes vorherzusagen. Dies ist besonders wichtig in der Produktion von kultiviertem Fleisch, wo Bioreaktorgrößen schließlich 200.000 Liter erreichen könnten - weit größer als traditionelle biopharmazeutische Gefäße [8]. Diese vorausschauenden Einblicke leiten Scale-Down-Experimente und beeinflussen die Auswahl der Ausrüstung.
Die Entwicklung von Berechnungstechniken war bemerkenswert. Während Reynolds-gemittelte Navier-Stokes (RANS)-Modelle, wie k-ε, in der Industrie weit verbreitet sind, stoßen fortschrittliche Methoden wie Large Eddy Simulations (LES) und GPU-gestützte Lattice-Boltzmann-Simulationen (LB-LES) an Grenzen. Laut Professor Miroslav Soos von der Universität für Chemie und Technologie Prag können GPU-basierte LB-LES Modelle „100 bis 1.000 Mal schneller lösen als die üblicherweise verwendeten Finite-Volumen-Methoden-Löser“ [2]. Dieser Geschwindigkeitsvorteil ermöglicht es Ingenieuren, massive Gefäße mit der Präzision zu simulieren, die erforderlich ist, um zellschädigende Wirbel zu erkennen.
Ein praktisches Beispiel für die Fähigkeiten der CFD stammt von Forschern bei Regeneron Ireland DAC und Thermo Fisher Scientific. Sie skalierten erfolgreich einen Zellkulturprozess von einem 2.000-Liter-Bioreaktor auf einen geometrisch unterschiedlichen 5.000-Liter-Einweg-Bioreaktor.Anstatt sich auf empirische Heuristiken zu verlassen, nutzten sie CFD, um Parameter wie Stoffübergangsrate, Mischzeiten und Scherraten zu analysieren. Dieser Ansatz ermöglichte einen erfolgreichen Scale-up beim ersten Versuch und vermied die kostspieligen Fehler, die oft mit der Skalierung basierend auf dem Leistungs-zu-Volumen-Verhältnis verbunden sind [5].
Einrichtung von CFD für gerührte Tank-Bioreaktoren
Um CFD für gerührte Tank-Bioreaktoren einzurichten, beginnen Sie mit der Definition der Behältergeometrie - dazu gehören die Tankabmessungen, das Rührerdesign (e.g., Rushton oder Schrägblatt) und die Platzierung der Prallbleche. Die Wahl des richtigen Turbulenzmodells ist entscheidend: Das realisierbare k-ε-Modell funktioniert gut für Gas-Flüssigkeitssysteme, während LB-LES eine höhere Auflösung bietet, um Spitzenbelastungen zu identifizieren, die Zellen schädigen könnten. Eine Gitterkonvergenzstudie stellt sicher, dass die Ergebnisse nicht von der Maschengröße abhängen.
Randbedingungen müssen reale Betriebsparameter widerspiegeln, wie z.B. die Impellergeschwindigkeit, Gasbegasungsraten, Fluiddichte und Viskosität. Für Anwendungen in der kultivierten Fleischproduktion werden oft konservative Blasenwiderstandsmodelle verwendet, um die Scherspannung abzuschätzen [8]. Das System sollte in einem vollständig turbulenten Regime betrieben werden, mit Reynolds-Zahlen über 10.000, um sicherzustellen, dass die Leistungszahl unabhängig von der Impellergeschwindigkeit konstant bleibt [1].
CFD-Vorhersagen für Sauerstoffübertragung, Mischzeiten und hydrodynamische Belastung sollten mit experimentellen Daten übereinstimmen, die mit scherempfindlichen Mikrosonden oder Nanopartikelaggregaten gesammelt wurden [2]. Zum Beispiel leitete ein mathematisches Stoffübertragungsmodell die direkte Hochskalierung eines CHO-Zellkulturprozesses von einer 2-Liter-Tischgerät-Einheit auf einen 1.500-Liter-Industrie-Bioreaktor bei Sartorius.Durch die Verwendung von CFD zur Vorhersage des Sauerstoffbedarfs und der CO₂-Entfernung konnte das Team konsistente Produktqualitätsmerkmale - wie N-Glykane und Ladungsvarianten - über verschiedene Maßstäbe hinweg beibehalten [6].
CFD für andere Bioreaktortypen
Während Rührkessel die industrielle Zellkultur dominieren, erfordern andere Bioreaktordesigns maßgeschneiderte CFD-Ansätze. Zum Beispiel verlassen sich Schaukel- oder Wellenbioreaktoren auf die Volume of Fluid (VOF)-Methode, um die Gas-Flüssigkeits-Grenzfläche zu simulieren, da die Wellenbewegung in diesen Systemen Scherspannungen erzeugt. Diese Designs schaffen viel sanftere Scherumgebungen - die maximale Spannung beträgt etwa 0,01 Pa im Vergleich zu Rührkesseln - aber ihre Skalierbarkeit ist für die großtechnische Produktion von kultiviertem Fleisch begrenzt [4].
Hohlfaser-Bioreaktoren hingegen verwenden poröse Medienmodelle basierend auf Brinkman-Gleichungen, um die Nährstoffdiffusion und den Strömungswiderstand durch Membranen zu simulieren.Fließbett-Systeme erfordern Euler-Lagrange-Modelle, um Partikel-Flüssigkeits-Interaktionen und Bettausdehnung zu erfassen, während Airlift-Bioreaktoren Euler-Euler-Methoden verwenden, um blaseninduzierte Turbulenzen und Gasrückhalt zu analysieren [4]. Jedes Design bringt einzigartige Herausforderungen mit sich: Fließbetten müssen die Verteilung von Mikrokörpern gegen Scherbelastung ausbalancieren, während Airlift-Systeme die durch platzende Blasen verursachten Spannungen bewältigen müssen, eine Hauptursache für das Absterben von Zellen in belüfteten Bioreaktoren [1] [7].
Das Verständnis dieser CFD-Ansätze ist entscheidend für die Kontrolle von Scherbelastungen in verschiedenen Bioreaktordesigns, die in der Produktion von kultiviertem Fleisch verwendet werden.
| Bioreaktortyp | CFD-Ansatz | Wichtige Überlegung |
|---|---|---|
| Rührkessel | RANS (SST), LES, LB-LES | Energiedissipation im Impellerbereich (εMax) |
| Wellen/Schaukeln | Volume of Fluid (VOF) | Verfolgung der Gas-Flüssigkeits-Grenzfläche |
| Hohlfaser | Poröse Medien (Brinkman) | Nährstofffluss und Membranwiderstand |
| Wirbelschicht | Euler-Lagrange | Interaktion zwischen Partikeln und Flüssigkeit, Bettausdehnung |
| Airlift | Euler-Euler | Turbulenz durch Blasen und Gasgehalt |
Diese verschiedenen CFD-Methoden unterstreichen die Notwendigkeit maßgeschneiderter Strategien, die eine entscheidende Rolle bei der Auswahl von Geräten und dem Management von Scherspannungen spielen.
Verkleinerte Modelle und experimentelle Validierung
Während die numerische Strömungsmechanik (CFD) wertvolle Vorhersagen liefert, kann sie die Notwendigkeit von realen Tests beim Hochskalieren von Prozessen nicht ersetzen. Die experimentelle Validierung spielt eine entscheidende Rolle, um sicherzustellen, dass rechnerische Modelle die realen Scherbelastungsbedingungen genau darstellen. Hier kommen verkleinerte Modelle ins Spiel, die die hydrodynamische Umgebung großer Produktionsbioreaktoren in kleineren, leichter zu handhabenden Systemen nachahmen. Dadurch wird das Risiko kostspieliger Fehler beim Übergang von kleinen zu industriellen Maßstäben verringert. Dieser Schritt bestätigt nicht nur die CFD-Vorhersagen, sondern sorgt auch für einen zuverlässigeren und effektiveren Hochskalierungsprozess.
Erstellung von verkleinerten Modellen
Das Design eines verkleinerten Modells beginnt mit der Beibehaltung der geometrischen Ähnlichkeit.Dies bedeutet, dass die gleichen Seitenverhältnisse zwischen den Hauptkomponenten beibehalten werden, wie z.B. die Höhe des Behälters im Verhältnis zum Durchmesser und der Durchmesser des Rührers im Verhältnis zum Behälterdurchmesser [11]. Sobald die Geometrie ausgerichtet ist, wählen Ingenieure ein Skalierungskriterium. Häufige Optionen sind Leistung pro Volumen (P/V), Rührerspitzen-Geschwindigkeit oder Energiedissipationsrate (EDR). Der Fokus auf lokalisierte EDR anstelle von durchschnittlichem P/V bietet jedoch ein besseres Verständnis der Scherheterogenität, was für eine genaue Modellierung entscheidend ist.
Ein fortschrittlicherer Ansatz beinhaltet Multi-Kompartiment-Simulatoren. Zum Beispiel entwickelten Emmanuel Anane und sein Team im Februar 2021 einen Zwei-Kompartiment-Skalierungs-Simulator, der einen Rührkesselreaktor (STR) und einen Rohrreaktor (PFR) kombiniert. Dieses Modell wurde verwendet, um zu untersuchen, wie CHO-Zellen auf gelöste Sauerstoffgradienten reagieren. Ihre Forschung ergab eine kritische Aufenthaltszeit-Schwelle von 90 Sekunden.Jenseits dieses Punktes zeigten CHO-Zellen einen Rückgang der lebensfähigen Zelldichte um 15 % und eine Zunahme der Laktatakkumulation [10]. Diese Erkenntnis bietet einen klaren Maßstab für die Gestaltung industrieller Bioreaktoren, die die Zellviabilität aufrechterhalten.
Um das Zellwachstum zu schützen, streben Ingenieure oft an, die Impellerspitzen-Geschwindigkeiten unter 1,5 m/s zu halten [1]. Darüber hinaus sollte die Kolmogorov-Mikrowirbellänge - ein Maß für Turbulenz - die Größe der Zellen übersteigen, typischerweise 20 μm oder mehr für Säugetierzellen, um hydrodynamische Schäden zu vermeiden [1][3]. Zum Beispiel sind bei einer Energiezufuhr von 0,1 W/kg in Tierzellkulturen die kleinsten Wirbel etwa 60 μm groß, was einen sicheren Puffer bietet [3].
Validierung von CFD-Vorhersagen durch Experimente
Sobald ein verkleinertes Modell vorhanden ist, sind experimentelle Methoden unerlässlich, um die aus CFD abgeleiteten Parameter zu validieren. Die Partikelbild-Velocimetrie (PIV) ist eine weit verbreitete Technik zu diesem Zweck. Durch das Verfolgen von Partikeln in der Flüssigkeit hilft PIV zu bestätigen, ob die Strömungsmuster und Geschwindigkeitsfelder im verkleinerten Modell mit den CFD-Vorhersagen übereinstimmen [12][4].
Tracer-Injektion und Entfärbungsmethoden werden ebenfalls verwendet, um Mischzeiten zu validieren. In diesem Prozess werden Tracer wie Säuren, Basen oder Salzlösungen in der Nähe des Rührers eingeführt, und ihre Verteilung wird überwacht, bis 95% Homogenität erreicht sind [12][3]. Für großtechnische Säugetierzell-Bioreaktoren (5.000 L bis 20.000 L) liegen die Mischzeiten typischerweise zwischen 80 und 180 Sekunden [10].
Im März 2020 haben James Scully und sein Team bei Regeneron Ireland DAC erfolgreich einen Zellkulturprozess von einem 2.000 L Bioreaktor auf einen 5.000 L Einweg-Bioreaktor mit einer anderen Geometrie skaliert. Sie verließen sich auf CFD, um wichtige Parameter wie Stoffübergangsrate, Mischzeiten und Scherraten vorherzusagen. Diese Vorhersagen wurden dann durch einphasige und mehrphasige Experimente validiert, was einen erfolgreichen ersten Versuch der Skalierung ohne die Notwendigkeit von großangelegten Pilotläufen ermöglichte [5].
"CFD-Simulationen werden zunehmend genutzt, um klassische prozesstechnische Untersuchungen im Labor mit räumlich und zeitlich aufgelösten Ergebnissen zu ergänzen oder sogar zu ersetzen, wenn Laboruntersuchungen nicht möglich sind." - Stefan Seidel, School of Life Sciences, ZHAW [12]
Zusätzliche Validierungstechniken umfassen die Drehmomentmessung zur Bestätigung der spezifischen Leistungsaufnahme (P/V) und dimensionsloser Leistungszahlen bei bestimmten Rührgeschwindigkeiten [12][3]. Sauerstoffübertragungsraten werden mit Methoden wie der Ausgas- oder Sulfit-Technik überprüft, die den volumetrischen Sauerstoffmassenübertragungskoeffizienten (kLa) bestimmen [12][7]. Für Systeme, die Mikrokügelchen verwenden, werden Lichtabschwächungs- oder kamerabasierte Methoden eingesetzt, um die minimale Geschwindigkeit zu ermitteln, die erforderlich ist, um alle Partikel in Schwebe zu halten, und sicherzustellen, dass CFD-Vorhersagen der Festphasenverteilung genau sind [12][4].
sbb-itb-ffee270
Faktoren, die die Schubspannung in Bioreaktoren beeinflussen
Um die Zellviabilität während des Scale-ups zu schützen, ist das Verständnis der physikalischen Faktoren, die die Schubspannung beeinflussen, entscheidend. Vorhersagen der Computational Fluid Dynamics (CFD) und Validierungen im kleineren Maßstab zeigen, dass die Energiedissipationsrate (EDR) eine Schlüsselrolle spielt. EDR misst, wie sich die kinetische Energie des Rührers in Wärme umwandelt, was zu einer ungleichmäßigen Energieverteilung führt. Bei Schrägblatt-Rührern konzentriert sich die Energie beispielsweise tendenziell um den Rührer, wodurch Zonen mit hoher Schubspannung entstehen, die Zellen schädigen können, wenn sie nicht richtig verwaltet werden.
Rührerdesign und Energiezufuhr
Der verwendete Rührertyp beeinflusst die Strömungsmuster und die Scherintensität erheblich. Rushton-Turbinen erzeugen beispielsweise radiale Strömung und hohe Scherung, was sie ideal für mikrobielle Fermentation macht, aber weniger geeignet für scherempfindliche tierische Zellen.Auf der anderen Seite erzeugen Schrägblatt-Rührer eine axiale Strömung mit geringerer Scherung und besserer Pumpeneffizienz bei gleicher Leistungsaufnahme. Dies macht sie zur bevorzugten Wahl für Anwendungen wie die Produktion von kultiviertem Fleisch, bei denen die Zellviabilität Priorität hat.
| Rührertyp | Strömungsmuster | Leistungszahl (Nₚ) | Scherungsniveau | Hauptanwendung |
|---|---|---|---|---|
| Rushton-Turbine | Radial | ~5,0 | Hoch | Mikrobielle Fermentation; Gasdispersion[3] |
| Schrägblatt | Axial | ~1.0 | Niedrig bis Mäßig | Säugetierzellkultur; Feststoffsuspension [3] |
Skalierungsstrategien basieren oft darauf, eine konstante Leistungsaufnahme pro Volumen (P/V) beizubehalten. Wenn jedoch die Reaktorgröße zunimmt, kann dies zu höheren Rührer-Spitzengeschwindigkeiten führen. Für Säugetierzellen sollten die Spitzengeschwindigkeiten unter 1,5 m/s bleiben, um Wachstumsprobleme zu vermeiden [1]. In großtechnischen Reaktoren kann das Begasen noch mehr hydrodynamischen Stress verursachen als Rührer, insbesondere in Behältern, die 20 m³ überschreiten [9]. Diese Faktoren stehen in engem Zusammenhang mit Turbulenzen, die in der Diskussion zur Kolmogorov-Skala weiter untersucht werden.
Kolmogorov-Skala und Turbulenzmodellierung
Die Kolmogorov-Skala (λ) definiert die Größe der kleinsten turbulenten Wirbel, bei denen Energie als Wärme dissipiert.Wenn diese Wirbel kleiner als der Zelldurchmesser sind, wird mechanische Beschädigung zu einem Problem. Für Säugetierzellen, die typischerweise 15–20 μm groß sind, muss die Wirbellänge mehr als 20 μm betragen, um Schäden zu vermeiden [1][3]. Beispielsweise beträgt bei einer Energiezufuhr von 0,1 W/kg der Kolmogorow-Wirbeldurchmesser etwa 60 μm, was einen sicheren Puffer bietet [3].
"Wenn biologische Einheiten (e.g., Säugetierzellen) kleiner als λ [Kolmogorow-Skala] in einem Bioreaktor sind, tritt keine Schädigung durch Scherung auf." - Muhammad Arshad Chaudhry [3]
Im August 2024 nutzten Forscher von Boehringer Ingelheim Pharma und der Universität für Chemie und Technologie Prag Lattice-Boltzmann Large Eddy Simulations (LB-LES), um CFD-Vorhersagen in einem 12.500 L industriellen Bioreaktor zu validieren.Durch die Verwendung von scherempfindlichen Nanopartikel-Aggregaten maßen sie den maximalen hydrodynamischen Stress und zeigten, dass LB-LES turbulente Skalen 100–1.000 Mal schneller als herkömmliche Methoden [2] auflösen konnte. Diese Erkenntnisse sind entscheidend für die Entwicklung von Strategien zur Minimierung von Scherstress.
Reduzierung von Scherstress durch Modellierungsdaten
Die CFD-Modellierung ermöglicht es Ingenieuren, Hochscherzonen zu identifizieren und die Betriebsbedingungen entsprechend anzupassen. Ein effektiver Ansatz besteht darin, Substrate, pH-Basen oder Entschäumer in der Nähe der Impellerzone einzuführen, anstatt an der Flüssigkeitsoberfläche. Dies gewährleistet eine schnelle Verteilung und minimiert lokale Konzentrationsgradienten [3]. In der Produktion von kultiviertem Fleisch kann übermäßige Scherung Zellen von Mikrokörpern lösen, während unzureichende Agitation zu Mikrokörpersedimentation und Nährstoffungleichgewichten führt [9].
Schutzadditive wie Pluronic F-68 (Poloxamer 188) werden häufig verwendet, um Zellen vor Scherkräften zu schützen, insbesondere vor solchen, die durch das Platzen von Blasen an der Flüssigkeitsoberfläche verursacht werden - ein Hauptfaktor für das Absterben von Zellen in Bioreaktoren [1]. Mit diesen Tensiden wurden Energieeinträge von bis zu 100.000 W/m³ ohne tödliche Auswirkungen berichtet [1]. Darüber hinaus hilft es, die Gas-Eintrittsgeschwindigkeit an der Spargeröffnung unter 30 m/s zu halten, um Produktivitätsverluste und Zellsterben zu reduzieren [1].
Finden von Ausrüstung für die Skalierung von Bioreaktoren
Wie Cellbase die Beschaffung von Bioreaktoren unterstützt
Die Skalierung von Bioreaktoren für die Produktion von kultiviertem Fleisch bringt ihre eigenen Herausforderungen mit sich. Hier kommt
Bei der Nutzung von
Der erfolgreiche Einsatz von Bioreaktoren in der biopharmazeutischen Industrie spielt eine große Rolle für die Qualität und die Markteinführungszeit dieser Produkte [5].
Durch die Nutzung von CFD-gestützten Daten können Teams die Auswahl der Ausrüstung optimieren und den Bedarf an wiederholten Testläufen minimieren [5]. Diese Erkenntnisse sind entscheidend für die Auswahl von Bioreaktoren, die mit optimalem Scherstressmanagement entwickelt wurden.
Auswahl der Ausrüstung zur Scherstresskontrolle
Um Scherstress effektiv zu kontrollieren, sind bestimmte Ausrüstungsspezifikationen besonders wichtig. Die Geometrie des Rührers ist ein Schlüsselfaktor. Zum Beispiel erzeugen Schrägblatt-Rührer einen axialen Fluss mit einer Leistungszahl (Np) von etwa 1,0, während Rushton-Turbinen eine viel höhere Np von etwa 5,0 haben.Dies bedeutet, dass Designs mit geneigten Schaufeln bei gleicher Drehzahl deutlich weniger Leistung und damit weniger Scherung erzeugen [3]. Bei Anwendungen mit Säugetierzellen, die in kultiviertem Fleisch verwendet werden, ist es wichtig, die Geschwindigkeit der Impellerspitze unter 1,5 m/s zu halten, um Zellschäden zu vermeiden [1].
Die Konfiguration des Spargers ist eine weitere wichtige Überlegung. Um übermäßige Scherung zu verhindern, sollte das Gerät sicherstellen, dass die Gas-Eintrittsgeschwindigkeit an der Spargeröffnung unter 30 m/s bleibt und die Reynolds-Zahl der Öffnung unter 2.000 bleibt. Das Überschreiten dieser Schwellenwerte kann zum "Jetting-Regime" führen, bei dem Blasen ungleichmäßig verteilt werden und lokale Scherzonen entstehen [1]. Sparger mit gebohrten Löchern oder offenen Rohren sind für scherempfindliche Zellen besser geeignet als Mikrosparger. Darüber hinaus sollte das Gerät die Kompatibilität mit dem Scale-Down unterstützen. Anbieter, die Tischmodelle anbieten (e.g., 3 L Systeme), die geometrisch ähnlich zu großmaßstäblichen Systemen (2.000 L oder mehr) sind, ermöglichen es Teams, CFD-Vorhersagen in kleinerem Maßstab zu validieren, bevor sie zur Produktion im vollen Maßstab übergehen [1][2].
Fazit
Die Skalierung von Bioreaktoren für die Produktion von kultiviertem Fleisch erfordert den Abschied von traditionellen Trial-and-Error-Methoden und die Hinwendung zu modellgesteuerten Strategien, um lokale Scherunterschiede zu adressieren. Computational Fluid Dynamics (CFD) ist zu einem wichtigen Werkzeug in diesem Prozess geworden, das es Ingenieuren ermöglicht, hydrodynamische Umgebungen vorherzusagen und Scherzonen über einfache Leistungs-zu-Volumen-Verhältnisse hinaus zu visualisieren [1]. Durch die Einhaltung kritischer Parameter - wie das Halten der Kolmogorov-Wirbellängen über 20 μm und der Impellerspitzen-Geschwindigkeiten unter 1,5 m/s - können Ingenieure Säugetierzellen vor Schädigungen durch Scherung schützen und gleichzeitig eine ordnungsgemäße Durchmischung und Sauerstoffübertragung sicherstellen [1].
Fortschrittliche Berechnungsmethoden, wie Large Eddy Simulation (LES) und Lattice-Boltzmann-Techniken, haben ihre Wirksamkeit bei der Skalierung von Prozessen gezeigt. Zum Beispiel hat Regeneron Ireland DAC im März 2020 erfolgreich einen Zellkulturprozess von einem 2.000 L Bioreaktor auf ein geometrisch unterschiedliches 5.000 L Einweg-System beim ersten Versuch skaliert. Dies wurde durch die Verwendung von multiparametrischen CFD-Vorhersagen erreicht, wodurch umfangreiche physische Versuche überflüssig wurden [5]. Diese "First-Time-Right"-Strategie reduziert nicht nur das Kontaminationsrisiko, sondern verkürzt auch die Markteinführungszeit - entscheidend für den Sektor des kultivierten Fleisches.
Experimentelle Validierungsmethoden, wie die Partikelbild-Velocimetrie (PIV), bestätigen zusätzlich die Genauigkeit der CFD-Modelle [2]. Diese validierten Modelle spielen nun eine entscheidende Rolle bei Beschaffungsentscheidungen.Unternehmen wie
FAQs
Wie unterstützt Computational Fluid Dynamics (CFD) das Hochskalieren von Bioreaktoren für die Produktion von kultiviertem Fleisch?
Computational Fluid Dynamics (CFD) ist ein Wendepunkt, wenn es um das Hochskalieren von Bioreaktoren für kultiviertes Fleisch geht. Es bietet ein tiefes Verständnis von Strömungsdynamik, Scherspannung, Mischeffizienz und Stoffübertragungsraten - alles entscheidende Faktoren für die Schaffung der idealen Umgebung für das Zellwachstum.
Mit CFD können Ingenieure wesentliche Elemente wie das Laufraddesign, die Rührgeschwindigkeit und die Gasbegasung optimieren. Dies stellt sicher, dass die Bioreaktoren unter den bestmöglichen Bedingungen arbeiten, was sowohl die Zellgesundheit als auch die Produktivität schützt.
Darüber hinaus ermöglicht CFD den Übergang von kleinen Laboreinrichtungen zu großen industriellen Bioreaktoren, ohne Effizienz oder Konsistenz zu beeinträchtigen. Dies bedeutet, dass die Produktion von kultiviertem Fleisch reibungslos skaliert werden kann, während hohe Standards beibehalten werden.
Was macht Large Eddy Simulations (LES) besser als traditionelle Methoden für die Modellierung von Bioreaktoren?
Large Eddy Simulations (LES) bieten einen tieferen und präziseren Einblick in turbulente Strömungen innerhalb von Bioreaktoren im Vergleich zu traditionellen Methoden wie Reynolds-averaged Navier-Stokes (RANS).Indem sich LES auf großskalige Wirbel konzentriert und nur die kleinsten dissipativen Bewegungen modelliert, kann es kritische Scherbelastungshotspots, wie durch Wirbel induzierte Hochscherzonen, identifizieren, die sonst möglicherweise übersehen werden. Dieses Detailniveau spielt eine entscheidende Rolle bei der Reduzierung von Zellschäden und gewährleistet eine höhere Zuverlässigkeit beim Hochskalieren der Produktion von kultiviertem Fleisch.
Im Gegensatz zu Methoden, die stark auf empirische Korrelationen angewiesen sind, bietet LES stärkere Vorhersagefähigkeiten beim Übergang von Labor- zu Industriebioreaktoren. Fortschritte in der Computertechnik haben LES auch zugänglicher gemacht, sodass detaillierte Simulationen ohne den Bedarf an prohibitivem Rechenaufwand möglich sind. Für Unternehmen, die LES-gesteuerte Designs integrieren möchten, bietet
Warum ist es wichtig, die Kolmogorov-Wirbellängen über 20 µm für die Lebensfähigkeit von Säugetierzellen zu halten?
Die Aufrechterhaltung der Kolmogorov-Wirbellängen über etwa 20 µm ist entscheidend für den Schutz von Säugetierzellen während der Bioreaktoroperationen. Wenn diese turbulenten Wirbel unter die Größe der Zellen schrumpfen, können sie die Zellen übermäßigen Scherkräften aussetzen, was das Risiko birgt, ihre Membranen zu beschädigen und die Zellviabilität zu verringern.
Wenn die kleinsten turbulenten Strukturen größer als die Zellen bleiben, wird die Wahrscheinlichkeit mechanischer Schäden verringert. Dies fördert nicht nur gesündere Zellkulturen, sondern verbessert auch die Gesamtleistung des Bioreaktors. Diese Überlegung wird bei der Hochskalierung von Bioreaktoren noch wichtiger, da es besonders schwierig ist, konsistente Scherkräftebedingungen sicherzustellen.











