Die Validierung von Wachstumsmedien ist ein obligatorischer Schritt für Unternehmen, die kultiviertes Fleisch herstellen und eine Zulassung auf dem britischen Markt anstreben. Dieser Prozess gewährleistet die Sicherheit, Qualität und Konformität der Produkte unter strengen regulatorischen Rahmenbedingungen wie den britischen Novel Food Regulations (EU 2015/2283). Folgendes müssen Sie wissen:
- Wesentliche Anforderungen: Wachstumsmedien müssen Standards für Toxikologie, Kontaminationskontrolle, Nährstoffqualität und Allergenität erfüllen.
- Britische Vorschriften: Die Food Standards Agency (FSA) verlangt die Einhaltung der HACCP-Prinzipien und die Klassifizierung unter Produkte tierischen Ursprungs (POAO).
- Globale Standards: Während das Vereinigte Königreich und die EU ähnliche Rahmenbedingungen teilen, folgen die USA den CGMP-Vorschriften unter dem FD&C Act.
- Validierungsprozess: Umfasst gründliche Tests der Zusammensetzung, Reinheit, Funktionalität und Lieferantenkonformität sowie eine umfassende Dokumentation.
- Unterstützungsinitiativen: Die im Jahr 2025 gestartete regulatorische Sandbox des Vereinigten Königreichs in Höhe von 1,6 Millionen Pfund unterstützt Unternehmen bei der Erfüllung dieser Standards.
Eine ordnungsgemäße Validierung gewährleistet Sicherheit, baut Vertrauen auf und entspricht den gesetzlichen Anforderungen. Der Artikel geht detailliert auf den Schritt-für-Schritt-Prozess ein, einschließlich Testmethoden, Lieferantenqualifikationen und Tipps zur Einreichung bei Regulierungsbehörden.
Regulatorische Standards für Wachstumsmedien
Standards und Richtlinien
Wachstumsmedien, ein entscheidender Bestandteil der Produktion von kultiviertem Fleisch, müssen strenge internationale regulatorische Standards erfüllen. Diese Standards variieren je nach Region und haben spezifische Anforderungen an Zusammensetzung, Sicherheit und Reinheit.
In the Vereinigten Königreich wird das Nährmedium gemäß der Novel Food Regulations (übernommene Verordnung (EU) 2015/2283) reguliert. Vor der Marktzulassung ist eine gründliche Sicherheitsbewertung erforderlich [1]. Die Food Standards Agency (FSA) klassifiziert zellkultivierte Produkte als Produkte tierischen Ursprungs (POAO) gemäß der Verordnung (EG) 853/2004. Diese Klassifizierung verpflichtet die Hersteller zur Implementierung von Lebensmittelsicherheitsmanagementsystemen basierend auf den Prinzipien der Gefahrenanalyse und der kritischen Kontrollpunkte (HACCP) [3]. Die FSA entwickelt auch detaillierte technische Leitlinien zur Zusammensetzung von Nährmedien, wobei weitere Aktualisierungen erwartet werden [1]. Diese Rahmenwerke bilden die Grundlage für spezifischere regulatorische Anforderungen.
In the Vereinigten Staaten unterscheidet sich der Ansatz.Die Komponenten des Wachstumsmediums müssen den Anforderungen der aktuellen Guten Herstellungspraxis (CGMP) entsprechen, die in Abschnitt 501(a)(4)(B) des Federal Food, Drug, and Cosmetic Act (FD&C Act) [4] festgelegt sind. Die FDA kategorisiert Medienkomponenten als "Zubehör und Reagenzien", die durch 21 CFR Teile 210 und 211 geregelt sind. Diese Komponenten müssen einer Qualitätsüberprüfung unterzogen werden, um Kontaminationen zu verhindern [4]. Interessanterweise werden synthetische Komponenten von kultivierten Fleischmedien - wie Aminosäuren, Vitamine und Salze - oft als Klasse I Medizinprodukte unter 21 CFR 864.2220 klassifiziert, was sie von den Anforderungen der Vorabbenachrichtigung befreit [6][7].
In der Europäischen Union stimmt der regulatorische Rahmen eng mit dem des Vereinigten Königreichs überein, da er ebenfalls der Verordnung (EU) 2015/2283 folgt.Die Europäische Behörde für Lebensmittelsicherheit (EFSA) überwacht den Zulassungsprozess [1]. Gemäß den ICH Q6B-Richtlinien werden Wachstumsmedienkomponenten, einschließlich Antibiotika, Induktoren und andere Bestandteile, als prozessbedingte Verunreinigungen behandelt. Diese Verunreinigungen müssen kontrolliert und auf akzeptable Werte reduziert werden [5]. Soweit möglich, sollten Hilfsstoffe und Reagenzien den pharmakopöischen Standards entsprechen [5].
| Zuständigkeit | Primäre Regulierung | Klassifizierung | Sicherheitssystem | Medienaufsicht |
|---|---|---|---|---|
| Vereinigtes Königreich (GB) | Assimilierte Verordnung (EU) 2015/2283 [1] | Produkt tierischen Ursprungs (POAO) [3] | HACCP (Verordnung 852/2004) [3] | FSA/FSS Sandbox-Leitfaden [1] |
| Europäische Union / NI | Verordnung (EU) 2015/2283 [1] | Produkt tierischen Ursprungs (POAO) [3] | HACCP (Verordnung 852/2004) [3] | EFSA-Zulassungsverfahren [1] |
| Vereinigte Staaten | FD&C Act Abschnitt 501(a)(4)(B) [4] | Neues Tierarzneimittel / Lebensmittel [4] | CGMP (21 CFR 210/211) [4] | FDA CVM / USDA-FSIS [4] |
Regulatorische Anforderungen für kultiviertes Fleisch
Produzenten von kultiviertem Fleisch müssen sicherstellen, dass jede Charge des Wachstumsmediums strengen Sicherheits- und Qualitätsstandards entspricht.Die Validierung von Wachstumsmedien ist ein Schlüsselelement des umfassenderen regulatorischen Rahmens für diese Produkte. Nach den HACCP-Grundsätzen (Verordnung (EG) 852/2004) wird Wachstumsmedium als primärer Input und potenzielle Kontaminationsquelle - chemisch, mikrobiell oder anderweitig - identifiziert [3]. Die FSA hebt dieses Anliegen hervor:
"Die Hauptgefahren bei der Produktion von zellkultivierten Produkten betreffen die Identität der Zelllinie (und deren Konsistenz), Gefahren, die während des Produktionsprozesses eingeführt werden (mikrobiologische Kontamination, Wachstumsmedien und Restkomponenten im Endprodukt) und Allergene." [3]
Wenn es Änderungen in der Formulierung des Wachstumsmediums gibt, ist eine sofortige HACCP-Überprüfung erforderlich [3].In Großbritannien muss die Validierung vor der Implementierung erfolgen, um die Genauigkeit von Flussdiagrammen und die Wirksamkeit von Kontrollmaßnahmen sicherzustellen [3].
In den Vereinigten Staaten verlangt die FDA, dass alle Reagenzien und Medienkomponenten strenge Qualitätsstandards erfüllen, um die Einführung schädlicher Stoffe zu vermeiden [4]. Lieferanten und Vertragslabore müssen die CGMP-Vorschriften einhalten, und jeder Lieferant, der dies nicht tut, sollte entfernt werden, um zu verhindern, dass Produkte als "verfälscht" eingestuft werden [4]. Die FDA betont die Bedeutung dessen:
"Alle neuen Tierarzneimittel, einschließlich ACTPs, müssen gemäß CGMP hergestellt werden, um sicherzustellen, dass diese Arzneimittel die Anforderungen des Federal Food, Drug, and Cosmetic Act (FD&C Act) in Bezug auf Sicherheit erfüllen." [4]
Derzeit arbeiten mehrere Unternehmen, die am regulatorischen Sandbox-Programm des Vereinigten Königreichs teilnehmen - wie BlueNalu, Gourmey, Hoxton Farms, Mosa Meat, Roslin Technologies, Vital Meat und Vow - mit der FSA zusammen, um diese technischen Standards zu verfeinern [1]. Nach den britischen Vorschriften können Unternehmen bis zu fünf Jahre Datenschutz für vertrauliche Informationen beantragen, die während des Genehmigungsverfahrens eingereicht werden [1].
Schritte zur Validierung von Wachstumsmedien
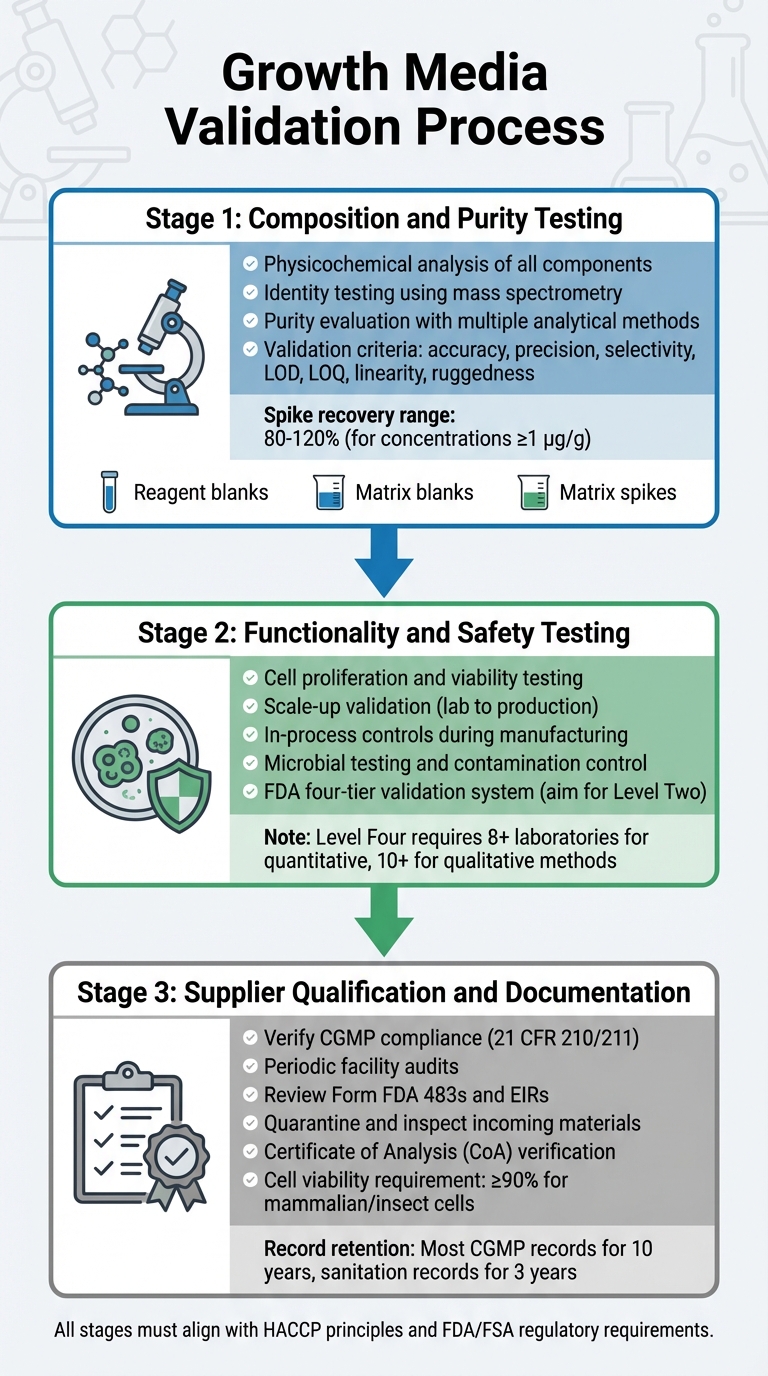
Validierungsprozess für Wachstumsmedien zur regulatorischen Zulassung von kultiviertem Fleisch
Die Validierung von Wachstumsmedien umfasst einen detaillierten Prozess, der deren Zusammensetzung, Funktionalität, Sicherheit und Lieferantenkonformität untersucht. Jeder Schritt baut auf dem vorherigen auf und stellt sicher, dass der Validierungsprozess den regulatorischen Anforderungen entspricht. Dies beinhaltet Tests zur Zusammensetzung, Funktionalität und Lieferantenkonformität.
Tests zur Zusammensetzung und Reinheit
Die erste Phase konzentriert sich auf eine gründliche physikochemische Analyse jedes Bestandteils. Dies beinhaltet die Identifizierung der genauen Zusammensetzung, physikalischen Eigenschaften und molekularen Struktur von Inhaltsstoffen wie Aminosäuren, Vitaminen und anorganischen Salzen [5].Um molekulare Strukturen zu bestätigen, verwendet die Identitätsprüfung hochspezifische Methoden, einschließlich physikochemischer, biologischer und immunochemischer Techniken. Werkzeuge wie die Massenspektrometrie werden verwendet, um molekulare Identitäten durch ihre Fragmentierungsmuster zu überprüfen [8].
Die Bewertung der Reinheit erfordert mehrere analytische Methoden, um gewünschte Komponenten von Verunreinigungen zu trennen. Diese Tests müssen sowohl prozessbedingte als auch produktbedingte Verunreinigungen berücksichtigen [5]. Analytische Techniken sollten strenge Validierungskriterien erfüllen, einschließlich Genauigkeit, Präzision, Selektivität, Nachweisgrenzen (LOD), Bestimmungsgrenzen (LOQ), Linearität und Robustheit [8]. Validierungsprotokolle sollten auch Folgendes beinhalten:
- Reagenzienblindproben, um sicherzustellen, dass Reagenzien frei von Analyten sind.
- Matrix-Blanks, um zu bestätigen, dass die Probenumgebung nicht stört.
- Matrix-Spikes, um Wiederfindung und Genauigkeit zu schätzen.
Für quantitative Methoden bei Konzentrationen von 1 µg/g (ppm) liegen akzeptable Spike-Wiederfindungen typischerweise zwischen 80% und 120% [8].
Um Konsistenz zu gewährleisten, sollten Hersteller interne Primärreferenzmaterialien aus produktionsrepräsentativen Chargen etablieren. Diese dienen als rückverfolgbare Standards zur Kalibrierung von Arbeitsreferenzmaterialien [5]. Sobald die Reinheitsprüfung abgeschlossen ist, muss das Medium seine Fähigkeit zur Unterstützung eines effektiven Zellwachstums und zur Erfüllung der Sicherheitsstandards nachweisen.
Funktionalitäts- und Sicherheitstests
Nach der Bestätigung der Zusammensetzung muss das Medium seine Wirksamkeit bei der Unterstützung der Produktion von kultiviertem Fleisch nachweisen. Dies umfasst den Nachweis, dass Zellen proliferieren, ihre Lebensfähigkeit aufrechterhalten und von Laborbedingungen auf Produktionsvolumen skaliert werden können. Die FDA verlangt während der Herstellung In-Prozess-Kontrollen, beginnend mit frühen Phasen wie Zellpassage und Ernte, um Produktkonsistenz und Sicherheit zu gewährleisten [4].
Die Sicherheitsvalidierung umfasst strenge mikrobiologische Tests und Kontaminationskontrolle, wie in den Vorab-Bewertungen der FDA beschrieben [9].
Die FDA verwendet ein vierstufiges System zur Validierung chemischer Methoden, das von Stufe Eins (Notfall- oder eingeschränkte Nutzung) bis Stufe Vier (vollständige kollaborative Studien, die AOAC/ISO-Standards erfüllen) reicht [8].Für routinemäßige regulatorische Tests streben Sie eine Level-Two-Einzel-Labor-Validierung an, die eine umfassende Leistungsbewertung umfasst [8]. Vollständige kollaborative Studien für quantitative Methoden erfordern die Teilnahme von mindestens acht Laboren, während qualitative Methoden zehn benötigen [8]. Sobald die Leistung des Mediums validiert ist, ist es wichtig sicherzustellen, dass alle Rohstoffe von konformen Lieferanten stammen.
Lieferantenqualifikation und Dokumentation
Hersteller müssen mit verifizierten, CGMP-konformen Lieferanten zusammenarbeiten. Lieferanten sollten die in 21 CFR 210/211 festgelegten Standards erfüllen [4]. Die Verifizierung umfasst regelmäßige Audits der Lieferanteneinrichtungen, um die Einhaltung von Qualitätsprogrammen, Verfahren und der allgemeinen CGMP-Konformität zu bewerten [4].
Vor dem Abschluss von Verträgen sollten Sie die Compliance-Historie eines Lieferanten überprüfen, einschließlich Form FDA 483s und Establishment Inspection Reports (EIRs) [4]. Die FDA betont diese Verpflichtung:
"Bevor Sie einen Vertrag, eine Vereinbarung oder eine andere Vereinbarung mit einem anderen Unternehmen abschließen, um einen Herstellungsschritt für Sie durchzuführen, sollten Sie überprüfen, ob das Unternehmen die geltenden regulatorischen CGMP einhält." [4]
Alle eingehenden Materialien müssen vor der Freigabe unter Quarantäne gestellt und inspiziert werden, um sicherzustellen, dass sie den Hauptspezifikationen entsprechen [10]. Lieferanten sind verpflichtet, ein Analysezertifikat (CoA) oder nachvollziehbare, CGMP/GLP-konforme Testergebnisse bereitzustellen [10].Für stabile Zelllinien muss die Dokumentation eine nachvollziehbare Klonierungshistorie enthalten [10]. Säugetier- oder Insektenzellen erfordern typischerweise eine Lebensfähigkeit von mindestens 90 % für die Akzeptanz in CGMP-Projekten [10]. Aufzeichnungen sollten gemäß den regulatorischen Richtlinien aufbewahrt werden [4].
Verträge müssen die CGMP-Verantwortlichkeiten klar umreißen und die Lieferanten verpflichten, die Hersteller über vorgeschlagene Änderungen an Testkits oder Methoden zu informieren [4]. Wenn Tests ausgelagert werden, stellen Sie sicher, dass Vertragslabore validierte analytische Methoden verwenden und bei der FDA registriert sind [4].
Vorbereitung von Dokumenten für die behördliche Einreichung
Sobald Ihr Wachstumsmedium validiert wurde, besteht der nächste Schritt darin, ein Dossier zusammenzustellen, das die Einhaltung aller von der FDA und USDA-FSIS geforderten Sicherheits- und Qualitätsstandards nachweist. Dieses Dossier dient als entscheidende Verbindung zwischen Validierung und behördlicher Konformität und gibt den Behörden einen klaren Überblick über die Sicherheit und Produktionsprozesse Ihres Mediums.
Erforderliche Elemente eines Einreichungsdossiers
Ihr Dossier sollte eine detaillierte Aufschlüsselung der Medienzusammensetzung enthalten, in der alle Aminosäuren, Vitamine, anorganischen Salze und Wachstumsfaktoren aufgelistet sind. Die FDA-Richtlinien betonen, dass der Überprüfungsprozess nicht nur das Medium selbst, sondern den gesamten Produktionsablauf bewertet. Dies umfasst die Etablierung von Zelllinien und -banken, die Implementierung von Herstellungssteuerungen und die Überprüfung aller Komponenten und Eingaben [11].
Zusätzlich muss das Dossier eine gründliche Sicherheits- und toxikologische Bewertung enthalten, die die Lebensmittelsicherheit des kultivierten Materials und aller seiner Eingaben nachweist. Fügen Sie Herstellungsüberwachungsprotokolle, Prozessvalidierungsdaten und Dokumentationen des Qualitätsprogramms bei, um zu zeigen, dass Ihre Produktion konsistent und frei von Verunreinigungen ist.
Sie sollten auch Nachweise zur Überprüfung von Lieferungen und Reagenzien bereitstellen, die die Validierung aller im Medium verwendeten Materialien zeigen, einschließlich derjenigen, die intern hergestellt wurden. Für Produkte, die von der USDA-FSIS reguliert werden, fügen Sie HACCP-Pläne und Hygieneprotokolle bei. Die FDA empfiehlt, die meisten CGMP-Aufzeichnungen mindestens 10 Jahre lang aufzubewahren, während Aufzeichnungen über die Reinigung und Hygiene der Einrichtung mindestens 3 Jahre lang aufbewahrt werden sollten [4]. Dies steht im Einklang mit den Bemühungen zur Lieferantenqualifikation und stellt sicher, dass alle Eingaben den CGMP- und regulatorischen Anforderungen entsprechen.
Dokumentation der Einhaltung von Vorschriften in Einrichtungen
Bevor kultiviertes Fleisch für den menschlichen Verzehr produziert, verarbeitet oder gelagert wird, müssen sich die Einrichtungen bei der FDA registrieren [12]. Ihre Dokumentation sollte einen umfassenden Lebensmittelsicherheitsplan enthalten, der die Gefahrenanalyse (biologisch, chemisch und physikalisch), präventive Kontrollen (wie Hygiene, Allergenmanagement und Maßnahmen in der Lieferkette) und Überwachungsverfahren umfasst [12].
Medienfüllsimulationen sind ebenfalls eine wichtige Anforderung. Diese beinhalten eine 14-tägige Inkubation und Wachstumsförderungstests, um aseptische Praktiken zu bestätigen.Wie die FDA erklärt:
"Der Medienfülltest sollte die aseptische Montage und den Betrieb der kritischen (sterilen) Ausrüstung bewerten, die Bediener qualifizieren und ihre Technik beurteilen sowie nachweisen, dass die Umweltkontrollen ausreichend sind" [2].
Stellen Sie sicher, dass Ihre Aufzeichnungen Daten zur Lieferantenqualifikation enthalten, wie z. B. Tests, die an den ersten drei Chargen eines Mediums von einem Anbieter durchgeführt wurden, um zu bestätigen, dass sie dem Analysezertifikat entsprechen. Weitere wichtige Aufzeichnungen umfassen Protokolle zur Umweltkontrolle, Zeitpläne für die Kalibrierung von Geräten und Daten zur Temperaturüberwachung. Für USDA-regulierte Prozesse bereiten Sie HACCP-Pläne, schriftliche Standardarbeitsanweisungen zur Hygiene (SSOPs) und Rückrufverfahren vor [12][13].
sbb-itb-ffee270
Verwendung von Cellbase für die regulatorisch konforme Beschaffung von Wachstumsmedien
Verifizierte Lieferanten für kultiviertes Fleisch
Sobald Sie Ihre Wachstumsmedienformulierung validiert haben, besteht der nächste Schritt darin, Komponenten zu beschaffen, die den regulatorischen Standards entsprechen. Dies ist nicht so einfach wie die Bestellung bei generischen Lieferanten. Für zellkultivierte Produkte gelten strenge Hygienevorschriften, und jede Komponente des Wachstumsmediums muss mit spezifischer Dokumentation für die behördliche Genehmigung geliefert werden [3]. Hier kommt
Beschaffungsmerkmale
Die Plattform bietet auch transparente Preisgestaltung und eine Direktnachrichtenfunktion, die es Teams ermöglicht, schnell Angebote, Analysezertifikate und andere regulatorische Dokumente anzufordern.Durch die Konsolidierung dieser kritischen Beschaffungsfunktionen in einem auf die Produktion von kultiviertem Fleisch zugeschnittenen System vereinfacht
Schlussfolgerung
Die Validierung von Wachstumsmedien zur behördlichen Genehmigung ist nicht nur ein Punkt zum Abhaken - es ist eine gesetzliche Anforderung für die Einführung von kultivierten Fleischprodukten auf dem britischen Markt. Dies beinhaltet gründliche Tests auf Zusammensetzung und Reinheit, die Implementierung eines starken HACCP-Plans und die Führung detaillierter Dokumentationen in jedem Schritt des Prozesses.
"Lebensmittel dürfen nicht auf den Markt gebracht werden, wenn sie unsicher sind. Das bedeutet, dass sie weder gesundheitsschädlich noch für den menschlichen Verzehr ungeeignet sind." - Food Standards Agency [3]
Die £1 der britischen Food Standards Agency.6 Millionen Regulatory Sandbox unterstreicht sein Engagement, mit Branchenakteuren zusammenzuarbeiten, um klare technische Leitlinien zur Zusammensetzung von Wachstumsmedien zu etablieren [1]. Unternehmen, die jetzt auf ordnungsgemäße Validierung setzen, werden in einer stärkeren Position sein, wenn diese Richtlinien vollständig definiert sind.
Die Einhaltung von Compliance-Standards bedeutet nicht nur, regulatorische Anforderungen zu erfüllen - es geht darum, das Vertrauen der Verbraucher zu gewinnen und die Produktsicherheit zu gewährleisten. Strenge Qualitätstests stehen im Mittelpunkt sowohl der behördlichen Zulassung als auch der Marktzulassung. Um den Genehmigungsprozess zu optimieren, konzentrieren Sie sich auf den Aufbau starker Validierungsprotokolle, die Führung genauer Aufzeichnungen und die Zusammenarbeit mit zuverlässigen Lieferanten. Diese Schritte werden nicht nur die Genehmigung vereinfachen, sondern auch den Weg für ein größeres Verbrauchervertrauen ebnen.
FAQs
Was sind die Hauptschritte zur Validierung von Wachstumsmedien für die behördliche Zulassung?
Die Validierung von Wachstumsmedien für die behördliche Zulassung dreht sich darum, zu beweisen, dass die Formulierung sicher, zuverlässig und geeignet für die Produktion von kultiviertem Fleisch ist. So sieht der Prozess normalerweise aus:
- Risikobewertung: Beginnen Sie mit der Definition der Zelllinie, die Sie verwenden werden, der Ziele des Produkts und seiner kritischen Qualitätsmerkmale (wie pH-Wert oder Nährstoffzusammensetzung). Identifizieren Sie potenzielle Gefahren, wie mikrobiologische Kontamination, und legen Sie Maßnahmen zur Kontrolle dieser Risiken fest.
- Tests und Spezifikationen: Legen Sie klare Akzeptanzkriterien für Faktoren wie Sterilität, Reinheit und Wirksamkeit fest. Verwenden Sie etablierte Testmethoden, um sicherzustellen, dass diese Standards konsequent erfüllt werden.
- Validierungsstudien: Führen Sie eine gründliche Prozessvalidierung durch, einschließlich der Qualifizierung von Geräten und der Prüfung mehrerer Chargen, um zu bestätigen, dass die Ergebnisse reproduzierbar und konsistent sind.
- Stabilitätstests: Überprüfen Sie, wie sich das Medium im Laufe der Zeit hält, indem Sie seine Qualität während der vorgesehenen Haltbarkeitsdauer unter ordnungsgemäßen Lagerbedingungen (typischerweise 2–8 °C) bewerten.
- Dokumentation: Fassen Sie alles in einem umfassenden Validierungsdossier zusammen. Dieses sollte alle Testergebnisse und Analysen enthalten, um die behördlichen Anforderungen zu erfüllen.
Indem Sie jeden dieser Schritte sorgfältig angehen, sammeln Sie die erforderlichen Nachweise, um zu zeigen, dass das Medium die Sicherheits- und Qualitätsstandards für die Produktion von kultiviertem Fleisch erfüllt.
Was sind die Hauptunterschiede zwischen den Vorschriften des Vereinigten Königreichs und der USA für Wachstumsmedien, die in kultiviertem Fleisch verwendet werden?
Im Vereinigten Königreich fällt die Regulierung von Wachstumsmedien für kultiviertes Fleisch unter die Novel Foods Regulation (EU-Verordnung 2015/2283), die in das britische Recht übernommen wurde. Alle Wachstumsmedien, die in Produkten verwendet werden, die vor dem 15. Mai 1997 nicht allgemein konsumiert wurden, müssen eine formelle neuartige Lebensmittelbewertung durch die Food Standards Agency (FSA) durchlaufen. Dieser Prozess erfordert die Einreichung detaillierter Dokumentationen, einschließlich Informationen über die Zusammensetzung, Herkunft und Reinheit des Mediums. Zusätzlich ist eine HACCP-basierte Risikobewertung erforderlich, um zu demonstrieren, wie Kontaminanten während des Zellkulturprozesses kontrolliert werden.
Seit Dezember 2025 hat die FSA eine Cell-Cultivated Products Sandbox implementiert. Diese Initiative bietet Anleitung und unterstützt eine schnellere Datenerfassung für neuartige Lebensmittelanträge.Um die endgültige Genehmigung zu erhalten, müssen Unternehmen ein umfassendes Dossier einreichen, das die Sicherheit der Medien, die Konsistenz und die Validierung der Herstellung behandelt. Erst nach dieser Genehmigung kann das Produkt in Großbritannien verkauft werden.
Im Gegensatz dazu hat die Vereinigten Staaten keinen spezifischen Novel-Food-Rahmen, der auf Wachstumsmedien zugeschnitten ist, was direkte regulatorische Vergleiche erschwert. Für in Großbritannien ansässige Unternehmen kann die Beschaffung von Medienkomponenten, die bereits diesen strengen Standards entsprechen, den Genehmigungsprozess vereinfachen.Wie unterstützt die regulatorische Sandbox des Vereinigten Königreichs die Validierung von Wachstumsmedien?
Die regulatorische Sandbox des Vereinigten Königreichs für kultivierte Produkte bietet einen gut organisierten Rahmen, in dem Unternehmen ihre Wachstumsmedienformulierungen testen und verfeinern können. Überwacht von der Food Standards Agency (FSA) und Food Standards Scotland (FSS), läuft dieses Programm in sechsmonatigen Phasen. Während dieser Zeit können Unternehmen Sicherheitstests durchführen, Risikobewertungen vornehmen und Dokumentationen überprüfen, während sie wertvolles Feedback von den Regulierungsbehörden erhalten.
Dieser praxisorientierte Ansatz ermöglicht praktische Versuche und schrittweise Verbesserungen, beschleunigt die Sammlung von Sicherheitsdaten und hilft Unternehmen, sich an regulatorische Anforderungen anzupassen. Für diejenigen, die an kultiviertem Fleisch arbeiten, kann die Beschaffung vorab genehmigter Wachstumsmedien über











