संवर्धित मांस कंपनियों के लिए यूके बाजार में अनुमोदन प्राप्त करने के लिए विकास मीडिया का सत्यापन एक अनिवार्य कदम है। यह प्रक्रिया उत्पादों की सुरक्षा, गुणवत्ता और अनुपालन को सुनिश्चित करती है, जो यूके नवीन खाद्य विनियम (EU 2015/2283) जैसे सख्त नियामक ढांचे के तहत होती है। यहाँ आपको क्या जानना चाहिए:
- मुख्य आवश्यकताएँ: विकास मीडिया को विष विज्ञान, संदूषण नियंत्रण, पोषण गुणवत्ता और एलर्जेनिकता के मानकों को पूरा करना चाहिए।
- यूके विनियम: खाद्य मानक एजेंसी (FSA) को HACCP सिद्धांतों और पशु मूल के उत्पादों (POAO) के तहत वर्गीकरण के साथ अनुपालन की आवश्यकता होती है।
- वैश्विक मानक: जबकि यूके और ईयू के पास समान ढांचे हैं, अमेरिका FD&C अधिनियम के तहत CGMP विनियमों का पालन करता है।
- प्रमाणीकरण प्रक्रिया: इसमें संरचना, शुद्धता, कार्यक्षमता, और आपूर्तिकर्ता अनुपालन का गहन परीक्षण शामिल है, साथ ही मजबूत दस्तावेजीकरण।
- समर्थन पहल: यूके का £1.6 मिलियन नियामक सैंडबॉक्स, 2025 में लॉन्च किया गया, कंपनियों को इन मानकों को पूरा करने में सहायता करता है।
उचित प्रमाणीकरण सुरक्षा सुनिश्चित करता है, विश्वास बनाता है, और कानूनी आवश्यकताओं के साथ मेल खाता है। लेख परीक्षण विधियों, आपूर्तिकर्ता योग्यताओं, और नियामक सबमिशन युक्तियों सहित चरण-दर-चरण प्रक्रिया में गहराई से जाता है।
विकास मीडिया के लिए नियामक मानक
मानक और दिशानिर्देश
विकसित मांस उत्पादन में विकास मीडिया, एक महत्वपूर्ण घटक है, जिसे कठोर अंतरराष्ट्रीय नियामक मानकों को पूरा करना होता है। ये मानक क्षेत्रों के अनुसार भिन्न होते हैं, प्रत्येक में संरचना, सुरक्षा, और शुद्धता के लिए विशिष्ट आवश्यकताएँ होती हैं।
यूनाइटेड किंगडम में, वृद्धि मीडिया को नॉवेल फूड रेगुलेशन्स (अनुकूलित रेगुलेशन (EU) 2015/2283) के तहत विनियमित किया जाता है। बाजार के लिए अनुमोदित होने से पहले, एक गहन सुरक्षा मूल्यांकन की आवश्यकता होती है [1]। फूड स्टैंडर्ड्स एजेंसी (FSA) सेल-संवर्धित उत्पादों को प्रोडक्ट्स ऑफ एनिमल ओरिजिन (POAO) के रूप में वर्गीकृत करती है, जो रेगुलेशन (EC) 853/2004 के तहत आता है। यह वर्गीकरण उत्पादकों को खाद्य सुरक्षा प्रबंधन प्रणालियों को लागू करने के लिए बाध्य करता है जो हेज़र्ड एनालिसिस एंड क्रिटिकल कंट्रोल पॉइंट्स (HACCP) सिद्धांतों पर आधारित हैं [3]। FSA वृद्धि मीडिया संरचना पर विस्तृत तकनीकी मार्गदर्शन विकसित करने की प्रक्रिया में भी है, और आगे के अपडेट की उम्मीद की जा रही है [1]। ये ढांचे अधिक विशिष्ट नियामक आवश्यकताओं के लिए आधार प्रदान करते हैं।
संयुक्त राज्य अमेरिका में, दृष्टिकोण भिन्न है।विकास मीडिया घटकों को फेडरल फूड, ड्रग, और कॉस्मेटिक अधिनियम (FD&C अधिनियम) [4] की धारा 501(a)(4)(B) में उल्लिखित वर्तमान गुड मैन्युफैक्चरिंग प्रैक्टिस (CGMP) आवश्यकताओं को पूरा करना चाहिए। FDA मीडिया घटकों को "आपूर्ति और अभिकर्मक" के रूप में वर्गीकृत करता है, जो 21 CFR भाग 210 और 211 द्वारा शासित होते हैं। इन घटकों को संदूषण को रोकने के लिए गुणवत्ता सत्यापन से गुजरना चाहिए [4]। दिलचस्प बात यह है कि संवर्धित मांस मीडिया के सिंथेटिक घटक - जैसे कि अमीनो एसिड, विटामिन, और लवण - अक्सर 21 CFR 864.2220 के तहत क्लास I चिकित्सा उपकरणों के रूप में वर्गीकृत होते हैं, जो उन्हें पूर्व-बाजार अधिसूचना आवश्यकताओं से मुक्त करते हैं [6][7]।
यूरोपीय संघ में , नियामक ढांचा UK के साथ निकटता से मेल खाता है, क्योंकि यह भी विनियमन (EU) 2015/2283 का पालन करता है।यूरोपीय खाद्य सुरक्षा प्राधिकरण (EFSA) प्राधिकरण प्रक्रिया की देखरेख करता है [1]। ICH Q6B दिशानिर्देशों के अनुसार, वृद्धि मीडिया घटक, जिनमें एंटीबायोटिक्स, प्रेरक, और अन्य घटक शामिल हैं, प्रक्रिया-संबंधित अशुद्धियों के रूप में माने जाते हैं। इन अशुद्धियों को नियंत्रित और स्वीकार्य स्तरों तक कम किया जाना चाहिए [5]। जहां संभव हो, सहायक और अभिकर्मक फार्माकोपियल मानकों का पालन करना चाहिए [5]।
| क्षेत्राधिकार | प्राथमिक विनियमन | वर्गीकरण | सुरक्षा प्रणाली | मीडिया निगरानी |
|---|---|---|---|---|
| यूनाइटेड किंगडम (GB) | अनुकूलित विनियमन (EU) 2015/2283 [1] | पशु मूल का उत्पाद (POAO) [3] | HACCP (Reg 852/2004) [3] | FSA/FSS सैंडबॉक्स मार्गदर्शन [1] |
| यूरोपीय संघ / NI | विनियमन (EU) 2015/2283 [1] | पशु मूल का उत्पाद (POAO) [3] | HACCP (Reg 852/2004) [3] | EFSA Authorisation Process [1] |
| United States | FD&C Act Section 501(a)(4)(B) [4] | New Animal Drug / Food [4] | CGMP (21 CFR 210/211) [4] | FDA CVM / USDA-FSIS [4] |
संवर्धित मांस के लिए नियामक आवश्यकताएँ
संवर्धित मांस के उत्पादकों को यह सुनिश्चित करना चाहिए कि विकास मीडिया का हर बैच सख्त सुरक्षा और गुणवत्ता मानकों का पालन करता है।विकास मीडिया मान्यता इन उत्पादों के व्यापक नियामक ढांचे का एक मुख्य पहलू है। HACCP सिद्धांतों (विनियमन (EC) 852/2004) के तहत, विकास मीडिया को एक प्राथमिक इनपुट और संदूषण का संभावित स्रोत - रासायनिक, सूक्ष्मजीव, या अन्यथा [3] के रूप में पहचाना गया है। FSA इस चिंता को उजागर करता है:
"कोशिका-संवर्धित उत्पादों के उत्पादन में मुख्य खतरों में कोशिका रेखा की पहचान (और स्थिरता), उत्पादन प्रक्रिया के दौरान पेश किए गए खतरे (सूक्ष्मजीव संदूषण, विकास मीडिया और अंतिम उत्पाद में अवशिष्ट घटक), और एलर्जेंस शामिल हैं।" [3]
यदि विकास मीडिया सूत्रीकरण में परिवर्तन होते हैं, तो एक तात्कालिक HACCP समीक्षा की आवश्यकता होती है [3]।यूके में, प्रवाह आरेखों की सटीकता और नियंत्रण उपायों की प्रभावशीलता सुनिश्चित करने के लिए कार्यान्वयन से पहले सत्यापन होना चाहिए। संयुक्त राज्य अमेरिका में, एफडीए यह अनिवार्य करता है कि सभी अभिकर्मक और मीडिया घटक हानिकारक एजेंटों को पेश करने से बचने के लिए कठोर गुणवत्ता मानकों को पूरा करें। आपूर्तिकर्ताओं और अनुबंध प्रयोगशालाओं को CGMP विनियमों का पालन करना चाहिए, और किसी भी आपूर्तिकर्ता को जो अनुपालन करने में विफल रहता है, उसे हटाया जाना चाहिए ताकि उत्पादों को "मिलावटी" के रूप में वर्गीकृत होने से रोका जा सके। एफडीए इस बात के महत्व को रेखांकित करता है: "सभी नए पशु दवाओं, जिसमें ACTPs शामिल हैं, को CGMP के अनुसार निर्मित किया जाना चाहिए ताकि यह सुनिश्चित किया जा सके कि ऐसी दवाएं संघीय खाद्य, औषधि, और प्रसाधन सामग्री अधिनियम (FD&C अधिनियम) की सुरक्षा आवश्यकताओं को पूरा करती हैं।" [4]
वर्तमान में, यूके के नियामक सैंडबॉक्स में भाग लेने वाली कई कंपनियाँ - जैसे BlueNalu, Gourmey, Hoxton Farms, Mosa Meat, Roslin Technologies, Vital Meat, और Vow - इन तकनीकी मानकों को परिष्कृत करने के लिए FSA के साथ सहयोग कर रही हैं [1]। यूके के नियमों के तहत, व्यवसाय प्राधिकरण प्रक्रिया के दौरान प्रस्तुत गोपनीय जानकारी के लिए पांच साल तक डेटा सुरक्षा का अनुरोध कर सकते हैं [1]।
विकास मीडिया को मान्य करने के लिए चरण
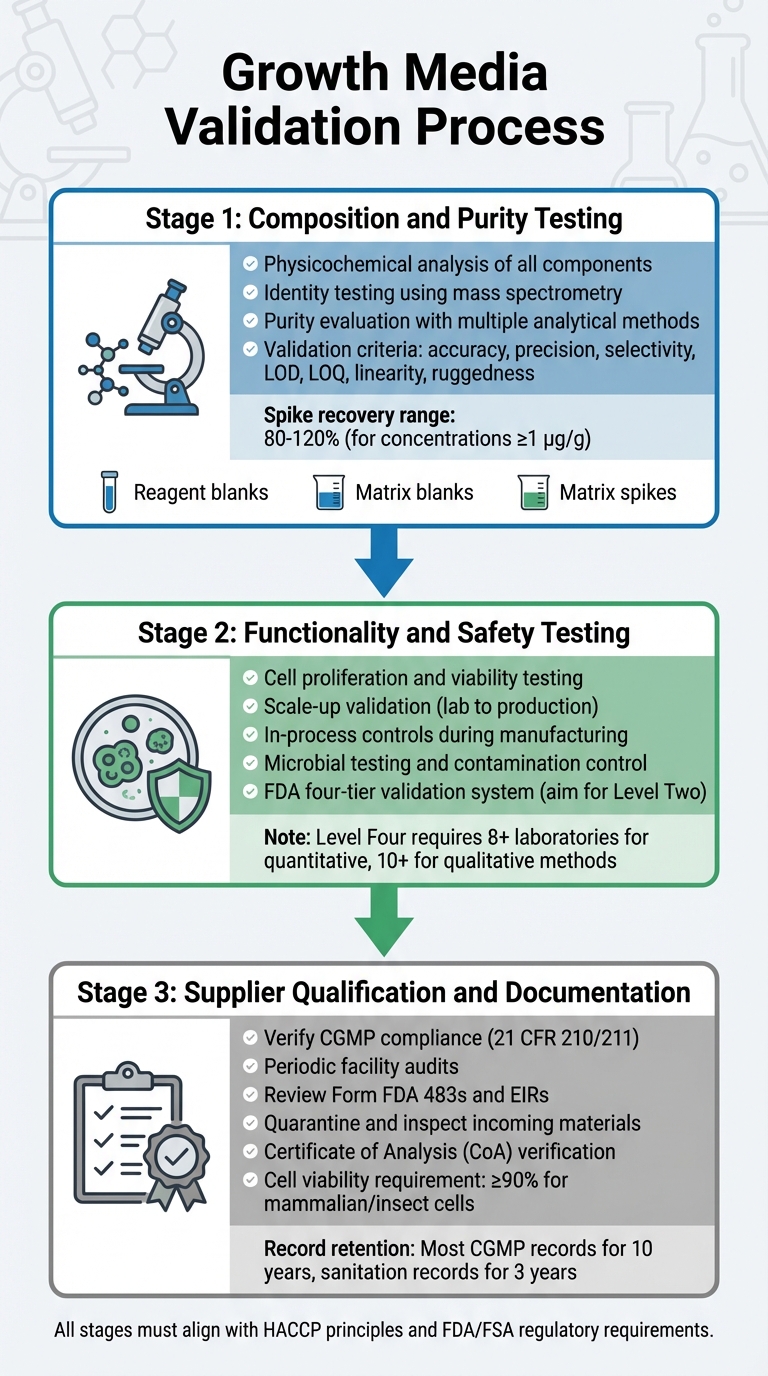
संवर्धित मांस नियामक अनुमोदन के लिए विकास मीडिया मान्यता प्रक्रिया
विकास मीडिया को मान्य करना एक विस्तृत प्रक्रिया है जो इसकी संरचना, कार्यक्षमता, सुरक्षा, और आपूर्तिकर्ता अनुपालन की जांच करती है। प्रत्येक चरण पिछले पर आधारित होता है, यह सुनिश्चित करते हुए कि एक मजबूत मान्यता प्रक्रिया है जो नियामक आवश्यकताओं के साथ मेल खाती है। इसमें संरचना, कार्यक्षमता, और आपूर्तिकर्ता अनुपालन के लिए परीक्षण शामिल है।
संरचना और शुद्धता परीक्षण
पहला चरण प्रत्येक घटक के गहन भौतिक-रासायनिक विश्लेषण पर केंद्रित है। इसमें अमीनो एसिड, विटामिन, और अकार्बनिक लवण जैसे अवयवों की सटीक संरचना, भौतिक गुण, और आणविक संरचना की पहचान शामिल है [5]।आणविक संरचनाओं की पुष्टि के लिए, पहचान परीक्षण अत्यधिक विशिष्ट विधियों का उपयोग करता है, जिसमें भौतिक-रासायनिक, जैविक, और इम्यूनोकेमिकल तकनीकें शामिल हैं। मास स्पेक्ट्रोमेट्री जैसे उपकरणों का उपयोग उनके विखंडन पैटर्न के माध्यम से आणविक पहचान की पुष्टि करने के लिए किया जाता है [8].
शुद्धता मूल्यांकन के लिए कई विश्लेषणात्मक विधियों की आवश्यकता होती है ताकि वांछित घटकों को अशुद्धियों से अलग किया जा सके। इन परीक्षणों को प्रक्रिया-संबंधित और उत्पाद-संबंधित अशुद्धियों दोनों को संबोधित करना चाहिए [5]. विश्लेषणात्मक तकनीकों को सटीकता, परिशुद्धता, चयनात्मकता, पहचान की सीमाएं (LOD), मात्रात्मकता की सीमाएं (LOQ), रैखिकता, और मजबूती सहित सख्त सत्यापन मानदंडों को पूरा करना चाहिए [8]. सत्यापन प्रोटोकॉल में शामिल होना चाहिए:
- रिएजेंट ब्लैंक्स यह सुनिश्चित करने के लिए कि रिएजेंट्स विश्लेषणात्मक पदार्थों से मुक्त हैं।
- मैट्रिक्स ब्लैंक्स यह सुनिश्चित करने के लिए कि नमूना वातावरण हस्तक्षेप नहीं करता है।
- मैट्रिक्स स्पाइक्स रिकवरी और सटीकता का अनुमान लगाने के लिए।
1 µg/g (ppm) के सांद्रण पर मात्रात्मक विधियों के लिए, स्वीकार्य स्पाइक रिकवरी आमतौर पर 80% और 120% के बीच होती है [8].
संगति बनाए रखने के लिए, निर्माताओं को उत्पादन-प्रतिनिधि लॉट से प्राप्त इन-हाउस प्राथमिक संदर्भ सामग्री स्थापित करनी चाहिए। ये कार्यशील संदर्भ सामग्री को कैलिब्रेट करने के लिए ट्रेस करने योग्य मानक के रूप में कार्य करते हैं [5]. एक बार शुद्धता परीक्षण पूरा हो जाने के बाद, मीडिया को प्रभावी सेल वृद्धि का समर्थन करने और सुरक्षा मानकों को पूरा करने की अपनी क्षमता का प्रदर्शन करना चाहिए।
कार्यात्मकता और सुरक्षा परीक्षण
संरचना की पुष्टि करने के बाद, मीडिया को संवर्धित मांस उत्पादन का समर्थन करने में अपनी प्रभावशीलता साबित करनी होगी। इसमें यह दिखाना शामिल है कि कोशिकाएं प्रयोगशाला की स्थितियों से उत्पादन मात्रा तक बढ़ सकती हैं, अपनी जीवंतता बनाए रख सकती हैं और पैमाना बढ़ा सकती हैं। एफडीए को निर्माण के दौरान इन-प्रोसेस नियंत्रण की आवश्यकता होती है, जैसे कि कोशिका पासेजिंग और हार्वेस्टिंग के शुरुआती चरणों से, उत्पाद की स्थिरता और सुरक्षा सुनिश्चित करने के लिए [4].
सुरक्षा मान्यता में एफडीए के पूर्व-बाजार मूल्यांकन में उल्लिखित कठोर सूक्ष्मजीव परीक्षण और संदूषण नियंत्रण शामिल है [9].
एफडीए रासायनिक विधि मान्यता के लिए चार-स्तरीय प्रणाली का उपयोग करता है, जो स्तर एक (आपातकालीन या सीमित उपयोग) से लेकर स्तर चार (AOAC/ISO मानकों को पूरा करने वाले पूर्ण सहयोगी अध्ययन) तक है [8].नियमित नियामक परीक्षण के लिए, स्तर दो एकल-प्रयोगशाला सत्यापन का लक्ष्य रखें, जिसमें एक व्यापक प्रदर्शन मूल्यांकन शामिल है [8]। मात्रात्मक विधियों के लिए पूर्ण सहयोगात्मक अध्ययन में कम से कम आठ प्रयोगशालाओं की भागीदारी की आवश्यकता होती है, जबकि गुणात्मक विधियों के लिए दस [8]। एक बार जब मीडिया के प्रदर्शन को मान्य कर दिया जाता है, तो यह सुनिश्चित करना आवश्यक है कि सभी कच्चे माल अनुपालन आपूर्तिकर्ताओं से आएं।
आपूर्तिकर्ता योग्यता और दस्तावेज़ीकरण
निर्माताओं को सत्यापित, CGMP-अनुपालन आपूर्तिकर्ताओं के साथ काम करना चाहिए। आपूर्तिकर्ताओं को 21 CFR 210/211 में उल्लिखित मानकों को पूरा करना चाहिए [4]। सत्यापन में गुणवत्ता कार्यक्रमों, प्रक्रियाओं और समग्र CGMP अनुपालन के पालन का आकलन करने के लिए आपूर्तिकर्ता सुविधाओं का समय-समय पर ऑडिट शामिल है [4]।
किसी अनुबंध में प्रवेश करने से पहले, एक आपूर्तिकर्ता के अनुपालन इतिहास की समीक्षा करें, जिसमें फॉर्म FDA 483s और स्थापना निरीक्षण रिपोर्ट (EIRs) शामिल हैं [4]। FDA इस दायित्व को रेखांकित करता है:
"किसी अन्य स्थापना के साथ किसी भी अनुबंध, समझौते, या अन्य व्यवस्था में प्रवेश करने से पहले, आपको यह सत्यापित करना चाहिए कि स्थापना लागू नियामक CGMP का अनुपालन करती है।" [4]
सभी आने वाली सामग्रियों को रिलीज़ से पहले क्वारंटाइन और निरीक्षण किया जाना चाहिए, यह सुनिश्चित करते हुए कि वे मास्टर विनिर्देशों को पूरा करते हैं [10]। आपूर्तिकर्ताओं को एक विश्लेषण प्रमाणपत्र (CoA) या ट्रेस करने योग्य, CGMP/GLP-अनुपालन परीक्षण परिणाम प्रदान करने की आवश्यकता होती है [10]।स्थिर सेल लाइनों के लिए, दस्तावेज़ में एक ट्रेस करने योग्य क्लोनिंग इतिहास शामिल होना चाहिए [10]। स्तनधारी या कीट कोशिकाओं को आमतौर पर CGMP परियोजनाओं में स्वीकृति के लिए कम से कम 90% जीवंतता की आवश्यकता होती है [10]। रिकॉर्ड को नियामक दिशानिर्देशों के अनुसार बनाए रखा जाना चाहिए [4]।
अनुबंधों में स्पष्ट रूप से CGMP जिम्मेदारियों को रेखांकित करना चाहिए और आपूर्तिकर्ताओं को परीक्षण किट या कार्यप्रणालियों में किसी भी प्रस्तावित परिवर्तन के बारे में निर्माताओं को सूचित करने की आवश्यकता होनी चाहिए [4]। यदि परीक्षण आउटसोर्स किया जाता है, तो सुनिश्चित करें कि अनुबंध प्रयोगशालाएं मान्य विश्लेषणात्मक विधियों का उपयोग करती हैं और FDA-पंजीकृत हैं [4]।
नियामक सबमिशन दस्तावेज़ तैयार करना
एक बार जब आपका वृद्धि माध्यम मान्य हो जाता है, तो अगला कदम एक डोजियर तैयार करना है जो FDA और USDA-FSIS द्वारा आवश्यक सभी सुरक्षा और गुणवत्ता मानकों के अनुपालन को प्रदर्शित करता है। यह डोजियर मान्यता और नियामक अनुपालन के बीच एक महत्वपूर्ण कड़ी के रूप में कार्य करता है, जिससे अधिकारियों को आपके माध्यम की सुरक्षा और उत्पादन प्रक्रियाओं का स्पष्ट दृष्टिकोण मिलता है।
सबमिशन डोजियर के आवश्यक तत्व
आपके डोजियर में माध्यम संरचना का विस्तृत विवरण शामिल होना चाहिए, जिसमें सभी अमीनो एसिड, विटामिन, अकार्बनिक लवण, और वृद्धि कारक सूचीबद्ध हों। FDA दिशानिर्देश इस बात पर जोर देते हैं कि समीक्षा प्रक्रिया केवल माध्यम ही नहीं बल्कि पूरे उत्पादन कार्यप्रवाह का मूल्यांकन करती है। इसमें सेल लाइनों और बैंकों की स्थापना, विनिर्माण नियंत्रणों का कार्यान्वयन, और सभी घटकों और इनपुट्स का सत्यापन शामिल है [11]।
इसके अतिरिक्त, डोजियर में एक व्यापक सुरक्षा और विषाक्तता मूल्यांकन शामिल होना चाहिए, जो कि संवर्धित सामग्री और उसके सभी इनपुट्स की खाद्य सुरक्षा को साबित करता हो। अपने उत्पादन की निरंतरता और प्रदूषण से मुक्त होने को प्रदर्शित करने के लिए विनिर्माण नियंत्रण रिकॉर्ड, प्रक्रिया सत्यापन डेटा, और गुणवत्ता कार्यक्रम दस्तावेज़ीकरण शामिल करें।
आपको मीडिया में उपयोग की गई सभी सामग्रियों के लिए सत्यापन दिखाते हुए आपूर्ति और अभिकर्मक सत्यापन रिकॉर्ड भी प्रदान करने चाहिए, जिसमें इन-हाउस तैयार की गई सामग्री भी शामिल है। USDA-FSIS द्वारा विनियमित उत्पादों के लिए, HACCP योजनाएं और स्वच्छता प्रोटोकॉल शामिल करें। FDA सलाह देता है कि अधिकांश CGMP रिकॉर्ड को कम से कम 10 वर्षों तक बनाए रखें, जबकि सुविधा की सफाई और स्वच्छता रिकॉर्ड को कम से कम 3 वर्षों तक रखा जाना चाहिए [4]। यह आपूर्तिकर्ता योग्यता प्रयासों के साथ मेल खाता है, यह सुनिश्चित करते हुए कि सभी इनपुट CGMP और नियामक आवश्यकताओं को पूरा करते हैं।
सुविधा अनुपालन का दस्तावेजीकरण
मानव उपभोग के लिए संवर्धित मांस का उत्पादन, प्रसंस्करण, या भंडारण करने से पहले, सुविधाओं को FDA के साथ पंजीकरण करना आवश्यक है [12]। आपके दस्तावेज में एक व्यापक खाद्य सुरक्षा योजना शामिल होनी चाहिए जो खतरे के विश्लेषण (जैविक, रासायनिक, और भौतिक), निवारक नियंत्रण (जैसे स्वच्छता, एलर्जेन प्रबंधन, और आपूर्ति श्रृंखला उपाय), और निगरानी प्रक्रियाओं को संबोधित करती है [12]।
मीडिया फिल सिमुलेशन भी एक प्रमुख आवश्यकता है। इनमें 14-दिन की ऊष्मायन और विकास संवर्धन परीक्षण शामिल हैं ताकि एसेप्टिक प्रथाओं की पुष्टि की जा सके।जैसा कि FDA समझाता है:
"मीडिया फिल को महत्वपूर्ण (स्टेराइल) उपकरणों की एसेप्टिक असेंबली और संचालन का मूल्यांकन करना चाहिए, ऑपरेटरों को योग्य बनाना चाहिए और उनकी तकनीक का आकलन करना चाहिए, और यह प्रदर्शित करना चाहिए कि पर्यावरणीय नियंत्रण पर्याप्त हैं" [2].
सुनिश्चित करें कि आपके रिकॉर्ड में आपूर्तिकर्ता योग्यता डेटा शामिल है, जैसे कि किसी विक्रेता से माध्यम के पहले तीन बैचों पर किए गए परीक्षण यह पुष्टि करने के लिए कि वे विश्लेषण के प्रमाणपत्र से मेल खाते हैं। अन्य आवश्यक रिकॉर्ड में पर्यावरणीय नियंत्रण लॉग, उपकरण अंशांकन अनुसूचियाँ, और तापमान निगरानी डेटा शामिल हैं। USDA-नियंत्रित प्रक्रियाओं के लिए, HACCP योजनाएँ, लिखित स्वच्छता मानक संचालन प्रक्रियाएँ (SSOPs), और रिकॉल प्रक्रियाएँ तैयार करें [12][13]।
sbb-itb-ffee270
विनियामक-अनुपालन वृद्धि मीडिया खरीद के लिए Cellbase
संस्कृत मांस के लिए सत्यापित आपूर्तिकर्ता
एक बार जब आपने अपनी वृद्धि मीडिया फॉर्मूलेशन को मान्य कर लिया है, तो अगला कदम उन घटकों की सोर्सिंग करना है जो नियामक मानकों को पूरा करते हैं। यह सामान्य आपूर्तिकर्ताओं से ऑर्डर करने जितना सरल नहीं है। सेल-संस्कृत उत्पादों के लिए, सख्त स्वच्छता नियम लागू होते हैं, और हर वृद्धि मीडिया घटक को नियामक अनुमोदन के लिए विशिष्ट दस्तावेज़ीकरण के साथ आना चाहिए [3]। यहीं पर
खरीदारी विशेषताएँ
प्लेटफ़ॉर्म पारदर्शी मूल्य निर्धारण और एक प्रत्यक्ष संदेश सुविधा भी प्रदान करता है, जिससे टीमों को जल्दी से उद्धरण, विश्लेषण प्रमाणपत्र और अन्य नियामक दस्तावेज़ों का अनुरोध करने में सक्षम बनाता है।इन महत्वपूर्ण खरीद कार्यों को एक प्रणाली में समेकित करके जो संवर्धित मांस उत्पादन के लिए अनुकूलित है,
निष्कर्ष
विनियामक अनुमोदन के लिए विकास मीडिया को मान्य करना सिर्फ एक बॉक्स को टिक करना नहीं है - यह यूके बाजार में संवर्धित मांस उत्पादों को पेश करने के लिए एक कानूनी आवश्यकता है। इसमें संरचना और शुद्धता के लिए गहन परीक्षण, एक मजबूत HACCP योजना को लागू करना, और हर कदम पर विस्तृत दस्तावेज रखना शामिल है।
"खाद्य को बाजार में नहीं रखा जाना चाहिए यदि यह असुरक्षित है। इसका मतलब है कि यह न तो स्वास्थ्य के लिए हानिकारक है और न ही मानव उपभोग के लिए अनुपयुक्त।" - खाद्य मानक एजेंसी [3]
यूके खाद्य मानक एजेंसी का £1.6 मिलियन रेगुलेटरी सैंडबॉक्स उद्योग के खिलाड़ियों के साथ काम करने की अपनी प्रतिबद्धता को उजागर करता है ताकि विकास मीडिया संरचना पर स्पष्ट तकनीकी मार्गदर्शन स्थापित किया जा सके [1]। जो कंपनियाँ अब उचित सत्यापन को प्राथमिकता देती हैं, वे इन दिशानिर्देशों के पूरी तरह से परिभाषित होने पर एक मजबूत स्थिति में होंगी।
अनुपालन मानकों को पूरा करना केवल नियामक बॉक्सों को टिक करने के बारे में नहीं है - यह उपभोक्ता विश्वास अर्जित करने और उत्पाद सुरक्षा सुनिश्चित करने के बारे में है। कठोर गुणवत्ता परीक्षण न केवल नियामक अनुमोदन के केंद्र में है बल्कि बाजार स्वीकृति प्राप्त करने के लिए भी है। प्राधिकरण प्रक्रिया को सुव्यवस्थित करने के लिए, मजबूत सत्यापन प्रोटोकॉल बनाने, सटीक रिकॉर्ड बनाए रखने और विश्वसनीय आपूर्तिकर्ताओं के साथ साझेदारी करने पर ध्यान केंद्रित करें। ये कदम न केवल अनुमोदन को सरल बनाएंगे बल्कि उपभोक्ता विश्वास के लिए भी मार्ग प्रशस्त करेंगे।
सामान्य प्रश्न
विनियामक अनुमोदन के लिए वृद्धि मीडिया को मान्य करने के मुख्य चरण क्या हैं?
विनियामक अनुमोदन के लिए वृद्धि मीडिया को मान्य करना इस बात को साबित करने के बारे में है कि सूत्रीकरण सुरक्षित, विश्वसनीय और संवर्धित मांस के उत्पादन के लिए उपयुक्त है। आमतौर पर प्रक्रिया इस प्रकार होती है:
- जोखिम मूल्यांकन: उस सेल लाइन को परिभाषित करके शुरू करें जिसका आप उपयोग करेंगे, उत्पाद के लक्ष्य और इसके महत्वपूर्ण गुणवत्ता विशेषताएँ (जैसे पीएच या पोषक तत्व संरचना)। किसी भी संभावित खतरों की पहचान करें, जैसे कि सूक्ष्मजीव संदूषण, और इन जोखिमों को नियंत्रित करने के उपाय निर्धारित करें।
- परीक्षण और विनिर्देश: नसबंदी, शुद्धता और शक्ति जैसे कारकों के लिए स्पष्ट स्वीकृति मानदंड निर्धारित करें। यह सुनिश्चित करने के लिए स्थापित परीक्षण विधियों का उपयोग करें कि ये मानक लगातार पूरे होते हैं।
- वैधता अध्ययन: परिणामों की पुनरुत्पादकता और स्थिरता की पुष्टि करने के लिए उपकरणों की योग्यता और कई बैचों का परीक्षण सहित व्यापक प्रक्रिया वैधता का संचालन करें।
- स्थिरता परीक्षण: उचित भंडारण स्थितियों (आमतौर पर 2–8 °C) के तहत अपने इरादित शेल्फ जीवन के दौरान इसकी गुणवत्ता का मूल्यांकन करके मीडिया की स्थिरता की जाँच करें।
- प्रलेखन: सभी को एक व्यापक वैधता डोजियर में एकत्रित करें। इसमें सभी परीक्षण परिणाम और विश्लेषण शामिल होने चाहिए ताकि नियामक आवश्यकताओं को पूरा किया जा सके।
इनमें से प्रत्येक चरण को सावधानीपूर्वक संबोधित करके, आप यह दिखाने के लिए आवश्यक साक्ष्य एकत्र करेंगे कि मीडिया खेती किए गए मांस उत्पादन के लिए आवश्यक सुरक्षा और गुणवत्ता मानकों को पूरा करता है।
संवर्धित मांस के लिए उपयोग किए जाने वाले विकास मीडिया के लिए यूके और यूएस विनियमों के बीच मुख्य अंतर क्या हैं?
यूनाइटेड किंगडम में, संवर्धित मांस के लिए विकास मीडिया का विनियमन नवीन खाद्य विनियमन (ईयू विनियमन 2015/2283) के अंतर्गत आता है, जिसे जीबी कानून में बनाए रखा गया है। 15 मई 1997 से पहले आमतौर पर उपभोग नहीं किए गए उत्पादों में उपयोग किए जाने वाले किसी भी विकास मीडिया को खाद्य मानक एजेंसी (FSA) द्वारा एक औपचारिक नवीन-खाद्य मूल्यांकन से गुजरना होगा। इस प्रक्रिया के लिए मीडिया की संरचना, उत्पत्ति, और शुद्धता की जानकारी सहित विस्तृत दस्तावेज प्रस्तुत करना आवश्यक है। इसके अतिरिक्त, HACCP-आधारित जोखिम मूल्यांकन की आवश्यकता होती है ताकि यह प्रदर्शित किया जा सके कि सेल-संस्कृति प्रक्रिया के दौरान संदूषकों को कैसे नियंत्रित किया जाता है।
दिसंबर 2025 से, FSA ने एक सेल-संवर्धित उत्पाद सैंडबॉक्स लागू किया है। यह पहल नवीन-खाद्य अनुप्रयोगों के लिए मार्गदर्शन और तेज डेटा संग्रह का समर्थन प्रदान करती है।अंतिम प्राधिकरण प्राप्त करने के लिए, कंपनियों को एक व्यापक दस्तावेज़ प्रस्तुत करना होगा जो मीडिया सुरक्षा, स्थिरता, और निर्माण सत्यापन को संबोधित करता है। केवल इस अनुमोदन के बाद ही उत्पाद को ग्रेट ब्रिटेन में बेचा जा सकता है।
इसके विपरीत, संयुक्त राज्य अमेरिका में वृद्धि मीडिया के लिए एक विशिष्ट नवीन-खाद्य ढांचा नहीं है, जिससे सीधे नियामक तुलना करना चुनौतीपूर्ण हो जाता है। यूके-आधारित कंपनियों के लिए, उन मीडिया घटकों का स्रोत जो पहले से ही इन सख्त मानकों का पालन करते हैं, अनुमोदन प्रक्रिया को सरल बना सकता है।
यूके का नियामक सैंडबॉक्स ग्रोथ मीडिया सत्यापन का समर्थन कैसे करता है?
संवर्धित उत्पादों के लिए यूके का नियामक सैंडबॉक्स एक सुव्यवस्थित सेटिंग प्रदान करता है जहां कंपनियां अपने ग्रोथ मीडिया फॉर्मूलेशन का परीक्षण और परिष्कृत कर सकती हैं। खाद्य मानक एजेंसी (FSA) और खाद्य मानक स्कॉटलैंड (FSS) द्वारा देखरेख किया गया, यह कार्यक्रम छह महीने के चरणों में चलता है। इस दौरान, व्यवसाय सुरक्षा परीक्षण कर सकते हैं, जोखिम आकलन कर सकते हैं, और दस्तावेज़ों की समीक्षा कर सकते हैं, जबकि नियामकों से मूल्यवान प्रतिक्रिया प्राप्त कर सकते हैं।
यह व्यावहारिक दृष्टिकोण व्यावहारिक परीक्षणों और चरण-दर-चरण सुधारों की अनुमति देता है, सुरक्षा डेटा के संग्रह को तेज करता है और कंपनियों को नियामक आवश्यकताओं के साथ संरेखित करने में मदद करता है। संवर्धित मांस पर काम करने वालों के लिए,











