キャリブレーションとバリデーションは、培養肉生産のクリーンルーム基準を維持するための重要な要素です。 こちらがその概要です:
- キャリブレーション は、温度計や圧力計のような個々の機器が、認定された基準( e.g., NIST)と比較して正確な読み取りを提供することを保証します。
- バリデーション は、機器やプロセスを含むクリーンルーム全体のシステムが、要求されるパラメータ内で一貫して動作することを確認します。
なぜ重要なのか:
- 培養肉のクリーンルームは、バイオファーマに比べてより厳しい要求に直面しており、微生物学的バッチ失敗率は19.5%(バイオファーマでは3.2%)です。正確なキャリブレーションと徹底したバリデーションは、これらのリスクを軽減します。
- キャリブレーションは個々のデバイスに焦点を当て、バリデーションはシステム全体のパフォーマンスを評価し、無菌性と規制の遵守を保証します。
主な違い:
- 校正は特定の機器の精度に関するものです。
- バリデーションは、実際の条件下でのシステム全体の性能を評価します。
- どちらのプロセスもISO 14644およびGMPのコンプライアンスにとって重要です。
要するに: 校正は個々のツールが正しく動作することを保証し、バリデーションはシステム全体が厳格なクリーンルーム基準を満たしていることを証明します。どちらも培養肉の生産における汚染リスクの低減と製品品質の維持に不可欠です。
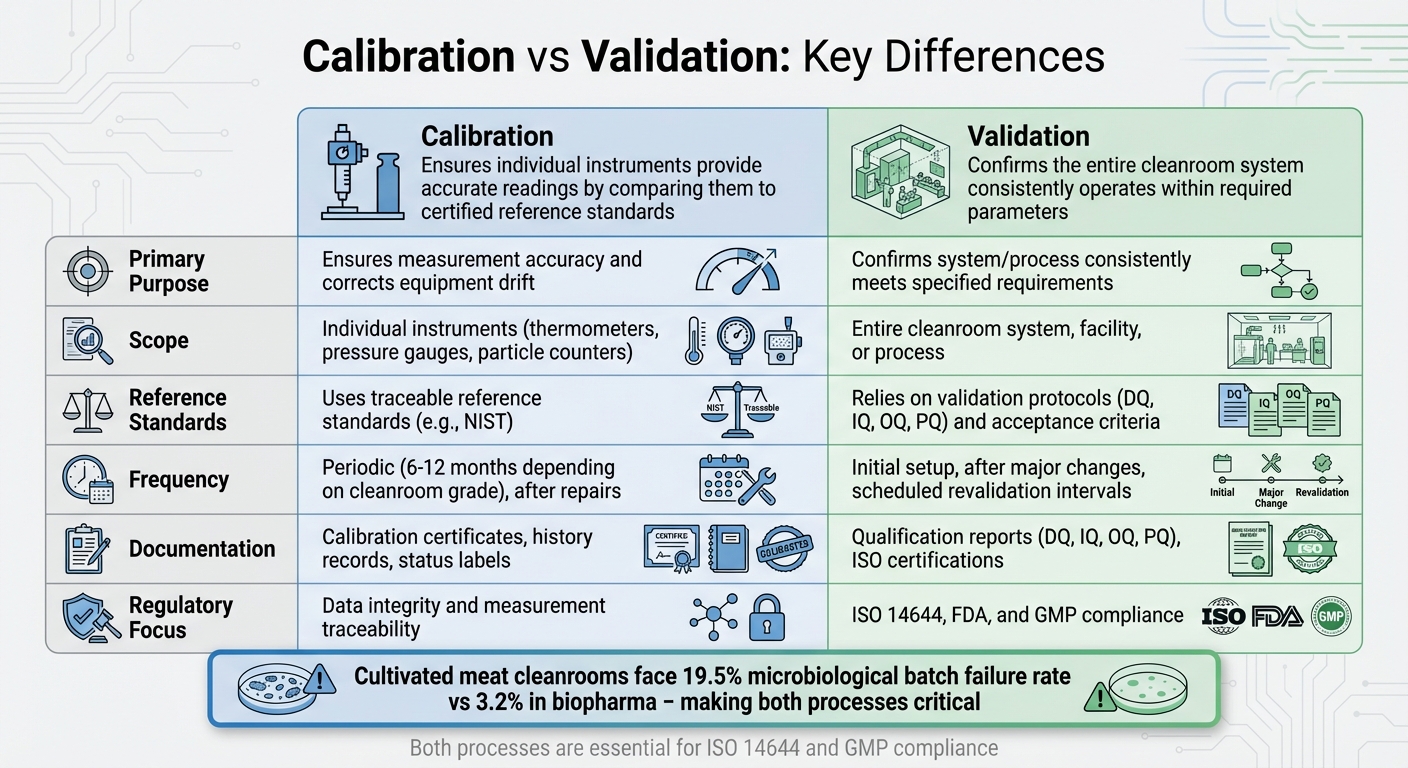
クリーンルームモニタリングにおける校正とバリデーション: 主な違い
校正とは何か?
定義と目的
校正は、測定バイアスを排除するために、機器の出力を検証済みの基準標準と比較することを含みます。[8].NISTによると:
校正の目的は、基準ベースに対するユーザーの測定システムのバイアスを排除または削減することです[8]。
培養肉施設では、精度は妥協できません。温度プローブ、粒子カウンター、圧力計からの正確な読み取りが不可欠です。小さな誤差でも無菌性を損ない、コストのかかるバッチの失敗につながる可能性があります。
校正の主要プロセス
校正は通常、構造化された一連のステップに従います。まず、技術者は機器の動作範囲に一致する既知の値を持つ基準標準を選択します [12]。開始前に、汚染やセンサーの摩耗などの目に見える問題がないかデバイスを確認します[11]。次のステップでは、計器の読み取り値を基準値と比較し、校正曲線[12]を生成します。差異が生じた場合は、ゼロ調整で定数オフセットを修正するか、 スパン調整で応答曲線の傾きを修正します [10]。プロセスが完了すると、証明書が発行されます。この文書には、測定結果、不確かさの値、NISTなどの国家標準へのトレーサビリティの証明が含まれています[11][2]。
クリーンルームモニタリングにおける校正
クリーンルーム環境では、校正は空中粒子、温度、湿度、差圧、気流などの重要なパラメータを測定する機器に焦点を当てています。 例えば、パーティクルカウンターは ISO 21501-4基準に準拠し、少なくとも年に一度の校正を受ける必要があります [6][11]。温度センサーは、熱電対であれPt100プローブであれ、定期的な校正が必要です。時間の経過とともに、老化や冶金の変化などの要因がこれらのセンサーにドリフトを引き起こす可能性があります[10]。同様に、差圧計や湿度プローブも、ISO 14644準拠のために必要な厳しい許容範囲を満たしていることを確認するために定期的なチェックが必要です[6][2]。
サービスディレクターのAntoine Nguyen氏、Dickson Dataにて、次のように説明しています:
校正とは、測定装置を既知の基準と比較することを厳密に意味します。これは、材料、物体、物理的プロセス(融解や凍結など)、または正確であることが知られている第二の装置である可能性があります[10]。
監査目的のために、調整前(「as-found」)および調整後(「as-left」)のパフォーマンスの記録を保持することが重要です[10][7]。この綿密なプロセスは、効果的な環境モニタリングの基盤です。次のステップは、システム全体のパフォーマンスを評価する検証です。
検証とは何ですか?
定義と目的
検証は、個々の機器の校正を超えて、クリーンルーム全体に焦点を当てます。これは、すべてのシステム、機器、およびモニタリングツールが連携して、制御された製造環境に必要な環境条件を維持することを保証する正式なプロセスです[5]。これは単に規制のチェックをするだけではなく、製品の品質を保護し、プロセスの一貫性を確保し、消費者の安全を守るための鍵です。重要な要素である粒子数、気流、圧力が設定された限界内にあることを確認することで、バリデーションはすべてをスムーズに運営します。これは、無菌性が絶対条件である培養肉のバイオプロセシングにおいて特に重要です。バリデーションは、クリーンルームが実際の条件下で信頼性を持って機能することを保証し、特定の資格ステップを伴う構造化されたアプローチを必要とします。
バリデーションにおける主要プロセス
バリデーションは、しばしば「Qシリーズ」と呼ばれる段階的なシーケンスに従います。
- 設計資格 (DQ): クリーンルームの設計が必要な仕様とプロセスに一致していることを保証します。
- 設置資格 (IQ): センサー、HVACシステム、監視装置などのすべてのコンポーネントが、承認された設計に従って正しく設置されていることを確認します。
- 運用資格 (OQ): 静的条件下で主要システムをテストし、必要なように動作することを確認するために、風速、圧力差、粒子数などのパラメータを検証します。
- 性能資格 (PQ): 通常の人員活動や機器の使用を含む実際の運用条件下での性能を維持するクリーンルームの能力を評価します。
工場受入試験 (FAT) や現地受入試験 (SAT) などの追加チェックは、出荷中の機器の完全性を保証します。すべてのステップは、詳細なテストプロトコルと受入基準を備えたバリデーションマスタープラン (VMP) に細心の注意を払って文書化され、最終的なバリデーションサマリーレポートで締めくくられます[5]。これらのステップを合わせて、施設とその監視システムが信頼性を持って動作することを保証します。
クリーンルームモニタリングにおけるバリデーション
培養肉の生産において、バリデーションはHEPAフィルター、気流パターン、圧力差などの要素が効果的に無菌状態を維持していることを確認します。校正が個々の機器の精度を保証する一方で、バリデーションはシステム全体が意図した通りに機能することを保証します。例えば、HEPAフィルターの完全性は、エアロゾルチャレンジ法を使用して漏れを検出することでテストされます。煙テストは気流の可視化に使用され、一方向の流れを確保し、敏感な領域付近の乱流を特定します。圧力マッピングは、ゾーン間の交差汚染を防ぐためにカスケード圧力差を検証します[5].
環境モニタリングシステムもバリデーションを受けます。ISO 14644-2によると、ISOクラス5の施設では粒子濃度を6ヶ月ごとにテストし、より緩やかな分類では年に一度テストする必要があります[7].空気速度と圧力差のテストは通常、年に一度実施されます[7]。ISOクラス7のクリーンルームでは、培養肉の生産に一般的であり、基準を満たすために1時間あたり60から90回の空気交換を達成する必要があります[5]。施設は通常、年次、半年ごと、または新しい機器の設置、HVACの調整、HEPAフィルターの交換などの重要な変更後に、完全または部分的な再検証をスケジュールします[5]。
URSからPQまでのクリーンルームバリデーション
校正とバリデーションの主な違い
校正とバリデーションはどちらもクリーンルームの基準を維持するために不可欠ですが、それぞれ異なる目的を果たします。校正は、個々の機器がトレーサブルな基準標準と比較することによって正確な測定を提供することを保証します[13] [2]。一方、バリデーションは、クリーンルームシステム全体が事前に定義された受け入れ基準を一貫して満たしていることを確認します[13] [15]。例えば、校正は温度計の精度をチェックする一方で、バリデーションはクリーンルームが必要な環境条件を維持していることを保証します。
これらのプロセスの範囲も大きく異なります。校正は、センサー、パーティクルカウンター、圧力計などの特定のハードウェアを対象とし、時間の経過による測定のドリフトを特定し修正します[13]。検証は、クリーンルームシステム全体を評価し、その設計、設置、および運用性能をカバーします[13][14]。これには、HEPAフィルターの効率、気流パターン、圧力差などのパラメータの厳密なテストが含まれます[13][14]。校正は通常、個々の機器に対してより定期的に行われますが、検証は広範なシステム全体の評価を含み、その役割は補完的でありながら異なります。
「検証は、システム、製品、またはサービスが許容基準内で一貫して結果を提供することを保証するプロセスです。」 - SIC Web [13]
もう一つの重要な違いは、規制遵守における役割にあります。校正は、測定の精度を検証するためにトレーサブルな基準標準に依存しています[13][17]。一方、バリデーションは、ISO 14644のような基準への準拠を確保するために、設計適格性評価(DQ)、設置適格性評価(IQ)、運用適格性評価(OQ)、性能適格性評価(PQ)などのプロトコルに従います[13][14][15]。特に、校正はしばしばバリデーションに先行します。すべての監視機器は、性能適格性評価テストに使用される前に校正されなければなりません[15]。
主な違いの概要: キャリブレーションとバリデーション
| 側面 | キャリブレーション | バリデーション |
|---|---|---|
| 主な目的 | 測定の精度を保証し、機器のドリフトを修正する[13][2] | システムまたはプロセスが指定された要件を一貫して満たしていることを確認する[13][14] |
| 範囲 | 個々の機器に焦点を当てる (e.g.、温度計、圧力計)[13][17] | クリーンルームシステム、施設、またはプロセス全体を評価します[13][15] |
| 参照基準 | 精度検証のために追跡可能な参照基準を使用します[13][17] | 検証プロトコルと事前定義された受け入れ基準に依存します[13] |
| 頻度 | 定期的に、修理後、または結果に疑問がある場合に実施されます[13][17] | 初期設定時、主要な変更後、または定期的な再検証間隔で実施されます [13][14][15] |
| 文書化 | 校正証明書、履歴記録、ステータスラベルを含みます [17] | 適格性報告書(DQ、IQ、OQ、PQ)およびISO認証を含みます [14][15] |
| 規制の焦点 | データの完全性と測定のトレーサビリティを確保します [17] | ISO 14644、FDA、およびGMP基準への準拠を示します [14][15][16] |
校正の使用時期
定期的なモニタリングと品質保証
校正は、特に定期的なモニタリングと品質保証プロセスにおいて、クリーンルームの運用の整合性を維持する上で重要な役割を果たします。センサーによって収集されたデータが正確で信頼できることを保証し、日常業務を効果的に監督するために重要です[1].
温度プローブ、湿度センサー、差圧計、または粒子カウンターであれ、すべての監視機器は、正確な測定を保証するために定期的な校正が必要です。これらの読み取り値のわずかな偏差でも、製品の品質を危険にさらしたり、規制への不遵守につながる可能性があります。
校正の頻度はクリーンルームの分類に依存します。グレードAおよびB(ISOクラス5-6)に分類されるクリーンルームでは、通常、6ヶ月ごとに校正が必要ですが、グレードCおよびD (ISOクラス7-8)のクリーンルームは通常、12ヶ月の校正スケジュールに従います[18] 。粒子カウンターは特にISO 21501-4基準に従う必要があり、少なくとも 年次校正[6]が求められます。これらのスケジュールを把握するために、多くの施設は自動リマインダーを送信する校正管理ソフトウェアに依存しており、締め切りが守られ、データの有効性が維持されるようにしています [6]。定期的な校正は、機器の正確な性能を維持するだけでなく、センサーのドリフトを早期に検出し、強力な品質保証体制を強化します。
機器のドリフトの検出と修正
定期的なスケジュールを超えて、校正はセンサーのドリフトを特定し対処するのに役立ちます。これは、部品の老朽化や環境要因によって発生する可能性があります[4]。
センサーが元の精度からドリフトした場合、校正は問題を特定し、複数の校正ポイントで調整を適用するのに役立ちます。このプロセスは、センサーの出力が標準に正しく一致することを保証します。調整が効果的であることを確認するために、校正手順を繰り返し、デバイスが正確な読み取りを提供していることを確認します [1].
"デバイスが正しく校正されていない場合、不正確なデータと意思決定につながる可能性があり、特に血液や薬品のような敏感な材料を扱う際には深刻な結果を招く可能性があります。" - フェルナンダ・レガレッタ、XiltriX [1]
継続的な環境モニタリングシステムは、データトレンドを分析することで、時間の経過とともにパフォーマンスのドリフトを明らかにすることもできます。これらの洞察により、コンプライアンスが損なわれないように積極的なメンテナンスが可能になります [5]。さらに、NISTトレーサビリティを検証する証明書は、監査目的において重要であり、校正の正確性を示すために必要な文書を提供します[1]。
sbb-itb-ffee270
バリデーションを使用するタイミング
初期資格と設置
バリデーションは、新しい機器を設置する際やクリーンルームを稼働させる際に重要な役割を果たします。校正が正確な測定を保証する一方で、バリデーションはさらに一歩進んで、システム全体が設計仕様に合致し、規制基準を満たしていることを確認します[2][19]。
このプロセスは通常、3つの段階に従います:IQ(設置適格性確認)は適切な設置を確認し、OQ(運用適格性確認)は異なる条件下での安定した性能を保証し、PQ(性能適格性確認)はシステムが要求される性能レベルを一貫して満たすことを確認します。これらのステップは、モニタリングシステムが信頼でき、運用に入る前に重要なクリーンルームの制御に準備ができていることを保証します [20] .
クリーンルームプロセスまたは機器の変更
クリーンルームの性能に影響を与える可能性のある重大な変更が発生した場合、再検証が必要になります。これには、主要なHVACの故障、端末フィルターの交換、非準拠問題の修正、またはモニタリング機器の移動などのイベントが含まれます。これらのシナリオのそれぞれは、環境条件が損なわれていないことを確認するために、新しい検証サイクルを必要とします[7][19].
ISO 14644-2 によれば:
"施設は...施設の運用に重大な影響を与える特別なメンテナンスの後に再評価されなければならない (i.e. 終端フィルターの交換)." - ISO 14644-2 [7]
これらの変更は、運用に影響を与えるだけでなく、規制要件を引き起こし、コンプライアンスを維持するために検証が重要なステップとなります。
規制およびコンプライアンス要件
GMP準拠の環境では、検証は単なる良い実践ではなく、法的な必要性です。培養肉を生産する施設では、例えば、バリデーションは環境条件が一貫して管理されていることを文書化された証拠として提供し、製品の安全性を確保します[20].
2022年8月22日に施行された更新されたEU GMP Annex 1は、Contamination Control Strategy (CCS)を導入しています。この戦略は、バリデーションが必要なすべての重要な管理ポイントを概説しています[6]。連続監視システムを使用する施設では、結果が一貫して許容範囲内に収まる限り、コンプライアンステストの間隔を延長することができます[6][7]。検証は、温度、湿度、差圧、粒子数などの重要なパラメータが正確に測定されることを保証し、敏感なバイオプロセス環境での汚染リスクを低減します [2][6].
プロセスと試験方法の比較
校正と検証はそれぞれ、クリーンルームのコンプライアンスを確保するために特定の役割を果たし、規制基準を満たすために異なる試験アプローチに依存しています。これらの方法は、厳格なプロトコルが遵守されなければならない培養肉のクリーンルームで特に重要です。校正は、粒子カウンター、温度センサー、湿度プローブなどの個々の機器に焦点を当て、それらの測定値を認定された基準と比較して精度を確認します [2][15]。一方、バリデーションはより広範な視点を持ち、ISO 14644-1の清浄度分類に適合していることを確認するためにクリーンルームシステム全体を評価します[7].
これらのプロセスに関する規制要件も異なります。粒子カウンターの校正は、ISO 21501-4に準拠して、空中粒子の正確なカウントとサイズ測定を保証する必要があります[6][9]。しかし、バリデーションは、清浄度分類のためのISO 14644-1と、気流速度測定や圧力差試験などの特定の手順のためのISO 14644-3に従います[7]。これらの規制は、各プロセスがどのくらいの頻度で行われるべきかも規定しています。
例えば、ISO 21501-4は、光散乱粒子カウンターの年次校正を義務付けています[6][9]。しかし、バリデーションは、より頻繁なスケジュールに従うことが多いです。ISOクラス5またはそれ以上のクリーンルームは、6ヶ月ごとに粒子濃度テストが必要ですが、ISOクラス5以上のクリーンルームは年に一度のテストが必要です[7]。その他のテスト、例えば風速、風量、圧力差の測定は通常12ヶ月ごとに検証が必要です。フィルター漏れや気流パターンの評価などのオプションテストは、24ヶ月ごとに推奨されます[7]。
キャリブレーションも信頼できる検証の前提条件です。ISO 14644-2によれば、検証中に使用されるすべての機器は、データの正確性と整合性を確保するために適切にキャリブレーションされている必要があります[7]。これがないと、検証結果が信頼できなくなり、コンプライアンスが損なわれる可能性があります[3][2]。
比較表: 試験方法と用途
| 試験タイプ | 校正用途 | 検証用途 |
|---|---|---|
| 粒子数 | 粒子カウンターの読み取り値を認定基準と比較して精度を確認[2][15] | 動的条件下での空中粒子濃度を試験し、ISO分類を認証[7] |
| フィルターの完全性 | 該当なし | フォトメーターを使用したエアロゾルチャレンジテストを実施し、HEPAフィルターの効率が99%以上であることを確認99% [15] |
| 環境チェック | キャリブレーションバスとジェネレーターを使用して温度および湿度センサーを校正する[21] | 連続監視のために校正されたデータロガーで全体的な環境条件を検証する[14][15] |
| 気流テスト | 通常は校正パラメータではありません | 風速計で風速を測定し、スモークジェネレーターで気流パターンを可視化する[21][14] |
| 圧力差 | 圧力校正器で圧力センサーを校正する[21] | ゾーン間の圧力差を1–20 mmHgに保つために、壁に取り付けられたマノメーターを使用する [14] |
培養肉バイオプロセスのクリーンルームにおける重要性
製品の安全性と品質の確保
精度は、培養肉生産における製品の安全性を確保するための基盤です。キャリブレーションとバリデーションは、わずかな環境の変動でも全体のバッチを危険にさらす可能性があるため、汚染リスクを排除するために連携します。例えば、バイオリアクター内の温度、溶存酸素(DO)、pH、グルコースレベルを監視するキャリブレーションされたセンサーは、動物細胞の増殖と成熟に必要な重要なデータを提供します[22]。これらのセンサーが正確でない場合、汚染や細胞成長の失敗のリスクが大幅に増加します[22] 。
バリデーションは、HVACシステム、空気ろ過、スタッフのプロトコルなど、クリーンルーム環境のすべての要素が、停電や頻繁なドアの開閉などの困難な条件下でも意図した通りに機能することを保証することで、キャリブレーションを補完します[1][5]。パフォーマンス適格性評価(PQ)は、実際の生産活動中にクリーンルームが安全性と品質基準を一貫して満たしていることを確認することで、さらに一歩進んでいます[5]。この綿密なアプローチは、従来の家畜農業で一般的に使用される抗生物質やホルモンを避ける培養肉の生産において特に重要です[22]。
規制遵守のサポート
規制当局は、培養肉の生産に厳格な基準を設定しており、厳しい環境管理を要求しています。ISO 14644、EU GMP 附属書 1、FDA/USDAガイドラインなどの枠組みへの準拠は、設計適格性評価(DQ)、設置適格性評価(IQ)、運用適格性評価(OQ)、およびパフォーマンス適格性評価(PQ)を含む詳細なプロトコルに依存しています[5][22] 。
規制の成功の画期的な例は、2020年12月2日に発生しました。この日、シンガポール食品庁(SFA)が、サンフランシスコに拠点を置く企業Eat Justによる培養チキンナゲットの商業販売を承認しました。この承認は、同社が厳格な安全性評価を満たした後に与えられたもので、これには生産プロセスの徹底的な監視と検証が含まれていました[22]。
「キャリブレーションとは、デバイスやセンサーの測定値を校正された基準と比較してその精度を判断するプロセスです」 - フェルナンダ・レガレッタ、XiltriX [1]
コンプライアンスの達成は、これらの高い基準を維持するための適切な機器の調達への道を開きます。
信頼できる機器の調達 Cellbase
これらの厳しい規制および運用基準を満たすには、専門的な機器へのアクセスが必要です。しかし、主流の実験室供給プラットフォームは、培養肉生産の特定のニーズに対応するための専門知識を欠いていることが多いです。ここで
このプラットフォームは、GMP準拠やバイオリアクターの互換性などの使用ケース仕様を含む厳選されたリストを提供し、チームがISO 14644基準やその他の規制要件を満たす機器を特定するのを支援します。培養肉生産の独自のニーズに焦点を当て、抗生物質を使用しない環境や正確な細胞微小環境の制御など、
結論
校正と検証は、クリーンルーム基準を維持する上で重要な役割を果たします。校正は、粒子カウンター、温度センサー、湿度モニターなどの機器が正確で追跡可能なデータを提供することを保証します[2] 。一方、検証は、クリーンルーム施設全体とそのシステムが設計仕様および規制要件に沿って運用されていることを確認します[5]。
これらのプロセスは、ISO 14644やGMPなどの国際基準を満たすための鍵です。キャリブレーションは収集されたデータの正確性を保証し、バリデーションはクリーンルーム環境が効果的に制御されていることを示します。
培養肉の生産において、厳格な環境管理は不可欠です。キャリブレーションされたセンサーは、温度、湿度、粒子レベルの正確な監視を提供し、安定した環境を確保します。同時に、バリデーションはHVACシステム、ろ過ユニット、および人員プロトコルがすべての条件下で信頼性を持って機能することを確認します。この徹底したアプローチは、現代のクリーンルーム管理の要求をサポートします。
これらの実践を進める中で、継続的な環境モニタリングは、従来の再バリデーションスケジュールに対する先進的な代替手段を提供します。リアルタイムデータは予測保守を可能にし、監査対応の環境を確保することで、施設が正式なクリーンルーム分類の間隔を延ばすことを可能にします。特定のイベントによって再検証がトリガーされるリスクベースのアプローチを採用することで、クリーンルーム管理はより柔軟で効率的になります[5].
よくある質問
なぜ培養肉の生産において、キャリブレーションよりもバリデーションが重要なのですか?
培養肉の生産において、バリデーションはキャリブレーションよりも重要です。なぜなら、機器、プロセス、ソフトウェアにわたるシステム全体が信頼性を持ち、事前に定められた基準に沿って動作することを保証するからです。キャリブレーション は、個々の機器の精度を確立された基準に対して確認することですが、バリデーションはより広範なアプローチを取ります。実際の運用条件下で、全体のプロセスが一貫して望ましい結果を達成することを確認します。
この区別は、環境要因やプロセスの正確な制御を維持することが製品の品質、安全性、規制の遵守に直接結びつく培養肉の製造において非常に重要です。検証は、すべてのコンポーネントが調和して機能することを保証し、最終製品の品質を保護し、業界の要件に準拠することを確実にします。
クリーンルームの監視機器はどのくらいの頻度で校正および検証されるべきですか?
クリーンルームの監視機器は、メーカーの推奨事項、規制基準、および特定のリスク評価に基づいて定期的に校正が必要です。このプロセスは、環境の重要性や機器の使用方法に応じて、通常は四半期ごと、半年ごと、または年に一度のスケジュールで行われます。
検証は異なる目的を持ち、機器が必要な基準に一貫して適合し、必要な基準を満たしていることを確認するために定期的に実施されます。培養肉の生産のように精度が不可欠な業界では、校正と検証の両方が厳格な品質と安全性の要件を維持する上で重要な役割を果たします。
クリーンルームでキャリブレーションとバリデーションが無視された場合、何が起こりますか?
クリーンルームでのキャリブレーションとバリデーションを怠ると、特に製薬、バイオテクノロジー、培養肉生産のような業界では、厳格な環境管理を維持することが不可欠であるため、重大な問題を引き起こす可能性があります。キャリブレーションが定期的に行われない場合、モニタリング機器は粒子数、温度、湿度、圧力などの重要な要素に対して誤った読み取りを提供する可能性があります。これにより、汚染が検出されず、製品の品質が損なわれ、規制要件を満たさない可能性があり、高額な製品リコールやコンプライアンス違反につながる可能性があります。
バリデーションも同様に重要です。これは、モニタリングシステム全体が時間の経過とともに正常に動作し続けることを確認します。検証がなければ、データの信頼性は低下し、汚染のリスクが増加し、規制違反の可能性が高まります。培養肉のような敏感な商品を生産する企業にとって、これらの不備は、バッチ全体の損失、規制罰金の発生、評判と顧客の信頼の損失を意味する可能性があります。
一貫した校正と検証は、クリーンルーム基準の維持、コンプライアンスの確保、製品の安全性と運用パフォーマンスの保護において重要な役割を果たします。











