培養肉の輸送は、世界各地の規制と安全要件の違いにより、独自の課題を抱えています。温度管理、トレーサビリティ、通関遵守などの重要な要素は地域によって異なり、物流コストやスケジュールに影響を与えます。以下はその概要です:
- アメリカ合衆国:二重機関の規制(FDAと USDA)。厳格な温度管理、詳細なトレーサビリティ、州レベルの禁止が物流を複雑にします。承認は中程度の速度ですが、費用がかかります。
- 欧州連合:新規食品分類で中央集権的な承認プロセス。承認されれば27の加盟国にアクセス可能ですが、プロセスは長期(18~36ヶ月)で高額です。一部の国での国内禁止が複雑さを増します。
- アジア太平洋:シンガポールが迅速な承認(9~12ヶ月)とカスタマイズされた安全対策でリードしています。オーストラリアとニュージーランドは統一された枠組みを共有していますが、公共の意見募集のためにスケジュールが延長されています。貿易障壁はこの地域全体で依然として課題です。
クイック比較:
| 地域 | 強み | 課題 | 承認タイムライン |
|---|---|---|---|
| アメリカ合衆国 | 確立された規制枠組み | 州レベルの禁止、高いコンプライアンスコスト | 中程度 |
| 欧州連合 | 27カ国への単一市場アクセス | 長い承認プロセス、国別の禁止 | 18–36ヶ月 |
| アジア太平洋 | シンガポールの迅速で柔軟なシステム | 貿易障壁、小規模市場 | 9–12ヶ月 (SG) |
これらの違いを理解することは、培養肉を世界的に流通させることを目指す企業にとって重要です。企業は現地の基準に合わせ、詳細な記録を維持し、複雑な貿易要件をナビゲートしてコンプライアンスを確保する必要があります。
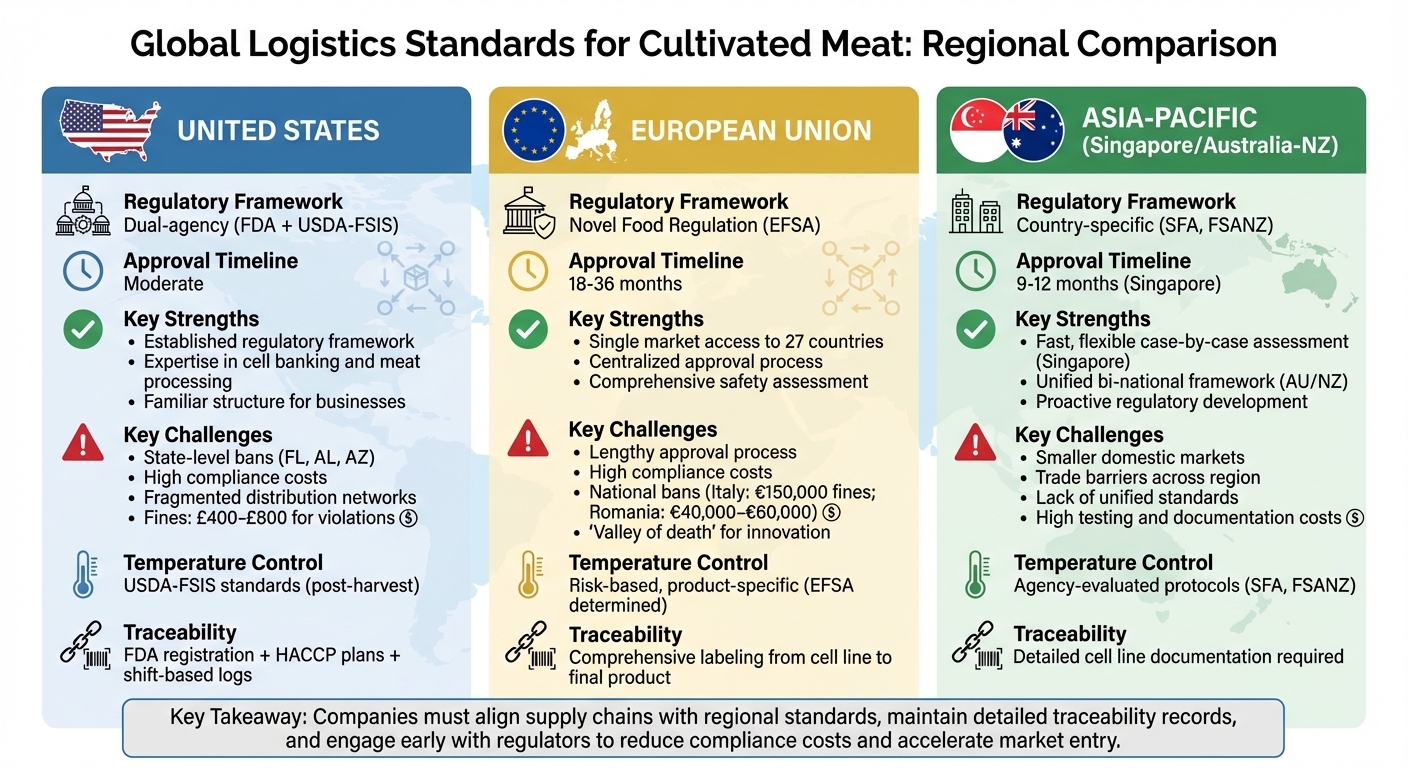
地域別のグローバル培養肉物流基準の比較
2023年業界の現状: 培養肉とシーフード
sbb-itb-ffee270
1. アメリカ合衆国の物流規制
アメリカ合衆国では、物流を規制するためにFDAとUSDA-FSISの二重機関システムを採用しており、供給チェーン全体での温度管理、トレーサビリティ、関税の管理に直接影響を与えています。FDAは、細胞の収集、バンキング、培養からバイオリアクターからのバイオマスの収穫までのプレハーベスト段階を監督します。その時点で、管轄はUSDAの食品安全検査局(FSIS)に移行し、陸上肉と家禽の基準を管理します[5][8]。
温度管理基準
収穫された培養肉は、従来の肉と同じ安全性と取り扱い要件を満たす必要があります[6]。これは、温度管理が、連邦食肉検査法 (FMIA) および 家禽製品検査法 (PPIA)[8] に記載されているように、USDA-FSISの規制の下にあることを意味します。FSISはまた、検査担当者が各シフトで少なくとも一度は業務を監視することを義務付けています [9][7]。
トレーサビリティ要件
培養肉の生産に関与する施設は、FDAに登録し、危害分析と予防管理を含む書面による食品安全計画を維持する必要があります。バイオマスが収穫された後、USDA-FSISから検査許可を取得し、オペレーターはHACCPプランを実施し、シフトごとに記録を維持する必要があります[7] [10][9]。監督を効率化するために、FDAは事前市場相談書類をUSDA-FSISと共有します。さらに、これらの製品のラベルはFSISラベリングおよびプログラム配信スタッフによって事前承認され、製品が培養肉であることを明確に示す必要があります[5][8]。この詳細なトレーサビリティプロセスは、関税と関税の課題を乗り越える上で重要な役割を果たします。
関税/タリフ
外国の輸出業者にとって、U.S市場へのアクセスを得るには、彼らの規制システムがFSISによって同等と見なされる必要があります[9][7]。このプロセスには、輸出国の規制枠組みの包括的な監査が含まれ、貿易に対する非関税障壁を作り出します。等価性が確認されると、その国はFSIS輸入ライブラリに種別ごとにリストされなければなりません。U.S。一方、輸出業者は、FSIS 9000シリーズの指令に従って、輸出認証を取得するために公衆衛生情報システム(PHIS)を使用しなければなりません[9]。これらの要件は、コンプライアンスにさらなる複雑さを加えます。
コンプライアンスコスト
二重機関の要件を満たすことは、かなりのコストを伴います。企業は、シフトベースのPHISログを維持し、すべての製品に対して事前承認されたラベルを確保し、複雑な規制枠組みをナビゲートしなければなりません[9]。インフラも課題を呈しており、従来の肉との価格均衡を達成するには、より大きなバイオリアクターやより高度な自動化などの大幅なアップグレードが必要かもしれません。サラ・ベイグ、USDAの研究、教育、経済担当次官補は次のように述べています:
細胞農業は、USDAの食品と農業システムの未来に対するビジョンに本当に適合しています[4]。
2. 欧州連合の物流基準
欧州連合(EU)は、培養肉を新規食品として分類しており、欧州食品安全機関(EFSA)による中央集権的な市場前安全性評価を受ける必要があります。これは、規則(EU)2015/2283の下で行われます。EUはリスク評価の際に予防原則を採用し、各製品に合わせた温度管理とトレーサビリティ要件を設定します。これらの詳細は、新規食品の連合リストでの製品の認可に記載されています[11]。この柔軟でリスクに基づく方法は、米国で使用されているより厳格で規範的なアプローチとは対照的です。承認プロセスは通常約18か月かかりますが、追加のデータが必要な場合は3年に延びることがあります[11].
温度管理基準
EFSAはリスク評価の際に培養肉製品の物流と温度管理基準を決定します[11]。すべての製品は一般食品法(規則(EC)No 178/2002)に従わなければならず、安全でない食品の販売を禁止しています[11]。製品の安全性に関する科学的不確実性が続く場合、予防原則に基づき、厳格な保管および輸送条件などの一時的な措置が課されることがあります。
トレーサビリティ要件
製造業者は、細胞株の識別から高度な生産システムを使用した成熟プロセスまで、生産の各段階を網羅する包括的なラベリングを提供する必要があります。これにより、完全なトレーサビリティが確保され、消費者が製品の起源や栄養情報を理解するのに役立ちます[1]。これらのラベリングルールは、透明性を保証するために製品の認可に明記されています [12]。
2024年7月、フランスの企業Gourmeyは、栽培フォアグラの規制申請を欧州委員会に提出した最初の企業となりました。このケースは、EUの枠組みにとって重要な試験となることが期待されています[11][13] 。
関税と関税
EU内の国家貿易政策は、物流にさらなる複雑さを加えます。例えば、一部の国では国際輸出業者に法的な課題をもたらす禁止措置を導入しています。イタリアの法律第172号(2023年12月)は最大€150,000の罰金を課し、ルーマニアは€40,000から€60,000の罰則を伴う法案を提案しています。輸出業者はまた、EUの厳格なラベル規則に準拠した包装と書類を確保する必要があります。
コンプライアンスコスト
新規食品の認可プロセスをナビゲートすることは高額になる可能性があり、安全性、栄養、衛生に関する詳細な書類が必要です。食品安全な成分を利用することで、これらの要件を合理化しつつコストを管理することができます。これは小規模企業にとって大きな課題となります。マーストリヒト大学のフランチェスカ・カラントーニ氏は次のように述べています:
EUの道筋は遅く、費用がかかり、特に直接的な財政的インセンティブがないことから、イノベーションにとって「死の谷」とも形容されることがあります[13] 。
しかし、進展の兆しもあります。2024年7月、ポーランドのLabFarm Sp. z o.o. は、国立研究開発センターから約200万ユーロの助成金を獲得しました。これは、中央・東欧政府による培養肉の研究開発への初の直接的な公的投資の例となりました。
3. アジア太平洋地域の物流フレームワーク
アジア太平洋地域は、培養肉の規制に向けたアプローチを着実に形成しており、各国がさまざまなフレームワークを採用しています。2025年後半までに、シンガポールとオーストラリアのみが地域内で商業販売のために培養肉を承認しており、アメリカ合衆国は規制基準のグローバルな参照点として機能しています[6].
温度管理基準
APAC規制調整フォーラムが主導する取り組みが進行中で、地域全体で文書化、トレーサビリティ、および貿易要件の統一基準を作成しています[3]。シンガポール食品庁(SFA)やオーストラリア・ニュージーランド食品基準局 (FSANZ)などの国家機関は、保管および輸送プロトコルの評価において重要な役割を果たしています。具体例として、2025年にFSANZはシドニーに拠点を置くVowの培養ウズラを6週間の公衆協議の後に承認し、地域の安全基準における重要な前例を設定しました[4] [6]。
トレーサビリティ要件
アジア太平洋市場におけるトレーサビリティは、詳細な細胞株の文書化に大きく依存しています。この文書化は、細胞の分離から最終製品までの生産プロセス全体の安全性を確保します[3]。企業は、プレマーケット承認を得るために、細胞の供給源と特性評価に関する包括的なデータを提供しなければなりません。例えば、2025年にGOOD Meatは、シンガポールで培養チキン生産における無血清培地の使用承認を得ました。このマイルストーンは、SFAのトレーサビリティ基準を満たすために広範な文書化が必要でした[6]。
韓国もまた、培養肉を成分として公式に分類するために食品衛生法を改正し、特定のプレマーケット要件を導入しました [4]。一方、日本は厚生労働省と消費者庁の二重機関監督システムをナビゲートしており、企業は規制遵守のために両機関と連携する必要があります[4]。
GFI APACのマネージングディレクターであるミルテ・ゴスカー氏は次のように述べています:GFI APAC、
日本と韓国は、APAC諸国の中で次にそのような枠組みを開発する可能性が高く、両国は業界団体からの意見を積極的に求め、明確で効率的な安全性審査プロセスを構築しようとしています。[4]
この厳格な文書化への焦点は、地域が堅牢な安全基準を確立することへのコミットメントを強調しています。
関税と関税
貿易と関税の課題は、規制の状況にさらに複雑さを加えます。国際的な製品分類基準の欠如は、アジア太平洋諸国と世界市場間で培養肉を移動させる上で重大な障害を生み出しています[3]。動物細胞の調達と特性評価は特に調整が取れておらず、貿易をさらに複雑にしています。これに対処するために、30社以上が「培養肉」という用語を標準化することに合意したMOUに署名し、消費者とのコミュニケーションを簡素化し、貿易障壁を減らすことを目指しています[6]。しかし、これらの未解決の貿易問題は、コンプライアンスの負担を増加させ続けています。
コンプライアンスコスト
地域全体で異なる食品安全規制は、コンプライアンスコストを大幅に押し上げています。企業はこれらの要求を満たすために、高度な試験、品質保証、堅牢な文書化システムに多額の投資をしなければなりません[14]。多くの業界専門家は、これらの厳しい要件に合わせた洞察と調達ソリューションを提供する
利点と欠点
このセクションでは、各地域に特有の規制上の利点と課題を分解し、培養肉の物流への影響に焦点を当てています。各地域には、培養肉に関する規制において独自の強みと課題があります。アメリカ合衆国では、FDAとUSDAの細胞バンキングと肉加工における専門知識が規制の枠組みに貢献し、企業がナビゲートしやすい構造を提供しています[15]。しかし、フロリダ、アラバマ、アリゾナのような州での禁止は、分断された流通ネットワークを生み出します。これらの禁止に違反すると、£400から£800の罰金が科される可能性があります[4]。この分断されたアプローチは、連邦の承認がある場合でも州間輸送を複雑にします。
欧州連合では、承認が得られると、製品は27の加盟国すべてにアクセスでき、広範な市場の可能性を提供します[5]。しかし、ブロックの予防的な姿勢は、コストの増加と18〜36か月かかる承認プロセスを意味し、市場参入を大幅に遅らせます[15][5]。さらに、イタリアやフランスのような国での国内禁止は、地域全体の物流計画に別の複雑さを加えます[17]。
シンガポールは、その効率的で柔軟な規制システムで際立っています。シンガポール食品庁は、ケースバイケースの安全性評価アプローチを使用して、9〜12か月以内に承認を完了することがよくあります[5]。これにより、厳格な基準ではなく、カスタマイズされた物流要件が可能になります。しかし、シンガポールの小さな国内市場は、米国やEUのような大規模市場と比較して、その物流インフラの規模を制限しています。一方、オーストラリアとニュージーランドは、両国で一貫した取り扱い基準を保証する共通の食品基準コードの恩恵を受けています [5]。この統一された枠組みは有利ですが、法定評価プロセスにはしばしば公衆の意見募集期間が含まれており、これがスケジュールを延ばすことがあります。
地域の利点と課題の簡単な比較はこちらです:
| 地域 | 主な利点 | 主な欠点 | 承認タイムライン |
|---|---|---|---|
| アメリカ合衆国 | 冷蔵チェーンの専門知識を活用した確立されたFDA/USDAの枠組み[15] | 州レベルの禁止(FL、AL、AZ)による分散した流通[4] | 中程度 |
| 欧州連合 | 承認されれば27か国への単一市場アクセス[5] | 長期の承認プロセス(18〜36か月)と高コスト[15][5] | 18〜36か月 |
| シンガポール | 迅速で柔軟なケースバイケースの評価 [5] | 小規模市場は物流インフラの規模を制限する | 9–12ヶ月 [5] |
| オーストラリア/ニュージーランド | 食品基準コードによる統一された二国間の枠組み [5] | 法定評価には公衆の意見募集期間が含まれる | 中程度 |
これらの地域比較は、企業がこれらの市場に参入する際に直面する財務および運用上の課題を浮き彫りにしています。例えば、EUの詳細な文書要件はコンプライアンスコストを増加させる一方で、米国は物流インフラへの大規模な投資を要求します[4]。これには、厳しい地域基準を満たしながらマージンを維持するためのバイオリアクター栽培コストの最適化が含まれます。
これらの規制の違いを理解することは、適応性がありコンプライアンスを満たすサプライチェーンを構築するために重要です。
結論
上記で議論された規制の状況を考えると、地域の違いを乗り越えるには、調整されたサプライチェーン戦略が必要であることは明らかです。例えば、アメリカ合衆国は二重機関システムに依存している一方で、欧州連合の新規食品規制は27の加盟国へのアクセスを提供しますが、承認プロセスは長くなります。その一方で、シンガポールのより柔軟なアプローチは、より迅速な市場参入を可能にしています。
これらの市場に進出する企業にとって、強力な食品安全システム を確立することは、サプライチェーン全体の危険を解決するための最優先事項です [2]。詳細なトレーサビリティ記録を維持し、ラベルが現地の規制に準拠していることを確認することも同様に重要です[8]。シンガポールのバーチャルクリニックや英国の細胞培養製品サンドボックス(2025年2月から2027年2月に予定)[16]などのイニシアチブを通じて早期に規制当局と関与することは、コンプライアンスコストを削減し、市場参入を迅速化するのに役立ちます。もう一つの課題は、異なる規制地域での専門的な投入物の調達です。プラットフォームのような
多様な地域基準に合致するサプライチェーンを構築することは、グローバルに拡大するために不可欠です。規制が変化し続ける中、柔軟な物流システムと信頼できる調達ネットワークを持つことが、培養肉産業の長期的な成長にとって重要です。これらの適応性があり、コンプライアンスに準拠したサプライチェーンは、成功するグローバル展開の基盤となります。
よくある質問
培養肉を米国、EU、シンガポールに出荷する前に必要な承認は何ですか?
培養肉の出荷には、各地域の規制要件を満たすという課題があります。アメリカ合衆国では、USDAとFDAの両方からの承認が必要であり、安全検査はHACCP原則に基づいて行われます。欧州連合では、製品は新規食品規則の下で評価され、詳細な安全性評価が必要です。一方、シンガポールでは、厳格な安全性評価とライセンスを含む規制承認が求められています。これらのプロセスは、すべての製品が市場に出る前に厳しい安全性と検査基準を満たすことを保証するために実施されています。
これらの地域での培養肉に関する温度管理規則はどのように異なりますか?
培養肉に関する温度管理規則は地域によって異なります。EUでは、培養肉は新規食品のカテゴリーに分類されており、安全な消費を確保するために生産および保管中に厳しい温度ガイドラインを遵守する必要があります。同様に、米国と英国では、食品安全規制が危険を防ぐための重要な要素として温度管理の重要性を強調しています。特定のアプローチは異なる場合がありますが、すべての地域が共通して注力しているのは、汚染を避け、食品安全基準を維持するための適切な温度管理です。











