Het valideren van groeimedia is een verplichte stap voor bedrijven die gekweekt vlees produceren en goedkeuring willen verkrijgen op de Britse markt. Dit proces waarborgt de veiligheid, kwaliteit en naleving van producten onder strikte regelgevende kaders zoals de Britse Novel Food Regulations (EU 2015/2283). Dit is wat u moet weten:
- Belangrijkste Vereisten: Groeimedia moeten voldoen aan normen voor toxicologie, contaminatiecontrole, voedingskwaliteit en allergeniciteit.
- Britse Regels: De Food Standards Agency (FSA) vereist naleving van HACCP-principes en classificatie onder Producten van Dierlijke Oorsprong (POAO).
- Wereldwijde Normen: Hoewel het VK en de EU vergelijkbare kaders delen, volgt de VS CGMP-regelgeving onder de FD&C Act.
- Validatieproces: Omvat grondige tests van samenstelling, zuiverheid, functionaliteit en naleving door leveranciers, samen met robuuste documentatie.
- Ondersteuningsinitiatieven: De Britse £1,6 miljoen regelgevende sandbox, gelanceerd in 2025, helpt bedrijven om aan deze normen te voldoen.
Een goede validatie zorgt voor veiligheid, bouwt vertrouwen op en stemt overeen met wettelijke vereisten. Het artikel gaat dieper in op het stapsgewijze proces, inclusief testmethoden, kwalificaties van leveranciers en tips voor regelgevende indieningen.
Regelgevende normen voor groeimedia
Normen en richtlijnen
Groeimedia, een cruciaal onderdeel in de productie van gekweekt vlees, moeten voldoen aan strenge internationale regelgevende normen. Deze normen variëren per regio, elk met specifieke vereisten voor samenstelling, veiligheid en zuiverheid.
In het Verenigd Koninkrijk wordt groeimedia gereguleerd onder de Novel Food Regulations (geassimileerde Verordening (EU) 2015/2283). Voordat het op de markt wordt goedgekeurd, is een grondige veiligheidsbeoordeling vereist [1]. De Food Standards Agency (FSA) classificeert celgekweekte producten als Producten van Dierlijke Oorsprong (POAO) onder Verordening (EG) 853/2004. Deze classificatie verplicht producenten om voedselveiligheidsbeheersystemen te implementeren op basis van de principes van Hazard Analysis and Critical Control Points (HACCP) [3]. De FSA is ook bezig met het ontwikkelen van gedetailleerde technische richtlijnen over de samenstelling van groeimedia, met verdere updates verwacht [1]. Deze kaders vormen de basis voor meer specifieke regelgevende vereisten.
In de Verenigde Staten verschilt de aanpak.Groei-mediacomponenten moeten voldoen aan de eisen van de Current Good Manufacturing Practice (CGMP) zoals uiteengezet in Sectie 501(a)(4)(B) van de Federal Food, Drug, and Cosmetic Act (FD&C Act) [4]. De FDA categoriseert mediacomponenten als "benodigdheden en reagentia", die worden gereguleerd door 21 CFR delen 210 en 211. Deze componenten moeten een kwaliteitsverificatie ondergaan om besmetting te voorkomen [4]. Interessant is dat synthetische componenten van gekweekt vleesmedia - zoals aminozuren, vitaminen en zouten - vaak worden geclassificeerd als Klasse I medische hulpmiddelen onder 21 CFR 864.2220, waardoor ze zijn vrijgesteld van de vereisten voor premarket notificatie [6][7].
In de Europese Unie komt het regelgevingskader nauw overeen met dat van het VK, aangezien het ook de Verordening (EU) 2015/2283 volgt.De European Food Safety Authority (EFSA) houdt toezicht op het autorisatieproces [1]. Volgens de ICH Q6B-richtlijnen worden groeimediacomponenten, waaronder antibiotica, inductoren en andere bestanddelen, behandeld als procesgerelateerde onzuiverheden. Deze onzuiverheden moeten worden gecontroleerd en teruggebracht tot acceptabele niveaus [5]. Waar mogelijk moeten hulpstoffen en reagentia voldoen aan farmacopeestandaarden [5].
| Rechtsgebied | Primaire Regeling | Classificatie | Veiligheidssysteem | Media Toezicht |
|---|---|---|---|---|
| Verenigd Koninkrijk (GB) | Gassimileerde Regeling (EU) 2015/2283 [1] | Product van Dierlijke Oorsprong (POAO) [3] | HACCP (Reg 852/2004) [3] | FSA/FSS Sandbox Richtlijnen [1] |
| Europese Unie / NI | Regeling (EU) 2015/2283 [1] | Product van Dierlijke Oorsprong (POAO) [3] | HACCP (Reg 852/2004) [3] | EFSA Autorisatieproces [1] |
| Verenigde Staten | FD&C Act Sectie 501(a)(4)(B) [4] | Nieuw Diergeneesmiddel / Voedsel [4] | CGMP (21 CFR 210/211) [4] | FDA CVM / USDA-FSIS [4] |
Regelgevende Vereisten voor Gekweekt Vlees
Producenten van gekweekt vlees moeten ervoor zorgen dat elke partij groeimedia voldoet aan strikte veiligheids- en kwaliteitsnormen.Validatie van groeimedia is een belangrijk aspect van het bredere regelgevingskader voor deze producten. Onder HACCP-principes (Verordening (EG) 852/2004) wordt groeimedia geïdentificeerd als een primaire input en een potentiële bron van besmetting - chemisch, microbiologisch of anderszins [3]. De FSA benadrukt deze zorg:
"De belangrijkste gevaren bij de productie van celgekweekte producten betreffen de identiteit van de cellijn (en consistentie), gevaren die tijdens het productieproces worden geïntroduceerd (microbiologische besmetting, groeimedia en resterende componenten in het eindproduct), en allergenen." [3]
Als er wijzigingen zijn in de samenstelling van het groeimedia, is een onmiddellijke HACCP-herziening vereist [3].In het Verenigd Koninkrijk moet validatie plaatsvinden voor implementatie om de nauwkeurigheid van stroomdiagrammen en de effectiviteit van beheersmaatregelen te waarborgen [3].
In de Verenigde Staten eist de FDA dat alle reagentia en mediacomponenten voldoen aan strenge kwaliteitsnormen om te voorkomen dat schadelijke stoffen worden geïntroduceerd [4]. Leveranciers en contractlaboratoria moeten zich houden aan CGMP-voorschriften, en elke leverancier die niet voldoet, moet worden verwijderd om te voorkomen dat producten als "vervalst" worden geclassificeerd [4]. De FDA benadrukt het belang hiervan:
"Alle nieuwe diergeneesmiddelen, inclusief ACTP's, moeten worden vervaardigd in overeenstemming met CGMP om ervoor te zorgen dat dergelijke geneesmiddelen voldoen aan de vereisten van de Federal Food, Drug, and Cosmetic Act (FD&C Act) met betrekking tot veiligheid." [4]
Momenteel werken verschillende bedrijven die deelnemen aan de Britse regelgevende sandbox - zoals BlueNalu, Gourmey, Hoxton Farms, Mosa Meat, Roslin Technologies, Vital Meat, en Vow - samen met de FSA om deze technische normen te verfijnen [1]. Onder de Britse regelgeving kunnen bedrijven tot vijf jaar gegevensbescherming aanvragen voor vertrouwelijke informatie die tijdens het autorisatieproces wordt ingediend [1].
Stappen voor het valideren van groeimedia
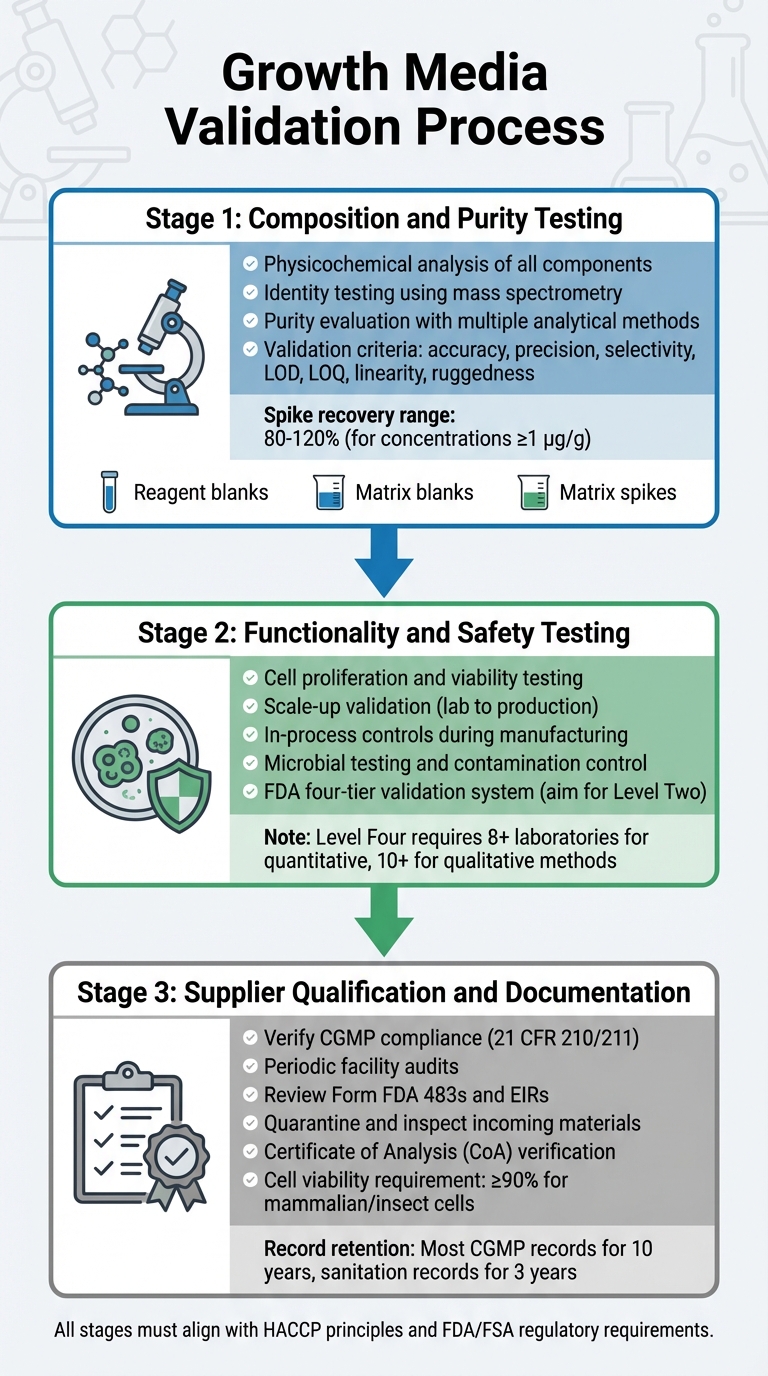
Validatieproces van groeimedia voor gereguleerde goedkeuring van gekweekt vlees
Het valideren van groeimedia omvat een gedetailleerd proces dat de samenstelling, functionaliteit, veiligheid en naleving door leveranciers onderzoekt. Elke stap bouwt voort op de vorige, wat zorgt voor een robuust validatieproces dat in lijn is met de regelgevingseisen. Dit omvat testen op samenstelling, functionaliteit en naleving door leveranciers.
Samenstelling- en zuiverheidstesten
De eerste fase richt zich op een grondige fysisch-chemische analyse van elk onderdeel. Dit omvat het identificeren van de precieze samenstelling, fysieke eigenschappen en moleculaire structuur van ingrediënten zoals aminozuren, vitaminen en anorganische zouten [5].Om moleculaire structuren te bevestigen, maakt identiteitstesten gebruik van zeer specifieke methoden, waaronder fysisch-chemische, biologische en immunochemische technieken. Hulpmiddelen zoals massaspectrometrie worden gebruikt om moleculaire identiteiten te verifiëren via hun fragmentatiepatronen [8].
Zuiverheidsevaluatie vereist meerdere analytische methoden om gewenste componenten van onzuiverheden te scheiden. Deze tests moeten zowel procesgerelateerde als productgerelateerde onzuiverheden aanpakken [5]. Analytische technieken moeten voldoen aan strikte validatiecriteria, waaronder nauwkeurigheid, precisie, selectiviteit, detectielimieten (LOD), kwantificatielimieten (LOQ), lineariteit en robuustheid [8]. Validatieprotocollen moeten ook bevatten:
- Reagensblanco's om ervoor te zorgen dat reagentia vrij zijn van analyten.
- Matrix blanks om te bevestigen dat de monsteromgeving niet interfereert.
- Matrix spikes om herstel en nauwkeurigheid te schatten.
Voor kwantitatieve methoden bij concentraties van 1 µg/g (ppm), liggen acceptabele spike-herstelpercentages doorgaans tussen 80% en 120% [8].
Om consistentie te behouden, moeten fabrikanten interne primaire referentiematerialen vaststellen die zijn afgeleid van productie-representatieve partijen. Deze dienen als traceerbare standaarden voor het kalibreren van werkende referentiematerialen [5]. Zodra de zuiverheidstests zijn voltooid, moet het medium zijn vermogen aantonen om effectieve celgroei te ondersteunen en aan veiligheidsnormen te voldoen.
Functionaliteit en Veiligheidstesten
Na bevestiging van de samenstelling moet het medium zijn effectiviteit bewijzen in het ondersteunen van de productie van gekweekt vlees. Dit omvat het aantonen dat cellen kunnen prolifereren, levensvatbaarheid behouden en kunnen opschalen van laboratoriumomstandigheden naar productieniveaus. De FDA vereist in-proces controles tijdens de productie, te beginnen bij vroege stadia zoals celpassage en oogsten, om productconsistentie en veiligheid te waarborgen [4].
Veiligheidsvalidatie omvat rigoureuze microbiële testen en besmettingscontrole, zoals uiteengezet in de pre-market evaluaties van de FDA [9].
De FDA gebruikt een vier-niveausysteem voor chemische methodevalidatie, variërend van Niveau Eén (nood- of beperkt gebruik) tot Niveau Vier (volledige collaboratieve studies die voldoen aan AOAC/ISO-normen) [8].Voor routinematige regelgevende tests, streef naar Niveau Twee validatie door een enkel laboratorium, wat een uitgebreide prestatie-evaluatie omvat [8]. Volledige samenwerkingsstudies voor kwantitatieve methoden vereisen deelname van ten minste acht laboratoria, terwijl kwalitatieve methoden tien nodig hebben [8]. Zodra de prestaties van het medium zijn gevalideerd, is het essentieel om ervoor te zorgen dat alle grondstoffen afkomstig zijn van conforme leveranciers.
Leverancierskwalificatie en documentatie
Fabrikanten moeten samenwerken met geverifieerde, CGMP-conforme leveranciers. Leveranciers moeten voldoen aan de normen uiteengezet in 21 CFR 210/211 [4]. Verificatie omvat periodieke audits van de faciliteiten van de leverancier om de naleving van kwaliteitsprogramma's, procedures en algehele CGMP-naleving te beoordelen [4].
Voordat u contracten aangaat, controleer de nalevingsgeschiedenis van een leverancier, inclusief Formulier FDA 483s en Establishment Inspection Reports (EIRs) [4]. De FDA benadrukt deze verplichting:
"Voordat u een contract, overeenkomst of andere regeling aangaat met een andere vestiging om een productiestap voor u uit te voeren, dient u te verifiëren dat de vestiging voldoet aan de toepasselijke regelgevende CGMP." [4]
Alle inkomende materialen moeten in quarantaine worden geplaatst en geïnspecteerd voordat ze worden vrijgegeven, om ervoor te zorgen dat ze voldoen aan de hoofdspecificaties [10]. Leveranciers zijn verplicht een Certificaat van Analyse (CoA) of traceerbare, CGMP/GLP-conforme testresultaten te verstrekken [10].Voor stabiele cellijnen moet de documentatie een traceerbare kloningsgeschiedenis bevatten [10]. Zoogdier- of insectencellen vereisen doorgaans ten minste 90% levensvatbaarheid voor acceptatie in CGMP-projecten [10]. Records moeten worden bewaard volgens de richtlijnen van de regelgeving [4].
Contracten moeten duidelijk de CGMP-verantwoordelijkheden omschrijven en vereisen dat leveranciers fabrikanten op de hoogte stellen van eventuele voorgestelde wijzigingen in testkits of methodologieën [4]. Als testen worden uitbesteed, zorg ervoor dat contractlaboratoria gevalideerde analytische methoden gebruiken en FDA-geregistreerd zijn [4].
Voorbereiden van Regelgevende Indieningsdocumenten
Zodra uw groeimedia is gevalideerd, is de volgende stap het samenstellen van een dossier dat aantoont dat aan alle veiligheids- en kwaliteitsnormen van de FDA en USDA-FSIS wordt voldaan. Dit dossier dient als een cruciale schakel tussen validatie en regelgevende naleving, waardoor autoriteiten een duidelijk beeld krijgen van de veiligheid en productieprocessen van uw media.
Vereiste Elementen van een Indieningsdossier
Uw dossier moet een gedetailleerde uitsplitsing van de mediacompositie bevatten, met een lijst van alle aminozuren, vitaminen, anorganische zouten en groeifactoren. FDA-richtlijnen benadrukken dat het beoordelingsproces niet alleen het medium zelf evalueert, maar de gehele productie workflow. Dit omvat de oprichting van cellijnen en banken, implementatie van productiecontroles en verificatie van alle componenten en inputs [11].
Bovendien moet het dossier een grondige veiligheids- en toxicologische beoordeling bevatten, die de voedselveiligheid van het gekweekte materiaal en al zijn inputs aantoont. Voeg productieregistraties, procesvalidatiegegevens en documentatie van het kwaliteitsprogramma toe om aan te tonen dat uw productie consistent en vrij van verontreinigingen is.
U moet ook leverings- en reagensverificatierecords verstrekken, die validatie tonen voor alle materialen die in het medium worden gebruikt, inclusief die in eigen huis zijn bereid. Voor producten die worden gereguleerd door de USDA-FSIS, voeg HACCP-plannen en sanitaire protocollen toe. De FDA adviseert om de meeste CGMP-records ten minste 10 jaar te bewaren, terwijl faciliteitsschoonmaak- en sanitatierapporten minimaal 3 jaar moeten worden bewaard [4]. Dit sluit aan bij inspanningen voor leverancierskwalificatie, waarbij wordt gegarandeerd dat alle inputs voldoen aan CGMP- en regelgevingsvereisten.
Documentatie van Faciliteitsnaleving
Voordat faciliteiten gekweekt vlees voor menselijke consumptie produceren, verwerken of opslaan, moeten ze zich registreren bij de FDA [12]. Uw documentatie moet een uitgebreid voedselveiligheidsplan bevatten dat risicoanalyse (biologisch, chemisch en fysiek), preventieve controles (zoals sanering, allergenenbeheer en maatregelen in de toeleveringsketen) en toezichtprocedures behandelt [12].
Media-vulsimulaties zijn ook een belangrijke vereiste. Deze omvatten 14-daagse incubatie- en groeibevorderingstests om aseptische praktijken te bevestigen.Zoals de FDA uitlegt:
"De media-invulling moet de aseptische montage en werking van de kritische (steriele) apparatuur evalueren, de operators kwalificeren en hun techniek beoordelen, en aantonen dat de omgevingscontroles adequaat zijn" [2].
Zorg ervoor dat uw dossiers gegevens over leverancierskwalificatie bevatten, zoals tests die zijn uitgevoerd op de eerste drie batches van een medium van een leverancier om te bevestigen dat ze overeenkomen met het analysecertificaat. Andere essentiële dossiers omvatten logboeken van omgevingscontroles, kalibratieschema's van apparatuur en gegevens over temperatuurmonitoring. Voor USDA-gereguleerde processen, bereid HACCP-plannen voor, geschreven standaardprocedures voor sanitaire voorzieningen (SSOP's) en terugroepprocedures [12][13].
sbb-itb-ffee270
Gebruik Cellbase voor Regelgeving-Conforme Inkoop van Groeimedia
Geverifieerde Leveranciers voor Gekweekt Vlees
Zodra je je groeimediaformulering hebt gevalideerd, is de volgende stap het inkopen van componenten die voldoen aan de regelgeving. Dit is niet zo eenvoudig als bestellen bij generieke leveranciers. Voor celgekweekte producten gelden strikte hygiënevoorschriften, en elk groeimediacomponent moet worden geleverd met specifieke documentatie voor goedkeuring door de regelgeving [3]. Daar komt
Inkoopfuncties
Het platform biedt ook transparante prijzen en een directe berichtenfunctie, waarmee teams snel offertes, analysecertificaten en andere regelgevende documenten kunnen aanvragen.Door deze kritieke inkoopfuncties te consolideren in één systeem dat is afgestemd op de productie van gekweekt vlees, vereenvoudigt
Conclusie
Het valideren van groeimedia voor wettelijke goedkeuring is niet alleen een formaliteit - het is een wettelijke vereiste voor de introductie van gekweekte vleesproducten op de Britse markt. Dit omvat grondige tests op samenstelling en zuiverheid, het implementeren van een sterk HACCP-plan en het bijhouden van gedetailleerde documentatie in elke stap van het proces.
"Voedsel mag niet op de markt worden gebracht als het onveilig is. Dit betekent dat het noch schadelijk voor de gezondheid, noch ongeschikt voor menselijke consumptie is." - Food Standards Agency [3]
De £1 van de UK Food Standards Agency.6 miljoen Regulatory Sandbox benadrukt zijn toewijding om samen te werken met spelers uit de industrie om duidelijke technische richtlijnen op te stellen voor de samenstelling van groeimedia [1]. Bedrijven die nu prioriteit geven aan juiste validatie zullen in een sterkere positie verkeren wanneer deze richtlijnen volledig zijn gedefinieerd.
Voldoen aan nalevingsnormen gaat niet alleen over het afvinken van regelgevende vakjes - het gaat om het verdienen van consumentenvertrouwen en het waarborgen van productveiligheid. Strenge kwaliteitstests staan centraal in zowel regelgevende goedkeuring als het verkrijgen van marktacceptatie. Om het autorisatieproces te stroomlijnen, richt u zich op het opbouwen van sterke validatieprotocollen, het bijhouden van nauwkeurige gegevens en het samenwerken met betrouwbare leveranciers. Deze stappen zullen niet alleen de goedkeuring vereenvoudigen, maar ook de weg vrijmaken voor groter consumentenvertrouwen.
Veelgestelde vragen
Wat zijn de belangrijkste stappen om groeimedia te valideren voor goedkeuring door de regelgeving?
Het valideren van groeimedia voor goedkeuring door de regelgeving draait om het bewijzen dat de formulering veilig, betrouwbaar en geschikt is voor de productie van gekweekt vlees. Zo ziet het proces er meestal uit:
- Risicobeoordeling: Begin met het definiëren van de celijn die je zult gebruiken, de doelen van het product en de kritische kwaliteitskenmerken (zoals pH of voedingsstofsamenstelling). Identificeer eventuele potentiële gevaren, zoals microbiële besmetting, en stel maatregelen op om deze risico's te beheersen.
- Testen en specificaties: Stel duidelijke acceptatiecriteria vast voor factoren zoals steriliteit, zuiverheid en potentie. Gebruik gevestigde testmethoden om ervoor te zorgen dat aan deze normen consistent wordt voldaan.
- Validatiestudies: Voer grondige procesvalidatie uit, inclusief het kwalificeren van apparatuur en het testen van meerdere batches, om te bevestigen dat de resultaten reproduceerbaar en consistent zijn.
- Stabiliteitstesten: Controleer hoe het medium zich in de loop van de tijd houdt door de kwaliteit gedurende de beoogde houdbaarheid onder juiste opslagomstandigheden (meestal 2–8 °C) te beoordelen.
- Documentatie: Verzamel alles in een uitgebreid validatiedossier. Dit moet alle testresultaten en analyses bevatten om aan de wettelijke vereisten te voldoen.
Door zorgvuldig elk van deze stappen aan te pakken, verzamelt u het bewijs dat nodig is om aan te tonen dat het medium voldoet aan de veiligheids- en kwaliteitsnormen die vereist zijn voor de productie van gekweekt vlees.
Wat zijn de belangrijkste verschillen tussen de Britse en Amerikaanse regelgeving voor groeimedia die worden gebruikt in gekweekt vlees?
In het Verenigd Koninkrijk valt de regelgeving voor groeimedia voor gekweekt vlees onder de Novel Foods Regulation (EU Regulation 2015/2283), die is behouden in de Britse wetgeving. Elk groeimedium dat wordt gebruikt in producten die vóór 15 mei 1997 niet algemeen werden geconsumeerd, moet een formele nieuw-voedselbeoordeling ondergaan door de Food Standards Agency (FSA). Dit proces vereist het indienen van gedetailleerde documentatie, inclusief informatie over de samenstelling, oorsprong en zuiverheid van het medium. Bovendien is een HACCP-gebaseerde risicoanalyse noodzakelijk om aan te tonen hoe verontreinigingen worden beheerst tijdens het celkweekproces.
Sinds december 2025 heeft de FSA een Cell-Cultivated Products sandbox geïmplementeerd. Dit initiatief biedt begeleiding en ondersteunt snellere gegevensverzameling voor nieuw-voedseltoepassingen.Om definitieve goedkeuring te verkrijgen, moeten bedrijven een uitgebreid dossier indienen dat de veiligheid van het medium, consistentie en validatie van de productie behandelt. Pas na deze goedkeuring kan het product in Groot-Brittannië worden verkocht.
Daarentegen heeft de Verenigde Staten geen specifiek nieuw-voedselkader dat is afgestemd op groeimedia, waardoor directe regelgevende vergelijkingen uitdagend zijn. Voor in het VK gevestigde bedrijven kan het verkrijgen van mediacomponenten die al aan deze strenge normen voldoen, het goedkeuringsproces vereenvoudigen.
Hoe ondersteunt de Britse regelgevende sandbox de validatie van groeimedia?
De regelgevende sandbox van het VK voor gekweekte producten biedt een goed georganiseerde omgeving waar bedrijven hun groeimediaformuleringen kunnen testen en verfijnen. Onder toezicht van de Food Standards Agency (FSA) en Food Standards Scotland (FSS) loopt dit programma in fasen van zes maanden. Gedurende deze tijd kunnen bedrijven veiligheidstests uitvoeren, risicobeoordelingen uitvoeren en documentatie beoordelen, terwijl ze waardevolle feedback van regelgevers ontvangen.
Deze praktische benadering maakt praktische proeven en stapsgewijze verbeteringen mogelijk, waardoor de verzameling van veiligheidsgegevens wordt versneld en bedrijven worden geholpen om aan de regelgevende vereisten te voldoen. Voor degenen die werken aan gekweekt vlees, kan het verkrijgen van vooraf goedgekeurde groeimedia via











