Die Skalierung von Bioreaktoren für die Produktion von kultiviertem Fleisch - von kleinen (1–5 L) zu großen (1.000+ L) Systemen - bringt Energieherausforderungen mit sich. Größere Volumina erfordern mehr Energie für das Mischen, den Sauerstofftransfer und die Wärmeregulierung, bieten jedoch auch Effizienzvorteile. Beispielsweise kann der Übergang von 5 m³ zu 100 m³ den spezifischen Energieverbrauch um bis zu 88 % reduzieren. Allerdings kann langsameres Mischen in großen Systemen Sauerstoff- und Nährstoffungleichgewichte verursachen, die das Zellwachstum beeinträchtigen. Automatisierte Steuerungssysteme und Strategien wie der Betrieb im "Flutpunkt" helfen, den Energieverbrauch auszugleichen und die Zellviabilität zu erhalten. Folgendes sollten Sie wissen:
- Kleinmaßstäbliche Bioreaktoren: Hoher Energieverbrauch pro Liter, schnelles Mischen, einfachere Wärmeabfuhr, aber nicht ideal für die Großproduktion.
- Großmaßstäbliche Bioreaktoren: Niedrigerer Energieverbrauch pro Liter, langsameres Mischen, komplexere Wärme- und Gasmanagement, aber besser für die kommerzielle Produktion.
Energieeffizienz verbessert sich mit der Skalierung, aber die Aufrechterhaltung der Zellqualität erfordert fortschrittliche Automatisierung und präzise Kontrolle von Rühren, Belüftung und Temperatur.
Fermentationsprozessdesign und -skalierung: Upstream Processing (USP)
sbb-itb-ffee270
1. Kleinmaßstäbliche Bioreaktoren (1–5 L)
Laborbioreaktoren arbeiten unter sehr unterschiedlichen Energiebedingungen im Vergleich zu ihren industriellen Gegenstücken. In diesem kleineren Maßstab wird die Leistung von Prozessen im Allgemeinen mehr von Zellkinetik als von Transportphänomenen beeinflusst [2]. Das hohe Verhältnis von Oberfläche zu Volumen erleichtert die Wärmeabfuhr, bedeutet jedoch auch, dass Rührparameter nicht direkt auf größere Systeme skaliert werden können. Diese Dynamik führt oft dazu, dass Rühren der Haupttreiber des Energieverbrauchs in dieser Phase ist.
In kleinmaßstäblichen Systemen wird der Energieverbrauch weitgehend durch Rühren und Mischen bestimmt.Um die gleiche volumetrische Leistungsaufnahme (P/V) wie größere Bioreaktoren zu erreichen, benötigen kleinere Bioreaktoren höhere Rührerdrehzahlen aufgrund ihrer kleineren Rührerdurchmesser [2][9]. Für Säugetierzellkulturen - entscheidend in der Produktion von kultiviertem Fleisch - ist ein P/V von 20–40 W/m³ typischerweise optimal. Dieser Bereich unterstützt das Zellwachstum und minimiert gleichzeitig die Zellaggregation [5].
Die Belüftung fügt eine weitere Komplexitätsebene hinzu. Der volumetrische Stoffübergangskoeffizient (kLa) misst, wie effizient Sauerstoff die Zellen erreicht. Eine Erhöhung der Durchmischung zur Verbesserung des kLa kann jedoch auch den hydromechanischen Scherstress erhöhen. Für scherempfindliche Prozesse, wie die Lentivirusproduktion, werden oft offene Rohrbelüfter bevorzugt, da Mikrosparger die funktionalen viralen Titer um bis zu 25% reduzieren können [5].Der Betrieb nahe am Flutpunkt, mit geringerer Durchmischung und höherer Belüftung, kann helfen, den Energieverbrauch auszugleichen und gleichzeitig den Sauerstoffübertragungsbedarf zu decken [1].
Das Wärmemanagement in diesen Bioreaktoren wird typischerweise durch wasserbasierte Kühlsysteme, wie Jacken oder interne Spulen, gehandhabt, um überschüssige Wärme abzuleiten. Jedes Watt mechanischer Durchmischung erzeugt Wärme, die effizient entfernt werden muss. Zusätzlich erzeugt die mikrobielle Stoffwechselaktivität etwa 14,7 kJ Wärme pro Gramm verbrauchten Sauerstoff [7]. Die benötigte Kühlleistung hängt von der insgesamt erzeugten Wärme und der Effizienz des Kühlsystems ab, mit einem typischen Leistungskoeffizienten von etwa 0,6. Die Anpassung der Rührereinstellungen während verschiedener Phasen eines Chargenbetriebs kann den Energieverbrauch erheblich reduzieren [7].
Moderne Bioreaktoren im kleinen Maßstab sind mit Automatisierungssystemen ausgestattet, die Sensoren und Algorithmen verwenden, um pH-Wert, Sauerstoffgehalt und Temperatur dynamisch zu regulieren. Diese Systeme stellen sicher, dass während jeder Wachstumsphase nur die notwendige Kühlung oder Bewegung angewendet wird, wodurch Energieverschwendung reduziert wird [6][10]. Für Unternehmen, die kultiviertes Fleisch herstellen und über Plattformen wie
2.Großmaßstäbliche Bioreaktoren (1.000+ L)
Beim Hochskalieren der Produktion nehmen die Herausforderungen zu, da sich die Mischzeiten erheblich verlängern - von nur 10 Sekunden in kleinen 3-Liter-Systemen auf deutlich längere 80–180 Sekunden in riesigen Behältern von 5.000 bis 20.000 Litern. Diese langsameren Mischzeiten schaffen betriebliche Hürden, wie gelöste Sauerstoffgradienten und metabolische Verschiebungen, die die lebensfähige Zelldichte in der stationären Phase um bis zu 15 % reduzieren können [4]. Bei Säugetierzellkulturen, die in der Produktion von kultiviertem Fleisch verwendet werden, kann das Überschreiten einer Mischzeitgrenze von 90 Sekunden metabolische Veränderungen auslösen, die zur Ansammlung von Laktat führen [4]. Um diese Probleme zu lösen, sind Anpassungen der Rühr- und Belüftungsstrategien in größeren Maßstäben unerlässlich.
Bei diesen größeren Volumina verschieben sich die Energieanforderungen. Zunächst spielt die Rührung eine größere Rolle im Energieverbrauch, wenn die Sauerstoffübertragungsraten niedrig sind.Allerdings wird bei beschleunigtem Zellwachstum die Belüftung zum dominierenden Faktor und macht bis zu 70 % des Energieverbrauchs aus. Der Betrieb in der Nähe des Flutpunktes - ein Punkt, an dem der Gasfluss die Flüssigkeitsmischung stört - bleibt entscheidend, aber in diesem Maßstab geht es hauptsächlich darum, die Energielast durch Belüftung zu verwalten. Die Erhöhung des Kopfraumdrucks ist eine weitere effektive Taktik, da sie die Sauerstofflöslichkeit erhöht und die Notwendigkeit hoher Rührgeschwindigkeiten verringert, wenn die Sauerstoffübertragungsraten hoch sind [9].
Das Wärmemanagement wird in größerem Maßstab ebenfalls komplexer, bietet jedoch Möglichkeiten für eine höhere Effizienz. Beispielsweise zeigen industrielle Fermentationen eine breite Palette von Leistungsanforderungen: Die Itaconsäure-Fermentation benötigt durchschnittlich 0,51 kW/m³, während die Lysinproduktion, die mehr Sauerstoff erfordert, 2,61 kW/m³ benötigt [1]. Kühlsysteme erreichen typischerweise eine Kühleffizienz von etwa 0.6, obwohl unter idealen Bedingungen die Leistungskoeffizienten bis zu 8,6 erreichen können [7].
Die Skalierung von 5 m³ auf 100 m³ kann die spezifischen Leistungsanforderungen um bis zu 88 % senken, vorausgesetzt, die Abläufe sind optimiert [9]. Dies ist entscheidend für die Produktion von kultiviertem Fleisch, bei der es darauf ankommt, Energieeffizienz mit der Aufrechterhaltung der Produktqualität in Einklang zu bringen. Mechanistische Modellierung ermöglicht es Produktionsteams nun, die Wärmeerzeugung und den Energiebedarf vorherzusagen, indem sie mikrobielle Wachstumsdaten mit thermodynamischen Modellen kombinieren [9][1]. Für Unternehmen im Bereich kultiviertes Fleisch, die groß angelegte Systeme über Plattformen wie
Um die Energieeinsparungen vollständig auszuschöpfen, müssen optimierte physikalische Parameter mit präziser Automatisierung kombiniert werden. Automatisierungssysteme in diesem Umfang müssen mehrere Anforderungen effektiv bewältigen. Eine Strategie besteht darin, den Fermentationsprozess in Intervalle zu unterteilen, in denen die Rührwerksleistung konstant bleibt, während der Luftstrom angepasst wird, um den Sauerstoffverbrauch zu decken und den Energieverbrauch zu minimieren [7]. Moderne Steuerungssysteme überwachen auch die gelösten Sauerstoffwerte in Echtzeit und passen sowohl mechanische als auch pneumatische Einstellungen dynamisch an, um die Stoffwechselstörungen zu verhindern, die auftreten, wenn die Mischzeiten die physiologischen Grenzen überschreiten [4] .
Vorteile und Nachteile
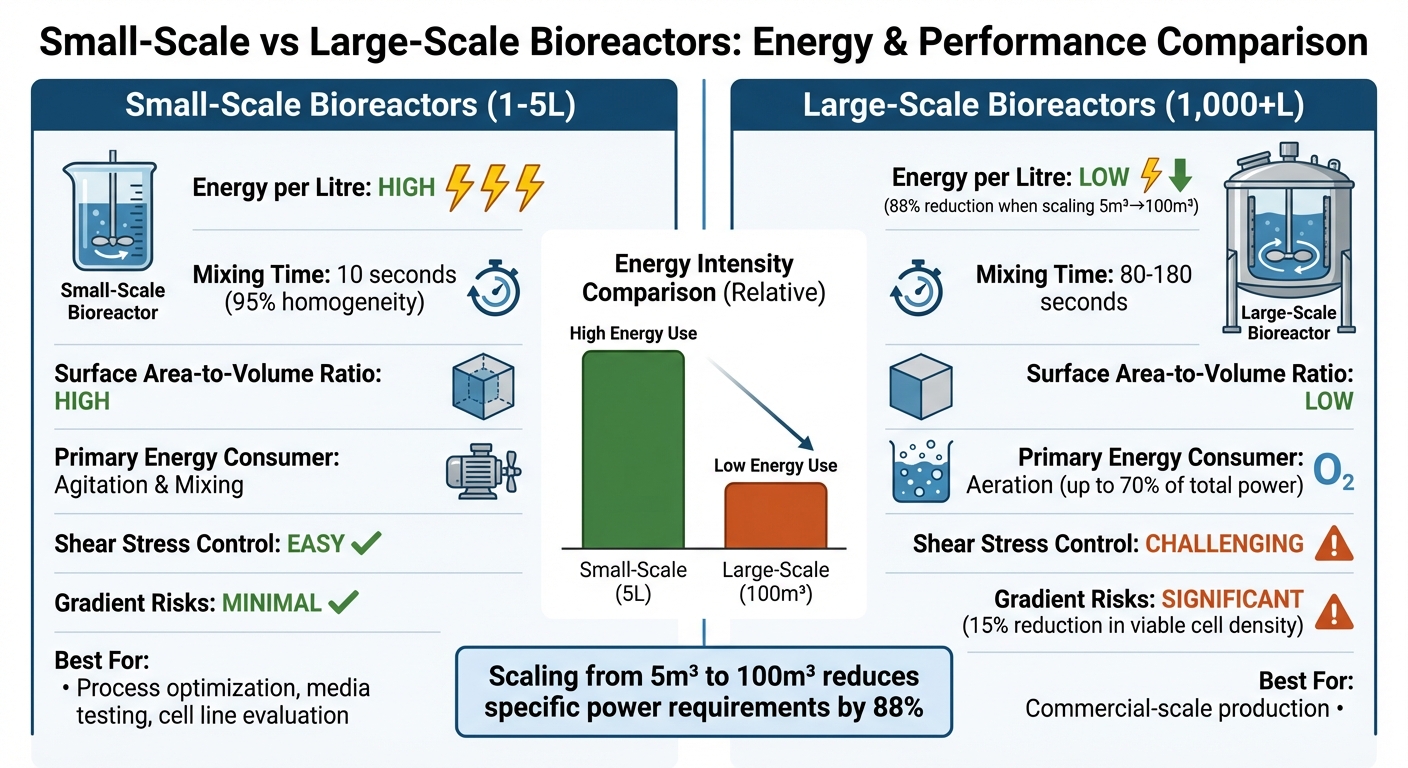
Vergleich der Energieeffizienz von kleinen und großen Bioreaktoren
Die Entscheidung zwischen kleinen und großen Bioreaktoren zur Herstellung von kultiviertem Fleisch erfordert das Abwägen von Energieeffizienz, betrieblicher Komplexität und Eignung für Produktionsanforderungen. Hier ist ein genauerer Blick darauf, wie sie im Vergleich stehen:
| Merkmal | Kleinmaßstäbliche Bioreaktoren (1–5 L) | Großmaßstäbliche Bioreaktoren (1.000+ L) |
|---|---|---|
| Energieintensität pro Liter | Hoch; erfordert mehr spezifische Leistung, um Gleichmäßigkeit und Sauerstoffübertragung aufrechtzuerhalten [9][8] | Niedrig; die Skalierung von 5 m³ auf 100 m³ kann den spezifischen Leistungsbedarf um 88 % senken [9] |
| Mischeffizienz | Effizient; erreicht 95 % Homogenität in etwa 10 Sekunden [4] | Schlecht; benötigt 80–180 Sekunden, was das Risiko von Gradienten erhöht [4] |
| Oberflächen-zu-Volumen-Verhältnis | Hoch; unterstützt effiziente Wärmeabfuhr und CO₂-Abstreifung [2] | Niedrig; stellt Herausforderungen bei der Wärme- und Gasaustauschverwaltung [2] |
| Primärer Energieverbraucher | Rühren und Mischen [9] | Belüftung (bis zu 70% der Gesamtleistung während des hohen Zellwachstums) [9] |
| Scherspannungsmanagement | Leichter zu kontrollieren; Zellen sind weniger schädlichen Kräften ausgesetzt [3][4] | Schwerer zu handhaben; hohe Rührintensität kann empfindliche tierische Zellen schädigen [3][4] |
| Gradientenbezogene Risiken | Minimal; schnelles Mischen vermeidet Stoffwechselstörungen | Signifikant; Sauerstoffgradienten über 90 Sekunden können die lebensfähige Zelldichte um 15 % senken [4] |
| Kultiviertes Fleisch Eignung | Ideal zur Optimierung von Prozessen, Testen von Medien und Evaluierung von Zelllinien [3][8] | Kritisch für die Produktion im kommerziellen Maßstab; erfordert spezialisierte Designs mit geringer Scherung [11][3] |
Tischbioreaktoren zeichnen sich durch schnelles und gleichmäßiges Mischen aus, was sie perfekt für die Feinabstimmung von Zellkulturbedingungen macht.Allerdings machen ihre hohen Energieanforderungen pro Liter sie weniger praktisch für die großflächige Produktion. Andererseits sind großflächige Bioreaktoren weitaus energieeffizienter auf einer Pro-Liter-Basis, aber sie bringen betriebliche Herausforderungen mit sich, die die Zellviabilität beeinträchtigen können. Zum Beispiel können langsamere Mischzeiten Sauerstoff- und Nährstoffgradienten erzeugen, die das Wachstum von scherempfindlichen Zellen, die in kultiviertem Fleisch verwendet werden, stören können.
Für Unternehmen, die mit Lieferanten wie
Fazit
Die Skalierung von Bioreaktoren bietet eine enorme Reduzierung des Energieverbrauchs pro Liter. Beispielsweise kann der Wechsel von einem 5 m³ zu einem 100 m³ Bioreaktor den spezifischen Energiebedarf um 88 % senken [9], was die Produktion im großen Maßstab wesentlich kostengünstiger macht. Diese Effizienz geht jedoch mit einem Kompromiss einher. Während kleinere Bioreaktoren eine gleichmäßige Durchmischung in etwa 10 Sekunden erreichen, benötigen größere industrielle Gefäße deutlich länger - etwa 80 bis 180 Sekunden. Diese langsamere Durchmischung kann schädliche gelöste Sauerstoffgradienten erzeugen [4].
Diese Verschiebung der Effizienz verändert auch, wo Energie verbraucht wird. In kleineren Systemen wird der Großteil der Energie für die Durchmischung verwendet. Aber im kommerziellen Maßstab, insbesondere bei hohen Zelldichten, wird die Belüftung zum dominierenden Energieverbraucher und macht bis zu 70 % des gesamten Energiebedarfs aus [9].
Automatisierung ist der Schlüssel zur Bewältigung dieser Herausforderungen. Werkzeuge wie CAE, CFD und KI ermöglichen es den Produzenten, das Gleichgewicht zwischen Rühren und Belüftung zu modellieren und zu optimieren, bevor sie physisch hochskalieren [3]. Zusätzlich ermöglichen Echtzeitsensoren, die den Gehalt an gelöstem Sauerstoff und Kohlendioxid überwachen, dynamische Anpassungen durch automatisierte Steuerungssysteme. Diese Systeme helfen, kostspielige Stoffwechselverschiebungen zu verhindern, den Energieverbrauch pro Kilogramm Produkt im Griff zu behalten und den Weg für intelligentere Skalierungsstrategien zu ebnen.
Für Produzenten, die expandieren möchten, ist der Betrieb in der Nähe des Flutpunkts oft der effizienteste Ansatz. Diese Strategie priorisiert intensive Belüftung gegenüber energieintensivem Rühren [1]. Techniken wie die Druckbeaufschlagung des Kopfraums können den Bedarf an Rühren während des Spitzen-Sauerstofftransfers weiter reduzieren [9].Wenn es um die Beschaffung von Ausrüstung geht, können Plattformen wie
FAQs
Wie verbessert Automatisierung die Energieeffizienz in großtechnischen Bioreaktoren?
Automatisierung spielt eine entscheidende Rolle bei der Steigerung der Energieeffizienz in großtechnischen Bioreaktoren, indem sie präzise, Echtzeit-Anpassungen kritischer Parameter wie Durchmischung, Belüftung, Temperatur und gelöster Sauerstoffgehalt ermöglicht.Anstatt sich an starre, übervorsichtige Einstellungen zu halten, verlassen sich automatisierte Systeme auf Echtzeit-Sensordaten, um diese Faktoren fein abzustimmen und sicherzustellen, dass Energie effizient genutzt wird, um die idealen Bedingungen für das Zellwachstum aufrechtzuerhalten.
Diese dynamische Steuerung ist besonders vorteilhaft während der Start- und Hochlaufphasen, in denen die Automatisierung schnelle Anpassungen an sich ändernde Prozessbedingungen ermöglicht und unnötigen Energieverbrauch reduziert. Durch die Anpassung der Steuerungssysteme an die spezifischen Eigenschaften von Bioreaktordesigns - wie Rührkessel- oder Airlift-Systeme - verbessert die Automatisierung nicht nur die Konsistenz, sondern reduziert auch die Energie, die zur Herstellung jedes Kilogramms kultivierten Fleisches erforderlich ist. Diese Fortschritte sind entscheidend, um die Produktion effizient hochzufahren und gleichzeitig die Umweltbelastung im Griff zu behalten.
Welche Probleme können bei langsameren Mischzeiten in großtechnischen Bioreaktoren auftreten?
In großtechnischen Bioreaktoren kann langsameres Mischen zu einer ungleichmäßigen Verteilung von Nährstoffen und Sauerstoff führen, was zur Entwicklung von Gradienten führt. Diese Gradienten können das Zellwachstum stören, zu ungleichmäßiger Abfallansammlung führen und die Gesamteffizienz des Systems verringern.
Um diese Probleme zu bewältigen, greifen Betreiber oft auf höhere Energieeinsätze zurück. Obwohl dieser Ansatz hilft, treibt er auch den Energieverbrauch und die Betriebskosten in die Höhe. Lösungen für diese Herausforderungen zu finden, ist entscheidend, um die Energieeffizienz aufrechtzuerhalten und während des Scale-ups optimale Leistung zu erzielen.
Warum wird das Betreiben nahe dem Flutpunkt während des Scale-ups von Bioreaktoren als energieeffizient angesehen?
Das Betreiben nahe dem Flutpunkt während des Scale-ups von Bioreaktoren wird oft als energieeffizienter Ansatz angesehen. Diese Methode optimiert die Gas-Flüssigkeits-Mischung, die für einen effektiven Stoffaustausch entscheidend ist. Durch die Maximierung der Gasflussrate, ohne das System in Instabilität zu versetzen, kann der Bioreaktor effizient arbeiten und gleichzeitig den Energieverbrauch im Griff behalten.
Das bedeutet jedoch, dass der Betrieb in der Nähe dieser Schwelle eine sorgfältige Überwachung und Steuerung erfordert. Ein Überschreiten des Flutpunktes kann das System stören oder zu einem Leistungsabfall führen, wodurch Präzision ein entscheidender Faktor für die Aufrechterhaltung der Effizienz wird.











