Memvalidasi media pertumbuhan adalah langkah wajib bagi perusahaan daging budidaya yang mencari persetujuan di pasar Inggris. Proses ini memastikan keamanan, kualitas, dan kepatuhan produk di bawah kerangka peraturan ketat seperti Peraturan Makanan Baru Inggris (EU 2015/2283). Berikut adalah yang perlu Anda ketahui:
- Persyaratan Utama: Media pertumbuhan harus memenuhi standar untuk toksikologi, pengendalian kontaminasi, kualitas nutrisi, dan alergenisitas.
- Peraturan Inggris: Food Standards Agency (FSA) mewajibkan kepatuhan dengan prinsip HACCP dan klasifikasi di bawah Produk Asal Hewan (POAO).
- Standar Global: Sementara Inggris dan Uni Eropa memiliki kerangka kerja yang serupa, AS mengikuti peraturan CGMP di bawah Undang-Undang FD&C.
- Proses Validasi: Termasuk pengujian menyeluruh terhadap komposisi, kemurnian, fungsionalitas, dan kepatuhan pemasok, serta dokumentasi yang kuat.
- Inisiatif Dukungan: Regulatory sandbox senilai £1,6 juta di Inggris, diluncurkan pada tahun 2025, membantu perusahaan dalam memenuhi standar ini.
Validasi yang tepat memastikan keamanan, membangun kepercayaan, dan sesuai dengan persyaratan hukum. Artikel ini membahas lebih dalam tentang proses langkah demi langkah, termasuk metode pengujian, kualifikasi pemasok, dan tips pengajuan regulasi.
Standar Regulasi untuk Media Pertumbuhan
Standar dan Pedoman
Media pertumbuhan, komponen penting dalam produksi daging budidaya, harus memenuhi standar regulasi internasional yang ketat. Standar ini bervariasi di berbagai wilayah, masing-masing dengan persyaratan khusus untuk komposisi, keamanan, dan kemurnian.
Di Inggris Raya, media pertumbuhan diatur di bawah Peraturan Makanan Baru (Regulasi (EU) 2015/2283 yang diasimilasi). Sebelum disetujui untuk pasar, penilaian keamanan yang menyeluruh diperlukan [1]. Badan Standar Makanan (FSA) mengklasifikasikan produk yang dibudidayakan sel sebagai Produk Asal Hewan (POAO) di bawah Regulasi (EC) 853/2004. Klasifikasi ini mewajibkan produsen untuk menerapkan sistem manajemen keamanan pangan berdasarkan prinsip Analisis Bahaya dan Titik Kendali Kritis (HACCP) [3]. FSA juga sedang dalam proses mengembangkan panduan teknis terperinci tentang komposisi media pertumbuhan, dengan pembaruan lebih lanjut diharapkan [1]. Kerangka kerja ini menyediakan dasar untuk persyaratan regulasi yang lebih spesifik.
Di Amerika Serikat, pendekatannya berbeda.Komponen media pertumbuhan harus memenuhi persyaratan Current Good Manufacturing Practice (CGMP) yang diuraikan dalam Bagian 501(a)(4)(B) dari Federal Food, Drug, and Cosmetic Act (FD&C Act) [4]. FDA mengkategorikan komponen media sebagai "persediaan dan reagen", yang diatur oleh 21 CFR bagian 210 dan 211. Komponen ini harus menjalani verifikasi kualitas untuk mencegah kontaminasi [4]. Menariknya, komponen sintetis dari media daging yang dibudidayakan - seperti asam amino, vitamin, dan garam - sering diklasifikasikan sebagai perangkat medis Kelas I di bawah 21 CFR 864.2220, membebaskan mereka dari persyaratan pemberitahuan pra-pasar [6][7].
Di Uni Eropa, kerangka peraturan sejalan erat dengan Inggris, karena juga mengikuti Regulation (EU) 2015/2283.European Food Safety Authority (EFSA) mengawasi proses otorisasi [1]. Menurut pedoman ICH Q6B, komponen media pertumbuhan, termasuk antibiotik, inducer, dan konstituen lainnya, diperlakukan sebagai pengotor terkait proses. Pengotor ini harus dikendalikan dan dikurangi ke tingkat yang dapat diterima [5]. Jika memungkinkan, eksipien dan reagen harus mematuhi standar farmakope [5].
| Yurisdiksi | Regulasi Utama | Klasifikasi | Sistem Keamanan | Pengawasan Media |
|---|---|---|---|---|
| United Kingdom (GB) | Regulasi yang Diadopsi (EU) 2015/2283 [1] | Produk Asal Hewan (POAO) [3] | HACCP (Reg 852/2004) [3] | Panduan FSA/FSS Sandbox [1] |
| Uni Eropa / NI | Regulasi (EU) 2015/2283 [1] | Produk Asal Hewan (POAO) [3] | HACCP (Reg 852/2004) [3] | Proses Otorisasi EFSA [1] |
| Amerika Serikat | FD&C Act Section 501(a)(4)(B) [4] | Obat Hewan Baru / Makanan [4] | CGMP (21 CFR 210/211) [4] | FDA CVM / USDA-FSIS [4] |
Persyaratan Regulasi untuk Daging Budidaya
Produsen daging budidaya harus memastikan bahwa setiap batch media pertumbuhan mematuhi standar keselamatan dan kualitas yang ketat.Validasi media pertumbuhan adalah aspek kunci dari kerangka peraturan yang lebih luas untuk produk-produk ini. Di bawah prinsip HACCP (Peraturan (EC) 852/2004), media pertumbuhan diidentifikasi sebagai input utama dan sumber potensial kontaminasi - kimia, mikroba, atau lainnya [3]. FSA menyoroti kekhawatiran ini:
"Bahaya utama dalam produksi produk yang dibudidayakan sel berkaitan dengan identitas garis sel (dan konsistensi), bahaya yang diperkenalkan selama proses produksi (kontaminasi mikrobiologis, media pertumbuhan dan komponen residu dalam produk akhir), dan alergen." [3]
Jika ada perubahan pada formulasi media pertumbuhan, tinjauan HACCP segera diperlukan [3].Di Inggris, validasi harus dilakukan sebelum implementasi untuk memastikan keakuratan diagram alir dan efektivitas langkah-langkah pengendalian [3].
Di Amerika Serikat, FDA mewajibkan bahwa semua reagen dan komponen media memenuhi standar kualitas yang ketat untuk menghindari pengenalan agen berbahaya [4]. Pemasok dan laboratorium kontrak harus mematuhi peraturan CGMP, dan setiap pemasok yang gagal mematuhi harus dihapus untuk mencegah produk diklasifikasikan sebagai "tercemar" [4]. FDA menekankan pentingnya hal ini:
"Semua obat hewan baru, termasuk ACTP, harus diproduksi sesuai dengan CGMP untuk memastikan bahwa obat tersebut memenuhi persyaratan Undang-Undang Makanan, Obat, dan Kosmetik Federal (FD&C Act) terkait keamanan." [4]
Saat ini, beberapa perusahaan yang berpartisipasi dalam kotak pasir regulasi Inggris - seperti BlueNalu, Gourmey, Hoxton Farms, Mosa Meat, Roslin Technologies, Vital Meat, dan Vow - sedang berkolaborasi dengan FSA untuk menyempurnakan standar teknis ini [1]. Di bawah peraturan Inggris, bisnis dapat meminta perlindungan data hingga lima tahun untuk informasi rahasia yang diserahkan selama proses otorisasi [1].
Langkah-langkah untuk Memvalidasi Media Pertumbuhan
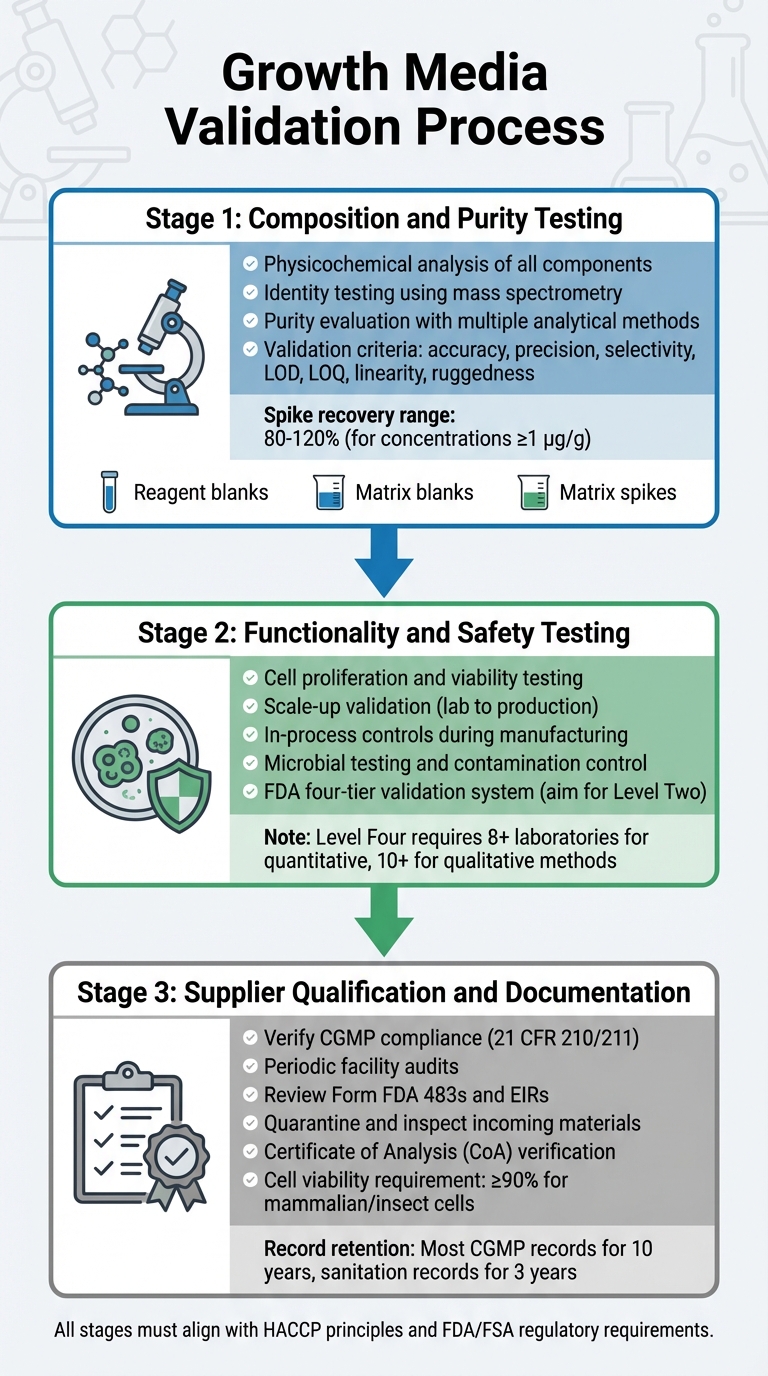
Proses Validasi Media Pertumbuhan untuk Persetujuan Regulasi Daging Budidaya
Memvalidasi media pertumbuhan melibatkan proses terperinci yang memeriksa komposisi, fungsionalitas, keamanan, dan kepatuhan pemasok. Setiap langkah dibangun di atas yang sebelumnya, memastikan proses validasi yang kuat yang sesuai dengan persyaratan regulasi. Ini termasuk pengujian untuk komposisi, fungsionalitas, dan kepatuhan pemasok.
Pengujian Komposisi dan Kemurnian
Tahap pertama berfokus pada analisis fisikokimia yang menyeluruh dari setiap komponen. Ini melibatkan identifikasi komposisi yang tepat, sifat fisik, dan struktur molekul dari bahan-bahan seperti asam amino, vitamin, dan garam anorganik [5].Untuk mengonfirmasi struktur molekul, pengujian identitas menggunakan metode yang sangat spesifik, termasuk teknik fisikokimia, biologis, dan imunokimia. Alat seperti spektrometri massa digunakan untuk memverifikasi identitas molekul melalui pola fragmentasinya [8].
Evaluasi kemurnian memerlukan beberapa metode analitik untuk memisahkan komponen yang diinginkan dari pengotor. Pengujian ini harus menangani pengotor yang terkait dengan proses dan produk [5]. Teknik analitik harus memenuhi kriteria validasi yang ketat, termasuk akurasi, presisi, selektivitas, batas deteksi (LOD), batas kuantitasi (LOQ), linearitas, dan kekasaran [8]. Protokol validasi juga harus mencakup:
- Reagen kosong untuk memastikan reagen bebas dari analit.
- Matrix blanks untuk memastikan lingkungan sampel tidak mengganggu.
- Matrix spikes untuk memperkirakan pemulihan dan akurasi.
Untuk metode kuantitatif pada konsentrasi 1 µg/g (ppm), pemulihan spike yang dapat diterima biasanya berkisar antara 80% dan 120% [8].
Untuk menjaga konsistensi, produsen harus menetapkan bahan referensi utama internal yang berasal dari lot yang mewakili produksi. Ini berfungsi sebagai standar yang dapat dilacak untuk mengkalibrasi bahan referensi kerja [5]. Setelah pengujian kemurnian selesai, media harus menunjukkan kemampuannya untuk mendukung pertumbuhan sel yang efektif dan memenuhi standar keselamatan.
Pengujian Fungsionalitas dan Keamanan
Setelah mengonfirmasi komposisi, media harus membuktikan efektivitasnya dalam mendukung produksi daging budidaya. Ini termasuk menunjukkan bahwa sel dapat berkembang biak, mempertahankan viabilitas, dan meningkatkan dari kondisi laboratorium ke volume produksi. FDA memerlukan kontrol dalam proses selama pembuatan, mulai dari tahap awal seperti pemindahan dan pemanenan sel, untuk memastikan konsistensi dan keamanan produk [4].
Validasi keamanan melibatkan pengujian mikroba yang ketat dan kontrol kontaminasi, seperti yang diuraikan dalam evaluasi pra-pasar FDA [9].
FDA menggunakan sistem empat tingkat untuk validasi metode kimia, mulai dari Level Satu (penggunaan darurat atau terbatas) hingga Level Empat (studi kolaboratif penuh yang memenuhi standar AOAC/ISO) [8].Untuk pengujian regulasi rutin, tujuannya adalah validasi laboratorium tunggal Level Dua, yang mencakup evaluasi kinerja yang komprehensif [8]. Studi kolaboratif penuh untuk metode kuantitatif memerlukan partisipasi dari setidaknya delapan laboratorium, sedangkan metode kualitatif memerlukan sepuluh [8]. Setelah kinerja media divalidasi, penting untuk memastikan bahwa semua bahan baku berasal dari pemasok yang patuh.
Kualifikasi dan Dokumentasi Pemasok
Produsen harus bekerja dengan pemasok yang terverifikasi dan mematuhi CGMP. Pemasok harus memenuhi standar yang diuraikan dalam 21 CFR 210/211 [4]. Verifikasi melibatkan audit berkala terhadap fasilitas pemasok untuk menilai kepatuhan terhadap program kualitas, prosedur, dan kepatuhan CGMP secara keseluruhan [4].
Sebelum membuat kontrak, tinjau riwayat kepatuhan pemasok, termasuk Formulir FDA 483 dan Laporan Inspeksi Pendirian (EIR) [4]. FDA menekankan kewajiban ini:
"Sebelum membuat kontrak, perjanjian, atau pengaturan lain dengan pendirian lain untuk melakukan langkah manufaktur apa pun untuk Anda, Anda harus memverifikasi bahwa pendirian tersebut mematuhi CGMP peraturan yang berlaku." [4]
Semua bahan yang masuk harus dikarantina dan diperiksa sebelum dilepas, memastikan mereka memenuhi spesifikasi utama [10]. Pemasok diharuskan menyediakan Sertifikat Analisis (CoA) atau hasil tes yang dapat dilacak, sesuai dengan CGMP/GLP [10].Untuk lini sel stabil, dokumentasi harus mencakup riwayat kloning yang dapat dilacak [10]. Sel mamalia atau serangga biasanya memerlukan setidaknya 90% viabilitas untuk diterima dalam proyek CGMP [10]. Catatan harus disimpan sesuai dengan pedoman regulasi [4].
Kontrak harus secara jelas menguraikan tanggung jawab CGMP dan mengharuskan pemasok untuk memberi tahu produsen tentang setiap perubahan yang diusulkan pada kit uji atau metodologi [4]. Jika pengujian dialihdayakan, pastikan bahwa laboratorium kontrak menggunakan metode analisis yang tervalidasi dan terdaftar di FDA [4].
Mempersiapkan Dokumen Pengajuan Regulasi
Setelah media pertumbuhan Anda divalidasi, langkah selanjutnya adalah menyusun dokumen yang menunjukkan kepatuhan terhadap semua standar keselamatan dan kualitas yang disyaratkan oleh FDA dan USDA-FSIS. Dokumen ini berfungsi sebagai penghubung penting antara validasi dan kepatuhan regulasi, memberikan otoritas pandangan yang jelas tentang keselamatan dan proses produksi media Anda.
Elemen yang Diperlukan dalam Dokumen Pengajuan
Dokumen Anda harus mencakup rincian lengkap dari komposisi media, mencantumkan semua asam amino, vitamin, garam anorganik, dan faktor pertumbuhan. Pedoman FDA menekankan bahwa proses peninjauan tidak hanya mengevaluasi media itu sendiri tetapi juga seluruh alur kerja produksi. Ini termasuk pembentukan garis sel dan bank, penerapan kontrol manufaktur, dan verifikasi semua komponen dan input [11].
Selain itu, dokumen harus menampilkan penilaian keamanan dan toksikologi yang menyeluruh, membuktikan keamanan pangan dari bahan yang dibudidayakan dan semua inputnya. Sertakan catatan kontrol manufaktur, data validasi proses, dan dokumentasi program kualitas untuk menunjukkan bahwa produksi Anda konsisten dan bebas dari kontaminan.
Anda juga harus menyediakan catatan verifikasi pasokan dan reagen, menunjukkan validasi untuk semua bahan yang digunakan dalam media, termasuk yang disiapkan secara internal. Untuk produk yang diatur oleh USDA-FSIS, sertakan rencana HACCP dan protokol sanitasi. FDA menyarankan untuk menyimpan sebagian besar catatan CGMP setidaknya selama 10 tahun, sementara catatan pembersihan dan sanitasi fasilitas harus disimpan minimal selama 3 tahun [4]. Ini sejalan dengan upaya kualifikasi pemasok, memastikan semua input memenuhi persyaratan CGMP dan regulasi.
Mendokumentasikan Kepatuhan Fasilitas
Sebelum memproduksi, memproses, atau menyimpan daging budidaya untuk konsumsi manusia, fasilitas harus terdaftar di FDA [12]. Dokumentasi Anda harus mencakup rencana keamanan pangan yang komprehensif yang mencakup analisis bahaya (biologis, kimia, dan fisik), pengendalian pencegahan (seperti sanitasi, manajemen alergen, dan langkah-langkah rantai pasokan), dan prosedur pengawasan [12].
Simulasi pengisian media juga merupakan persyaratan utama. Ini melibatkan inkubasi 14 hari dan pengujian promosi pertumbuhan untuk mengkonfirmasi praktik aseptik.Seperti yang dijelaskan oleh FDA:
"Pengisian media harus mengevaluasi perakitan aseptik dan pengoperasian peralatan kritis (steril), mengkualifikasi operator dan menilai teknik mereka, serta menunjukkan bahwa kontrol lingkungan memadai" [2].
Pastikan catatan Anda mencakup data kualifikasi pemasok, seperti tes yang dilakukan pada tiga batch pertama media dari vendor untuk mengonfirmasi bahwa mereka sesuai dengan Sertifikat Analisis. Catatan penting lainnya termasuk log kontrol lingkungan, jadwal kalibrasi peralatan, dan data pemantauan suhu. Untuk proses yang diatur oleh USDA, siapkan rencana HACCP, prosedur operasi standar sanitasi tertulis (SSOP), dan prosedur penarikan kembali [12][13].
sbb-itb-ffee270
Menggunakan Cellbase untuk Pengadaan Media Pertumbuhan yang Mematuhi Regulasi
Pemasok Terverifikasi untuk Daging Budidaya
Setelah Anda memvalidasi formulasi media pertumbuhan Anda, langkah selanjutnya adalah mendapatkan komponen yang memenuhi standar regulasi. Ini tidak sesederhana memesan dari pemasok umum. Untuk produk yang dibudidayakan dari sel, peraturan kebersihan yang ketat berlaku, dan setiap komponen media pertumbuhan harus disertai dengan dokumentasi khusus untuk persetujuan regulasi [3]. Di situlah
Fitur Pengadaan
Platform ini juga menyediakan harga yang transparan dan fitur pesan langsung, memungkinkan tim untuk dengan cepat meminta penawaran, sertifikat analisis, dan dokumen regulasi lainnya.Dengan mengkonsolidasikan fungsi pengadaan penting ini ke dalam satu sistem yang disesuaikan untuk produksi daging budidaya,
Kesimpulan
Memvalidasi media pertumbuhan untuk persetujuan regulasi bukan hanya sekadar formalitas - ini adalah persyaratan hukum untuk memperkenalkan produk daging budidaya ke pasar Inggris. Ini melibatkan pengujian menyeluruh untuk komposisi dan kemurnian, menerapkan rencana HACCP yang kuat, dan menjaga dokumentasi terperinci di setiap langkah.
"Makanan tidak boleh ditempatkan di pasar jika tidak aman. Ini berarti bahwa makanan tersebut tidak membahayakan kesehatan atau tidak layak untuk dikonsumsi manusia." - Food Standards Agency [3]
The UK Food Standards Agency's £1.6 juta Regulatory Sandbox menyoroti komitmennya untuk bekerja dengan pelaku industri guna menetapkan panduan teknis yang jelas tentang komposisi media pertumbuhan [1]. Perusahaan yang memprioritaskan validasi yang tepat sekarang akan berada dalam posisi yang lebih kuat ketika pedoman ini sepenuhnya ditetapkan.
Memenuhi standar kepatuhan bukan hanya tentang mencentang kotak regulasi - ini tentang mendapatkan kepercayaan konsumen dan memastikan keamanan produk. Pengujian kualitas yang ketat adalah inti dari persetujuan regulasi dan penerimaan pasar. Untuk menyederhanakan proses otorisasi, fokuslah pada membangun protokol validasi yang kuat, menjaga catatan yang akurat, dan bermitra dengan pemasok yang dapat diandalkan. Langkah-langkah ini tidak hanya akan menyederhanakan persetujuan tetapi juga membuka jalan untuk kepercayaan konsumen yang lebih besar.
FAQs
Apa langkah utama untuk memvalidasi media pertumbuhan untuk persetujuan regulasi?
Memvalidasi media pertumbuhan untuk persetujuan regulasi adalah tentang membuktikan bahwa formulasi tersebut aman, andal, dan cocok untuk memproduksi daging budidaya. Berikut adalah gambaran umum dari prosesnya:
- Penilaian risiko: Mulailah dengan mendefinisikan garis sel yang akan Anda gunakan, tujuan produk, dan atribut kualitas kritisnya (seperti pH atau komposisi nutrisi). Identifikasi potensi bahaya, seperti kontaminasi mikroba, dan susun langkah-langkah untuk mengendalikan risiko ini.
- Pengujian dan spesifikasi: Tetapkan kriteria penerimaan yang jelas untuk faktor-faktor seperti kemandulan, kemurnian, dan potensi. Gunakan metode pengujian yang sudah mapan untuk memastikan standar ini selalu terpenuhi.
- Studi validasi: Lakukan validasi proses yang menyeluruh, termasuk mengkualifikasi peralatan dan menguji beberapa batch, untuk memastikan bahwa hasilnya dapat direproduksi dan konsisten.
- Pengujian stabilitas: Periksa bagaimana media bertahan seiring waktu dengan menilai kualitasnya selama masa simpan yang dimaksudkan di bawah kondisi penyimpanan yang tepat (biasanya 2–8 °C).
- Dokumentasi: Kumpulkan semuanya menjadi berkas validasi yang komprehensif. Ini harus mencakup semua hasil tes dan analisis untuk memenuhi persyaratan regulasi.
Dengan menangani setiap langkah ini dengan hati-hati, Anda akan mengumpulkan bukti yang diperlukan untuk menunjukkan bahwa media memenuhi standar keamanan dan kualitas yang diperlukan untuk produksi daging budidaya.
Apa perbedaan utama antara peraturan Inggris dan AS untuk media pertumbuhan yang digunakan dalam daging budidaya?
Di Inggris, regulasi media pertumbuhan untuk daging budidaya berada di bawah Peraturan Makanan Baru (Peraturan UE 2015/2283), yang telah dipertahankan dalam hukum GB. Setiap media pertumbuhan yang digunakan dalam produk yang tidak umum dikonsumsi sebelum 15 Mei 1997 harus melalui penilaian makanan baru formal oleh Badan Standar Makanan (FSA). Proses ini memerlukan pengajuan dokumentasi rinci, termasuk informasi tentang komposisi, asal, dan kemurnian media. Selain itu, penilaian risiko berbasis HACCP diperlukan untuk menunjukkan bagaimana kontaminan dikendalikan selama proses kultur sel.
Sejak Desember 2025, FSA telah menerapkan Kotak Pasir Produk Budidaya Sel. Inisiatif ini menawarkan panduan dan mendukung pengumpulan data yang lebih cepat untuk aplikasi makanan baru.Untuk mendapatkan otorisasi akhir, perusahaan harus menyerahkan dokumen lengkap yang membahas keamanan media, konsistensi, dan validasi manufaktur. Hanya setelah persetujuan ini produk dapat dijual di Britania Raya.
Sebaliknya, Amerika Serikat tidak memiliki kerangka kerja makanan baru yang spesifik untuk media pertumbuhan, membuat perbandingan regulasi langsung menjadi menantang. Bagi perusahaan yang berbasis di Inggris, mendapatkan komponen media yang sudah memenuhi standar ketat ini dapat menyederhanakan proses persetujuan.
Bagaimana kotak pasir regulasi Inggris mendukung validasi media pertumbuhan?
Kotak pasir regulasi Inggris untuk produk budidaya menyediakan lingkungan yang terorganisir dengan baik di mana perusahaan dapat menguji dan menyempurnakan formulasi media pertumbuhan mereka. Diawasi oleh Food Standards Agency (FSA) dan Food Standards Scotland (FSS), program ini berjalan dalam fase enam bulan. Selama waktu ini, bisnis dapat melakukan uji keamanan, melakukan penilaian risiko, dan meninjau dokumentasi sambil menerima umpan balik berharga dari regulator.
Pendekatan langsung ini memungkinkan uji coba praktis dan perbaikan langkah demi langkah, mempercepat pengumpulan data keamanan dan membantu perusahaan menyesuaikan diri dengan persyaratan regulasi. Bagi mereka yang bekerja pada daging budidaya, mendapatkan media pertumbuhan yang telah disetujui sebelumnya melalui











