A certificação de sala limpa é vital para a produção de carne cultivada, garantindo segurança e conformidade com regulamentos do Reino Unido, como o Regulamento (CE) 853/2004. Sem certificação, as instalações correm o risco de contaminação, não conformidade e problemas de qualidade do produto. Aqui está uma visão geral rápida do processo:
- Por que a Certificação é Importante: Previne a contaminação microbiana, alinha-se com os princípios HACCP e garante produção consistente.
- Padrões Chave: ISO 14644-1 (limpeza do ar), EU GMP Anexo 1 (fabricação estéril) e EN 17141 (controle microbiano).
-
Etapas para Certificação:
- Design e Construção: Instalar filtros HEPA, sistemas de fluxo de ar e manter diferenciais de pressão adequados.
- Qualificação de Instalação (IQ): Verificar se a sala limpa corresponde às especificações de design.
- Qualificação Operacional (OQ): Testar o desempenho sob condições controladas.
- Qualificação de Desempenho (PQ): Validar a funcionalidade durante operações reais.
- Monitoramento Contínuo: Verificações regulares de partículas, pressão, temperatura e umidade.
- Conformidade Contínua: Requalificação a cada 6–12 meses ou após grandes mudanças.
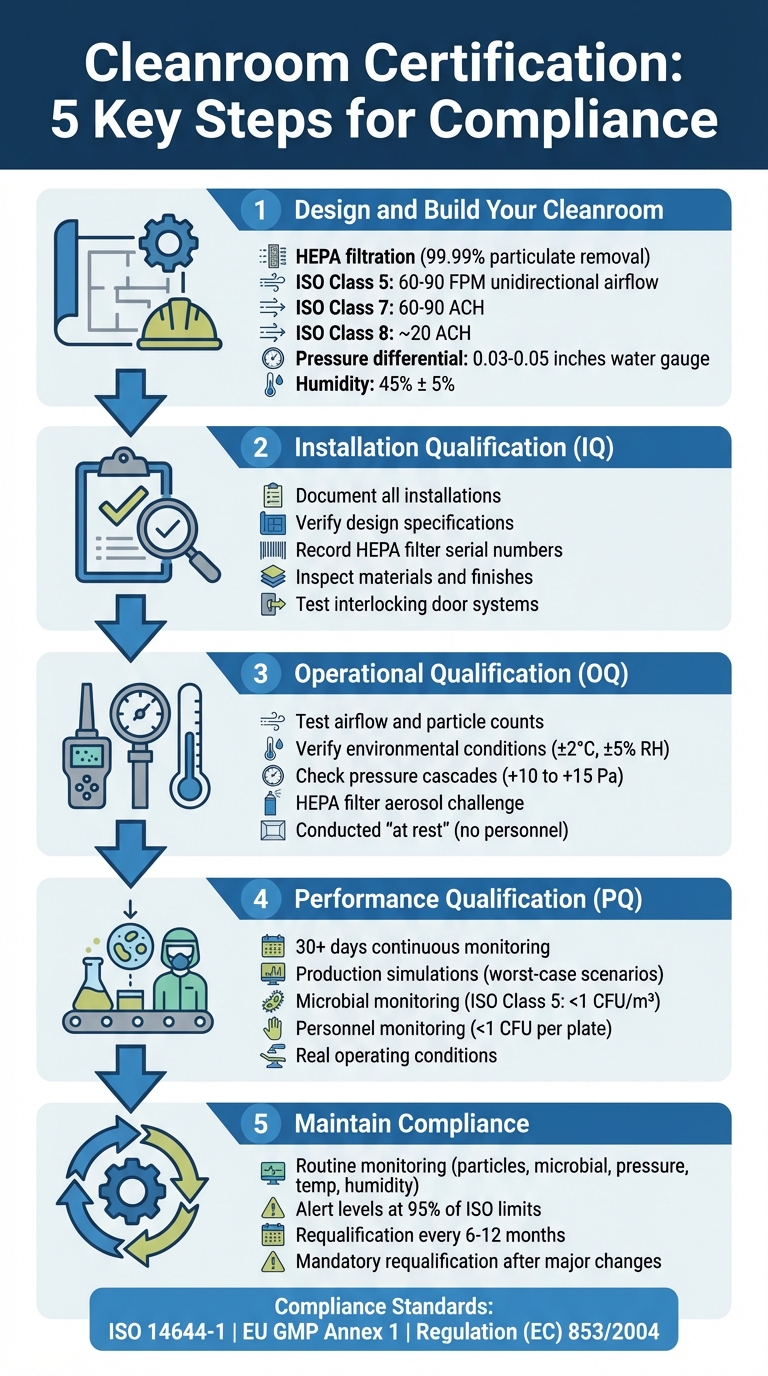
Processo de Certificação de Sala Limpa em 5 Etapas para Instalações de Carne Cultivada
Design e Certificação de Sala Limpa
Etapa 1: Projete e Construa Sua Sala Limpa
Construir uma sala limpa para produção de carne cultivada requer planejamento cuidadoso em torno de três sistemas principais: filtração HEPA, controles ambientais, e separação de fluxo de trabalho. Esses elementos garantem condições estéreis e ajudam a evitar modificações custosas posteriormente.Assim que esses sistemas estiverem em funcionamento, concentre-se em otimizar seu desempenho durante a instalação.
Requisitos de Filtragem HEPA e Fluxo de Ar
O sistema de manuseio de ar é a espinha dorsal da sua sala limpa e determina se ela atende à classificação ISO necessária. Os filtros HEPA removem 99,99% das partículas[5], mas sua eficácia depende da entrega de ar em taxas e padrões específicos adaptados a cada zona de produção.
Para áreas de Classe ISO 5 - onde ocorrem processos assépticos como a colheita de carne - você precisará de fluxo de ar unidirecional (laminar) a 60 a 90 pés por minuto (FPM) [5]. Isso envolve unidades de filtro de ventilador montadas no teto (FFUs) direcionando o fluxo de ar através de ventiladores de parede baixa com um ângulo de descarga estreito.
Nas zonas de Classe ISO 7 e 8, é utilizado um design de fluxo de ar misto. Aqui, o ar fresco de suprimento se mistura com o ar interno, exigindo menos trocas de ar por hora (ACH).As zonas de Classe ISO 7 precisam de 60–90 ACH, enquanto as zonas de Classe ISO 8 requerem cerca de 20 ACH[1][6]. Para calcular o ACH, divida o volume de ar fornecido (por hora) pelo volume da sala. Lembre-se de que tetos mais altos aumentam tanto as demandas de fluxo de ar quanto os custos[3].
Diferenciais de pressão são fundamentais para manter os contaminantes fora. Mantenha um diferencial de pressão positiva de 0,03–0,05 polegadas de coluna de água entre salas limpas e áreas adjacentes [7]. No entanto, não exceda 0,1 polegadas de coluna de água através das portas, pois isso pode dificultar a abertura - exigindo até 11 libras de força em uma porta padrão de 3×7 pés[7].
Após a instalação, teste o sistema de filtração para integridade usando testes de desafio de aerossol como testes DOP ou PAO para confirmar que não há vazamentos ou selos fracos nas carcaças dos filtros HEPA[1]. Estudos de visualização de fumaça também podem ajudar a verificar o fluxo de ar laminar e garantir que não haja turbulência ou refluxo em zonas sensíveis.
Com a filtração em vigor, o próximo passo é garantir condições ambientais consistentes.
Controles Ambientais para Produção
Manter temperatura, umidade e pressão estáveis é crucial para minimizar riscos microbianos[9]. Seu sistema HVAC deve continuamente manter esses parâmetros enquanto suporta as altas taxas de troca de ar necessárias para a classificação ISO da sua sala limpa.
O controle de temperatura é especialmente importante. O sistema deve contrabalançar o calor de biorreatores, iluminação e pessoal sem interromper os padrões de fluxo de ar. A umidade relativa deve permanecer em 45% ± 5%, o que ajuda a prevenir cargas eletrostáticas que atraem partículas e evita problemas de condensação. Esta faixa também garante um ambiente de trabalho confortável para a equipe vestida[7].
O monitoramento em tempo real de parâmetros ambientais como pH e oxigênio dissolvido pode ajudar a detectar sinais precoces de crescimento microbiano[9]. O monitoramento contínuo do ar, superfícies e água é outra prática essencial para detectar a contaminação antes que ela se agrave. Além disso, projete seu sistema HVAC para um curto tempo de recuperação - isso garante que a sala limpa retorne rapidamente ao seu nível de limpeza especificado após um evento de contaminação, reduzindo o tempo de inatividade[1].
Uma vez que os controles ambientais estejam em vigor, concentre-se em gerenciar como materiais e pessoas se movem pelo espaço para minimizar os riscos de contaminação.
Gerenciamento do Fluxo de Materiais e Pessoal
"Os trabalhadores de salas limpas são a maior fonte de contaminação de uma sala limpa e todos os processos críticos devem ser isolados das portas de acesso e caminhos do pessoal." - Vincent A. Sakraida, Engenheiro[7]
O pessoal é o maior risco de contaminação em salas limpas, liberando partículas de pele, cabelo e outros detritos[7][6]. Para resolver isso, o layout da sua sala limpa deve separar fisicamente os processos críticos das áreas de alto tráfego e pontos de acesso.
Os materiais devem se mover em uma direção - de zonas de menor grau para zonas de maior grau - usando processos validados de desinfecção ou esterilização ao longo do caminho[8].Esterilizadores de dupla extremidade, como autoclaves de porta dupla ou túneis de depirogenação, são ideais para transferir itens para áreas de processamento asséptico sem comprometer a qualidade do ar[8].
Ante-câmaras atuam como buffers entre áreas de diferentes níveis de limpeza. Zonas ISO Classe 7 ou mais limpas devem incluir uma ante-sala para vestimenta, que impede que contaminantes externos entrem nas áreas de produção[6]. Para zonas de Grau A e B, sistemas de portas intertravadas garantem que apenas uma porta possa ser aberta por vez[8]. Se ante-câmaras separadas para pessoal e materiais não forem viáveis, a separação temporal por procedimentos pode ajudar a evitar movimentos simultâneos entre zonas[8].
Limite espaços críticos a um único ponto de acesso para reduzir os riscos de contaminação cruzada[7].As janelas de observação ou câmeras remotas podem permitir que supervisores monitorem as atividades sem entrar na sala limpa, reduzindo o acesso desnecessário[8].
Cada uma dessas medidas desempenha um papel vital na obtenção da certificação de sala limpa e garante que sua instalação atenda aos rigorosos padrões exigidos para a produção segura e em conformidade de carne cultivada.
Passo 2: Completar a Qualificação de Instalação (IQ)
Uma vez que a construção é concluída, o próximo passo é a Qualificação de Instalação (IQ). Este processo garante que cada componente da sala limpa tenha sido instalado corretamente antes de passar para os testes operacionais. Essencialmente, o IQ atua como a ponte entre a conclusão da construção física e o início do balanceamento do HVAC, confirmando que tudo está pronto para a próxima fase.
"As verificações de Qualificação de Instalação (IQ) garantem que o equipamento, os componentes e a configuração da sala limpa estejam em conformidade com as especificações do fabricante e que tudo tenha sido instalado corretamente." - Kjeld Lund, Especialista em Salas Limpas [11]
IQ foca no estado "conforme construído" - quando a estrutura da sala limpa está concluída, mas o equipamento de produção ainda não está no lugar. O principal objetivo aqui é garantir que o que foi construído corresponda ao design original, com quaisquer desvios devidamente documentados e tratados.
Documente Todas as Etapas de Instalação
A documentação completa é fundamental durante esta fase. Você precisará de registros detalhados conforme construído, que incluem desenhos arquitetônicos atualizados, listas de equipamentos HVAC, sequências de controle e diagramas de fiação elétrica. Esses registros devem refletir como a sala limpa foi realmente construída, não apenas como foi planejada.
Para cada filtro HEPA ou ULPA, registre o número de série, localização exata e data de instalação. É crucial inspecionar os filtros para danos de transporte imediatamente após a instalação - já que até mesmo pequenos vazamentos podem comprometer a integridade da sala limpa. Etiquete cada peça de equipamento e sensor com um ID único que corresponda à sua lista de equipamentos, simplificando auditorias e manutenções futuras.
Os certificados de calibração para todos os instrumentos de monitoramento também devem ser arquivados. Isso inclui contadores de partículas, sensores de pressão diferencial, sondas de temperatura e umidade, e dispositivos de fluxo de ar. Como explica Toni Horsfield da ISO Cleanroom, "O certificado de calibração [para contadores de partículas] está incluído no seu relatório de validação da sala limpa." [10]
As inspeções de materiais e acabamentos são igualmente importantes. Verifique se os painéis de parede, pisos, portas, pass-throughs e selantes atendem aos padrões GMP.As superfícies devem ser não-desprendentes, com baixo VOC e devidamente seladas. Portas e janelas devem estar alinhadas com as paredes para manter a integridade da pressão.
Mantenha um registro de desvios para quaisquer variações de design, anotando as avaliações e ações corretivas tomadas. Este registro posteriormente fará parte do seu relatório final de validação, consolidando todas as descobertas da fase de instalação.
Verificar Especificações de Design
Uma vez que seus registros de instalação estejam completos, o próximo passo é garantir que cada sistema esteja alinhado com o design aprovado. Faça uma referência cruzada entre a Especificação de Requisitos do Usuário (URS) e as instalações físicas para confirmar que nada foi negligenciado durante o envio ou montagem.
Para sistemas de HVAC e filtração, verifique se as unidades de tratamento de ar, conexões de dutos e posições dos difusores correspondem aos desenhos de design.Confirme que os filtros HEPA estão devidamente assentados em suas carcaças e que todos os testes de pressão dos dutos foram concluídos com sucesso. Registre as especificações e fichas técnicas de cada unidade de filtro de ventilador.
A verificação estrutural inclui a inspeção de intertravamentos, antecâmaras e passagens para garantir que funcionem conforme o esperado. Teste os sistemas de portas intertravadas para garantir que ambas as portas não possam ser abertas ao mesmo tempo. Verifique se todas as vedações estão intactas e se a sala limpa pode manter as diferenças de pressão necessárias.
Execute o sistema HVAC para atingir condições de estado estacionário antes de passar para a próxima etapa de testes.
Conduzir o IQ com precisão é crucial, pois estabelece a base para todas as etapas subsequentes de qualificação. Pular etapas ou apressar a documentação pode levar a complicações durante os testes operacionais e auditorias regulatórias. Ao completar essas verificações minuciosamente, você garante uma transição suave para a qualificação operacional.
Etapa 3: Realizar a Qualificação Operacional (OQ)
Uma vez que a Qualificação de Instalação confirma que tudo está instalado corretamente, o próximo passo é a Qualificação Operacional (OQ). Esta fase garante que sua sala limpa opere conforme o esperado sob condições definidas. Normalmente, esses testes são conduzidos "em repouso", o que significa que o sistema HVAC está funcionando, mas nenhuma atividade de pessoal ou produção está ocorrendo.
"A validação fornece prova objetiva de que a sala limpa faz o que foi projetada para fazer: manter uma atmosfera estável e livre de contaminantes tanto em condições estáticas (em repouso) quanto operacionais." - Standard Tech [12]
O teste de OQ é crucial para demonstrar conformidade com os padrões ISO 14644-1 e GMP. Para instalações de carne cultivada, esta etapa é especialmente importante, pois os processos biológicos dependem de um controle rigoroso de partículas e microrganismos.Para garantir resultados precisos, estabilize a sala limpa por pelo menos 30 minutos antes de iniciar os testes para evitar contagens de partículas distorcidas [12]. Essas verificações se baseiam na fase de instalação, estabelecendo as bases para o ajuste fino dos seus controles ambientais.
Teste de Fluxo de Ar e Contagem de Partículas
A contagem de partículas no ar é a base da classificação ISO. Usando um contador de partículas a laser calibrado, meça a concentração de partículas no ar para confirmar a conformidade com a classe ISO requerida. Para a Classe ISO 5, consulte os limites de partículas especificados na tabela de normas.
O número de locais de amostragem depende do tamanho da sala limpa. A ISO 14644-1 fornece diretrizes claras: salas maiores requerem mais pontos de amostragem, dispostos em um padrão de grade [16]. Se você estiver testando de dois a nove locais, será necessário calcular o Limite Superior de Confiança de 95% (UCL) para determinar a conformidade.Para dez ou mais pontos de amostragem, este cálculo é desnecessário [15].
As medições de velocidade e volume do fluxo de ar garantem que sua taxa de troca de ar atenda às especificações de design. Use um anemômetro para medir a velocidade em vários pontos, especialmente perto de áreas críticas do processo, e confirme se esses valores correspondem aos seus objetivos de design.
Estudos de fumaça oferecem uma maneira visual de verificar a direção do fluxo de ar, garantindo que ele se mova de zonas mais limpas para menos limpas. Gere fumaça perto de portas, passagens e outras áreas vulneráveis para detectar vazamentos ou turbulências que possam interromper o fluxo de ar [12]. Embora os contadores de partículas sejam precisos, os estudos de fumaça podem revelar problemas como zonas estagnadas que, de outra forma, poderiam passar despercebidas.
Os filtros HEPA e ULPA também devem ser revalidados durante a OQ. Use um desafio de aerossol para verificar vazamentos nos filtros ou em suas vedações.Mesmo pequenos erros de instalação podem comprometer o desempenho, então sempre reteste após qualquer manutenção ou substituição de filtro [12].
Uma vez que o desempenho do fluxo de ar é confirmado, o foco se desloca para as condições ambientais que impactam tanto a qualidade do produto quanto o conforto do operador.
Verificar Condições Ambientais
A temperatura e a umidade desempenham um papel significativo na manutenção da qualidade do produto e na garantia de um ambiente de trabalho confortável. Para instalações de carne cultivada, os alvos de validação são tipicamente ±2°C para temperatura e ±5% para umidade relativa [12]. Recomenda-se o monitoramento contínuo por pelo menos 24 horas, pois verificações pontuais podem não detectar flutuações que poderiam afetar a validação [12].
Salas limpas para carne cultivada geralmente mantêm uma faixa de temperatura de 18–22°C e umidade relativa entre 30–60% [14].Essas condições apoiam os processos de cultura celular enquanto evitam a condensação, que poderia incentivar o crescimento microbiano. Use sensores térmicos calibrados e sondas de UR colocadas em toda a sala limpa para identificar quaisquer variações nas condições.
Cascatas de pressão são outro fator crítico. Elas garantem que o ar flua de áreas mais limpas para menos limpas, reduzindo os riscos de contaminação. Verifique os diferenciais de pressão - comumente +10 a +15 Pa entre salas classificadas adjacentes - usando medidores calibrados. Faça medições em portas e passagens sob condições de estado estacionário para confirmar as relações de pressão adequadas [12].
O teste de tempo de recuperação mede quão rapidamente a sala limpa retorna à conformidade após um evento de contaminação. Introduza uma fonte de partículas controlada e, em seguida, monitore quanto tempo leva para que a contagem de partículas retorne à linha de base.Tempos de recuperação mais rápidos indicam melhor design de fluxo de ar e controle de contaminação mais eficaz [1].
Para evitar atrasos ou retestes caros, calibre todos os instrumentos imediatamente antes do teste OQ. Registre todos os detalhes relevantes, incluindo a data, hora, local, ID do instrumento e condições ambientais para cada teste. Esta documentação é essencial para o seu relatório de validação e será exigida durante auditorias regulatórias [12].
sbb-itb-ffee270
Etapa 4: Realizar a Qualificação de Desempenho (PQ)
A Qualificação de Desempenho (PQ) avalia o desempenho da sua sala limpa em condições reais de produção, com equipamentos em funcionamento e equipe trabalhando ativamente [1][12].Construindo sobre as Qualificações de Instalação e Operacional, a PQ fornece confirmação de que a sala limpa funciona de forma consistente e confiável durante operações reais.
"PQ valida o desempenho da sala limpa sob condições reais de operação, incluindo operação de equipamentos e atividade do pessoal." - G-CON [1]
Para garantir testes completos, a fase de PQ deve incluir pelo menos 30 dias de monitoramento contínuo. Este período prolongado ajuda a identificar variações, como flutuações de temperatura durante ciclos de produção ou mudanças na contaminação microbiana devido ao movimento do pessoal, que testes mais curtos podem não detectar. Para instalações de carne cultivada, onde o controle rigoroso de contaminação é crítico, a PQ oferece prova documentada de que a sala limpa permanece em conformidade durante operações de rotina.
Executar Simulações de Produção
As simulações de produção devem replicar cenários de pior caso.Esses podem incluir ocupação máxima, operação simultânea de todos os equipamentos e riscos temporários de contaminação, como aberturas frequentes de portas ou movimento intenso [1][13]. Uma abordagem baseada em risco, como o uso da Análise de Modo de Falha e Efeitos (FMEA), pode ajudar a identificar locais de amostragem com base em riscos de contaminação, fluxo de materiais e áreas de alto tráfego [16].
O monitoramento microbiano durante essas simulações é fundamental. Unidades formadoras de colônias (UFC) devem ser monitoradas usando métodos de amostragem ativos e passivos [14][17]. Para salas limpas de Classe ISO 5, o limite de ação para contaminação microbiana é geralmente 1 UFC/m³ [14].
Como os humanos são a maior fonte de partículas em salas limpas, o monitoramento de pessoal é igualmente importante.A amostragem da ponta dos dedos com luvas pode confirmar técnicas assépticas adequadas, com um limite aceitável de menos de 1 UFC por placa [17]. Os operadores devem ser informados sobre os protocolos de vestimenta e movimento com antecedência para evitar picos artificiais nos níveis de contaminação [12].
Além disso, teste a rapidez com que a sala limpa se recupera após um desafio controlado de partículas. Introduza uma fonte de partículas e meça o tempo necessário para que as condições retornem ao normal. Este processo avalia o fluxo de ar e a eficácia dos sistemas de controle de contaminação [1][12].
Configurar Monitoramento Ambiental
Após o teste de simulação, o monitoramento ambiental contínuo garante desempenho consistente.Esses sistemas fornecem dados em tempo real sobre parâmetros críticos, como partículas no ar, contaminação microbiana, temperatura, umidade e diferenciais de pressão. Isso é essencial para detectar mudanças de desempenho antes que levem a problemas de conformidade [1]. Para a produção de carne cultivada, o monitoramento contínuo é indispensável.
Durante a fase de qualificação, realize amostragem de ar microbiana a cada 1–2 horas em zonas críticas para confirmar o controle eficaz de contaminação [14]. Use Ágar de Soja Tripticase (TSA) para detectar bactérias, incubando amostras a 30–35°C por um mínimo de três dias, e Ágar Dextrose Sabouraud (SAB) para fungos e bolores, incubando a 20–25°C por pelo menos sete dias [17]. Evite usar sprays aerossóis ou desinfetantes perto dos amostradores de ar durante os testes.Se desinfetantes rotacionais ou álcool isopropílico a 70% foram aplicados, aguarde pelo menos cinco minutos antes de iniciar a amostragem de ar [17].
Estabeleça limites claros de alerta e ação para todos os parâmetros monitorados. Os níveis de alerta sinalizam a necessidade de investigação quando os valores começam a desviar, enquanto os limites de ação exigem ação corretiva imediata se os parâmetros excederem os intervalos aceitáveis [14]. Mantenha registros detalhados de cada medição, incluindo data, hora, local, detalhes do instrumento e condições ambientais. Isso garante que você esteja sempre preparado para auditorias e possa demonstrar conformidade com os padrões ISO 14644 e GMP.
Passo 5: Mantenha a Conformidade Através do Monitoramento
Depois de concluir a Qualificação de Desempenho, o trabalho não para por aí. Manter a conformidade requer monitoramento contínuo e requalificação periódica.A certificação de sala limpa não é um marco único - ela exige um esforço consistente para manter sua instalação em um "estado de controle". Para instalações de carne cultivada, esse processo contínuo garante que você atenda aos padrões regulatórios e operacionais, estendendo as práticas meticulosas das fases de qualificação para as operações diárias.
Implementar Monitoramento de Rotina
Para garantir que sua sala limpa permaneça em conformidade com os padrões ISO 14644 e GMP, é necessário monitorar regularmente contaminantes microbianos e particulados. Os principais parâmetros a serem observados incluem:
- Contagem de partículas
- Níveis microbianos
- Pressão
- Temperatura
- Umidade
- Fluxo de ar
A frequência do monitoramento deve estar alinhada com a classificação da sua sala limpa e uma avaliação de risco completa.Por exemplo, as zonas de Classe ISO 5 frequentemente requerem monitoramento contínuo ou horário de partículas durante a produção, enquanto áreas menos críticas podem precisar apenas de verificações diárias ou semanais.
Defina níveis de alerta em 95% dos limites ISO para detectar problemas potenciais cedo. Esses níveis atuam como um aviso quando os parâmetros começam a desviar, provocando investigações antes que eles se agravem. Por outro lado, limites de ação exigem ação corretiva imediata se os parâmetros excederem os intervalos aceitáveis [14] .
Outra parte essencial do monitoramento é a amostragem de ponta de dedo com luva (GFS). Este método garante que o pessoal mantenha técnicas assépticas adequadas. O critério padrão é tipicamente menos de 1 UFC por placa [17]. Realizar GFS após tarefas assépticas críticas ou no final de cada turno ajuda a identificar e corrigir falhas na técnica cedo.
Enquanto o monitoramento de rotina ajuda a manter o controle diário, a requalificação garante que seus sistemas de sala limpa permaneçam eficazes a longo prazo.
Agendar Requalificação
A requalificação deve ser realizada a cada 6 a 12 meses. No entanto, certos eventos tornam a requalificação obrigatória, como reformas estruturais, novas instalações de equipamentos, substituições de filtros HEPA ou mudanças significativas no sistema HVAC [1][14].
Durante a requalificação, muitos dos testes da fase de Qualificação Operacional precisarão ser repetidos. Estes incluem:
- Contagem de partículas no ar
- Teste de integridade do filtro HEPA (comprovando 99,99% de eficiência para partículas ≥0.3 microns)
- Medições de velocidade do fluxo de ar
- Verificações de diferencial de pressão
Um teste particularmente crítico é o teste de tempo de recuperação, que mede a rapidez com que a sala limpa retorna ao seu nível de limpeza alvo após um evento de contaminação. Este teste verifica a capacidade do seu sistema HVAC de lidar com o estresse de forma eficaz [1].
Mantenha um Plano Mestre de Validação (VMP) para documentar todas as etapas de qualificação (IQ, OQ, PQ) e seu cronograma de requalificação. Certifique-se de que todos os instrumentos usados para testes - como contadores de partículas e anemômetros - estejam calibrados e tenham certificados rastreáveis a padrões nacionais [1] [14]. Isso garante precisão e confiabilidade em seus esforços de conformidade.
Equipamentos de Sala Limpa para Conformidade
Encontre Fornecedores Verificados em Cellbase
Uma vez que os padrões operacionais e de desempenho da sua sala limpa são estabelecidos e validados, o próximo passo é adquirir o equipamento certo para manter a conformidade. Para a produção de carne cultivada, isso significa trabalhar com fornecedores que entendem as demandas únicas da indústria.
Garanta Aquisição Compatível com GMP
Após verificar o equipamento, o processo de aquisição também deve atender aos rigorosos padrões GMP.
Além disso, a plataforma prioriza materiais que atendem aos requisitos de GMP. Por exemplo, materiais de construção como aço inoxidável 316L com superfícies polidas e que não soltam partículas são destacados. Esses materiais são resistentes à desinfecção química repetida e suportam protocolos validados de Limpeza no Local (CIP) e Esterilização no Local (SIP) [4]. Ao verificar a compatibilidade dos materiais desde o início, você pode evitar reformas caras ou ciclos de requalificação mais tarde. Essa abordagem proativa ajuda a manter a conformidade enquanto economiza tempo e recursos.
Conclusão
Principais Conclusões
Conseguir a certificação de sala limpa é crucial para manter a qualidade do produto e atender aos padrões regulatórios. Começa com o projeto de uma sala limpa equipada com filtragem HEPA, fluxo de ar controlado e fluxo de material eficiente. O processo continua com uma abordagem de qualificação em três etapas: Qualificação de Instalação (IQ), Qualificação Operacional (OQ) e Qualificação de Desempenho (PQ). Essas etapas garantem que todos os sistemas operem efetivamente sob condições reais de trabalho.
A certificação não termina aí. O monitoramento contínuo de fatores como temperatura, umidade, pressão e contagem de partículas é essencial para identificar quaisquer problemas de desempenho. A revalidação regular garante a conformidade com ISO 14644-1 e padrões GMP, criando uma estrutura sólida para melhorias futuras.
Próximos Passos para Sua Instalação
Para alinhar sua instalação com esses padrões, considere desenvolver um Plano Mestre de Validação (VMP). Este plano integra processos de qualificação com as necessidades operacionais diárias, ajudando você a se antecipar às exigências regulatórias [1]. Além disso, implementar um sistema de gestão de segurança alimentar baseado em HACCP é fundamental. Pelo menos um membro da equipe deve ser treinado no Nível 4 nos princípios HACCP para garantir a conformidade [2].
Para necessidades de equipamentos, recorra a
Perguntas Frequentes
Quais são os benefícios da certificação de sala limpa para a produção de carne cultivada?
A certificação de sala limpa desempenha um papel crucial na produção de carne cultivada, garantindo a conformidade com rigorosos padrões de segurança e ambientais. As salas limpas certificadas são projetadas para minimizar os riscos de contaminação por micróbios e partículas, mantendo as condições estéreis essenciais para o cultivo celular. Isso não apenas protege a qualidade e a segurança do produto final, mas também garante a conformidade com padrões internacionalmente reconhecidos, como classificações ISO e graus GMP - requisitos chave para aprovação regulatória e aceitação no mercado.
Além da conformidade, a certificação melhora a confiabilidade operacional ao validar sistemas críticos como fluxo de ar, filtração e monitoramento ambiental. Esses sistemas trabalham juntos para reduzir os riscos de contaminação, permitindo uma produção consistente e melhorando a eficiência geral do processo.Uma sala limpa certificada também inspira confiança entre as partes interessadas, simplifica as inspeções regulatórias e apoia os esforços de escalonamento ao demonstrar a adesão às melhores práticas na gestão de ambientes controlados.
Com que frequência as salas limpas devem ser requalificadas para garantir a conformidade?
As salas limpas precisam ser requalificadas regularmente para garantir que atendam aos padrões da indústria. A frequência com que isso acontece depende de vários fatores, incluindo a classificação da sala limpa, como ela é usada e descobertas de avaliações de risco ou planos de monitoramento ambiental.
Normalmente, a requalificação é feita uma vez por ano. No entanto, ambientes de alto risco ou situações que envolvem grandes mudanças - como atualizações de equipamentos ou ajustes de layout - podem exigir verificações mais frequentes. O monitoramento contínuo de desempenho também é crucial para verificar se o fluxo de ar, a filtração e os controles ambientais continuam atendendo aos padrões exigidos.
Quais fatores ambientais precisam ser monitorados em uma sala limpa para a produção de carne cultivada?
Para garantir conformidade e reduzir riscos de contaminação em instalações de carne cultivada, é crucial monitorar de perto vários fatores ambientais. Estes incluem contagem de partículas, contaminação microbiana, padrões de fluxo de ar, diferenças de pressão do ar, temperatura e níveis de umidade. O monitoramento regular desses elementos ajuda a manter os padrões GMP e cria um ambiente controlado essencial para a produção.
Ao gerenciar cuidadosamente essas condições, as instalações podem proteger a qualidade do produto enquanto atendem aos critérios rigorosos exigidos para a certificação de sala limpa.











