Sterilitetstestning är avgörande för produktion av odlat kött, där även mindre kontaminering kan leda till kostsamma batchmisslyckanden. Denna process säkerställer att inga skadliga mikroorganismer stör bioreaktorernas drift, vilket skyddar både produktkvalitet och ekonomisk lönsamhet. Med kontamineringsnivåer som i genomsnitt ligger på 11,2 % - och stiger till 19,5 % för storskalig produktion - står producenter inför betydande utmaningar i att upprätthålla sterila miljöer.
Viktiga punkter inkluderar:
- Huvudsakliga kontamineringskällor: Personal, råmaterial och bioreaktoroperationer är vanliga ingångspunkter för mikrober.
- Testmetoder: Membranfiltrering för stora volymer, direkt inokulering för mindre prover och biobördetestning under produktion används i stor utsträckning.
- Övervakning i realtid: Verktyg som löst syresensorer och avgasanalyser möjliggör tidig upptäckt av mikrobiell aktivitet.
- Framväxande teknologier: AI-driven övervakning, kallplasmasterilisering och automatiserade bildsystem erbjuder snabbare och mer exakt kontaminationshantering.
För odlade köttproducenter är det viktigt att kombinera traditionella sterilitetstester med avancerade övervakningslösningar för att minska risker och förbättra produktionseffektiviteten.
Rocker Discover - Hur utför man ett sterilitetstest?
sbb-itb-ffee270
Kontaminationskällor i bioreaktorsystem
För att förhindra batchfel i bioreaktorsystem är det avgörande att identifiera var kontaminering uppstår. Föroreningar faller vanligtvis in i tre huvudkategorier: mikrobiella, partikulära och endotoxin. Varje typ utgör unika utmaningar för produktion av odlat kött, vilket gör det viktigt att utveckla specifika förebyggande strategier.
Personal är den primära källan till kontaminering, ofta genom att introducera föroreningar genom hudavfall, felaktig klädsel eller dålig handhygien [4][7]. Även med strikta protokoll kan enkla rörelser störa luftflödet, vilket leder till turbulens eller stillastående områden där föroreningar kan ackumuleras [4][9]. The U.S. Food and Drug Administration framhäver de risker som är inblandade och säger, "any manual or mechanical manipulation of the sterilised drug, components, containers, or closures prior to or during aseptic assembly poses the risk of contamination and thus necessitates careful control" [4].
Miljöfaktorer spelar också en betydande roll.Till exempel kan bristande upprätthållande av ett positivt tryck på 10–15 Pascal tillåta ofiltrerad luft att komma in i sterila zoner [3][4]. Dessutom kan problem som ineffektivitet hos HEPA-filter - där partikelretentionen faller under 99,97% - eller komprometterade komprimerade gasfilter snabbt äventyra steriliteten [4].
Kontaminering av råmaterial och cellinjer
Råmaterial som kommer in i bioreaktorsystemet utgör en stor kontaminationsrisk. Overifierade ingredienser, komponenter i tillväxtmedier och cellinjer (tillgängliga genom specialiserade B2B-marknadsplatser) kan introducera opportunistiska patogener [2]. Den näringsrika miljön i cellkulturmedier är särskilt mottaglig för kontaminering, vilket gör odlingsprocesser för kött mer sårbara jämfört med mikrobiella bioprocesser [8].
Värmekänsliga ingredienser som inte kan autoklaveras är särskilt riskfyllda, eftersom de kräver alternativa steriliseringsmetoder som filtrering [1][8]. Dessutom medför själva inokuleringsprocessen inneboende risker. Även när membran desinficeras med alkohol eller procedurer utförs nära en öppen låga, finns det ingen absolut garanti mot kontaminering vid introduktion av cellinjer [8]. Dessa risker understryker vikten av noggrann verifiering av råmaterial innan de introduceras i systemet.
Bioreaktorens operativa risker
Dagliga operationer inom bioreaktorer innebär många möjligheter till kontaminering. Manuell provtagning är särskilt hög risk, eftersom varje åtkomstpunkt ökar risken för att introducera kontaminanter [1].Problem som komprometterade tätningar, skadade O-ringar eller osteriliserade förslutningar ökar ytterligare risken [4][8]. Dessutom är överföring av material från lägre klassificerade områden till högre klassificerade zoner utan korrekt dekontaminering en annan kritisk sårbarhet [7].
Att upprätthålla strikta miljökontroller är icke-förhandlingsbart. Tryckskillnader mellan renrumsområden bör övervakas kontinuerligt, och alla ovanliga förändringar måste undersökas omedelbart [4]. I klass 100 (ISO 5) kritiska områden måste partikelantal för storlekar ≥0,5 μm förbli under 3 520 partiklar per kubikmeter under drift [4].Dessutom kan aerosoliserande desinfektionsmedel eller 70% isopropylalkohol nära luftprovtagare öka partikelavläsningar, medan kondensat på gasfilter kan orsaka blockeringar eller främja mikrobiell tillväxt [4][7].
Dessa operativa risker belyser vikten av att implementera rigorösa sterilitetstestmetoder för att skydda bioreaktorprocesser.
Sterilitetstestmetoder för bioreaktorer
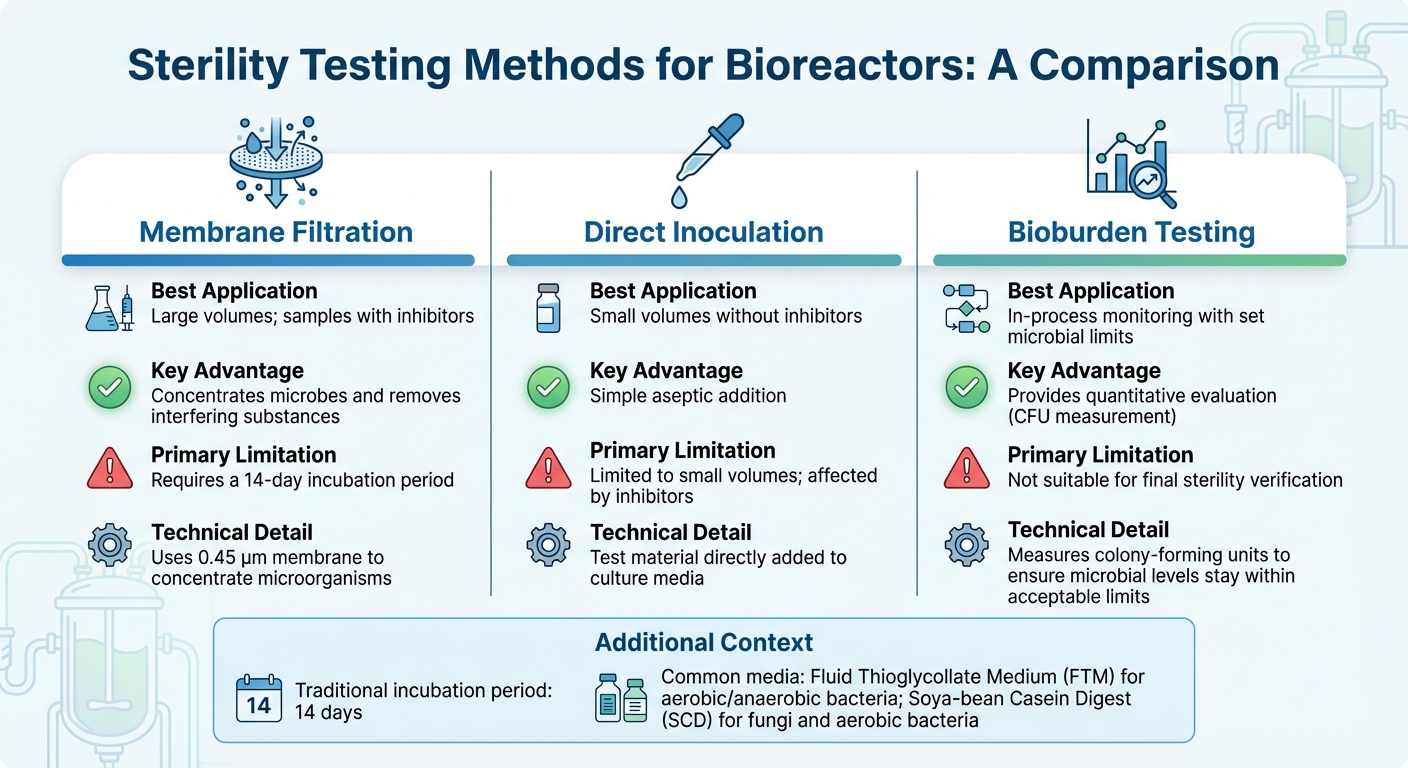
Jämförelse av sterilitetstestmetoder för bioreaktorer
Att välja rätt sterilitetstest för bioreaktorer beror på faktorer som bioreaktorstorlek, produktionsstadium och skalningsutmaningar, och provets sammansättning - särskilt när hämmare är närvarande. För de flesta industriella tillämpningar är membranfiltrering den föredragna metoden [3].Under tiden erbjuder molekylära tekniker som PCR snabbare detektion av specifika föroreningar. Nedan kommer vi att utforska metoder anpassade för odlad köttproduktion, som tar itu med de unika utmaningarna med både stora och små provtestningar.
För storskaliga prover, vanliga i industriella bioreaktorer, membranfiltrering använder ett 0,45 µm membran för att koncentrera mikroorganismer, vilket förbättrar detektionskänsligheten [10]. Denna metod är särskilt effektiv för prover som innehåller antibiotika eftersom sköljning kan eliminera inhibitorer före inkubation. Å andra sidan fungerar direkt inokulering, där testmaterialet direkt tillsätts till odlingsmediet, bättre för mindre provvolymer men har svårt att hantera inhibitoriska ämnen. Efter att proverna har koncentrerats och inhibitorer har avlägsnats, säkerställer inkubation och validering resultatens noggrannhet.
Traditionella sterilitetstester förlitar sig på en 14-dagars inkubationsperiod för att visuellt bekräfta mikrobiell tillväxt [3]. Vanligt använda medier inkluderar Fluid Thioglycollate Medium (FTM) för aeroba och anaeroba bakterier, och Soya-bean Casein Digest (SCD) för svampar och aeroba bakterier. Innan något sterilitetstest utförs är det viktigt att validera att produkten inte hämmar mikrobiell tillväxt genom bakteriostas och fungistasis-testning.
För pågående processövervakning erbjuder kvantitativ bioburden-testning en mer praktisk lösning än binära sterilitetstester, särskilt inom odlad köttproduktion. Till skillnad från sterilitetstester som ger ett enkelt godkänt/icke godkänt resultat, mäter bioburden-testning kolonibildande enheter (CFU) för att säkerställa att mikrobiella nivåer håller sig inom acceptabla gränser.Denna metod överensstämmer med framväxande livsmedelsstandarder och balanserar mellan strikta farmaceutiska kontroller och de ekonomiska realiteterna för storskalig livsmedelsproduktion.
För sterilitetstestningsmaterial och bioreaktorlösningar kan yrkesverksamma inom odlat kött vända sig till pålitliga leverantörer som
| Metod | Bästa tillämpning | Huvudfördel | Primär begränsning |
|---|---|---|---|
| Membranfiltrering | Stora volymer; prover med inhibitorer | Koncentrerar mikrober och avlägsnar störande ämnen [3] | Kräver en 14-dagars inkubationsperiod [3] |
| Direkt inokulering | Små volymer utan inhibitorer | Enkel aseptisk tillsats | Begränsad till små volymer; påverkad av inhibitorer [3] |
| Bioburden-testning | Övervakning under processen med fastställda mikrobiella gränser | Ger en kvantitativ utvärdering | Inte lämplig för slutlig sterilitetverifiering [3] |
Realtidsövervakning och sterilitetssäkring
Att förlita sig på traditionella 14-dagars sterilitetstester innebär risken att förlora hela partier om kontaminering upptäcks för sent. Realtidsövervakning erbjuder en proaktiv lösning genom att hålla koll på kritiska processparametrar när de inträffar. Detta möjliggör omedelbara åtgärder om något går fel. Inom produktion av odlat kött, där bioreaktorprocesser pågår i veckor och använder kostsamma tillväxtmedier, kan tidig upptäckt av kontaminering spara tusentals pund och undvika produktionsförseningar. Genom att kombinera realtidsdata med konventionella sterilitetstester kan producenter överbrygga klyftan mellan fördröjd bekräftelse och snabb intervention.
Sensorbaserad övervakning
Viktiga indikatorer som löst syre (DO) och pH-nivåer kan signalera kontaminering tidigt. När bakterier eller svampar infiltrerar en bioreaktor, konsumerar de snabbt syre - vilket får DO-nivåerna att sjunka - och frigör metaboliska syror som sänker pH avsevärt [12]. Dessa förändringar kan upptäckas timmar innan kontamineringen blir visuellt uppenbar. Medan traditionella sterilitetstester bekräftar resultat efter processen, fungerar realtidsövervakning som en skyddsåtgärd, säkerställer att processen håller sig på rätt spår och adresserar kontaminationsrisker tidigare.
Avgasanalys, med hjälp av magnetsektor masspektrometri, mäter kontinuerligt syre- och koldioxidnivåer i en bioreaktors avgaser. I kontrollerade kontaminationsstudier identifierade denna metod mikrobiell tillväxt inom 22,4 timmar genom syreförändringar, medan pH-baserad detektion släpade efter vid 25,8 timmar [13]. Magnetsektorsystem levererar precisa syremätningar med en noggrannhet på upp till 0,003% (v/v) över sju dagar, vilket överträffar traditionella paramagnetiska detektorer, som endast är noggranna till ±0,2% (v/v) [13].
Spektroskopiska sensorer ger icke-invasiv övervakning genom väggarna på engångsbioreaktorer, vilket är avgörande för att upprätthålla sterilitet.UV-vis-spektroskopi kan upptäcka membranskador genom att mäta ljusabsorption vid 350–400 nm, medan läckta intracellulära material uppträder vid 800–900 nm [14]. Kapacitanssonder, de enda kommersiellt tillgängliga sensorerna utformade för att mäta livskraftig celldensitet, uppnår detta genom att upptäcka förändringar i membranpolarisering [14]. För anläggningar som hanterar flera bioreaktorer kan verktyg som Rapid Multi-Stream Sampler övervaka upp till 16 gasströmmar samtidigt [13].
Dessa sensorbaserade system, kombinerade med miljökontroller, såsom HVAC-kontaminationsförebyggande, skapar ett robust försvar mot kontaminering.
Miljö- och tryckkontroller
Att upprätthålla positivt tryck mellan renrumszoner är avgörande för att förhindra att föroreningar tränger in [3].Positiva trycksystem, när de kombineras med HEPA-filtrering, fungerar som fysiska barriärer mot mikrobiell intrång. Ljud- eller visuella larm på HEPA-filter kan omedelbart meddela personalen om trycket sjunker under acceptabla nivåer [3].
Räkning av icke-levande partiklar är ett annat försvarslager. Laserpartikelräknare verifierar kontinuerligt att miljön uppfyller ISO-standarder för luftrenhet under drift. Genom att övervaka både 0,5 µm och 5,0 µm partiklar säkerställer dessa enheter att luftkvaliteten förblir inom de nödvändiga gränserna [7]. Om oväntade avvikelser uppstår - såsom ett plötsligt fall i DO eller en pH-fluktuation - kan omedelbar isolering av den drabbade bioreaktorn och stopp av tillsatser förhindra att kontaminering sprids [12].
För att skaffa specialiserade sensorer och utrustning anpassade för odlad köttproduktion, kopplar företag som
Nya teknologier inom sterilitetstestning
Traditionella metoder för sterilitetstestning brister ofta på grund av sina långa 14-dagars inkubationsperioder och beroendet av manuell provtagning, vilket kan lämna utrymme för detektionsluckor. Nyare teknologier träder in för att hantera dessa utmaningar och erbjuder snabbare och mer exakt detektion av kontaminering. Detta är särskilt viktigt i produktionen av odlat kött, där de höga kostnaderna för tillväxtmedia och långa odlingstider gör kontaminering i ett sent skede till en ekonomisk mardröm.
AI-drivna övervakningssystem
Artificiell intelligens omformar detektering av kontaminering genom att analysera realtidsdata för att identifiera mikrobiella intrång. När bakterier invaderar en bioreaktor konsumerar de syre och producerar metaboliska syror, vilket leder till märkbara minskningar i löst syre och pH-nivåer. AI-system kan upptäcka dessa avvikelser i syre- och näringskonsumtion, och flagga potentiell kontaminering långt tidigare än traditionella biobördetestning och sterilitetprotokoll kan ge resultat [12].
Dessa AI-plattformar inkluderar också matematiska modeller för att fastställa den exakta tidpunkten för när kontamineringen inträffade och simulera hur mikrobiella populationer växer över tid. Detta hjälper operatörer att spåra kontamineringen tillbaka till dess källa, oavsett om det är en defekt matningskälla, ett operativt misstag eller ett utrustningsproblem. Tekniker som Poisson-sannolikhetsanalys förbättrar ytterligare noggrannheten i biobördetestning, vilket minskar risken för falska negativa [12].
"Matematiska modeller hjälper till att uppskatta tidpunkten för kontaminationsintroduktion och mikrobiell tillväxtdynamik, vilket förbättrar spårbarheten av kontaminering." - Naveenganesh Muralidharan, Senior Manager, MSAT, AGC Biologics [12]
När avvikelser flaggas kan omedelbara åtgärder - såsom att isolera bioreaktorn och stoppa alla tillsatser - förhindra att problemet sprider sig [12]. Ett systematiskt tillvägagångssätt som involverar biobördetestning, molekylär identifiering och tillväxthastighetsanalys är avgörande för att identifiera grundorsaken och genomföra korrigerande åtgärder. Dessa AI-verktyg överbryggar klyftan mellan traditionella metoder och proaktiv kontaminationshantering.
Kallplasmasterilisering
Kallplasmateknologi erbjuder ett icke-termiskt steriliseringsalternativ som är särskilt väl lämpat för odlad köttproduktion.Operating at or near room temperature, it’s ideal for sterilising sensitive components like bioreactor parts, sensors, and plastics that can’t withstand the heat of traditional autoclaving [15][16][17]. This method uses reactive oxygen and nitrogen species, along with UV light, to disrupt microbial membranes and DNA. It’s effective against a wide range of contaminants, including bacterial spores (Bacillus, Clostridium), fungi, viruses, and even prions [15][17].
One of cold plasma’s standout features is that it leaves no toxic residues. Once the power is turned off, reactive species quickly revert to oxygen, eliminating the need for a desorption phase [16][18].Det är också energieffektivt och kräver endast ett vanligt eluttag istället för värmekällor baserade på fossila bränslen [15][16]. Till exempel visar studier att kall plasma kan uppnå en >5 log-reduktion av Bacillus cereus sporer inom 25 minuter vid 300W effekt [15].
Men teknologin har sina begränsningar. Dess steriliseringseffekter är främst ytliga, vilket innebär att den har svårt att tränga igenom komplexa geometriska former där mikrober kan gömma sig i sprickor eller spår [15][16]. Hög proteinhalt eller fetthalt i bioreaktormiljöer kan också skydda mikrober genom att fånga upp reaktiva arter, vilket minskar steriliseringens effektivitet [15][18].
| Egenskap | Kall Plasma |
|---|---|
| Fördelar | Icke-termisk, icke-toxisk, energieffektiv, inga rester, snabb [16] |
| Begränsningar | Begränsad penetration, minskad effektivitet i komplexa geometriska former [15][16] |
Automatiserade bildbaserade detekteringssystem
Som ett tillägg erbjuder automatiserade bildsystem ett kraftfullt verktyg för realtidsdetektering av kontaminering. Dessa system erbjuder detaljerad morfologisk insikt i celltillväxt, vilket är avgörande för att upptäcka kontamineringsmönster när de uppstår [19].Till skillnad från traditionell offline-mikroskopi - som kräver manuell provtagning och färgning - integreras automatiserad avbildning sömlöst i online- eller at-line-övervakningssystem. Detta gör det möjligt för operatörer att övervaka biomassa och cellhälsa utan att kompromissa med steriliteten [19].
Genom att minska manuella ingrepp minskar dessa system mänskliga fel och förbättrar reproducerbarheten över odlingsprocesser [19]. Avancerade bildbehandlingsalgoritmer kan spåra fermenteringsframsteg, optimera metabolitproduktion och säkerställa konsekvens - en kritisk faktor vid uppskalning av bioprocesser [19].
"Tillgången till avancerade provtagningstekniker i kombination med automatiserade mätverktyg...kan avsevärt minska den tid som krävs för stamval, processutveckling och processkontroll genom att minska antalet steg i produktions-/odlingsprocessen, särskilt manuella steg, och minska felpropagering." - A.C. Veloso och E.C. Ferreira, University of Minho [19]
Trots deras fördelar är det inte alltid enkelt att integrera dessa system. Cellkulturer är komplexa, råmaterial varierar och sensorer måste tåla hårda sterilisationsmetoder som ånga eller gamma-bestrålning [19]. För företag som vill anta dessa teknologier kan plattformar som
Slutsats
Att säkerställa bioreaktorsterilitet i odlad köttproduktion är ingen liten uppgift, men en integrerad strategi för sterilitetstestning kan göra det uppnåeligt.Denna strategi kombinerar traditionella metoder, som membranfiltrering för större provvolymer och direkt inokulering för mindre, med moderna molekylära verktyg som PCR och qPCR för snabb patogenscreening. Dessutom ger miljöövervakning - via luftprovtagning och ytsvabbning - en extra säkerhetsåtgärd, som adresserar kontaminationsrisker i HVAC system, och fångar potentiell kontaminering innan det kan påverka produktionskärl [11].
Valet av testmetod beror på faktorer som provstorlek, förekomsten av ämnen som kan störa resultaten, och om fokus ligger på fullständig sterilitetvalidering eller enbart övervakning av biobörda. Provtagning från flera punkter i bioreaktorn - topp, mitten och botten - hjälper till att skapa en grundlig mikrobiell profil och minskar risken för att missa lokaliserad kontaminering [1].Detta är särskilt kritiskt med tanke på att kontaminationsriskerna vid produktion av odlat kött är avsevärt högre än vid tillverkning av biofarmaceutiska produkter, vilket understryker behovet av rigorösa sterilitetprotokoll [6].
Nyckeln till att upprätthålla mediasterilitet i bioreaktorer är att skaffa rätt utrustning. Verktyg som aseptiska provtagningssystem med försteriliserade septa och HEPA-filter som kan fånga 99,97% av partiklar större än 0,3 μm är väsentliga [4]. Plattformar som
Allt eftersom branschen växer blir hybrida sterilitetstillvägagångssätt allt viktigare.Att tillämpa farmaceutiska kvalitetskontroller under de tidiga fröodlingsstadierna, samtidigt som man antar livsmedelsstandarder för storskalig produktion, skapar en balans mellan säkerhet och kostnadseffektivitet [5][6]. Dessa integrerade åtgärder kommer att vara hörnstenen för säker och effektiv produktion av odlat kött när området fortsätter att utvecklas.
Vanliga frågor
Vilka är de främsta orsakerna till kontaminering i bioreaktorsystem som används för produktion av odlat kött?
Kontaminering i bioreaktorsystem sker när den sterila miljön störs eller när näringsrika medier ger en idealisk miljö för mikrober att frodas. Detta kan orsakas av flera faktorer, såsom brott under provtagning, underhåll eller cellskörd; skadade eller blockerade gasfilter; kontaminering som redan finns i tillväxtmediet; eller tillfälliga öppningar som skapas vid installation eller service av sensorer.Utöver det kan utsliten utrustning avge mikroplastpartiklar, som kan fungera som hem för mikroorganismer.
Vid produktion av odlat kött kan även den minsta kontamineringen äventyra både säkerheten och avkastningen av en sats. För att minska dessa risker är det viktigt att investera i högkvalitativ utrustning som sterila filter, bioreaktorer och sensorkit som följer strikta aseptiska standarder. Plattformar som
Hur förbättrar artificiell intelligens sterilitetstestning i bioreaktorer?
AI-drivna system omvandlar sterilitetstestning i bioreaktorer för odlat kött genom att erbjuda insikter i realtid genom kontinuerlig övervakning.Användning av avancerade biosensorer gör att dessa system kan hålla koll på kritiska faktorer som pH, lösta syre och viktiga metaboliter som glukos och aminosyror. Allt detta sker utan behov av manuella kontroller, vilket dramatiskt minskar risken för kontaminering.
Det som skiljer dessa system åt är deras förmåga att analysera data med hjälp av algoritmer som jämför avläsningar med etablerade sterilitetstandarder. Detta innebär att de kan upptäcka även de minsta tecknen på mikrobiell tillväxt långt tidigare än traditionella metoder. Utöver bara detektering kommer prediktiv analys in i bilden, identifierar potentiella risker som problem under sensorinstallation eller inträde genom portar. Dessa system föreslår till och med korrigerande åtgärder för att hjälpa producenter att undvika kostsamma batchförluster.
AI-driven mikroskopi lägger till ytterligare ett lager av effektivitet genom att omedelbart skilja mellan friska celler och föroreningar, vilket påskyndar sterilitetverifieringsprocesserna. För producenter gör plattformar som
Vilka utmaningar begränsar användningen av kallplasmasterilisering i bioreaktorer för odlad köttproduktion?
Kallplasmasterilisering är effektiv på att neutralisera mikrober, men det medför en rad utmaningar när det appliceras på bioreaktorer i odlad köttproduktion. Ett stort problem är den begränsade penetrationsdjupet hos de reaktiva arter som produceras av plasma. Detta gör det svårt att sterilisera stora volymer eller tätt packade medier grundligt. Dessutom blir det allt svårare att uppnå jämn plasmatäckning över en hel reaktor när systemets storlek ökar.
Att skala upp kallplasmasystem från laboratoriemiljöer till kommersiella bioreaktorer introducerar ytterligare hinder.Större reaktorer kräver högre effekt-till-volym-förhållanden, vilket kan resultera i steriliseringstider som är långt ifrån praktiska. Många kalla plasmasystem fungerar också under vakuumförhållanden eller är beroende av reaktiva gaser, vilket lägger till lager av komplexitet när det gäller säkerhet, efterlevnad av regler och utrustningsdesign. Dessa faktorer gör metoden mindre idealisk för de storskaliga bioreaktorer som vanligtvis krävs i kommersiell odlad köttproduktion.
Ett annat bekymmer är risken för skador orsakade av reaktiva syre- och kvävearter (RONS), som är nyckeln till mikrobiell inaktivering. Dessa reaktiva arter kan skada känsliga däggdjursceller eller bryta ner mediekomponenter, vilket kräver noggrann optimering för att bibehålla cellernas livskraft. Som ett resultat används kall plasma ofta i kombination med andra steriliseringstekniker snarare än som en fristående lösning.











