Kryopreservation är processen att frysa och lagra levande celler vid ultralåga temperaturer för att bevara deras livskraft över tid. Denna metod är avgörande för produktion av odlad kött, vilket säkerställer konsekventa, stabila cellinjer och skyddar mot förluster från kontaminering eller utrustningsfel. Nyckelsteg inkluderar:
- Förberedelse: Skörda celler under deras tillväxtfas, kontrollera livskraft (sikta på ≥90%), och förbered dem i frysmiljö med kryoprotektanter som DMSO eller glycerol.
- Frysning: Använd en kontrollerad kylhastighet (-1°C till -3°C per minut) för att förhindra skador från iskristaller. Lagra celler i flytande kväveånga (-135°C till -190°C) för långsiktig bevarande.
- Upptining: Snabbt upptina celler i ett 37°C vattenbad för att minimera kryoprotektantens toxicitet, och överför dem sedan till tillväxtmedia för återhämtning.
- Kvalitetskontroll: Märk flaskor noggrant, övervaka lagringsförhållanden och testa livskraft efter upptining för att säkerställa framgångsrik bevarande.
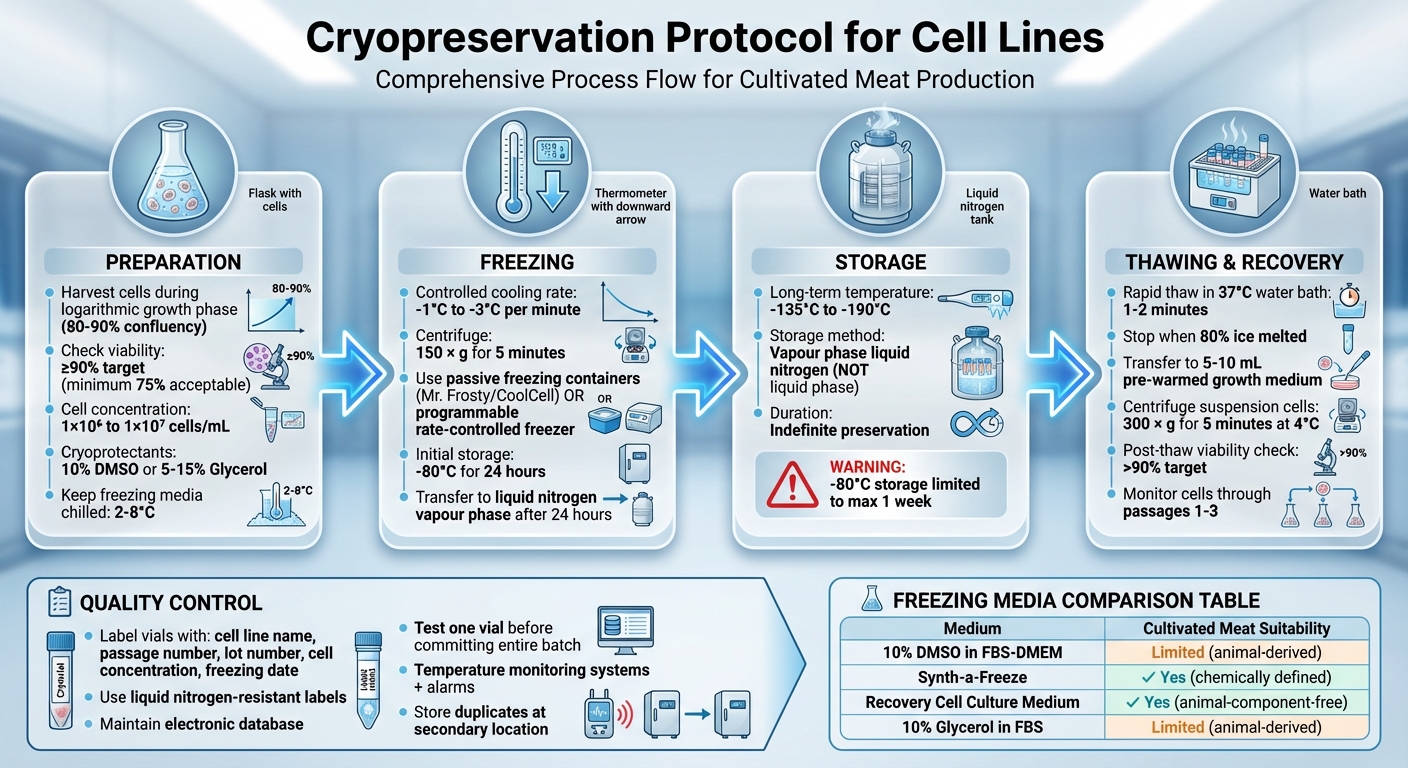
Komplett Kryokonserveringsprotokoll för Cellinjer: 4-Stegs Process från Förberedelse till Lagring
Förbereda Celler för Kryokonservering
Cellextraktion och Livskraftskontroller
För att säkerställa bästa återhämtning efter upptining, extrahera celler under deras logaritmiska (log) tillväxtfas. För adherenta cellinjer är detta vanligtvis när de når 80–90% konfluens [2][3][6].
Kontrollera livskraften hos cellerna med hjälp av Trypan Blue-exklusionsmetoden. Blanda lika delar (1:1) av 0,4% Trypan Blue med cellupphängningen, och räkna sedan cellerna med en hemocytometer.Levnadsceller kommer att utesluta färgen och framträda klart under mikroskopet, medan icke-levnadsceller kommer att färgas blå [4]. Målet bör vara en livbarhet på minst 90% för de bästa återvinningsgraderna, även om vissa protokoll kan acceptera ett minimum på 75% [1][2][3][5].
Innan skörd, använd ett mikroskop för att kontrollera för bakteriell eller svampkontaminering. Friska suspensionsceller bör framträda klara, runda och refraktiva under ett inverterat faskontrastmikroskop [2][3].
När cellerna uppfyller de erforderliga livbarhetsstandarderna, gå vidare till förfrysningsstegen.
Förberedelser före frysning
För adherenta celler, använd skonsamma dissociationsmetoder, såsom trypsin eller TrypLE Express, och begränsa inkubationstiden för att undvika att cellmembranen skadas [5]. Förbered cellerna vid en koncentration av 1 × 10⁶ till 1 × 10⁷ celler/mL, beroende på cellinjen [1][6]. Vid aliquotering, se till att cellupphängningen blandas ofta för att upprätthålla en jämn fördelning över kryovialer [5].
Håll frysningsmediet kallt mellan 2°C och 8°C under resuspensionen för att minska toxiciteten hos kryoprotektanten innan frysningsprocessen påbörjas [5]. När cellerna är resuspenderade i frysningsmediet, gå snabbt vidare till frysningsprotokollet [1].Alltid kryopreservera celler vid det lägsta möjliga passageantalet för att minska risken för genetisk drift eller morfologiska förändringar [5][7].
Val av kryoprotektanter och frysmiljö
Kryoprotektantalternativ och deras funktioner
Dimetylsulfoxid (DMSO) används i stor utsträckning som en kryoprotektant, vanligtvis vid en koncentration av 10% [2]. Det fungerar genom att tränga in i cellmembran och minska isbildning under frysning. Emellertid kan DMSO vara giftigt för celler vid rumstemperatur, så snabb upptining är avgörande för att minimera exponeringen och snabbt späda ut det [1].
Glycerol fungerar som ett användbart alternativ för cellinjer som är känsliga för DMSO, vanligtvis använt i koncentrationer som sträcker sig från 5% till 15% [8].Det är särskilt effektivt för celltyper där DMSO kan orsaka oönskad differentiering [3], och det tenderar att ha lägre toxicitet jämfört med DMSO.
I tillämpningar av odlad kött använder traditionella frysningsprotokoll ofta en blandning av 90% Fetal Bovine Serum (FBS) och 10% DMSO [1]. Emellertid begränsar beroendet av djurkomponenter dessa metoder när det gäller skalbarhet och regulatoriskt godkännande [9]. För att ta itu med dessa frågor, kemiskt definierade medier - som Synth-a-Freeze eller Recovery Cell Culture Medium - erbjuder ett alternativ utan djurkomponenter. Dessa medier upprätthåller hög cellöverlevnad efter upptining samtidigt som de övervinner de utmaningar som är förknippade med komponenter av animaliskt ursprung [9].
Jämförelse av frysningsmedier
Här är en sammanställning av fördelarna och begränsningarna med olika frysningsmedier som används i produktionen av odlat kött:
| Medium | Fördelar | Nackdelar | Lämplighet för odlat kött |
|---|---|---|---|
| 10% DMSO i FBS-DMEM | Fastställda protokoll [1] | Innehåller animaliska komponenter; batchvariabilitet [9] | Begränsad skalbarhet |
| Synth-a-Freeze | Kemiskt definierad; konsekvent kvalitet; fri från animaliska komponenter [9] | Högre initialkostnad [9] | Ja |
| Återhämtningscellkulturmedium | Lätt att använda; utformad för snabb återhämtning [9] | Kan behöva optimering för specifika cellinjer | Ja |
| 10% Glycerol i FBS | Alternativ för DMSO-känsliga celler [1] | Beror på serum av animaliskt ursprung [9] | Begränsad skalbarhet |
I februari 2023 visade forskare vid Tokyo Women's Medical University, ledda av Hironobu Takahashi, vikten av att välja rätt frysmaterial.Användning av kommersiella alternativ som CELLBANKER 1 och 2, lyckades de framgångsrikt kryokonservera primära boskapsmyogena celler vid –80°C i upp till ett år. Anmärkningsvärt nog behöll dessa celler sin förmåga att proliferera och differentiera till kontraktil muskelvävnad med intakta sarkomerstrukturer efter upptining [10].
För produktion av odlad kött föredras alltmer kemiskt definierade och GMP-kompatibla medier. Som STEMCELL Technologies framhäver:
I starkt reglerade områden som cell- och genterapi rekommenderas det att använda ett GMP-tillverkat, helt definierat kryokonserveringsmedium för att säkerställa att produkterna konsekvent produceras och kontrolleras enligt kvalitetsstandarder [9].
Plattformar som
Kryokonserveringsprocedur och kylhastigheter
Steg-för-steg frysningsprotokoll
Nyckeln till framgångsrik kryokonservering ligger i att upprätthålla en jämn kylhastighet på -1°C till -3°C per minut[2]. Denna gradvisa process gör att vatten långsamt kan lämna cellerna, vilket förhindrar bildandet av skadliga intracellulära iskristaller som kan spränga cellmembran[1].
Börja med att centrifugera cellerna vid 150 x g i 5 minuter[3]. När centrifugeringen är klar, återupplös cellpellet i en kall frysmiljö som innehåller 10% DMSO vid en koncentration av 2–4×10⁶ celler/mL[3].För att minska DMSO-exponeringen, gå snabbt vidare till nästa steg - frysning.
Fördela cellupphängningen i förhandsmärkta kryogeniska rör. Varje rör bör tydligt ange viktiga detaljer såsom cellinje namn, passage nummer, batchnummer, cellkoncentration och datum för frysning[3]. När rören är förberedda är det dags att välja och använda lämplig kylutrustning.
Kylutrustning och tekniker
Placera rören omedelbart i en kontrollerad kylapparat. Passiva frysningsbehållare, som Nalgene "Mr Frosty" (som använder isopropanol) eller Corning "CoolCell", är populära val. Dessa verktyg kan uppnå en kylhastighet på cirka 1°C per minut när de placeras i en -80°C frys[2].
För större operationer där konsekvens är avgörande, är en programmerbar hastighetskontrollerad frys det bästa alternativet. Som angivet av Sigma-Aldrich:
ECACC använder rutinmässigt en programmerbar hastighetskontrollerad frys. Detta är det mest pålitliga och reproducerbara sättet att frysa celler[3].
Efter cirka 24 timmar vid -80°C, överför ampullerna till ångfasen av flytande kväve, där temperaturerna ligger mellan -135°C och -190°C, för långtidslagring[4]. Undvik att lagra celler vid -80°C längre än en vecka, eftersom detta kan påverka deras livskraft. Temperaturer under -135°C är avgörande för oändlig bevarande[2]. Att använda ångfasen istället för vätskefasen minskar risken för korskontaminering samtidigt som tillräckligt låga temperaturer upprätthålls.
Avfrostnings- och återhämtningsprotokoll
Avfrostningsprocess
Att avfrosta celler snabbt är avgörande för att begränsa exponeringen för toxiska kryoprotektanter och förhindra att iskristaller orsakar skador. Se till att bära visir och isolerade handskar för säkerhet. Börja med att ta bort kryovialen från flytande kväve och lossa locket något för att släppa ut eventuell uppbyggd tryck. Återfäst sedan locket.
Placera vials i ett vattenbad vid 37°C, se till att locket hålls ovanför vattenlinjen. Låt det avfrysa i 1–2 minuter, eller tills endast några få iskristaller återstår. När det är avfrostat, torka vialens utsida med 70% alkohol för att upprätthålla sterilitets.
Överför innehållet i vialen till ett rör som innehåller 5–10 mL förvärmd tillväxtmedium. Tillsätt mediumet långsamt för att hjälpa till att minska osmotisk chock. Om du arbetar med suspensionscellinjer, centrifugera cellupphängningen omedelbart vid 300 × g i 5 minuter vid 4°C.Detta steg hjälper till att pelletisera cellerna och tar bort kryoprotektanten. Efter centrifugering, återupplös cellerna i färskt medium. För adherenta celler är centrifugering vanligtvis onödig. Istället, så frö direkt cellerna i en lämplig odlingskärl och ta bort eventuell kvarvarande DMSO under den första medieförändringen, vanligtvis efter 24 timmar.
Utvärderingar efter upptining
Direkt efter upptining, kontrollera cellernas livskraft för att säkerställa att återhämtningen har varit framgångsrik. Använd Trypan Blue-exklusionsmetoden för denna bedömning. Idealiskt bör cellernas livskraft överstiga 90% [11], men ett minimum på 75% är acceptabelt. Efter 24 timmar, inspektera cellerna under ett faskontrastmikroskop för att bekräfta vidhäftning, utvärdera celltäthet och kontrollera för eventuella tecken på kontaminering.
Fortsätt att övervaka cellerna genom passage 1–3 för att säkerställa normal proliferation och att de behåller sina förväntade egenskaper.För cellinjer som återhämtar sig långsammare kan du förbättra överlevnaden genom att öka den initiala koncentrationen av fötal bovint serum till cirka 20% v/v.
sbb-itb-ffee270
Lagring och långsiktig livskraft
Lagringsförhållanden och varaktighet
För att upprätthålla cellinjes livskraft på lång sikt är det viktigt att lagra dem vid temperaturer under -135°C [7][2]. Detta säkerställer att de förblir bevarade på obestämd tid.Den föredragna metoden för att lagra odlade köttcellinjer är ångfas flytande kväve. Denna teknik håller temperaturer mellan -135°C och -190°C, vilket gör den idealisk för långsiktig bevarande samtidigt som den erbjuder ökad säkerhet jämfört med lagring i vätskefas.
Om du behöver lagra celler vid -80°C, begränsa detta till en period av 24 timmar till en vecka. Utöver detta kan cellernas livskraft minska.För tillfällig lagring vid denna temperatur, överför cellerna till flytande kvävelagring så snart som möjligt.
Använd standardsterila kryovials (1–2 mL) med inre gängor och en O-ring för säker lagring [4][5]. Placera alltid förseglade kryovials i gasfasen snarare än i vätskefasen av kväve för att minska risken för flaskexplosioner under upptining [5]. Se dessutom till att bulkflytande kvävebehållare hålls minst halvfulla för att upprätthålla en säkerhetsbuffert.
Slutligen är rigorösa kvalitetskontrollåtgärder avgörande för att säkerställa cellernas långsiktiga livskraft.
Kvalitetskontrollkontroller
För att säkerställa tillförlitligheten hos lagrade cellinjer, följ strikta protokoll för kvalitetskontroll. Börja med att noggrant märka varje flaska med kväleksresistenta etiketter.Inkludera viktiga detaljer såsom cellinjeidentitet, batchnummer, passagesnummer och frysdato. Upprätthåll en elektronisk databas för att registrera den exakta platsen för varje flaska, vilket minskar den tid som lagringsbehållare behöver för att förbli öppna [7][2].
Innan hela batcher åläggs långsiktig lagring, testa en flaskas livskraft efter kortvarig gasfaslagring. Detta steg hjälper till att bekräfta att frysningsprocessen var framgångsrik och identifierar eventuella potentiella problem [4][7][2]. För mycket värdefulla celllager är det klokt att lagra dubbletter på en sekundär plats för att skydda mot utrustningsfel eller lokala katastrofer [7][2].
Utrusta alla lagringskärl med temperaturövervakningssystem och larm för att upptäcka låga nivåer av flytande kväve [7]. Installera dessutom syrelarm i lagringsområden, inställda på att utlösas vid 18% syre (v/v), för att minimera kvävningsrisker för personal som arbetar med flytande kväve [7][2].
Kryopreservation av däggdjurscellinjer video protokoll
Slutsats och Viktiga Punkter
Här är en snabb sammanfattning av de väsentliga stegen och rekommendationerna för effektiv kryopreservation i produktion av odlad kött:
- Cellskörd: Samla celler under deras logaritmiska tillväxtfas, och säkerställ att livbarheten överstiger 90%. Använd 10% DMSO som kryoprotektant, även om glycerol kan vara ett alternativ för mer känsliga cellinjer [11][1].
- Kylning och lagring: Upprätthåll en kontrollerad kylhastighet och överför snabbt ampuller till ångfas vätsnitrogenlagring för att skydda cellintegriteten [11]
En studie av Roka Kakehi et al. belyser vikten av precision i kryopreservering [10]:
"Att säkerställa en pålitlig och konsekvent källa av celler genom att använda kryopreservering kommer att göra det möjligt för oss att öka den stabila tillgången på lovande celler för produktion av odlad kött." - Roka Kakehi et al., Tokyo Women's Medical University
- Upptiningsprocess: Upptina celler i ett vattenbad vid 37°C i cirka två minuter, stoppa när 80% av isen har smält. Detta minskar DMSO-toxicitet och förbättrar cellåtervinning [1]. Följ upp med livskraftskontroller efter upptining för att säkerställa framgång och finjustera framtida procedurer.
Dessa metoder fungerar hand i hand med strikta kvalitetskontrollpraxis. Märk alltid flaskor noggrant, upprätthåll organiserade register och genomför noggranna kontroller innan långsiktig lagring [11]. För specialiserade kryopreservationsbehov kopplar plattformar som
Vanliga frågor
Vilka är fördelarna med att använda kemiskt definierade medier för kryopreservering av cellinjer i produktion av odlat kött?
Kemiskt definierade medier ger flera fördelar när det gäller kryopreservering av cellinjer för produktion av odlat kött. Genom att ta bort odefinierade komponenter, som serum från djur, säkerställer de konsekventa och förutsägbara resultat - en avgörande faktor för att upprätthålla långsiktig tillförlitlighet hos cellinjer.
En annan nyckelfördel är den minskade risken för kontaminering och variabilitet. Detta stödjer inte bara högre kvalitets- och säkerhetsstandarder utan stämmer också perfekt överens med den precision och skalbarhet som krävs för att möta både regulatoriska krav och konsumentförväntningar inom den odlade köttindustrin.
Hur påverkar valet av kryoprotektant cellöverlevnad under frysning och upptining?
Valet av kryoprotektant är en nyckelfaktor för att bevara cellhälsan under frysning och upptining. Två allmänt använda alternativ är dimetylsulfoxid (DMSO) och glycerol, var och en med distinkta egenskaper. DMSO är känt för sin förmåga att snabbt tränga in i celler och ge starkt skydd. Men det kommer med en varning: vid höga koncentrationer eller med långvarig exponering kan det bli giftigt, vilket potentiellt kan sänka cellens livskraft.
Glycerol, å sin sida, är mindre giftigt och kan appliceras direkt.Nackdelen ligger i dess långsammare cellpenetration, vilket kan resultera i mindre omedelbart skydd jämfört med DMSO.
Att uppnå rätt balans är avgörande. Att korrekt justera koncentrationen och exponeringstiden för kryoprotektanten hjälper till att skydda celler samtidigt som risken för toxicitet minimeras. Dessutom är det viktigt att följa bästa praxis för kylhastigheter och lagringsförhållanden för att säkerställa de högsta möjliga återhämtningsgraden efter upptining.
Varför är det viktigt att kontrollera kylhastigheten under kryokonservering?
Att upprätthålla en jämn kylhastighet, vanligtvis mellan –1°C och –3°C per minut, är nyckeln till att hålla celler livskraftiga. Att kyla gradvis gör att celler kan avvattnas i en kontrollerad takt, vilket minskar risken för att skadliga iskristaller bildas, vilket kan riva eller skada cellmembran.
Denna mätade metod skyddar cellernas struktur, vilket ökar deras överlevnad och funktionalitet när de har tinats.
Att följa exakta kylprotokoll är avgörande för att säkerställa framgångsrik långsiktig lagring och återhämtning av cellinjer.











