Büyüme ortamını doğrulamak, İngiltere pazarında onay almak isteyen kültürlenmiş et şirketleri için zorunlu bir adımdır. Bu süreç, ürünlerin İngiltere Yeni Gıda Yönetmelikleri (AB 2015/2283) gibi sıkı düzenleyici çerçeveler altında güvenliğini, kalitesini ve uyumluluğunu sağlar. İşte bilmeniz gerekenler:
- Ana Gereklilikler: Büyüme ortamı, toksikoloji, kontaminasyon kontrolü, besin kalitesi ve alerjenlik standartlarını karşılamalıdır.
- İngiltere Yönetmelikleri: Gıda Standartları Ajansı (FSA), HACCP ilkelerine uyum ve Hayvansal Kökenli Ürünler (POAO) sınıflandırmasını gerektirir.
- Küresel Standartlar: İngiltere ve AB benzer çerçeveleri paylaşırken, ABD FD&C Yasası kapsamında CGMP düzenlemelerini takip eder.
- Doğrulama Süreci: Bileşim, saflık, işlevsellik ve tedarikçi uyumluluğunun kapsamlı test edilmesini, yanı sıra sağlam belgelerle birlikte içerir.
- Destek Girişimleri: 2025 yılında başlatılan Birleşik Krallık'ın £1.6 milyonluk düzenleyici sandbox'ı, şirketlerin bu standartlara uymasına yardımcı olur.
Uygun doğrulama, güvenliği sağlar, güven oluşturur ve yasal gerekliliklerle uyumlu hale getirir. Makale, test yöntemleri, tedarikçi nitelikleri ve düzenleyici başvuru ipuçları dahil olmak üzere adım adım süreci daha derinlemesine inceler.
Büyüme Ortamı için Düzenleyici Standartlar
Standartlar ve Kılavuzlar
Kültür et üretiminde kritik bir bileşen olan büyüme ortamı, uluslararası düzenleyici standartlara uymalıdır. Bu standartlar, her biri bileşim, güvenlik ve saflık için belirli gerekliliklere sahip bölgeler arasında farklılık gösterir.
Birleşik Krallık'ta, büyüme ortamı Yeni Gıda Yönetmelikleri (uyarlanmış Yönetmelik (AB) 2015/2283) kapsamında düzenlenmektedir. Piyasaya onaylanmadan önce kapsamlı bir güvenlik değerlendirmesi gereklidir [1]. Gıda Standartları Ajansı (FSA), hücrede yetiştirilen ürünleri Hayvansal Kökenli Ürünler (POAO) olarak Yönetmelik (EC) 853/2004 kapsamında sınıflandırmaktadır. Bu sınıflandırma, üreticilerin Tehlike Analizi ve Kritik Kontrol Noktaları (HACCP) ilkelerine dayalı gıda güvenliği yönetim sistemlerini uygulamalarını zorunlu kılmaktadır [3]. FSA ayrıca büyüme ortamı bileşimi hakkında ayrıntılı teknik rehberlik geliştirme sürecindedir ve daha fazla güncelleme beklenmektedir [1]. Bu çerçeveler, daha spesifik düzenleyici gereklilikler için temel sağlamaktadır.
Amerika Birleşik Devletleri'nde yaklaşım farklıdır.Büyüme ortamı bileşenleri, Federal Gıda, İlaç ve Kozmetik Yasası'nın (FD&C Yasası) Bölüm 501(a)(4)(B)'de belirtilen Mevcut İyi Üretim Uygulamaları (CGMP) gerekliliklerini karşılamalıdır [4]. FDA, ortam bileşenlerini "malzemeler ve reaktifler" olarak sınıflandırır ve bunlar 21 CFR bölümleri 210 ve 211 tarafından yönetilir. Bu bileşenler, kontaminasyonu önlemek için kalite doğrulamasından geçmelidir [4]. İlginç bir şekilde, kültive edilmiş et ortamının sentetik bileşenleri - amino asitler, vitaminler ve tuzlar gibi - genellikle 21 CFR 864.2220 altında Sınıf I tıbbi cihazlar olarak sınıflandırılır ve bu da onları ön pazar bildirim gerekliliklerinden muaf tutar [6][7].
Avrupa Birliği'nde, düzenleyici çerçeve, Birleşik Krallık ile yakından uyumludur ve aynı zamanda (AB) 2015/2283 Yönetmeliği'ni takip eder .Avrupa Gıda Güvenliği Otoritesi (EFSA), yetkilendirme sürecini denetler [1]. ICH Q6B kılavuzlarına göre, antibiyotikler, indükleyiciler ve diğer bileşenler dahil olmak üzere büyüme ortamı bileşenleri, süreçle ilgili safsızlıklar olarak kabul edilir. Bu safsızlıklar kontrol edilmeli ve kabul edilebilir seviyelere düşürülmelidir [5]. Mümkünse, yardımcı maddeler ve reaktifler farmakopoeial standartlara uygun olmalıdır [5].
| Yargı Yetkisi | Birincil Düzenleme | Sınıflandırma | Güvenlik Sistemi | Medya Denetimi |
|---|---|---|---|---|
| Birleşik Krallık (GB) | Uyumlaştırılmış Düzenleme (AB) 2015/2283 [1] | Hayvansal Kökenli Ürün (POAO) [3] | HACCP (Reg 852/2004) [3] | FSA/FSS Sandbox Rehberi [1] |
| Avrupa Birliği / NI | Düzenleme (AB) 2015/2283 [1] | Hayvansal Kökenli Ürün (POAO) [3] | HACCP (Reg 852/2004) [3] | EFSA Yetkilendirme Süreci [1] |
| Amerika Birleşik Devletleri | FD&C Yasası Bölüm 501(a)(4)(B) [4] | Yeni Hayvan İlacı / Gıda [4] | CGMP (21 CFR 210/211) [4] | FDA CVM / USDA-FSIS [4] |
Kültive Et için Düzenleyici Gereklilikler
Kültive et üreticileri, her bir büyüme ortamı partisinin katı güvenlik ve kalite standartlarına uygun olmasını sağlamalıdır.Büyüme ortamı doğrulaması, bu ürünler için daha geniş düzenleyici çerçevenin ana unsurlarından biridir. HACCP ilkeleri (Regülasyon (EC) 852/2004) uyarınca, büyüme ortamı birincil bir girdi ve kimyasal, mikrobiyal veya başka bir şekilde kontaminasyon kaynağı olarak tanımlanır [3]. FSA bu endişeyi vurgulamaktadır:
"Hücre kültürü ile üretilen ürünlerin üretimindeki ana tehlikeler, hücre hattı kimliği (ve tutarlılığı), üretim sürecinde ortaya çıkan tehlikeler (mikrobiyolojik kontaminasyon, büyüme ortamı ve nihai üründeki kalıntı bileşenler) ve alerjenlerdir." [3]
Büyüme ortamı formülasyonunda değişiklikler varsa, derhal bir HACCP incelemesi gereklidir [3].Birleşik Krallık'ta, akış diyagramlarının doğruluğunu ve kontrol önlemlerinin etkinliğini sağlamak için uygulamadan önce doğrulama yapılmalıdır . [3].
Amerika Birleşik Devletleri'nde, FDA, zararlı ajanların tanıtılmasını önlemek için tüm reaktiflerin ve medya bileşenlerinin katı kalite standartlarını karşılamasını zorunlu kılar [4]. Tedarikçiler ve sözleşmeli laboratuvarlar CGMP düzenlemelerine uymalıdır ve uyumsuz olan herhangi bir tedarikçi, ürünlerin "bozulmuş" olarak sınıflandırılmasını önlemek için kaldırılmalıdır [4]. FDA bunun önemini vurgular:
"Tüm yeni hayvan ilaçları, ACTP'ler dahil, bu tür ilaçların Federal Gıda, İlaç ve Kozmetik Yasası (FD&C Yasası) gerekliliklerini güvenlik açısından karşılamasını sağlamak için CGMP'ye uygun olarak üretilmelidir." [4]
Şu anda, BlueNalu, Gourmey, Hoxton Farms, Mosa Meat, Roslin Technologies, Vital Meat ve Vow gibi İngiltere'nin düzenleyici sandbox'ına katılan birkaç şirket, bu teknik standartları geliştirmek için FSA ile işbirliği yapıyor [1]. İngiltere düzenlemeleri uyarınca, işletmeler, yetkilendirme sürecinde sunulan gizli bilgiler için beş yıla kadar veri koruma talep edebilir [1].
Büyüme Ortamının Doğrulanması İçin Adımlar
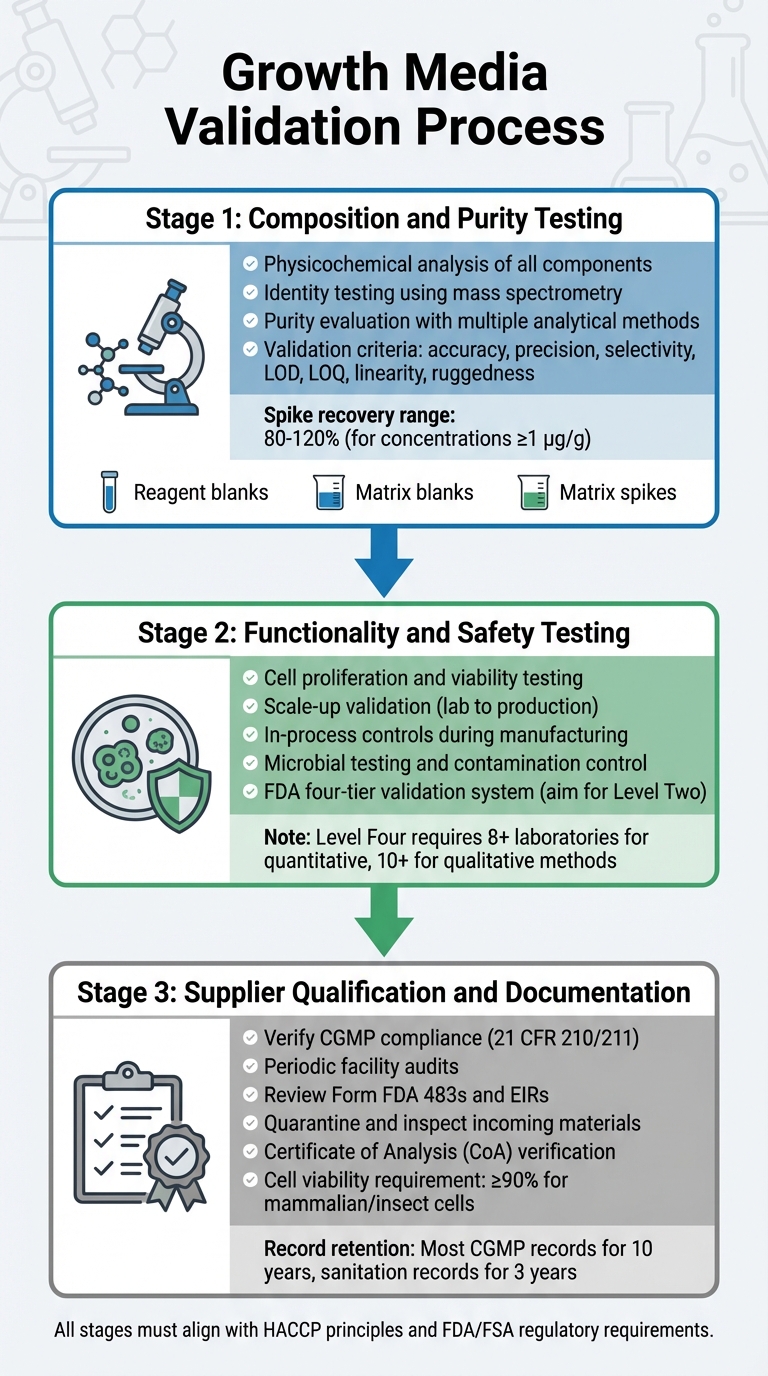
Kültive Edilmiş Etin Düzenleyici Onayı İçin Büyüme Ortamı Doğrulama Süreci
Büyüme ortamının doğrulanması, bileşimi, işlevselliği, güvenliği ve tedarikçi uyumluluğunu inceleyen ayrıntılı bir süreci içerir. Her adım, düzenleyici gerekliliklerle uyumlu sağlam bir doğrulama süreci sağlamak için bir öncekine dayanır. Bu, bileşim, işlevsellik ve tedarikçi uyumluluğu için testleri içerir.
Bileşim ve Saflık Testi
İlk aşama, her bileşenin kapsamlı bir fizikokimyasal analizine odaklanır. Bu, amino asitler, vitaminler ve inorganik tuzlar gibi bileşenlerin kesin bileşimini, fiziksel özelliklerini ve moleküler yapısını tanımlamayı içerir [5].Moleküler yapıları doğrulamak için kimlik testi, fizikokimyasal, biyolojik ve immünokimyasal teknikler dahil olmak üzere son derece spesifik yöntemler kullanır. Kütle spektrometrisi gibi araçlar, moleküler kimlikleri parçalanma desenleri aracılığıyla doğrulamak için kullanılır [8].
Saflık değerlendirmesi, istenen bileşenleri safsızlıklardan ayırmak için birden fazla analitik yöntem gerektirir. Bu testler, hem süreçle ilgili hem de ürünle ilgili safsızlıkları ele almalıdır [5]. Analitik teknikler, doğruluk, kesinlik, seçicilik, tespit sınırları (LOD), miktar tayin sınırları (LOQ), doğrusallık ve sağlamlık dahil olmak üzere katı doğrulama kriterlerini karşılamalıdır [8]. Doğrulama protokolleri ayrıca şunları içermelidir:
- Reaktif boşlukları reaktiflerin analitlerden arınmış olduğundan emin olmak için.
- Matris boşlukları numune ortamının müdahale etmediğini doğrulamak için.
- Matris artışları geri kazanım ve doğruluğu tahmin etmek için.
1 µg/g (ppm) konsantrasyonlarındaki kantitatif yöntemler için, kabul edilebilir artış geri kazanımları tipik olarak %80 ile %120 arasında değişir [8].
Tutarlılığı sağlamak için, üreticiler üretimle temsil edilen partilerden türetilen dahili birincil referans malzemeleri oluşturmalıdır. Bunlar, çalışma referans malzemelerini kalibre etmek için izlenebilir standartlar olarak hizmet eder [5]. Saflık testi tamamlandıktan sonra, ortamın etkili hücre büyümesini destekleme yeteneğini göstermesi ve güvenlik standartlarını karşılaması gerekir.
Fonksiyonellik ve Güvenlik Testi
Bileşimin doğrulanmasından sonra, medyanın kültürlenmiş et üretimini desteklemedeki etkinliğini kanıtlaması gerekir. Bu, hücrelerin çoğalabildiğini, canlılığını koruyabildiğini ve laboratuvar koşullarından üretim hacimlerine ölçeklenebildiğini göstermeyi içerir. FDA, ürün tutarlılığı ve güvenliğini sağlamak için hücre pasajı ve hasat gibi erken aşamalardan başlayarak üretim sırasında süreç içi kontroller gerektirir [4].
Güvenlik doğrulaması, FDA'nın ön-pazar değerlendirmelerinde belirtildiği gibi titiz mikrobiyal testler ve kontaminasyon kontrolünü içerir [9].
FDA, kimyasal yöntem doğrulaması için Dört Aşamalı bir sistem kullanır; bu sistem, Seviye Bir (acil veya sınırlı kullanım) ile Seviye Dört (AOAC/ISO standartlarını karşılayan tam işbirlikçi çalışmalar) arasında değişir [8].Rutin düzenleyici testler için, kapsamlı bir performans değerlendirmesi içeren Seviye İki tek laboratuvar doğrulamasını hedefleyin [8]. Kantitatif yöntemler için tam işbirlikçi çalışmalar en az sekiz laboratuvarın katılımını gerektirirken, kalitatif yöntemler on [8] laboratuvar gerektirir. Medyanın performansı doğrulandıktan sonra, tüm ham maddelerin uyumlu tedarikçilerden geldiğinden emin olmak önemlidir.
Tedarikçi Yeterliliği ve Belgeleri
Üreticiler, doğrulanmış, CGMP uyumlu tedarikçilerle çalışmalıdır. Tedarikçiler, 21 CFR 210/211'de belirtilen standartları karşılamalıdır [4]. Doğrulama, tedarikçi tesislerinin kalite programlarına, prosedürlerine ve genel CGMP uyumuna bağlılığını değerlendirmek için periyodik denetimleri içerir [4].
Sözleşmelere girmeden önce, bir tedarikçinin uyum geçmişini, Form FDA 483'ler ve Kuruluş Denetim Raporları (EIR'ler) dahil olmak üzere gözden geçirin [4]. FDA bu yükümlülüğün altını çizmektedir:
"Başka bir kuruluşla sizin için herhangi bir üretim adımını gerçekleştirmek üzere herhangi bir sözleşme, anlaşma veya başka bir düzenlemeye girmeden önce, kuruluşun geçerli düzenleyici CGMP'ye uyduğunu doğrulamalısınız." [4]
Tüm gelen malzemeler karantinaya alınmalı ve serbest bırakılmadan önce incelenmeli, ana spesifikasyonlara uygun olduklarından emin olunmalıdır [10]. Tedarikçilerin bir Analiz Sertifikası (CoA) veya izlenebilir, CGMP/GLP uyumlu test sonuçları sağlaması gerekmektedir [10].Kararlı hücre hatları için, belgeler izlenebilir bir klonlama geçmişini içermelidir [10]. Memeli veya böcek hücreleri genellikle CGMP projelerinde kabul için en az %90 canlılık gerektirir [10]. Kayıtlar, düzenleyici kılavuzlara göre saklanmalıdır [4].
Sözleşmeler, CGMP sorumluluklarını açıkça belirtmeli ve tedarikçilerin test kitleri veya metodolojilerinde önerilen herhangi bir değişikliği üreticilere bildirmesini gerektirmelidir [4]. Testler dış kaynaklıysa, sözleşmeli laboratuvarların doğrulanmış analitik yöntemler kullandığından ve FDA'ya kayıtlı olduğundan emin olun [4].
Düzenleyici Başvuru Belgelerinin Hazırlanması
Büyüme ortamınız doğrulandıktan sonra, FDA ve USDA-FSIS tarafından talep edilen tüm güvenlik ve kalite standartlarına uygunluğu gösteren bir dosya derlemek bir sonraki adımdır. Bu dosya, doğrulama ve düzenleyici uyum arasında kritik bir bağlantı görevi görerek yetkililere ortamınızın güvenliği ve üretim süreçleri hakkında net bir görüş sunar.
Başvuru Dosyasının Gerekli Unsurları
Dosyanız, tüm amino asitler, vitaminler, inorganik tuzlar ve büyüme faktörlerini listeleyen ortam bileşiminin ayrıntılı bir dökümünü içermelidir. FDA yönergeleri, inceleme sürecinin sadece ortamı değil, tüm üretim iş akışını değerlendirdiğini vurgular. Bu, hücre hatlarının ve bankalarının kurulmasını, üretim kontrollerinin uygulanmasını ve tüm bileşenlerin ve girdilerin doğrulanmasını içerir [11].
Ayrıca, dosya, kültürlenmiş malzemenin ve tüm girdilerinin gıda güvenliğini kanıtlayan kapsamlı bir güvenlik ve toksikolojik değerlendirme içermelidir. Üretiminizin tutarlı ve kirleticilerden arınmış olduğunu göstermek için üretim kontrol kayıtları, süreç doğrulama verileri ve kalite programı belgelerini ekleyin.
Ayrıca, ortamda kullanılan tüm malzemeler için doğrulama gösteren tedarik ve reaktif doğrulama kayıtlarını sağlamalısınız, bunlar evde hazırlananları da içermelidir. USDA-FSIS tarafından düzenlenen ürünler için HACCP planları ve sanitasyon protokollerini ekleyin. FDA, çoğu CGMP kaydının en az 10 yıl süreyle saklanmasını tavsiye ederken, tesis temizliği ve sanitasyon kayıtlarının en az 3 yıl saklanması gerektiğini belirtir [4]. Bu, tüm girdilerin CGMP ve düzenleyici gereklilikleri karşıladığını sağlamak için tedarikçi yeterlilik çabalarıyla uyumludur.
Tesis Uygunluğunu Belgeleme
İnsan tüketimi için kültive edilmiş et üretmeden, işlemden geçirmeden veya depolamadan önce, tesislerin FDA'ya kaydolması gerekmektedir [12]. Belgeleriniz, tehlike analizi (biyolojik, kimyasal ve fiziksel), önleyici kontroller (temizlik, alerjen yönetimi ve tedarik zinciri önlemleri gibi) ve denetim prosedürlerini kapsayan kapsamlı bir gıda güvenliği planını içermelidir [12].
Medya dolum simülasyonları da önemli bir gerekliliktir. Bunlar, aseptik uygulamaları doğrulamak için 14 günlük inkübasyon ve büyüme teşvik testi içerir.FDA'nın açıkladığı gibi:
"Medya dolumu, kritik (steril) ekipmanın aseptik montajını ve çalışmasını değerlendirmeli, operatörleri nitelendirmeli ve tekniklerini değerlendirmeli ve çevresel kontrollerin yeterli olduğunu göstermelidir" [2].
Kayıtlarınızın, bir satıcıdan gelen ilk üç parti ortam üzerinde yapılan testler gibi tedarikçi nitelik verilerini içerdiğinden emin olun, böylece Analiz Sertifikası ile eşleştiği doğrulanabilir. Diğer önemli kayıtlar arasında çevresel kontrol günlükleri, ekipman kalibrasyon programları ve sıcaklık izleme verileri bulunur. USDA tarafından düzenlenen süreçler için HACCP planları, yazılı temizlik standart işletim prosedürleri (SSOP'ler) ve geri çağırma prosedürleri hazırlayın [12][13].
sbb-itb-ffee270
Regülasyona Uygun Büyüme Ortamı Tedariki için Cellbase Kullanımı
Kültür Et için Doğrulanmış Tedarikçiler
Büyüme ortamı formülasyonunuzu doğruladıktan sonra, düzenleyici standartlara uygun bileşenleri temin etmek bir sonraki adımdır. Bu, genel tedarikçilerden sipariş vermek kadar basit değildir. Hücre kültürü ürünleri için katı hijyen düzenlemeleri geçerlidir ve her büyüme ortamı bileşeni, düzenleyici onay için belirli belgelerle birlikte gelmelidir [3]. İşte burada
Tedarik Özellikleri
Platform ayrıca şeffaf fiyatlandırma ve doğrudan mesajlaşma özelliği sunarak ekiplerin hızlı bir şekilde teklif, analiz sertifikaları ve diğer düzenleyici belgeleri talep etmelerini sağlar.Bu kritik tedarik fonksiyonlarını, kültive edilmiş et üretimine özel bir sistemde birleştirerek,
Sonuç
Büyüme medyasının düzenleyici onay için doğrulanması sadece bir kutuyu işaretlemek değil - Birleşik Krallık pazarına kültive edilmiş et ürünlerini sunmak için yasal bir gerekliliktir. Bu, bileşim ve saflık için kapsamlı testler yapmayı, güçlü bir HACCP planı uygulamayı ve her adımda ayrıntılı belgeler tutmayı içerir.
"Gıda, eğer güvensizse piyasaya sürülmemelidir. Bu, sağlığa zararlı olmadığı ve insan tüketimi için uygun olmadığı anlamına gelir." - Gıda Standartları Ajansı [3]
Birleşik Krallık Gıda Standartları Ajansı'nın £1.6 milyonluk Düzenleyici Kum Havuzu, büyüme ortamı bileşimi hakkında net teknik rehberlik oluşturmak için sektör oyuncularıyla çalışma taahhüdünü vurgulamaktadır [1]. Şu anda uygun doğrulamaya öncelik veren şirketler, bu kılavuzlar tamamen tanımlandığında daha güçlü bir konumda olacaklardır.
Uyum standartlarını karşılamak sadece düzenleyici kutuları işaretlemekle ilgili değildir - tüketici güvenini kazanmak ve ürün güvenliğini sağlamakla ilgilidir. Katı kalite testleri, hem düzenleyici onayın hem de pazar kabulünün merkezindedir. Yetkilendirme sürecini kolaylaştırmak için güçlü doğrulama protokolleri oluşturun, doğru kayıtlar tutun ve güvenilir tedarikçilerle işbirliği yapın. Bu adımlar, yalnızca onayı basitleştirmekle kalmayacak, aynı zamanda daha büyük tüketici güveninin de yolunu açacaktır.
SSS
Büyüme ortamını düzenleyici onay için doğrulamanın ana adımları nelerdir?
Büyüme ortamını düzenleyici onay için doğrulamak, formülasyonun güvenli, güvenilir ve yetiştirilen et üretimi için uygun olduğunu kanıtlamakla ilgilidir. İşte sürecin genellikle nasıl göründüğü:
- Risk değerlendirmesi: Kullanacağınız hücre hattını, ürünün hedeflerini ve kritik kalite özelliklerini (pH veya besin bileşimi gibi) tanımlayarak başlayın. Mikrobiyal kontaminasyon gibi potansiyel tehlikeleri belirleyin ve bu riskleri kontrol altına almak için önlemler belirleyin.
- Test ve spesifikasyonlar: Sterilite, saflık ve etkinlik gibi faktörler için net kabul kriterleri belirleyin. Bu standartların sürekli olarak karşılandığından emin olmak için yerleşik test yöntemlerini kullanın.
- Doğrulama çalışmaları: Sonuçların tekrarlanabilir ve tutarlı olduğunu doğrulamak için ekipman kalifikasyonu ve birden fazla partinin test edilmesi dahil olmak üzere kapsamlı bir süreç doğrulaması yapın.
- Stabilite testi: Medyanın zaman içinde nasıl dayandığını, uygun saklama koşulları altında (genellikle 2–8 °C) planlanan raf ömrü boyunca kalitesini değerlendirerek kontrol edin.
- Dokümantasyon: Tüm test sonuçları ve analizleri içeren kapsamlı bir doğrulama dosyası oluşturun. Bu, düzenleyici gereklilikleri karşılamak için gereklidir.
Bu adımların her birini dikkatlice ele alarak, medyanın kültive edilmiş et üretimi için gerekli güvenlik ve kalite standartlarını karşıladığını göstermek için gereken kanıtları toplayacaksınız.
Birleşik Krallık ve ABD'deki kültive et için kullanılan büyüme medyası düzenlemeleri arasındaki temel farklar nelerdir?
Birleşik Krallık'ta, kültive et için büyüme medyasının düzenlenmesi Yeni Gıdalar Yönetmeliği (AB Yönetmeliği 2015/2283) kapsamında olup, GB yasasında korunmuştur. 15 Mayıs 1997'den önce yaygın olarak tüketilmeyen ürünlerde kullanılan herhangi bir büyüme medyası, Gıda Standartları Ajansı (FSA) tarafından resmi bir yeni gıda değerlendirmesinden geçmelidir. Bu süreç, medyanın bileşimi, kökeni ve saflığı hakkında ayrıntılı belgelerin sunulmasını gerektirir. Ayrıca, hücre kültürü sürecinde kirleticilerin nasıl kontrol edildiğini göstermek için HACCP tabanlı bir risk değerlendirmesi gereklidir.
Aralık 2025'ten itibaren, FSA Hücre-Kültive Ürünler sandbox uygulamaya koymuştur. Bu girişim, yeni gıda başvuruları için rehberlik sağlar ve daha hızlı veri toplanmasını destekler.Nihai yetkilendirmeyi kazanmak için, şirketler medya güvenliği, tutarlılık ve üretim doğrulamasını ele alan kapsamlı bir dosya sunmalıdır. Bu onaydan sonra ürün Büyük Britanya'da satılabilir.
Buna karşılık, Amerika Birleşik Devletleri'nde büyüme medyasına özel bir yeni gıda çerçevesi bulunmamaktadır, bu da doğrudan düzenleyici karşılaştırmaları zorlaştırmaktadır. İngiltere merkezli şirketler için, bu katı standartlara zaten uyan medya bileşenlerini temin etmek, onay sürecini basitleştirebilir.
Birleşik Krallık'ın düzenleyici sandbox'ı büyüme medyası doğrulamasını nasıl destekliyor?
Birleşik Krallık'ın kültive edilmiş ürünler için düzenleyici sandbox'ı, şirketlerin büyüme medyası formülasyonlarını test edip geliştirebilecekleri iyi organize edilmiş bir ortam sağlar. Gıda Standartları Ajansı (FSA) ve Gıda Standartları İskoçya (FSS) tarafından denetlenen bu program altı aylık aşamalar halinde yürütülür. Bu süre zarfında, işletmeler güvenlik testleri yapabilir, risk değerlendirmeleri gerçekleştirebilir ve belgeleri gözden geçirirken düzenleyicilerden değerli geri bildirimler alabilirler.
Bu uygulamalı yaklaşım, pratik denemelere ve adım adım iyileştirmelere olanak tanır, güvenlik verilerinin toplanmasını hızlandırır ve şirketlerin düzenleyici gerekliliklere uyum sağlamasına yardımcı olur. Kültive edilmiş et üzerinde çalışanlar için, önceden onaylanmış büyüme medyasını











