Skalering af bioreaktorer til produktion af dyrket kød er komplekst, især når man håndterer shear stress, en mekanisk kraft, der kan beskadige pattedyrsceller under opskalering. I modsætning til mikrobielle celler er pattedyrsceller skrøbelige og følsomme over for turbulens og luftning. Når shear stress overstiger 3 Pa, kan celler sprænges, hvilket reducerer levedygtighed og produktivitet.
For at imødegå disse udfordringer stoler ingeniører på Computational Fluid Dynamics (CFD) og skalering-ned modeller for at forudsige og håndtere shear stress før fuldskala produktion. CFD analyserer strømningsmønstre, shear zoner og blandingseffektivitet i bioreaktorer, mens skalering-ned modeller validerer disse forudsigelser eksperimentelt, hvilket minimerer risici under opskalering.
Vigtige Punkter:
- Shear Stress Grænser: Pattedyrsceller tåler op til 3 Pa; overskridelse af dette skader cellerne.
- CFD-værktøjer: Avancerede metoder som Large Eddy Simulations (LES) og Lattice-Boltzmann-simuleringer (LB-LES) muliggør præcis modellering af flow og turbulens.
- Scale-Down Modeller: Disse replikerer store bioreaktorbetingelser i mindre opsætninger for at validere CFD-forudsigelser.
-
Designovervejelser:
- Brug pitched-blade impellere for lavere shear.
- Oprethold Kolmogorov hvirvellængder over 20 μm for at forhindre celledamage.
- Hold impellerspidsens hastigheder under 1,5 m/s.
Ved at kombinere CFD-indsigter med eksperimentel validering kan teams optimere bioreaktordesigns til dyrket kødproduktion, hvilket sikrer celleoverlevelse og effektiv skalering.
CFD Kompas | Bedste Praksis for Bioreaktor CFD
Brug af Computational Fluid Dynamics (CFD) til at Modellere Skærspænding
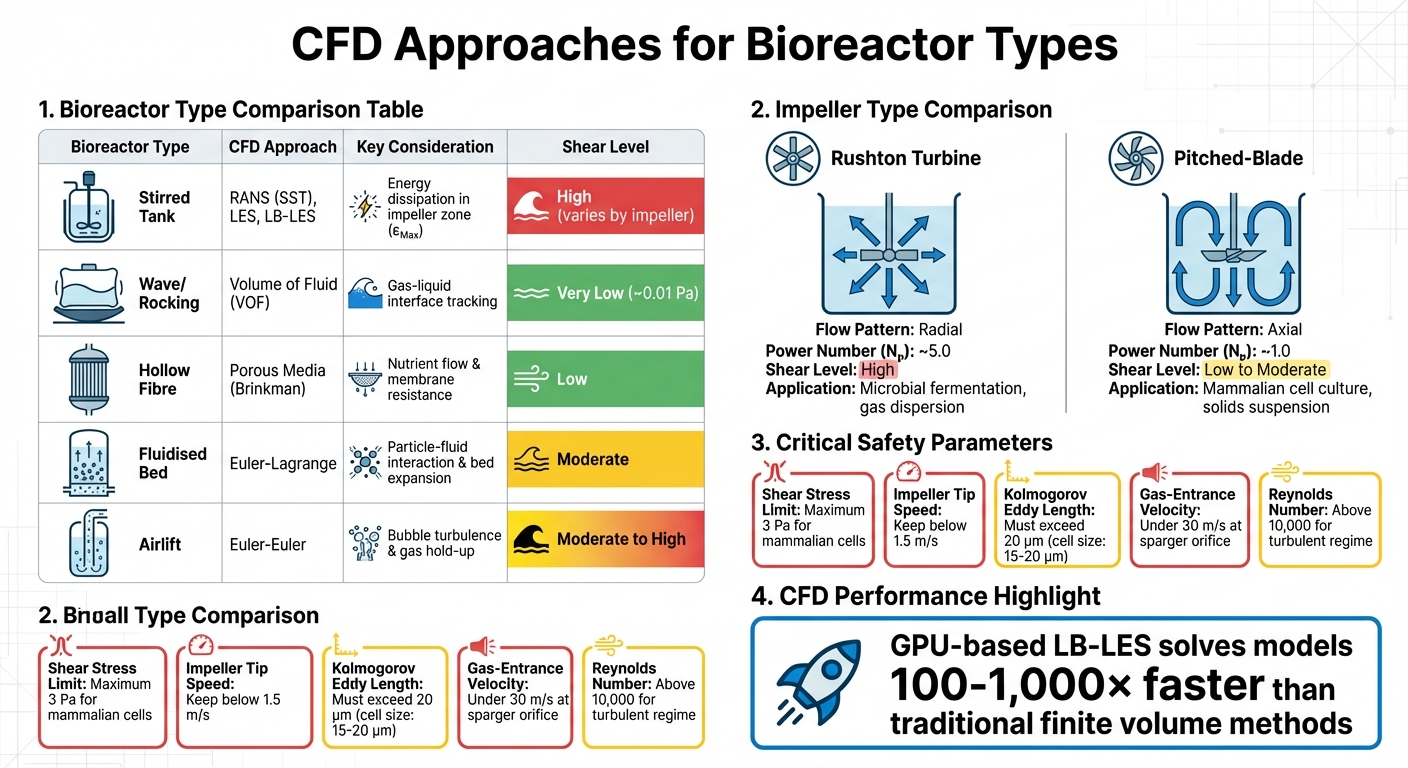
CFD Tilgange og Nøgleparametre for Forskellige Bioreaktortyper i Dyrket Kødproduktion
CFD-simuleringer giver ingeniører værktøjerne til at kortlægge væskedynamik og skærkræfter inden i bioreaktorer, før de fysisk bygges. I stedet for at stole på forsøg-og-fejl-metoder i produktionsskala hjælper CFD med at forudsige kritiske faktorer som høj-skær zoner, turbulente hvirvler og cellelevedygtighed i specifikke dele af beholderen. Dette er især vigtigt i dyrket kødproduktion, hvor bioreaktorskalaer potentielt kan nå 200.000 liter - langt større end traditionelle biofarmaceutiske beholdere [8]. Disse forudsigende indsigter vejleder skaleringsforsøg og påvirker udstyrsvalg.
Udviklingen af beregningsmetoder har været bemærkelsesværdig. Mens Reynolds-Averaged Navier-Stokes (RANS) modeller, såsom k-ε, fortsat er meget anvendt i industrien, presser avancerede metoder som Large Eddy Simulations (LES) og GPU-drevne Lattice-Boltzmann simuleringer (LB-LES) grænserne. Ifølge professor Miroslav Soos fra University of Chemistry and Technology Prague kan GPU-baserede LB-LES løse modeller "100 til 1.000 gange hurtigere end almindeligt anvendte finite volume metode løsere" [2]. Denne hastighedsfordel gør det muligt for ingeniører at simulere massive beholdere med den præcision, der er nødvendig for at opdage cellebeskadigende hvirvler.
Et praktisk eksempel på CFD's kapaciteter kommer fra forskere hos Regeneron Ireland DAC og Thermo Fisher Scientific. De skalerede med succes en cellekulturproces fra en 2.000-liters bioreaktor til en geometrisk forskellig 5.000-liters engangsbioreaktor.I stedet for at stole på empiristiske heuristikker, brugte de CFD til at analysere parametre som massetransferrater, blandingstider og skærehastigheder. Denne tilgang muliggjorde en vellykket opskalering ved første forsøg, hvilket undgik de dyre fejl, der ofte er forbundet med opskalering baseret på effekt-per-volumen-forhold [5].
Opsætning af CFD for omrørte tankbioreaktorer
For at opsætte CFD for omrørte tankbioreaktorer, start med at definere beholderens geometri - dette inkluderer tankdimensioner, impellerdesign (e.g., Rushton eller skråbladet) og baffelplacering. Valg af den rigtige turbulensmodel er afgørende: den realiserbare k-ε model fungerer godt for gas-væske systemer, mens LB-LES tilbyder højere opløsning til at identificere topbelastninger, der kunne skade celler. En gitterkonvergensundersøgelse sikrer, at resultaterne ikke er afhængige af maske størrelse.
Grænsebetingelser skal afspejle virkelige driftsparametre, såsom impellerhastighed, gasindblæsningshastigheder, væsketæthed og viskositet. Til dyrket kød anvendes ofte konservative bobletrækningsmodeller til at estimere forskydningsspænding [8]. Systemet bør operere i et fuldt turbulent regime, med Reynolds-tal over 10.000 for at sikre, at effektantallet forbliver konsistent uanset impellerhastighed [1].
CFD-forudsigelser for iltoverførsel, blandingstider og hydrodynamisk stress bør stemme overens med eksperimentelle data indsamlet ved hjælp af forskydningsfølsomme mikroprober eller nanopartikelaggregater [2]. For eksempel guidede en matematisk masseoverførselsmodel den direkte opskalering af en CHO-cellekulturproces fra en 2-liters bordmodel til en 1.500-liters industriel bioreaktor hos Sartorius.Ved at bruge CFD til at forudsige iltbehov og CO₂-fjernelse, opretholdt teamet ensartede produktkvalitetsattributter - såsom N-glykaner og ladningsvarianter - på tværs af skalaer [6].
CFD for andre bioreaktortyper
Mens omrørte tanke dominerer industriel cellekultur, kræver andre bioreaktordesign skræddersyede CFD-tilgange. For eksempel er vuggende eller bølge bioreaktorer afhængige af Volume of Fluid (VOF) metoden til at simulere gas-væske grænsefladen, da bølgebevægelse driver forskydningsspænding i disse systemer. Disse designs skaber meget mildere forskydningsmiljøer - maksimal spænding er omkring 0,01 Pa sammenlignet med omrørte tanke - men deres skalerbarhed er begrænset for storskalaproduktion af dyrket kød [4].
Hul-fiber bioreaktorer, derimod, bruger porøse mediemodeller baseret på Brinkman-ligninger til at simulere næringsstofdiffusion og flowmodstand gennem membraner.Fluidiserede bedsystemer kræver Euler-Lagrange-modeller for at fange partikel-væske-interaktioner og bedudvidelse, mens airlift-bioreaktorer bruger Euler-Euler-metoder til at analysere bobleinduceret turbulens og gasophold [4]. Hver design har unikke udfordringer: fluidiserede senge skal balancere mikrobærerfordeling mod skæreksponering, mens airlift-systemer skal håndtere stress forårsaget af sprængende bobler, en førende årsag til celledød i spargede bioreaktorer [1] [7].
Forståelse af disse CFD-tilgange er afgørende for at kontrollere skærestress på tværs af forskellige bioreaktordesigns, der anvendes i produktionen af dyrket kød.
| Bioreaktor Type | CFD Metode | Vigtig Overvejelse |
|---|---|---|
| Omrørt Tank | RANS (SST), LES, LB-LES | Energidissipation i impellerzonen (εMax) |
| Bølge/Gynge | Volume of Fluid (VOF) | Sporing af gas-væske grænsefladen |
| Hul Fiber | Porøst Medie (Brinkman) | Næringsstofstrøm og membranmodstand |
| Fluidiseret Seng | Euler-Lagrange | Interaktion mellem partikler og væske, sengeekspansion |
| Luftløft | Euler-Euler | Turbulens fra bobler og gasophobning |
Disse forskellige CFD-metoder fremhæver behovet for skræddersyede strategier, som spiller en kritisk rolle i valg af udstyr og håndtering af forskydningsspænding.
Skaleringsmodeller og eksperimentel validering
Mens Computational Fluid Dynamics (CFD) giver værdifulde forudsigelser, kan det ikke erstatte behovet for test i den virkelige verden, når processer skaleres op. Eksperimentel validering spiller en afgørende rolle i at sikre, at computermodeller nøjagtigt repræsenterer virkelige skærebelastningsforhold. Det er her, skaleringsmodeller kommer ind i billedet, idet de efterligner det hydrodynamiske miljø i store produktionsbioreaktorer i mindre, lettere håndterbare systemer. Ved at gøre dette reducerer de risikoen for dyre fejl, når man går fra småskala til industriskala operationer. Dette trin bekræfter ikke kun CFD-forudsigelser, men sikrer også en mere pålidelig og effektiv opskaleringsproces.
Oprettelse af skaleringsmodeller
Design af en skaleringsmodel begynder med at opretholde geometrisk lighed.Dette betyder at holde de samme aspektforhold mellem nøglekomponenter, såsom forholdet mellem beholderens højde og diameter samt impellerens diameter til tankens diameter [11]. Når geometrien er justeret, vælger ingeniører et skaleringskriterium. Almindelige valg inkluderer effekt pr. volumen (P/V), impellerens spidshastighed eller energidissipationshastighed (EDR). Dog giver fokus på lokaliseret EDR frem for gennemsnitlig P/V en bedre forståelse af skær heterogenitet, hvilket er kritisk for præcis modellering.
En mere avanceret tilgang involverer multi-kompartment simulatorer. For eksempel udviklede Emmanuel Anane og hans team i februar 2021 en to-kompartment skaleringssimulator, der kombinerer en omrørt tankreaktor (STR) og en plug-flow reaktor (PFR). Denne model blev brugt til at studere, hvordan CHO-celler reagerer på opløste iltgradienter. Deres forskning afslørede en kritisk opholdstidstærskel på 90 sekunder.Ud over dette punkt viste CHO-celler et fald på 15% i levedygtig celletæthed og en stigning i laktatakkumulering [10]. Denne opdagelse giver en klar benchmark for design af industrielle bioreaktorer, der opretholder cellelevedygtighed.
For at beskytte cellevækst sigter ingeniører ofte mod at holde impellertipshastigheder under 1,5 m/s [1]. Derudover bør Kolmogorov mikrohvirvellængden - et mål for turbulens - overstige cellernes størrelse, typisk 20 μm eller mere for pattedyrsceller, for at undgå hydrodynamisk skade [1][3]. For eksempel, ved en energitilførsel på 0,1 W/kg i dyrecellekulturer, er de mindste hvirvler omkring 60 μm, hvilket giver en sikker buffer [3].
Validering af CFD-forudsigelser gennem eksperimenter
Når en nedskaleret model er på plads, er eksperimentelle metoder essentielle for at validere de parametre, der er afledt fra CFD. Particle Image Velocimetry (PIV) er en meget anvendt teknik til dette formål. Ved at spore partikler i væsken hjælper PIV med at bekræfte, om strømningsmønstrene og hastighedsfelterne i den nedskalerede model stemmer overens med CFD-forudsigelserne [12][4].
Sporstofinjektion og affarvningsmetoder bruges også til at validere blandingstider. I denne proces introduceres sporstoffer som syrer, baser eller saltopløsninger nær impelleren, og deres fordeling overvåges, indtil 95% homogenitet er opnået [12][3]. For store bioreaktorer til pattedyrsceller (5.000 L til 20.000 L) varierer blandingstiderne typisk fra 80 til 180 sekunder [10].
I marts 2020 lykkedes det James Scully og hans team hos Regeneron Ireland DAC at opskalere en cellekulturproces fra en 2.000 L bioreaktor til en 5.000 L engangsbioreaktor med en anden geometri. De stolede på CFD til at forudsige nøgleparametre som massetransferrater, blandingstider og skærehastigheder. Disse forudsigelser blev derefter valideret gennem enkeltfase- og flerfaseeksperimenter, hvilket muliggjorde et vellykket første forsøg på opskalering uden behov for storskala pilotkørsler [5].
"CFD-simuleringer bliver i stigende grad brugt til at supplere klassiske procesingeniørundersøgelser i laboratoriet med rumligt og tidsmæssigt opløste resultater, eller endda erstatte dem, når laboratorieundersøgelser ikke er mulige." - Stefan Seidel, School of Life Sciences, ZHAW [12]
Yderligere valideringsteknikker inkluderer momentmåling for at bekræfte specifik effektindgang (P/V) og dimensionsløse effektantal ved specifikke omrøringshastigheder [12][3]. Ilttransferrater verificeres ved hjælp af metoder som udgasnings- eller sulfitteknikker, der bestemmer det volumetriske iltmasseoverførselskoefficient (kLa) [12][7]. For systemer, der bruger mikrobærere, anvendes lysdæmpning eller kamerabaserede metoder til at finde den minimale hastighed, der er nødvendig for at suspendere alle partikler, hvilket sikrer, at CFD-forudsigelser af fast fasefordeling er nøjagtige [12][4].
sbb-itb-ffee270
Faktorer Der Påvirker Skærspænding i Bioreaktorer
For at beskytte cellelevedygtighed under opskalering er det afgørende at forstå de fysiske faktorer, der driver skærspænding. Beregninger med Computational Fluid Dynamics (CFD) og valideringer i mindre skala afslører, at energidissipationshastighed (EDR) spiller en nøglerolle. EDR måler, hvordan impellerens kinetiske energi omdannes til varme, hvilket fører til ujævn energifordeling. For eksempel i impellere med skrå blade har energien tendens til at koncentrere sig omkring impelleren, hvilket skaber zoner med høj skærspænding, der kan skade celler, hvis de ikke håndteres korrekt.
Impellerdesign og Effektinput
Den type impeller, der anvendes, påvirker i høj grad strømningsmønstre og skærintensitet. Rushton-turbiner genererer for eksempel radial strømning og høj skærspænding, hvilket gør dem ideelle til mikrobiel fermentering, men mindre egnede til skærefølsomme pattedyrsceller.På den anden side skaber pitched-blade impellere aksial flow med lavere shear og bedre pumpeeffektivitet ved samme effektinput. Dette gør dem til det foretrukne valg til applikationer som dyrket kødproduktion, hvor cellelevedygtighed er en prioritet.
| Impeller Type | Flow Pattern | Power Number (Nₚ) | Shear Level | Primary Application |
|---|---|---|---|---|
| Rushton Turbine | Radial | ~5.0 | High | Mikrobiel fermentering; gasdispersion[3] |
| Pitched-Blade | Axial | ~1.0 | Lav til Moderat | Pattedyrscellekultur; suspension af faste stoffer [3] |
Skaleringsstrategier er ofte afhængige af at opretholde en konstant effektindgang pr. volumen (P/V). Men når reaktorstørrelsen øges, kan dette føre til højere impellerspids hastigheder. For pattedyrsceller bør spidshastigheder forblive under 1,5 m/s for at undgå vækstproblemer [1]. I storskala reaktorer kan sparging introducere endnu mere hydrodynamisk stress end impellere, især i beholdere der overstiger 20 m³ [9]. Disse faktorer er tæt forbundet med turbulens, som udforskes yderligere i diskussionen om Kolmogorov-skalaen.
Kolmogorov-skala og Turbulensmodellering
Kolmogorov-skalaen (λ) definerer størrelsen af de mindste turbulente hvirvler, hvor energi dissiperer som varme.Hvis disse hvirvler er mindre end cellediameteren, bliver mekanisk skade en bekymring. For pattedyrsceller, som typisk er 15–20 μm i størrelse, skal hvirvellængden overstige 20 μm for at undgå skade [1][3]. For eksempel, ved en energitilførsel på 0,1 W/kg, er Kolmogorov hvirveldiameteren omkring 60 μm, hvilket giver en sikker buffer [3].
"Hvis biologiske enheder (e.g., pattedyrsceller) er mindre end λ [Kolmogorov skala] i en bioreaktor, vil skæreskade på sådanne enheder ikke forekomme." - Muhammad Arshad Chaudhry [3]
I august 2024 brugte forskere fra Boehringer Ingelheim Pharma og University of Chemistry and Technology Prague Lattice-Boltzmann Large Eddy Simulations (LB-LES) til at validere CFD-forudsigelser i en 12.500 L industriel bioreaktor.Ved at bruge skærefølsomme nanopartikelaggregater målte de maksimalt hydrodynamisk stress og demonstrerede, at LB-LES kunne løse turbulente skalaer 100–1.000 gange hurtigere end traditionelle metoder [2]. Disse fund er afgørende for at udvikle strategier til at minimere skærestress.
Reducering af skærestress ved hjælp af modelleringsdata
CFD-modellering gør det muligt for ingeniører at identificere høj-skærezoner og justere driftsbetingelserne i overensstemmelse hermed. En effektiv tilgang er at introducere substrater, pH-baser eller antiskummidler nær impellerzonen i stedet for ved væskeoverfladen. Dette sikrer hurtig distribution og minimerer lokaliserede koncentrationsgradienter [3]. I produktionen af dyrket kød kan overdreven skæring løsne celler fra mikrobærere, mens utilstrækkelig omrøring fører til mikrobæreraflejring og næringsstofubalancer [9].
Beskyttende additiver som Pluronic F-68 (Poloxamer 188) anvendes ofte til at beskytte celler mod skærekrafter, især dem forårsaget af boblebristning ved væskeoverfladen - en stor bidragyder til celledød i bioreaktorer [1]. Med disse overfladeaktive stoffer er energitilførsler så høje som 100.000 W/m³ blevet rapporteret uden dødelige effekter [1]. Derudover hjælper det at holde gasindgangshastigheden ved spargeråbningen under 30 m/s med at reducere produktivitetstab og celledødelighed [1].
Find udstyr til bioreaktorskala
Hvordan Cellbase understøtter indkøb af bioreaktorer
Opskalering af bioreaktorer til produktion af dyrket kød kommer med sine egne udfordringer. Det er her
Når man bruger
Succesfuld skalering af bioreaktorer brugt inden for biofarmaceutisk industri spiller en stor rolle i kvaliteten og tiden til markedet for disse produkter [5].
Ved at udnytte CFD-understøttede data kan teams strømline udvælgelsen af udstyr og minimere behovet for gentagne prøveforsøg [5]. Disse indsigter er afgørende for at vælge bioreaktorer designet med optimal styring af skærespænding i tankerne.
Valg af udstyr til kontrol af skærespænding
For effektivt at kontrollere skærespænding er visse udstyrsspecifikationer særligt vigtige. Impellergeometri er en nøglefaktor. For eksempel genererer skråbladede impellere aksial flow med et effektantal (Np) på cirka 1,0, mens Rushton-turbiner har en meget højere Np på omkring 5,0.Dette betyder, at design med skrå blade producerer betydeligt mindre kraft og derfor mindre skær ved samme rotationshastighed [3]. For applikationer, der involverer pattedyrsceller brugt i dyrket kød, er det essentielt at holde impeller-spidsens hastighed under 1,5 m/s for at undgå celledamage [1].
Spargerkonfiguration er en anden kritisk overvejelse. For at forhindre overdreven skær skal udstyret sikre, at gasindgangshastigheden ved spargeråbningen forbliver under 30 m/s, og at åbningens Reynolds-tal forbliver under 2.000. Overskridelse af disse grænser kan føre til "jetting regime", hvor bobler spredes ujævnt og skaber lokaliserede skærzoner [1]. Borede huller eller åbne rør-spargere er bedre egnet til skærfølsomme celler sammenlignet med mikrospargere. Derudover skal udstyret understøtte skalerbarhed. Leverandører, der tilbyder bordmodeller (e.g., 3 L systemer), der er geometrisk lignende store systemer (2.000 L eller mere), giver teams mulighed for at validere CFD-forudsigelser i mindre skala, før de går videre til fuldskala produktion [1][2].
Konklusion
Skalering af bioreaktorer til produktion af dyrket kød kræver, at man bevæger sig væk fra traditionelle forsøg-og-fejl-metoder og omfavner modeldrevne strategier for at adressere lokaliserede forskelle i skærekraft. Computational Fluid Dynamics (CFD) er blevet et nøgleværktøj i denne proces, der gør det muligt for ingeniører at forudsige hydrodynamiske miljøer og visualisere skærezoner ud over simple effekt-per-volumen forhold [1]. Ved at overholde kritiske parametre - som at holde Kolmogorov hvirvellængder over 20 μm og impeller-spidshastigheder under 1,5 m/s - kan ingeniører beskytte pattedyrsceller mod skæreskader, samtidig med at de sikrer korrekt blanding og iltoverførsel [1].
Avancerede beregningsmetoder, såsom Large Eddy Simulation (LES) og Lattice-Boltzmann teknikker, har vist deres effektivitet i opskalering af processer. For eksempel, i marts 2020, lykkedes det Regeneron Ireland DAC at opskalere en cellekulturproces fra en 2.000 L bioreaktor til et geometrisk forskelligt 5.000 L engangssystem ved første forsøg. Dette blev opnået ved hjælp af multiparameter CFD-forudsigelser, hvilket eliminerede behovet for omfattende fysiske forsøg [5]. Denne "første-gangs-rigtige" strategi reducerer ikke kun risikoen for kontaminering, men forkorter også tiden til markedet - kritisk for sektoren for dyrket kød.
Eksperimentelle valideringsmetoder, såsom Particle Image Velocimetry (PIV), bekræfter yderligere nøjagtigheden af CFD-modeller [2]. Disse validerede modeller spiller nu en afgørende rolle i indkøbsbeslutninger.Virksomheder som
Ofte stillede spørgsmål
Hvordan understøtter Computational Fluid Dynamics (CFD) opskalering af bioreaktorer til produktion af dyrket kød?
Computational Fluid Dynamics (CFD) er en game-changer, når det kommer til opskalering af bioreaktorer til dyrket kød. Det giver en dyb forståelse af strømningsdynamik, skærspænding, blandingseffektivitet, og masseoverførselsrater - alle kritiske faktorer for at skabe det ideelle miljø for cellevækst.
Med CFD kan ingeniører optimere væsentlige elementer som impellerdesign, omrøringshastighed og gasindblæsning. Dette sikrer, at bioreaktorerne opererer under de bedst mulige forhold, hvilket beskytter både cellehelbred og produktivitet.
Desuden gør CFD det muligt at gå fra små laboratorieopsætninger til store industrielle bioreaktorer uden at gå på kompromis med effektivitet eller konsistens. Dette betyder, at produktionen af dyrket kød kan skaleres op jævnt, mens høje standarder opretholdes.
Hvad gør Large Eddy Simulations (LES) bedre end traditionelle metoder til modellering af bioreaktorer?
Large Eddy Simulations (LES) giver et dybere og mere præcist indblik i turbulent strømning inden for bioreaktorer sammenlignet med traditionelle metoder som Reynolds-averaged Navier-Stokes (RANS).Ved at fokusere på storskala hvirvler og kun modellere de mindste dissipative bevægelser, kan LES identificere kritiske skærspændings-hotspots, såsom vortex-inducerede høj-skær zoner, der ellers kunne blive overset. Dette detaljeringsniveau spiller en vigtig rolle i at reducere celleskader og sikre større pålidelighed ved opskalering af dyrket kødproduktion.
I modsætning til metoder, der i høj grad afhænger af empiriske korrelationer, tilbyder LES stærkere forudsigelsesevner, når man bevæger sig fra laboratorie- til industriskala bioreaktorer. Fremskridt inden for beregningsteknikker har også gjort LES mere tilgængelig, hvilket muliggør detaljerede simuleringer uden behov for forbudt store beregningsressourcer. For virksomheder, der sigter mod at integrere LES-drevne designs,
Hvorfor er det vigtigt at opretholde Kolmogorov eddy-længder over 20 µm for pattedyrs cellers levedygtighed?
At opretholde Kolmogorov eddy-længder over cirka 20 µm er afgørende for at beskytte pattedyrsceller under bioreaktoroperationer. Når disse turbulente hvirvler krymper til under cellernes størrelse, kan de udsætte cellerne for overdreven forskydningsspænding, hvilket risikerer at beskadige deres membraner og sænke cellernes levedygtighed.
At holde de mindste turbulente strukturer større end cellerne hjælper med at reducere risikoen for mekanisk skade. Dette fremmer ikke kun sundere cellekulturer, men forbedrer også bioreaktorens samlede ydeevne. Denne overvejelse bliver endnu vigtigere under opskalering af bioreaktorer, hvor det er særligt vanskeligt at sikre ensartede forskydningsspændingsforhold.











