At opretholde præcis pH og temperatur er afgørende for at dyrke pattedyrsceller, især i produktionen af dyrket kød. Celler har brug for et kontrolleret miljø for at formere sig (proliferation) og udvikle sig til muskelfibre (differentiering). Her er det vigtigste at tage med:
- Optimale Betingelser: pH skal holdes mellem 7,2–7,4, og temperaturen ved 37 °C. Selv små afvigelser (e.g., pH falder med 0,3 enheder) kan bremse væksten og reducere produktiviteten.
- Hvorfor Det Er Vigtigt: Celler bruger ekstra energi på at rette ubalancer, hvilket påvirker deres væksteffektivitet. Kulturer med høj tæthed er særligt tilbøjelige til pH-fald på grund af ophobning af mælkesyre.
- Udfordringer i Stor Skala: Større bioreaktorer står over for ujævne forhold, som pH-spidser eller CO₂-ophobning, hvilket gør præcis kontrol sværere.
- Løsninger: Avancerede bioreaktorer med automatiserede systemer og pålidelige sensorer hjælper med at opretholde stabilitet, hvilket forbedrer cellevækst og konsistens.
Uanset om du dyrker celler i et laboratorium eller skalerer op til produktion, er det ikke til forhandling at holde pH og temperatur stabile for succes.
Sensore i bioreaktorer
Hvordan pH og Temperatur Påvirker Cellevækst
Rollerne af pH og temperatur i bioreaktordesign går ud over teoretisk betydning - de påvirker direkte cellens metabolisme og vækst. Dette afsnit udforsker, hvordan disse to faktorer former cellulær adfærd og produktivitet.
pH's Effekt på Cellemetabolisme og Levedygtighed
Når pH-niveauer afviger fra optimale områder, skal celler arbejde hårdere for at opretholde balance. For eksempel aktiverer de mekanismer som Na⁺/H⁺ antiportere, der forbruger energi, som ellers ville drive vækst [3].Denne energiomdirigering kan føre til store ændringer i genaktivitet. I en undersøgelse forårsagede sænkning af mediets pH til 6,7, at over 2.000 gener ændrede deres udtryksniveauer inden for blot 24 timer [3].
Samspillet mellem pH og metabolisme kan skabe en ond cirkel. Høj glykolytisk aktivitet genererer mælkesyre, som sænker mediets pH. I nogle høj-densitetskulturer omdannes op til 90% af glukosen til laktat [2], hvilket fører til hurtig forsuring. Mens denne forsuring til sidst stopper yderligere mælkesyreproduktion, sker det på bekostning af betydeligt reduceret cellevækst [5].
Både sure og alkaliske ekstremer er skadelige. Mens sure forhold under pH 7,1 er bredt kendt for at hæmme vækst, alkaliske forhold - der spænder fra pH 7,7 til 9.0 - kan også bremse proliferation og reducere produktudbytter [2][4]. For de fleste pattedyrsceller er den kritiske nedre pH-grænse mellem 6,6 og 6,8. Uden for dette område står celler over for øgede risici for apoptose eller nekrose [5].
Disse pH-drevne metaboliske forstyrrelser baner vejen for temperaturens rolle i yderligere at påvirke celleadfærd.
Temperatureffekter på celleproliferation og differentiering
Temperatur spiller en afgørende rolle i metabolisk aktivitet og gasopløselighed. Mens 37 °C er standarden for de fleste kulturer, kan selv små afvigelser påvirke vækst og proteinproduktion [3][5]. En undersøgelse udført ved Wien Tekniske Universitet i 2017 demonstrerede denne effekt. Forskere brugte CHO-celler i en 10–12 m³ omrørt tankbioreaktor til at simulere pH-uhomogeniteter. Midlertidig eksponering for pH 9,0 zoner under den eksponentielle vækstfase reducerede betydeligt både den maksimale levedygtige celletæthed og det endelige produktudbytte [4].
Inden for produktion af dyrket kød tjener temperaturkontrol to formål. Under proliferationsfasen sikrer opretholdelse af en stabil 37 °C effektiv celledeling. Imidlertid er avancerede temperatur-responsive systemer blevet udviklet til at facilitere vævslagdeling uden stillads ved at kontrollere celleadhæsion og -frigørelse [6].
Det er tydeligt, at præcis temperaturregulering er lige så afgørende som opretholdelse af en optimal pH for vellykket cellevækst og differentiering.
Kombinerede pH- og Temperatureffekter
Interaktionen mellem pH og temperatur er tæt knyttet til CO₂-kemi.Ændringer i temperatur påvirker CO₂'s opløselighed, hvilket igen påvirker syre-base-balancen i bikarbonat-bufferede systemer [3]. Højere temperaturer fremskynder cellulær metabolisme, hvilket øger produktionen af biprodukter som mælkesyre og CO₂. Dette yderligere forsurer mediet, hvilket forværrer stressen på cellerne [2][3].
"Opløseligheden af opløste gasser, og dermed CO₂'s indflydelse på syre-base-kemi, er stærkt afhængig af temperatur, osmolaritet, fugtighed og tryk." - Shannon G. Klein et al., King Abdullah University of Science and Technology [3]
Når pH og temperatur afviger samtidigt, kan den resulterende metaboliske stress alvorligt forstyrre både celleproliferation og differentiering. For eksempel viser standard batch-kulturer ofte et median pH-skift på 0,425 enheder [3].I høj-densitetskulturer kan dette skift nå op til 0,9 enheder, ledsaget af CO₂-niveauer, der stiger til 10,45% [3]. Disse forhold tvinger celler til at bruge endnu mere energi på at opretholde homeostase, hvilket reducerer deres effektivitet i biomasseproduktion.
For at minimere disse stressfaktorer bør frisklavet medium afbalanceres i en CO₂-inkubator i mindst en time før brug. Dette tillader den langsomme omvendte reaktion af CO₂-hydrering at stabilisere [2]. Sådanne forholdsregler er essentielle for at opnå optimal cellevækst og produktivitet.
Metoder til Kontrol af pH og Temperatur i Bioreaktorer
At holde pH og temperatur stabile i bioreaktorer involverer en blanding af hardware, sensorer og kontrolstrategier. Den valgte teknologi afhænger ofte af produktionsskalaen, typen af celler, der bruges til dyrket kød, og om processen hælder mere mod automatisering eller manuel styring.
Bioreaktor Design og Kontrolmetoder
Bioreaktorer, der anvendes i produktionen af dyrket kød, er afhængige af varmevekslingssystemer for at opretholde en temperatur på 37 °C [1]. pH-niveauer reguleres typisk gennem CO₂-sparging, som justerer CO₂-koncentrationen og flowet i hovedrummet [9], eller ved automatiserede sprøjtepumper, der tilsætter syrer eller baser efter behov [8].
Engangsbioreaktorer (SUBs) tilbyder en praktisk løsning ved at eliminere behovet for rengøring og reducere risikoen for kontaminering. Disse systemer kan skaleres op til 2.000 L. Dog varierer de arbejdsmængder, der kræves for at producere 1 kg biomasse, betydeligt afhængigt af bioreaktordesignet: cirka 570 L for omrørte tankreaktorer (STRs), 110 L for pakkede sengbioreaktorer (PBBs), og kun 1,4 L for hulfiberbioreaktorer (HFBs) [1].
Sensor teknologier til overvågning
Når bioreaktoren er opsat, spiller præcise sensorer en kritisk rolle i overvågning af pH og temperatur i realtid. Til pH-måling er elektrokemiske sensorer, især glaselektroder, bredt anvendt på grund af deres holdbarhed og effektivitet [7]. Når det kommer til temperatur, er modstandstermometre industristandarden [7].
I de senere år har optiske sensorer vundet popularitet, især i engangssystemer. Disse sensorer anvender fluorescerende farvestoffer - såsom 6,8-dihydroxypyren-1,3-disulfonsyre dinatriumsalt - indlejret i hydrogel patches. De er kompakte og hjælper med at minimere risikoen for kontaminering [7].
Ikke-kontakt sensorer er en anden mulighed, der bruger permeable membraner som cellulose til at måle pH eksternt, hvilket yderligere reducerer risikoen for kontaminering [7]. I mellemtiden farvemetriske systemer sporer pH ved at detektere farveændringer i phenolrøde indikatorer inden for mediet. Disse systemer bruger LED-lyskilder og omgivende lyssensorer til detektion [8]. Mens optiske sensorer er mindre invasive, kan de nogle gange blive påvirket af problemer som indikator-proteinbinding eller medieturbiditet. I modsætning hertil er elektrokemiske sensorer, selvom de er mere omfangsrige, mere robuste og pålidelige i sådanne scenarier [7].
Automatisering og Feedback Systemer
Automatisering har revolutioneret bioreaktorkontrol, reduceret menneskelige fejl og forbedret konsistens.Automatiserede systemer med lukkede kredsløbskontroller er særligt værdifulde for langvarig produktion af dyrket kød [8]. For eksempel introducerede en undersøgelse fra 2022 fra Chiang Mai University en 3D-printet automatisk bioreaktor med kolorimetrisk pH-overvågning. Dette system opretholdt en pH på 7,4 ± 0,2 og opnåede over 80% cellelevedygtighed, hvilket betydeligt forbedrede celleproliferationen over 72 timer sammenlignet med manuelle medieændringer [8].
Et andet bemærkelsesværdigt eksempel kommer fra Merck Biodevelopment i Martillac, Frankrig. I december 2013 testede teamet Mobius CellReady 3L engangsbioreaktoren til perfusionsprocesser. Ved at bruge Alternative Tangential Flow (ATF) teknologi til automatisk celleretention og medieudveksling opnåede de en 2,9-dobbelt stigning i produktionen af monoklonale antistoffer sammenlignet med batch-mode.Forskere Aurore Polès-Lahille og Flavien Thuet rapporterede, at dette automatiserede system understøttede celletætheder på 33 millioner celler/mL, mens pH-niveauerne blev opretholdt mellem 6,80 og 7,10 [10]. Disse systemer leverer kontinuerlige data, der muliggør justeringer i realtid for at optimere cellevækst og produktivitet [8].
Avancerede bioreaktorer, sensorer og kontrolsystemer til produktion af dyrket kød er tilgængelige gennem leverandører som
sbb-itb-ffee270
Studieresultater: pH- og temperaturkontrolresultater
Automatiserede vs Manuelle Kontrolsystemer
I april 2022 testede forskere Suruk Udomsom, Pathinan Paengnakorn og deres team ved Chiang Mai University en automatiseret programmerbar bioreaktor ved brug af L929 musefibroblastceller. Dette system udførte delvise medieopfriskninger hver 6. time over en periode på 72 timer.Resultaterne? Celleproliferationen var signifikant højere i det automatiserede system sammenlignet med traditionelle manuelle kulturmetoder. Bioreaktoren opretholdt en stabil pH på 7,4 ± 0,2, med cellelevedygtighed konsekvent over 80% gennem hele eksperimentet [8].
Manuelle systemer, derimod, står over for udfordringer. Når mediet fjernes fra en CO₂-inkubator til inspektion, begynder det næsten øjeblikkeligt at alkalinisere, med en tidskonstant på 2–3 timer. Når det placeres tilbage i inkubatoren, tager det cirka 45 minutter at vende tilbage til den korrekte pH [2]. Disse udsving kan destabilisere celler. Automatiserede systemer er dog designet til at eliminere sådanne inkonsekvenser, hvilket sikrer et mere stabilt miljø for cellevækst.
Testning af forskellige pH- og temperaturområder
I april 2019 undersøgte Johanna Michl og hendes team ved University of Oxford den metaboliske aktivitet af DLD1-celler over en 6-dages inkubationsperiode. Når glukoseniveauerne blev holdt over 12 mM, producerede cellerne cirka 20 mM mælkesyre, hvilket førte til mediumforsuring. Undersøgelsen fandt, at selv mindre afvigelser fra den optimale pH-værdi på 7,4 - specifikt skift større end 0,3 enheder - reducerede proliferationsraterne på tværs af tre pattedyrscellelinjer: NCI-H747, DLD1 og Caco2 [2][3].
"Cellulær vækst... var optimal ved pH 7,4, men når mediets pH afveg fra 7,4 med > 0,3 enheder, udviste alle tre cellelinjer reducerede proliferationsrater." – Shannon G. Klein et al.[3]
I standard batch-kulturer er pH-ændringer almindelige på grund af metabolisk aktivitet. Høj-densitetskulturer kan især opleve, at niveauerne af opløst ilt falder til så lavt som 0,95% [3]. Disse fund fremhæver, hvor vigtigt det er at opretholde miljømæssig stabilitet, især når produktionen skaleres op for dyrket kød.
Resultater for dyrkede kødcelletype
Ved at udvide kontrollerede studier har skaleringssimuleringer kastet lys over udfordringerne ved at opretholde pH- og temperaturstabilitet i store bioreaktorsystemer. I juli 2017 brugte forskere ved Wiens Tekniske Universitet, ledet af Matthias Brunner og Jens Fricke, en to-kammer skaleringsmodel til at efterligne forholdene i en 10–12 m³ omrørt tankbioreaktor. De udsatte CHO-celler for korte perioder med pH 9,0 for at simulere inhomogeniteter forårsaget af baseaddition i storskala systemer.Selv kortvarig eksponering for sådanne forhøjede pH-niveauer forstyrrede den specifikke vækstrate under den eksponentielle fase, hvilket resulterede i reduceret maksimal levedygtig celletæthed og lavere produktudbytte [4].
"Selv kortvarig eksponering af celler for forhøjede pH-værdier under storskala processer kan påvirke cellefysiologi og den overordnede procesydelse." – Matthias Brunner et al. [4]
I nogle pattedyrscellekulturer metaboliseres omkring 90% af glukosen til laktat, hvilket understreger behovet for aktiv pH-buffering. Disse fund understreger den kritiske rolle af præcis miljøkontrol gennem hele produktionsprocessen for at sikre optimal cellevækst og produktivitet.
Udstyrsvalg og opskalering af bioreaktor
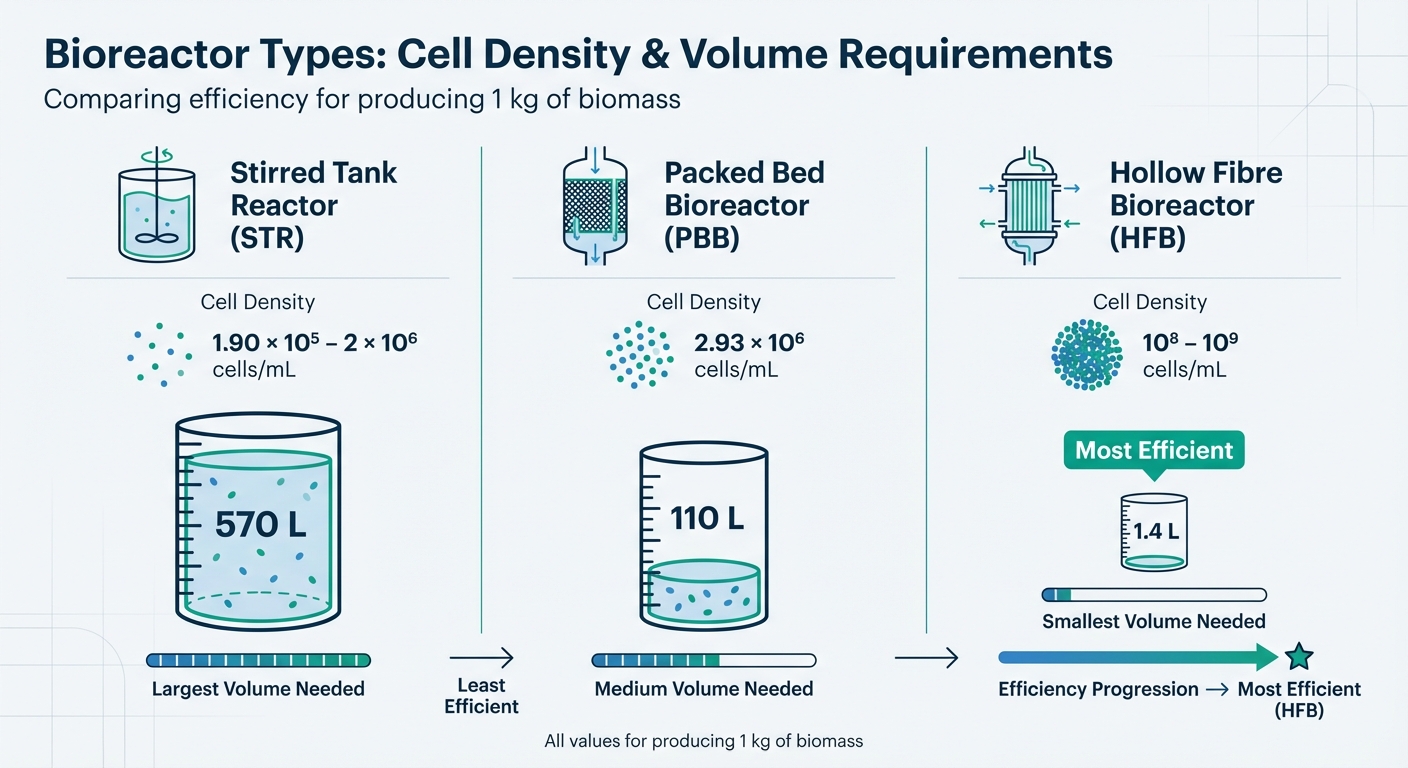
Sammenligning af bioreaktortyper til produktion af dyrket kød
Designkrav til pH- og temperaturkontrol
Bioreaktorer, der anvendes til produktion af dyrket kød, skal have præcise kontrolsystemer for at opretholde et snævert pH-område på 7,2–7,4 [1]. Avancerede systemer som ikke-lineære modelprædiktive controllere (NMPC) og adaptive controllere er særligt effektive til at regulere fodringshastigheder, mens de holder pH og temperatur stabile [12]. Automatiserede feedbacksystemer spiller også en vigtig rolle i at eliminere uoverensstemmelser forårsaget af manuelle justeringer.
For stabil pH-regulering er CO₂/bicarbonat-buffering meget effektiv.CO₂ fungerer som et selvbufferende middel nær neutral pH og er ikke-korrosivt, hvilket gør det til et passende valg [1][2][11]. For at håndtere den metaboliske varme, der produceres under cellevækst, bør bioreaktorer være udstyret med varmevekslere eller servicevæskestrømsystemer [1][12].
Opdyrkede kød celler, især myocytforstadier, er meget følsomme over for hydrodynamisk stress på grund af deres forankringsafhængige natur. Disse celler er langt mere skrøbelige end suspensionstilpassede celler [1]. For at beskytte dem foretrækkes boblefri beluftningsmetoder som gasgennemtrængelige silikoneslanger frem for traditionelle spargeteknikker, som kan forårsage skadelig skærestress [1][11].Derudover muliggør integration af sensorer af høj kvalitet - såsom in-line prober til pH og opløst ilt (pO₂), sammen med off-gas sensorer til overvågning af kuldioxidspænding (pCO₂) - realtids miljøkontrol [13].
Selvom disse kontrolstrategier fungerer godt i mindre systemer, bliver det stadig mere komplekst at opretholde samme præcisionsniveau, når bioreaktorens størrelse øges.
Skaleringsudfordringer i større bioreaktorer
Opskalering af bioreaktorer fra laboratorieindstillinger til kommerciel produktion introducerer en række udfordringer. Ved større volumener kan der opstå gradienter i hydrogenionkoncentration, kuldioxid og opløst ilt, hvilket fører til ujævne miljøforhold [13][14]. Disse uoverensstemmelser er særligt problematiske for dyrket kød, hvor ensartet cellevækst er kritisk.For eksempel kan dCO₂-niveauer i store fed-batch-processer nå 75–225 mg/L, mens opløst ilt forbliver under 8,0 mg/L [11]. Denne ophobning af CO₂ kan få pH-niveauer til at falde så lavt som 6,8 [13].
"Forståelse af procesparameterinteraktioner er især nyttig under procesopskalering, hvor uønskede variationer af pH, opløst iltspænding (pO₂) og kuldioxidspænding (pCO₂) sandsynligvis vil forekomme." – Matthias Brunner et al. [13]
At opretholde en konstant temperatur på 37°C er en anden kritisk faktor, der kræver kontinuerlig fjernelse af metabolisk varme [1]. At opnå denne balance involverer tilstrækkelig omrøring for at sikre homogenitet, men overdreven impellerhastighed kan beskadige shear-følsomme celler [1].For at løse disse problemer i kommerciel skala kan det være nødvendigt at adskille pH- og pCO₂-kontrol. For eksempel kan brug af HCl eller NaOH til pH-justeringer i stedet for udelukkende at stole på CO₂-gas forhindre CO₂-toksicitet, samtidig med at stabile pH-niveauer opretholdes [13].
| Bioreaktortype | Opnåelig celletæthed (celler/mL) | Arbejdsvolumen for 1 kg biomasse |
|---|---|---|
| Omrørt tank (STR) | 1.90 × 10⁵ – 2 × 10⁶ | 570 L |
| Pakket seng (PBB) | 2.93 × 10⁶ | 110 L |
| Hul fiber (HFB) | 10⁸ – 10⁹ | 1.4 L |
Indkøb af udstyr gennem Cellbase
At finde bioreaktorer, der opfylder de specifikke krav til produktion af dyrket kød, kan være en udfordrende opgave.
I modsætning til generelle laboratorieforsyningsplatforme fokuserer
Konklusion
At opretholde præcis pH- og temperaturkontrol er absolut afgørende i produktionen af dyrket kød. Disse faktorer påvirker direkte cellelevedygtighed og vækstkonsekvens. Selv en mindre afvigelse - blot 0,3 pH-enheder uden for det optimale område - kan betydeligt hæmme celleproliferation [3]. Ligeledes er stabil temperatur essentiel for at bevare den metaboliske balance, der understøtter cellevækst.Johanna Michl fra University of Oxford fremhæver denne følsomhed og bemærker:
"Biologiske processer er yderst følsomme over for syre-base kemi" [2]
Denne præcision bliver endnu mere udfordrende i kommerciel skala, hvor opretholdelse af homeostase på tværs af store volumener introducerer betydelige ingeniørmæssige udfordringer.
Overgangen fra manuelle laboratoriemetoder til automatiserede bioprocesser er en vigtig milepæl for at gøre produktionen af dyrket kød økonomisk bæredygtig og reproducerbar. Automatisering eliminerer de uoverensstemmelser, der er forbundet med manuel overvågning. Avancerede bioreaktorsystemer - lige fra omrørte tanke til hulfibersystemer - tilbyder varierende celletæthedskapaciteter, samtidig med at de påvirker anlæggets fysiske fodaftryk og medieeffektivitet.
Men opskalering bringer sine egne komplikationer.Store bioreaktorer, ofte i størrelsesordenen 10–12 m³, er særligt udsatte for pH-inkonsistenser. For eksempel kan lokaliserede pH-spidser nå op til 9,0 under base-tilsætninger [4], hvilket understreger behovet for robuste kontrolmekanismer. Shannon G. Klein fra Red Sea Research Centre understreger vigtigheden af at opretholde stabile forhold:
"Opretholdelse af relevante fysiologiske forhold i cellekulturer er af allerstørste betydning for at sikre reproducerbarheden af offentliggjorte resultater og den translationelle relevans af eksperimentelle data til kliniske anvendelser" [3]
For at tackle disse udfordringer er specialiseret udstyr og avancerede overvågningssystemer essentielle. Platforme som
Med over 175 virksomheder, der nu er aktive i den dyrkede kødindustri på tværs af seks kontinenter og investeringer, der overstiger £2,4 milliarder [15], er det afgørende for kommerciel succes at opretholde optimale pH- og temperaturforhold. Innovationer inden for bioreaktordesign, automatisering og specialiseret indkøb gør det muligt for industrien at overgå fra forskningslaboratorier til storskala produktionsfaciliteter. Disse fremskridt former fremtiden for dyrket kød og hjælper sektoren med at overvinde sine mest presserende udfordringer.
Ofte stillede spørgsmål
Hvorfor er det vigtigt at kontrollere pH og temperatur under produktionen af dyrket kød?
Præcis kontrol over pH og temperatur er absolut kritisk, når man producerer dyrket kød, da pattedyrsceller er meget følsomme over for selv små miljøændringer. De fleste cellelinjer, der anvendes i denne proces, trives ved en optimal temperatur på omkring 37°C. Dog kan selv små udsving - såsom temperaturer, der overstiger 38°C eller falder for lavt - betydeligt påvirke cellernes levedygtighed, bremse deres vækst eller forstyrre metaboliske funktioner. Ligeledes er det lige så vigtigt at holde pH stabil inden for området 7,0 til 7,4. Ændringer i dette område, ofte forårsaget af metaboliske biprodukter som CO₂ eller laktat, kan skade cellevækst og kompromittere vævskvaliteten.
I storskala bioreaktorer bliver det endnu mere kritisk at opretholde ensartet pH og temperatur i hele systemet.Konsekvent regulering i hele bioreaktoren sikrer forudsigelig celledannelse og understøtter vækst, differentiering og tekstur af det endelige produkt. Det hjælper også med at minimere dyre forsøg-og-fejl justeringer under produktionen. For forskere og producenter i den dyrkede kødindustri, platforme som
Hvordan forbedrer automatiserede bioreaktorer cellevækst sammenlignet med manuelle systemer?
Automatiserede bioreaktorer bringer et nyt niveau af præcision til styring af nøgleparametre som temperatur, pH, og opløst ilt, hvilket sikrer de ideelle betingelser for cellevækst. For eksempel opretholder disse systemer typisk temperaturer omkring 37°C og pH-niveauer mellem 7,0 og 7,4.Udstyret med avancerede sensorer overvåger de kontinuerligt disse variable og foretager hurtige justeringer - hvad enten det er opvarmning, køling, regulering af gasstrøm eller balancering af syre- og baseniveauer. Denne næsten øjeblikkelige respons eliminerer de forsinkelser og unøjagtigheder, der ofte ses ved manuelle indgreb. Resultatet? Et stabilt miljø, der minimerer cellestress, øger den metaboliske effektivitet og fremmer højere vækstrater og celletætheder.
Derudover anvender moderne bioreaktorer cloud-baseret analyse til at spore ydeevne, optimere fodringsplaner og finjustere processer på tværs af forskellige produktionskørsler. I sammenhæng med dyrket kød betyder disse innovationer større celleudbytter, accelereret vævsudvikling og lavere produktionsomkostninger. For dem i branchen giver platforme som
Hvad er de største udfordringer ved opskalering af bioreaktorer til produktion af dyrket kød?
Opskalering af bioreaktorer til produktion af dyrket kød er ikke en let opgave. Når størrelsen af disse reaktorer vokser, bliver det stadig mere udfordrende at opretholde stram kontrol over faktorer som pH, temperatur, og opløste gasser. Disse udsving kan føre til ujævn cellevækst og uoverensstemmelser i det endelige produkt. Almindelige forhindringer inkluderer ineffektiv omrøring, begrænset iltoverførsel og langsommere sensorreaktioner, som alle kan forstyrre den sarte balance, der er nødvendig for optimal cellekultur.
En anden kompleksitetslag kommer fra brugen af adherente cellelinjer. Disse celler kræver enten store overfladearealer eller specialiserede mikrobærersystemer for at trives. Når systemerne skaleres op, er det afgørende at støtte disse celler korrekt uden at udsætte dem for mekanisk stress, der kan forårsage skade.Ud over det skal industrielle bioreaktorer sikre ensartet temperaturfordeling, opretholde sterilitet og overholde strenge fødevaresikkerhedsstandarder - alt imens omkostningerne holdes håndterbare.
For at tackle disse udfordringer giver platforme som











