培養肉生産のためのバイオリアクターのスケーリングは複雑であり、特にスケールアップ中に哺乳類細胞を損傷する可能性のある機械的力であるせん断応力の管理が重要です。微生物細胞とは異なり、哺乳類細胞は壊れやすく、乱流やエアレーションの力に敏感です。せん断応力が3 Paを超えると、細胞が破裂し、細胞の生存率と生産性が低下します。
これらの課題に対処するために、エンジニアは計算流体力学 (CFD)とスケールダウンモデルに依存して、フルスケール生産前にせん断応力を予測し管理します。CFDはバイオリアクター内の流れのパターン、せん断ゾーン、混合効率を分析し、スケールダウンモデルはこれらの予測を実験的に検証し、スケールアップ時のリスクを最小限に抑えます。
重要なポイント:
- せん断応力の限界: 哺乳類細胞は3 Paまで耐えられます。これを超えると細胞が損傷します。
- CFDツール: ラージ・エディ・シミュレーション(LES)やラティス・ボルツマン・シミュレーション(LB-LES)などの高度な手法により、流れと乱流の正確なモデリングが可能になります。
- スケールダウンモデル: これらは、大規模なバイオリアクターの条件を小規模なセットアップで再現し、CFD予測を検証します。
-
設計上の考慮事項:
- 低せん断のためにピッチドブレードインペラーを使用します。
- コルモゴロフ渦長を20μm以上に維持して、細胞の損傷を防ぎます。
- インペラーチップ速度を1.5 m/s以下に保ちます。
CFDの洞察を実験的検証と組み合わせることで、チームは培養肉生産のためのバイオリアクターデザインを最適化し、細胞の生存と効率的なスケーリングを確保できます。
CFDコンパス | バイオリアクターCFDのベストプラクティス
計算流体力学(CFD)を使用したせん断応力のモデル化
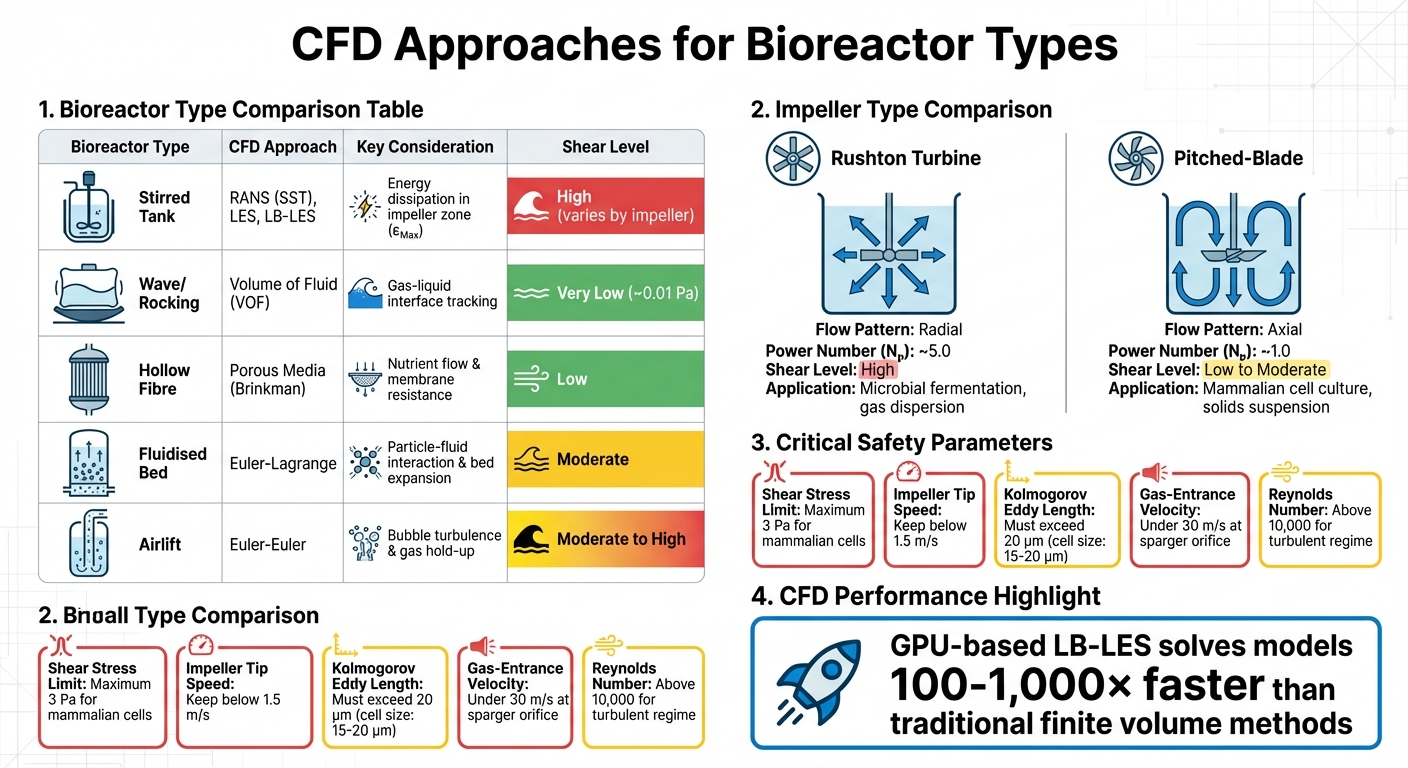
培養肉生産における異なるバイオリアクタータイプのためのCFDアプローチと主要パラメータ
CFDシミュレーションは、エンジニアに物理的に構築される前にバイオリアクター内の流体力学とせん断力をマッピングするツールを提供します。生産規模での試行錯誤の方法に頼る代わりに、CFDは特定の容器の部分での高せん断ゾーン、乱流渦、細胞の生存率などの重要な要因を予測するのに役立ちます。これは、バイオリアクターの規模が最終的に200,000リットルに達する可能性がある培養肉生産において特に重要です - これは従来のバイオ医薬品容器よりもはるかに大きいです[8]。これらの予測的洞察は、スケールダウン実験を導き、機器の選択に影響を与えます。
計算技術の進化は著しいものがあります。k-εのようなレイノルズ平均ナビエ・ストークス(RANS)モデルは業界で広く使用されていますが、ラージ・エディ・シミュレーション(LES)やGPUを活用したラティス・ボルツマンシミュレーション(LB-LES)のような先進的な手法が限界を押し広げています。プラハ化学技術大学のミロスラフ・スース教授によれば、GPUベースのLB-LESは「一般的に使用される有限体積法ソルバーよりも100倍から1,000倍速くモデルを解くことができる」[2]とのことです。この速度の利点により、エンジニアは細胞に損傷を与える渦を検出するために必要な精度で大規模な容器をシミュレートすることができます。
CFDの能力の実用的な例として、Regeneron Ireland DACとThermo Fisher Scientificの研究者が挙げられます。彼らは、2,000リットルのバイオリアクターから幾何学的に異なる5,000リットルのシングルユースバイオリアクターへの細胞培養プロセスのスケールアップに成功しました。 経験的なヒューリスティックに頼る代わりに、彼らはCFDを使用して、物質移動速度、混合時間、せん断速度などのパラメータを分析しました。このアプローチにより、体積あたりの電力比に基づくスケーリングにしばしば関連する高価な失敗を避け、最初の試みでの成功したスケールアップが可能になりました。[5].
撹拌槽バイオリアクターのためのCFDの設定
撹拌槽バイオリアクターのためのCFDを設定するには、まず容器の形状を定義します - これにはタンクの寸法、インペラーデザイン(e.g., ラシュトンまたはピッチドブレード)、およびバッフルの配置が含まれます。適切な乱流モデルの選択が重要です:実現可能なk-εモデルはガス-液体システムに適しており、LB-LESは細胞に害を及ぼす可能性のあるピークストレスを特定するための高解像度を提供します。グリッド収束研究は、結果がメッシュサイズに依存しないことを保証します。
境界条件は、インペラの速度、ガスのスパージング率、流体の密度、粘度など、現実世界の運用パラメータを反映する必要があります。培養肉のアプリケーションでは、保守的なバブルドラッグモデルがしばしば使用され、せん断応力を推定します[8]。システムは完全に乱流の状態で動作し、レイノルズ数が10,000を超えて、インペラの速度に関係なくパワーナンバーが一貫していることを保証する必要があります[1]。
酸素移動、混合時間、流体力学的ストレスに関するCFD予測は、せん断に敏感なマイクロプローブやナノ粒子凝集体を使用して収集された実験データと一致する必要があります[2]。例えば、数学的な物質移動モデルが、2リットルのベンチトップユニットから1,500リットルの産業用バイオリアクターへのCHO細胞培養プロセスの直接スケールアップを導きましたSartorius。CFDを使用して酸素需要とCO₂除去を予測することにより、チームはスケールを超えて一貫した製品品質属性(N-グリカンや電荷変異体など)を維持しました[6].
他のバイオリアクタータイプのCFD
撹拌槽が産業用細胞培養を支配している一方で、他のバイオリアクターデザインはカスタマイズされたCFDアプローチを必要とします。例えば、ロッキングまたはウェーブバイオリアクターは、波の動きがこれらのシステムにおけるせん断応力を駆動するため、ガス-液体界面をシミュレートするために流体の体積(VOF)法に依存しています。これらのデザインは非常に穏やかなせん断環境を作り出します - 最大応力は撹拌槽と比較して約0.01 Paですが、大規模な培養肉生産のためのスケーラビリティは制限されています[4].
一方、ホローファイバーバイオリアクターは、膜を通る栄養素の拡散と流れ抵抗をシミュレートするために、ブリンクマン方程式に基づく多孔質媒体モデルを使用します。流動層システムは、粒子と流体の相互作用および層の膨張を捉えるためにオイラー-ラグランジュモデルを必要とし、エアリフトバイオリアクターはバブルによる乱流とガス保持を分析するためにオイラー-オイラー法を使用します[4]。各設計には独自の課題があります。流動層はマイクロキャリアの分布とせん断曝露のバランスを取る必要があり、エアリフトシステムはスパージバイオリアクターでの細胞死の主な原因であるバブルの破裂によるストレスを管理する必要があります[1] [7].
これらのCFDアプローチを理解することは、培養肉生産に使用されるさまざまなバイオリアクターデザインにおけるせん断応力を制御するために不可欠です。
| バイオリアクターの種類 | CFDアプローチ | 重要な考慮事項 |
|---|---|---|
| 撹拌槽 | RANS (SST), LES, LB-LES | インペラゾーンでのエネルギー散逸 (εMax) |
| 波/ロッキング | 流体の体積 (VOF) | 気液界面の追跡 |
| 中空繊維 | 多孔質媒体 (Brinkman) | 栄養素の流れと膜抵抗 |
| 流動床 | オイラー-ラグランジュ | 粒子と流体の相互作用、床の膨張 |
| エアリフト | オイラー-オイラー | 泡による乱流とガス保持 |
これらの多様なCFD手法は、機器の選択やせん断応力の管理において重要な役割を果たすカスタマイズされた戦略の必要性を強調しています。
縮小モデルと実験的検証
計算流体力学(CFD)は貴重な予測を提供しますが、プロセスをスケールアップする際の実世界でのテストの必要性を置き換えることはできません。実験的検証は、計算モデルが実世界のせん断応力条件を正確に表現していることを確認する上で重要な役割を果たします。ここで縮小モデルが登場し、大規模な生産用バイオリアクターの流体力学的環境を、より小さく管理しやすいシステムで模倣します。これにより、小規模から産業規模への移行時に高額なエラーのリスクを軽減します。このステップは、CFDの予測を確認するだけでなく、より信頼性が高く効果的なスケールアッププロセスを保証します。
縮小モデルの作成
縮小モデルの設計は、幾何学的類似性を維持することから始まります。これは、容器の高さと直径、インペラの直径とタンクの直径など、主要なコンポーネント間のアスペクト比を同じに保つことを意味します。[11] 一度ジオメトリが整ったら、エンジニアはスケーリング基準を選択します。一般的な選択肢には、体積あたりのパワー(P/V)、インペラの先端速度、またはエネルギー散逸率(EDR)が含まれます。しかし、平均P/Vではなく局所的なEDRに焦点を当てることで、剪断の不均一性をよりよく理解でき、正確なモデリングにとって重要です。
より高度なアプローチには、マルチコンパートメントシミュレーターが含まれます。例えば、2021年2月にエマニュエル・アナネと彼のチームは、撹拌タンクリアクター(STR)とプラグフローリアクター(PFR)を組み合わせた二コンパートメントスケールダウンシミュレーターを開発しました。このモデルは、CHO細胞が溶存酸素勾配にどのように反応するかを研究するために使用されました。彼らの研究は、90秒の重要な滞留時間の閾値を明らかにしました。このポイントを超えると、CHO細胞は生存細胞密度が15%低下し、乳酸の蓄積が増加しました[10]。この発見は、細胞の生存率を維持する産業用バイオリアクターの設計における明確なベンチマークを提供します
。細胞の成長を保護するために、エンジニアはしばしばインペラの先端速度を1.5 m/s未満に保つことを目指します[1]。さらに、コルモゴロフの微小渦長 - 乱流の尺度 - は細胞のサイズを超えるべきであり、通常は哺乳類細胞の場合20μm以上で、流体力学的損傷を避けるためです[1][3]。例えば、動物細胞培養におけるエネルギー入力が0.1 W/kgの場合、最小の渦は約60μmで、安全なバッファを提供します[3]。
実験を通じたCFD予測の検証
スケールダウンモデルが確立されたら、CFDから導き出されたパラメータを検証するために実験的方法が不可欠です。粒子画像流速測定法(PIV)は、この目的で広く使用されている技術です。流体中の粒子を追跡することで、PIVはスケールダウンモデルの流れのパターンと速度場がCFD予測と一致しているかどうかを確認するのに役立ちます[12][4]。
トレーサー注入と脱色法も混合時間を検証するために使用されます。このプロセスでは、酸、塩基、または塩溶液のようなトレーサーがインペラーの近くに導入され、その分布が95%の均一性に達するまで監視されます[12][3]。大規模な哺乳類細胞バイオリアクター(5,000 Lから20,000 L)では、混合時間は通常80秒から180秒の範囲です[10]。
2020年3月、Regeneron Ireland DACのジェームズ・スカリーと彼のチームは、2,000 Lのバイオリアクターから異なる形状の5,000 Lのシングルユースバイオリアクターへの細胞培養プロセスのスケールアップに成功しました。彼らは、質量移動率、混合時間、せん断速度などの重要なパラメータを予測するためにCFDに依存しました。これらの予測は、単相および多相の実験を通じて検証され、大規模なパイロットランを必要とせずにスケールアップを初めて成功させることができました[5]。
「CFDシミュレーションは、空間的および時間的に解決された結果を伴う古典的なプロセスエンジニアリング調査を補完するために、または実験室での調査が不可能な場合にはそれらを置き換えるために、ますます使用されています。" - Stefan Seidel, School of Life Sciences, ZHAW [12]
追加の検証技術には、特定の撹拌速度での比電力入力(P/V)と無次元パワーナンバーを確認するためのトルク測定が含まれます[12][3]。酸素移動速度は、ガス抜き法や亜硫酸法のような方法を使用して、体積酸素質量移動係数(kLa)を決定することで検証されます[12][7]。マイクロキャリアを使用するシステムでは、光減衰法やカメラベースの方法を用いて、すべての粒子を懸濁させるのに必要な最小速度を見つけ、固体相分布のCFD予測が正確であることを確認します[12][4]。
sbb-itb-ffee270
バイオリアクターにおけるせん断応力に影響を与える要因
スケールアップ中の細胞の生存率を保護するためには、せん断応力を引き起こす物理的要因を理解することが重要です。計算流体力学(CFD)の予測とスケールダウンの検証により、エネルギー散逸率(EDR)が重要な役割を果たすことが明らかになっています。EDRは、インペラの運動エネルギーが熱に変換される過程を測定し、不均一なエネルギー分布を引き起こします。例えば、ピッチドブレードインペラでは、エネルギーがインペラの周囲に集中し、高せん断のゾーンを作り出し、適切に管理されないと細胞を損傷する可能性があります。
インペラ設計と電力入力
使用するインペラの種類は、流れのパターンとせん断の強度に大きく影響します。例えば、ラシュトンタービンは放射状の流れと高せん断を生成し、微生物発酵には理想的ですが、せん断に敏感な哺乳類細胞にはあまり適していません。一方、ピッチドブレードインペラは、同じ電力入力で低いせん断とより良いポンピング効率を持つ軸流を生成します。これにより、細胞の生存率が優先される培養肉の生産などの用途において、好ましい選択肢となります。
| インペラタイプ | 流れパターン | 動力数 (Nₚ) | せん断レベル | 主な用途 |
|---|---|---|---|---|
| ラシュトンタービン | ラジアル | ~5.0 | 高い | 微生物発酵; ガス分散[3] |
| ピッチドブレード | アキシャル | ~1.0 | 低から中程度 | 哺乳類細胞培養; 固体懸濁 [3] |
スケーリング戦略は、しばしば体積あたりの一定の電力入力(P/V)を維持することに依存しています。しかし、反応器のサイズが大きくなるにつれて、これによりインペラの先端速度が高くなる可能性があります。哺乳類細胞の場合、成長の問題を避けるために先端速度は1.5 m/s未満に保つ必要があります[1]。大規模な反応器では、特に20 m³を超える容器では、スパージングがインペラよりもさらに多くの流体力学的ストレスを引き起こす可能性があります[9]。これらの要因は乱流と密接に関連しており、コルモゴロフスケールの議論でさらに探求されています。
コルモゴロフスケールと乱流モデリング
コルモゴロフスケール(λ)は、エネルギーが熱として消散する最小の乱流渦のサイズを定義します。これらの渦がセルの直径より小さい場合、機械的損傷が懸念されます。哺乳類の細胞は通常15–20 μmのサイズであるため、渦の長さは20 μmを超える必要があります。損傷を避けるために[1][3]。例えば、エネルギー入力が0.1 W/kgの場合、コルモゴロフ渦の直径は約60 μmであり、安全なバッファを提供します[3]。
"生物学的エンティティ(e.g., 哺乳類の細胞)がバイオリアクター内でλ [コルモゴロフスケール]より小さい場合、そのようなエンティティへのせん断損傷は発生しません。" - Muhammad Arshad Chaudhry [3]
2024年8月、Boehringer Ingelheim Pharmaとプラハ化学技術大学の研究者たちは、12,500 Lの産業用バイオリアクターでCFD予測を検証するために、ラティス・ボルツマン大渦シミュレーション(LB-LES)を使用しました。剪断感受性ナノ粒子凝集体を使用することにより、最大の流体力学的ストレスを測定し、LB-LESが従来の方法よりも100〜1,000倍速く乱流スケールを解決できることを示しました。これらの発見は、剪断ストレスを最小限に抑える戦略の開発に役立ちます。 剪断ストレスをモデリングデータで削減 CFDモデリングは、エンジニアが高剪断ゾーンを特定し、それに応じて運転条件を調整することを可能にします。効果的なアプローチの一つは、液面ではなくインペラーゾーン付近に基質、pHベース、または消泡剤を導入することです。これにより、迅速な分布が確保され、局所的な濃度勾配が最小限に抑えられます。培養肉の生産では、過度の剪断が細胞をマイクロキャリアから分離させる可能性があり、不十分な攪拌はマイクロキャリアの沈降と栄養不均衡を引き起こします。
バブルの破裂による剪断力から細胞を保護するために、Pluronic F-68(ポロキサマー188)のような保護添加剤が一般的に使用されます。これは、バイオリアクターにおける細胞死の主な原因です[1]。これらの界面活性剤を使用することで、100,000 W/m³という高いエネルギー入力でも致死的な影響を受けないことが報告されています[1]。さらに、スパージャーの開口部でのガス入口速度を30 m/s未満に保つことで、生産性の低下や細胞の死亡率を減少させることができます[1]。
バイオリアクターのスケーリングのための機器の見つけ方
どのようにCellbase がバイオリアクターの調達をサポートするか
培養肉生産のためのバイオリアクターのスケールアップには独自の課題があります。ここで
バイオ医薬品業界で使用されるバイオリアクターのスケーリングの成功は、これらの製品の品質と市場投入までの時間に大きく影響します[5]。
CFDに基づくデータを活用することで、チームは機器の選択を効率化し、繰り返しの試行を最小限に抑えることができます[5]。これらの洞察は、最適なせん断応力管理を考慮して設計されたバイオリアクターを選択するために重要です。
せん断応力制御のための機器選択
せん断応力を効果的に制御するためには、特定の機器仕様が特に重要です。インペラの形状は重要な要素です。例えば、ピッチドブレードインペラは、パワーナンバー(Np)が約1.0の軸流を生成しますが、ラシュトンタービンは約5.0のはるかに高いNpを持っています。これは、ピッチドブレード設計が同じ回転速度で大幅に少ないパワーを生み出し、したがって、せん断も少なくなることを意味します[3]。培養肉に使用される哺乳動物細胞を含むアプリケーションでは、インペラーチップの速度を1.5 m/s未満に保つことが、細胞の損傷を避けるために不可欠です[1]。
スパージャーの構成も重要な考慮事項です。過度のせん断を防ぐために、スパージャーの開口部でのガス入口速度が30 m/s未満であり、開口部のレイノルズ数が2,000未満であることを機器が保証する必要があります。これらの閾値を超えると、「ジェットレジーム」に入り、泡が不均一に分散し、局所的なせん断ゾーンを作成する可能性があります[1]。ドリル穴またはオープンパイプスパージャーは、マイクロスパージャーと比較してせん断に敏感な細胞により適しています。さらに、機器はスケールダウンの互換性をサポートする必要があります。ベンチトップモデルを提供するサプライヤーe.g。, 3 Lシステム)は、大規模システム(2,000 L以上)と幾何学的に類似しており、チームがCFD予測を小規模で検証してから本格的な生産に移行することを可能にします[1][2].
結論
培養肉生産のためのバイオリアクターのスケーリングには、従来の試行錯誤の方法から脱却し、局所的なせん断の違いに対処するためのモデル駆動型戦略を採用する必要があります。計算流体力学(CFD)はこのプロセスにおいて重要なツールとなり、エンジニアが流体力学的環境を予測し、単純な体積当たりのパワー比を超えてせん断ゾーンを視覚化することを可能にします[1]。コルモゴロフ渦長を20μm以上、インペラーチップ速度を1.5 m/s以下に保つなどの重要なパラメータを遵守することで、エンジニアは哺乳類細胞をせん断損傷から保護しながら、適切な混合と酸素移動を確保できます[1]。
大規模渦シミュレーション(LES)や格子ボルツマン法などの高度な計算手法は、プロセスのスケールアップにおいてその効果を示しています。例えば、2020年3月にRegeneron Ireland DACは、2,000 Lのバイオリアクターから幾何学的に異なる5,000 Lの使い捨てシステムへの細胞培養プロセスのスケールアップを初回で成功させました。これは、多パラメータCFD予測を使用することで達成され、広範な物理的試験の必要性を排除しました[5]。この「初回成功」戦略は、汚染リスクを低減するだけでなく、市場投入までの時間を短縮します - 培養肉セクターにとって重要です。
粒子画像流速測定(PIV)などの実験的検証手法は、CFDモデルの精度をさらに確認します[2]。これらの検証済みモデルは、調達決定において重要な役割を果たしています。企業の
よくある質問
培養肉生産のためのバイオリアクターのスケールアップにおいて、計算流体力学(CFD)はどのようにサポートしますか?
計算流体力学(CFD)は、培養肉のためのバイオリアクターのスケールアップにおいて画期的な役割を果たします。流体力学、せん断応力、混合効率、物質移動速度など、細胞成長に理想的な環境を作り出すための重要な要素を深く理解することができます。
CFDを使用することで、エンジニアはインペラーデザイン、攪拌速度、ガススパージングなどの重要な要素を最適化できます。これにより、バイオリアクターが最適な条件で動作し、細胞の健康と生産性を保護します。
さらに、CFDを使用することで、小規模な実験室のセットアップから大規模な産業用バイオリアクターに移行しても、効率や一貫性を損なうことなく実現可能です。これにより、培養肉の生産は高い基準を維持しながらスムーズに拡大できます。
バイオリアクターのモデリングにおいて、ラージエディシミュレーション(LES)が従来の方法より優れているのはなぜですか?
ラージエディシミュレーション(LES)は、従来の方法であるレイノルズ平均ナビエ・ストークス(RANS)と比較して、バイオリアクター内の乱流の流れをより深く、より正確に分析できます。大規模な渦に焦点を当て、最小の散逸運動のみをモデル化することにより、LESは、渦によって引き起こされる高せん断ゾーンのような、見落とされがちな重要なせん断応力のホットスポットを特定できます。この詳細レベルは、細胞損傷を減らし、培養肉の生産をスケールアップする際の信頼性を高める上で重要な役割を果たします。
経験的相関に大きく依存する方法とは異なり、LESは、ラボスケールから産業スケールのバイオリアクターに移行する際に、より強力な予測能力を提供します。計算技術の進歩により、LESはよりアクセスしやすくなり、禁止的な計算資源を必要とせずに詳細なシミュレーションが可能になりました。LES駆動の設計を統合しようとする企業にとって、
哺乳類細胞の生存率を維持するために、コルモゴロフ渦の長さを20 µm以上に保つことがなぜ重要なのですか?
コルモゴロフ渦の長さをおおよそ20 µm以上に維持することは、バイオリアクターの操作中に哺乳類細胞を保護するために重要です。これらの乱流渦が細胞のサイズよりも小さくなると、細胞に過度のせん断応力を与える可能性があり、細胞膜を損傷し、細胞の生存率を低下させるリスクがあります。
最小の乱流構造を細胞よりも大きく保つことで、機械的損傷の可能性を減らすことができます。これにより、より健康的な細胞培養が促進されるだけでなく、バイオリアクターの全体的な性能も向上します。この考慮事項は、特にバイオリアクターのスケールアップ時に重要であり、一貫したせん断応力条件を確保することが特に困難です。











