Escalar biorreactores para la producción de carne cultivada es complejo, especialmente al gestionar el esfuerzo cortante, una fuerza mecánica que puede dañar las células de mamíferos durante la ampliación. A diferencia de las células microbianas, las células de mamíferos son frágiles y sensibles a las fuerzas de turbulencia y aireación. Cuando el esfuerzo cortante supera 3 Pa, las células pueden romperse, reduciendo la viabilidad y la productividad.
Para abordar estos desafíos, los ingenieros confían en la Dinámica de Fluidos Computacional (CFD) y modelos de escala reducida para predecir y gestionar el esfuerzo cortante antes de la producción a gran escala. CFD analiza los patrones de flujo, las zonas de esfuerzo cortante y la eficiencia de mezcla en los biorreactores, mientras que los modelos de escala reducida validan estas predicciones experimentalmente, minimizando los riesgos durante la ampliación.
Puntos Clave:
- Límites de Esfuerzo Cortante: Las células de mamíferos toleran hasta 3 Pa; exceder este límite daña las células.
- Herramientas CFD: Métodos avanzados como las simulaciones de grandes remolinos (LES) y las simulaciones de Lattice-Boltzmann (LB-LES) permiten un modelado preciso del flujo y la turbulencia.
- Modelos a Escala Reducida: Estos replican las condiciones de grandes biorreactores en configuraciones más pequeñas para validar las predicciones de CFD.
-
Consideraciones de Diseño:
- Utilice impulsores de palas inclinadas para menor cizallamiento.
- Mantenga longitudes de remolinos de Kolmogorov por encima de 20 μm para prevenir daños celulares.
- Mantenga las velocidades de punta del impulsor por debajo de 1.5 m/s.
Al combinar los conocimientos de CFD con la validación experimental, los equipos pueden optimizar los diseños de biorreactores para la producción de carne cultivada, asegurando la supervivencia celular y una escalabilidad eficiente.
CFD Compass | Mejores Prácticas para CFD en Biorreactores
Uso de Dinámica de Fluidos Computacional (CFD) para Modelar el Estrés de Cizallamiento
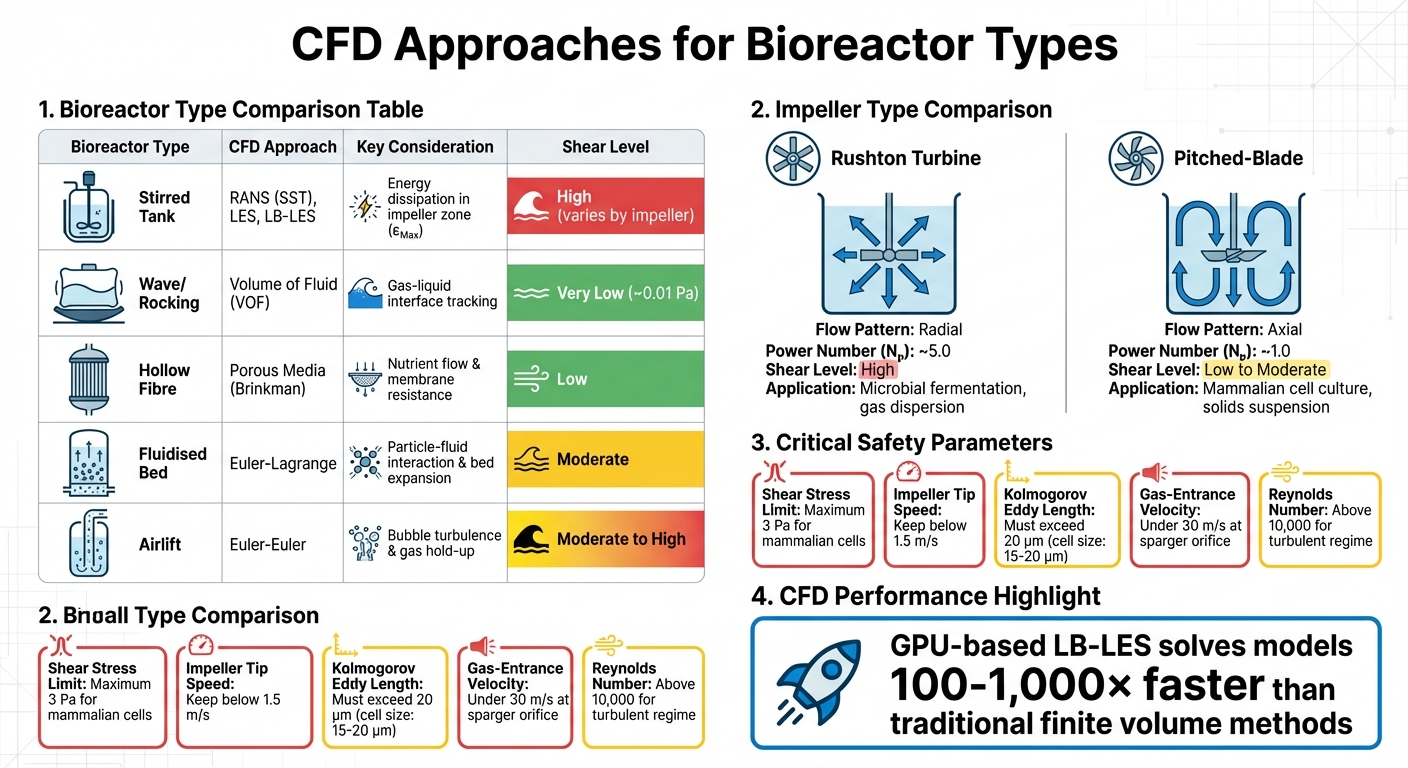
Enfoques CFD y Parámetros Clave para Diferentes Tipos de Biorreactores en la Producción de Carne Cultivada
Las simulaciones CFD proporcionan a los ingenieros las herramientas para mapear la dinámica de fluidos y las fuerzas de cizallamiento dentro de los biorreactores antes de que se construyan físicamente. En lugar de depender de métodos de prueba y error a escala de producción, CFD ayuda a predecir factores críticos como zonas de alto cizallamiento, remolinos turbulentos y viabilidad celular en partes específicas del recipiente. Esto es especialmente importante en la producción de carne cultivada, donde las escalas de los biorreactores podrían eventualmente alcanzar los 200,000 litros, mucho más grandes que los recipientes biofarmacéuticos tradicionales [8]. Estos conocimientos predictivos guían los experimentos de reducción de escala e influyen en la selección de equipos.
La evolución de las técnicas computacionales ha sido notable. Mientras que los modelos de Reynolds-Averaged Navier-Stokes (RANS), como k-ε, siguen siendo ampliamente utilizados en la industria, métodos avanzados como las Simulaciones de Grandes Vórtices (LES) y las simulaciones Lattice-Boltzmann potenciadas por GPU (LB-LES) están empujando los límites. Según el Profesor Miroslav Soos de la Universidad de Química y Tecnología de Praga, el LB-LES basado en GPU puede resolver modelos “100 a 1,000 veces más rápido que los solucionadores de método de volumen finito comúnmente usados” [2]. Esta ventaja de velocidad permite a los ingenieros simular recipientes masivos con la precisión necesaria para detectar remolinos que dañan las células.
Un ejemplo práctico de las capacidades de CFD proviene de los investigadores de Regeneron Ireland DAC y Thermo Fisher Scientific. Ellos escalaron con éxito un proceso de cultivo celular de un biorreactor de 2,000 litros a un biorreactor de un solo uso de 5,000 litros geométricamente diferente.En lugar de depender de heurísticas empíricas, utilizaron CFD para analizar parámetros como las tasas de transferencia de masa, los tiempos de mezcla y las tasas de cizallamiento. Este enfoque permitió una ampliación exitosa en el primer intento, evitando los costosos fracasos a menudo asociados con la escalabilidad basada en la relación potencia por volumen [5].
Configuración de CFD para Biorreactores de Tanque Agitado
Para configurar CFD para biorreactores de tanque agitado, comience definiendo la geometría del recipiente: esto incluye las dimensiones del tanque, el diseño del impulsor (e.g., Rushton o de palas inclinadas) y la colocación de los deflectores. Elegir el modelo de turbulencia adecuado es crucial: el modelo k-ε realizable funciona bien para sistemas gas-líquido, mientras que LB-LES ofrece una mayor resolución para identificar picos de estrés que podrían dañar las células. Un estudio de convergencia de malla asegura que los resultados no dependan del tamaño de la malla.
Las condiciones de contorno deben reflejar los parámetros operativos del mundo real, como la velocidad del impulsor, las tasas de burbujeo de gas, la densidad del fluido y la viscosidad. Para aplicaciones de carne cultivada, a menudo se utilizan modelos conservadores de arrastre de burbujas para estimar el esfuerzo cortante [8]. El sistema debe operar en un régimen completamente turbulento, con números de Reynolds que superen los 10,000 para asegurar que el número de potencia permanezca constante independientemente de la velocidad del impulsor [1].
Las predicciones de CFD para la transferencia de oxígeno, los tiempos de mezcla y el estrés hidrodinámico deben alinearse con los datos experimentales recopilados utilizando microsondas sensibles al esfuerzo cortante o agregados de nanopartículas [2]. Por ejemplo, un modelo matemático de transferencia de masa guió la ampliación directa de un proceso de cultivo de células CHO desde una unidad de banco de 2 litros hasta un biorreactor industrial de 1,500 litros en Sartorius.Al utilizar CFD para predecir la demanda de oxígeno y la eliminación de CO₂, el equipo mantuvo atributos de calidad del producto consistentes, como N-glicanos y variantes de carga, a través de escalas [6].
CFD para Otros Tipos de Biorreactores
Si bien los tanques agitados dominan el cultivo celular industrial, otros diseños de biorreactores requieren enfoques CFD personalizados. Por ejemplo, los biorreactores de balanceo o de onda dependen del método de Volumen de Fluido (VOF) para simular la interfaz gas-líquido, ya que el movimiento de las ondas genera estrés de corte en estos sistemas. Estos diseños crean entornos de corte mucho más suaves: el estrés máximo es de aproximadamente 0.01 Pa en comparación con los tanques agitados, pero su escalabilidad es limitada para la producción de carne cultivada a gran escala [4].
Los biorreactores de fibra hueca, por otro lado, utilizan modelos de medios porosos basados en las ecuaciones de Brinkman para simular la difusión de nutrientes y la resistencia al flujo a través de membranas.Los sistemas de lecho fluidizado requieren modelos de Euler-Lagrange para capturar las interacciones partícula-fluido y la expansión del lecho, mientras que los biorreactores de circulación utilizan métodos de Euler-Euler para analizar la turbulencia inducida por burbujas y la retención de gas [4]. Cada diseño presenta desafíos únicos: los lechos fluidizados deben equilibrar la distribución de microportadores contra la exposición al cizallamiento, mientras que los sistemas de circulación deben gestionar las tensiones causadas por la ruptura de burbujas, una causa principal de muerte celular en biorreactores con burbujeo [1] [7].
Comprender estos enfoques de CFD es esencial para controlar el estrés por cizallamiento en los diferentes diseños de biorreactores utilizados en la producción de carne cultivada.
| Tipo de Biorreactor | Enfoque CFD | Consideración Clave |
|---|---|---|
| Tanque Agitado | RANS (SST), LES, LB-LES | Disipación de energía en la zona del impulsor (εMax) |
| Onda/Balancín | Volumen de Fluido (VOF) | Seguimiento de la interfaz gas-líquido |
| Fibra Hueca | Medios Porosos (Brinkman) | Flujo de nutrientes y resistencia de la membrana |
| Lecho Fluidizado | Euler-Lagrange | Interacción entre partículas y fluido, expansión del lecho |
| Airlift | Euler-Euler | Turbulencia de burbujas y retención de gas |
Estos variados métodos CFD destacan la necesidad de estrategias personalizadas, que desempeñan un papel crítico en la selección de equipos y la gestión del esfuerzo cortante.
Modelos a Escala Reducida y Validación Experimental
Si bien la Dinámica de Fluidos Computacional (CFD) proporciona predicciones valiosas, no puede reemplazar la necesidad de pruebas en el mundo real al escalar procesos. La validación experimental juega un papel crucial para garantizar que los modelos computacionales representen con precisión las condiciones de esfuerzo cortante del mundo real. Aquí es donde entran en juego los modelos a escala reducida, que imitan el entorno hidrodinámico de los biorreactores de producción a gran escala en sistemas más pequeños y fáciles de manejar. Al hacerlo, reducen el riesgo de errores costosos al pasar de operaciones a pequeña escala a operaciones a escala industrial. Este paso no solo confirma las predicciones de CFD, sino que también asegura un proceso de escalado más confiable y efectivo.
Creación de Modelos a Escala Reducida
El diseño de un modelo a escala reducida comienza con el mantenimiento de la similitud geométrica.Esto significa mantener las mismas proporciones entre componentes clave, como la altura del recipiente en relación con el diámetro y el diámetro del impulsor en relación con el diámetro del tanque [11]. Una vez que la geometría está alineada, los ingenieros seleccionan un criterio de escalado. Las opciones comunes incluyen potencia por volumen (P/V), velocidad de punta del impulsor o tasa de disipación de energía (EDR). Sin embargo, centrarse en la EDR localizada en lugar de la P/V promedio proporciona una mejor comprensión de la heterogeneidad del cizallamiento, lo cual es crítico para un modelado preciso.
Un enfoque más avanzado involucra simuladores de múltiples compartimentos. Por ejemplo, en febrero de 2021, Emmanuel Anane y su equipo desarrollaron un simulador de escala reducida de dos compartimentos que combina un reactor de tanque agitado (STR) y un reactor de flujo pistón (PFR). Este modelo se utilizó para estudiar cómo las células CHO responden a los gradientes de oxígeno disuelto. Su investigación reveló un umbral crítico de tiempo de residencia de 90 segundos.Más allá de este punto, las células CHO mostraron una caída del 15% en la densidad celular viable y un aumento en la acumulación de lactato [10]. Este hallazgo ofrece un punto de referencia claro para diseñar biorreactores industriales que mantengan la viabilidad celular.
Para proteger el crecimiento celular, los ingenieros a menudo buscan mantener las velocidades de punta del impulsor por debajo de 1.5 m/s [1]. Además, la longitud de microvórtice de Kolmogorov - una medida de la turbulencia - debe exceder el tamaño de las células, típicamente 20 μm o más para células de mamíferos, para evitar daños hidrodinámicos [1][3]. Por ejemplo, a una entrada de energía de 0.1 W/kg en cultivos de células animales, los vórtices más pequeños son de alrededor de 60 μm, proporcionando un margen de seguridad [3].
Validación de Predicciones CFD a través de Experimentos
Una vez que se establece un modelo a escala reducida, los métodos experimentales son esenciales para validar los parámetros derivados de CFD. La Velocimetría de Imágenes de Partículas (PIV) es una técnica ampliamente utilizada para este propósito. Al rastrear partículas en el fluido, PIV ayuda a confirmar si los patrones de flujo y los campos de velocidad en el modelo a escala reducida se alinean con las predicciones de CFD [12][4].
También se utilizan métodos de inyección de trazadores y decoloración para validar los tiempos de mezcla. En este proceso, se introducen trazadores como ácidos, bases o soluciones salinas cerca del impulsor, y su distribución se monitorea hasta que se logra un 95% de homogeneidad [12][3]. Para biorreactores de células de mamíferos a gran escala (5,000 L a 20,000 L), los tiempos de mezcla generalmente varían de 80 a 180 segundos [10].
En marzo de 2020, James Scully y su equipo en Regeneron Ireland DAC escalaron con éxito un proceso de cultivo celular de un biorreactor de 2,000 L a un biorreactor de un solo uso de 5,000 L con una geometría diferente. Se basaron en CFD para predecir parámetros clave como las tasas de transferencia de masa, los tiempos de mezcla y las tasas de cizallamiento. Estas predicciones fueron luego validadas a través de experimentos de fase única y multifase, lo que permitió un primer intento exitoso de escalado sin la necesidad de pruebas piloto a gran escala [5].
"Las simulaciones CFD se están utilizando cada vez más para complementar las investigaciones clásicas de ingeniería de procesos en el laboratorio con resultados resueltos espacial y temporalmente, o incluso reemplazarlas cuando las investigaciones de laboratorio no son posibles." - Stefan Seidel, Escuela de Ciencias de la Vida, ZHAW [12]
Técnicas adicionales de validación incluyen la medición de torque para confirmar la entrada de potencia específica (P/V) y números de potencia adimensionales a velocidades específicas del agitador [12][3]. Las tasas de transferencia de oxígeno se verifican utilizando métodos como las técnicas de desgasificación o sulfito, que determinan el coeficiente de transferencia de masa de oxígeno volumétrico (kLa) [12][7]. Para sistemas que utilizan microportadores, se emplean métodos de atenuación de luz o basados en cámaras para encontrar la velocidad mínima necesaria para suspender todas las partículas, asegurando que las predicciones de CFD de la distribución de la fase sólida sean precisas [12][4].
sbb-itb-ffee270
Factores que Afectan el Esfuerzo Cortante en Biorreactores
Para proteger la viabilidad celular durante la ampliación de escala, es fundamental comprender los factores físicos que impulsan el esfuerzo cortante. Las predicciones de Dinámica de Fluidos Computacional (CFD) y las validaciones a escala reducida revelan que la tasa de disipación de energía (EDR) desempeña un papel clave. EDR mide cómo la energía cinética del impulsor se convierte en calor, lo que lleva a una distribución desigual de energía. Por ejemplo, en impulsores de palas inclinadas, la energía tiende a concentrarse alrededor del impulsor, creando zonas de alto esfuerzo cortante que pueden dañar las células si no se gestionan adecuadamente.
Diseño del Impulsor y Entrada de Potencia
El tipo de impulsor utilizado influye significativamente en los patrones de flujo y la intensidad del esfuerzo cortante. Las turbinas Rushton, por ejemplo, generan flujo radial y alto esfuerzo cortante, lo que las hace ideales para la fermentación microbiana pero menos adecuadas para células mamíferas sensibles al esfuerzo cortante.Por otro lado, los impulsores de palas inclinadas crean un flujo axial con menor cizallamiento y mejor eficiencia de bombeo con la misma entrada de energía. Esto los convierte en la opción preferida para aplicaciones como la producción de carne cultivada, donde la viabilidad celular es una prioridad.
| Tipo de Impulsor | Patrón de Flujo | Número de Potencia (Nₚ) | Nivel de Cizallamiento | Aplicación Principal |
|---|---|---|---|---|
| Turbina Rushton | Radial | ~5.0 | Alto | Fermentación microbiana; dispersión de gas [3] |
| Pala Inclinada | Axial | ~1.0 | Bajo a Moderado | Cultivo de células de mamíferos; suspensión de sólidos [3] |
Las estrategias de escalado a menudo se basan en mantener una entrada de potencia constante por volumen (P/V). Sin embargo, a medida que aumenta el tamaño del reactor, esto puede llevar a velocidades de punta del impulsor más altas. Para las células de mamíferos, las velocidades de punta deben mantenerse por debajo de 1.5 m/s para evitar problemas de crecimiento [1]. En reactores a gran escala, el burbujeo puede introducir aún más estrés hidrodinámico que los impulsores, especialmente en recipientes que superan los 20 m³ [9]. Estos factores están estrechamente relacionados con la turbulencia, que se explora más a fondo en la discusión de la escala de Kolmogorov.
Escala de Kolmogorov y Modelado de Turbulencia
La escala de Kolmogorov (λ) define el tamaño de los remolinos turbulentos más pequeños donde la energía se disipa como calor.Si estos remolinos son más pequeños que el diámetro de la célula, el daño mecánico se convierte en una preocupación. Para las células de mamíferos, que típicamente miden 15–20 μm, la longitud del remolino debe exceder los 20 μm para evitar daños [1][3]. Por ejemplo, con una entrada de energía de 0.1 W/kg, el diámetro del remolino de Kolmogorov es de aproximadamente 60 μm, proporcionando un margen de seguridad [3].
"Si las entidades biológicas (e.g., células de mamíferos) son más pequeñas que λ [escala de Kolmogorov] en un biorreactor, entonces no ocurrirá daño por cizallamiento a tales entidades." - Muhammad Arshad Chaudhry [3]
En agosto de 2024, investigadores de Boehringer Ingelheim Pharma y la Universidad de Química y Tecnología de Praga utilizaron Simulaciones de Grandes Remolinos de Lattice-Boltzmann (LB-LES) para validar las predicciones de CFD en un biorreactor industrial de 12,500 L.Al utilizar agregados de nanopartículas sensibles al cizallamiento, midieron el estrés hidrodinámico máximo y demostraron que LB-LES podría resolver escalas turbulentas 100–1,000 veces más rápido que los métodos tradicionales [2]. Estos hallazgos son fundamentales para desarrollar estrategias para minimizar el estrés por cizallamiento.
Reducción del Estrés por Cizallamiento Usando Datos de Modelado
El modelado CFD permite a los ingenieros identificar zonas de alto cizallamiento y ajustar las condiciones de operación en consecuencia. Un enfoque efectivo es introducir sustratos, bases de pH o antiespumantes cerca de la zona del impulsor en lugar de en la superficie del líquido. Esto asegura una distribución rápida y minimiza los gradientes de concentración localizados [3]. En la producción de carne cultivada, un cizallamiento excesivo puede desprender células de los microportadores, mientras que una agitación insuficiente lleva al asentamiento de microportadores y desequilibrios de nutrientes [9].
Aditivos protectores como Pluronic F-68 (Poloxamer 188) se utilizan comúnmente para proteger las células de las fuerzas de cizallamiento, particularmente aquellas causadas por la ruptura de burbujas en la superficie del líquido, un contribuyente importante a la muerte celular en biorreactores [1]. Con estos surfactantes, se han reportado entradas de energía de hasta 100,000 W/m³ sin efectos letales [1]. Además, mantener la velocidad de entrada de gas en el orificio del dispersor por debajo de 30 m/s ayuda a reducir las pérdidas de productividad y la mortalidad celular [1].
Encontrar Equipos para Escalado de Biorreactores
Cómo Cellbase Apoya la Adquisición de Biorreactores
Escalar biorreactores para la producción de carne cultivada presenta su propio conjunto de desafíos. Aquí es donde
Al usar
La escalabilidad exitosa de los biorreactores utilizados en la industria biofarmacéutica juega un papel importante en la calidad y el tiempo de comercialización de estos productos [5].
Al aprovechar los datos respaldados por CFD, los equipos pueden optimizar la selección de equipos y minimizar la necesidad de realizar pruebas repetidas [5]. Estos conocimientos son cruciales para elegir biorreactores diseñados con una gestión óptima del esfuerzo cortante en mente.
Elección de Equipos para el Control del Esfuerzo Cortante
Para controlar el esfuerzo cortante de manera efectiva, ciertas especificaciones del equipo son particularmente importantes. La geometría del impulsor es un factor clave. Por ejemplo, los impulsores de palas inclinadas generan flujo axial con un número de potencia (Np) de aproximadamente 1.0, mientras que las turbinas Rushton tienen un Np mucho más alto de alrededor de 5.0.Esto significa que los diseños de palas inclinadas producen significativamente menos potencia y, por lo tanto, menos cizallamiento a la misma velocidad de rotación [3]. Para aplicaciones que involucran células de mamíferos utilizadas en carne cultivada, mantener la velocidad de la punta del impulsor por debajo de 1.5 m/s es esencial para evitar daños a las células [1].
La configuración del dispersor es otra consideración crítica. Para prevenir un cizallamiento excesivo, el equipo debe asegurar que la velocidad de entrada de gas en el orificio del dispersor se mantenga por debajo de 30 m/s, y que el número de Reynolds del orificio permanezca por debajo de 2,000. Superar estos umbrales puede llevar al "régimen de chorro", donde las burbujas se dispersan de manera desigual y crean zonas de cizallamiento localizadas [1]. Los dispersores de agujero perforado o de tubo abierto son más adecuados para células sensibles al cizallamiento en comparación con los microdispersores. Además, el equipo debe ser compatible con la reducción de escala. Proveedores que ofrecen modelos de banco (e.g., 3 L systems) que son geométricamente similares a sistemas a gran escala (2,000 L o más) permiten a los equipos validar predicciones de CFD a menor escala antes de pasar a la producción a gran escala [1][2].
Conclusión
Escalar biorreactores para la producción de carne cultivada requiere alejarse de los métodos tradicionales de prueba y error y adoptar estrategias basadas en modelos para abordar las diferencias de cizallamiento localizadas. La Dinámica de Fluidos Computacional (CFD) se ha convertido en una herramienta clave en este proceso, permitiendo a los ingenieros predecir entornos hidrodinámicos y visualizar zonas de cizallamiento más allá de simples relaciones de potencia por volumen [1]. Al adherirse a parámetros críticos, como mantener las longitudes de los remolinos de Kolmogorov por encima de 20 μm y las velocidades de punta del impulsor por debajo de 1.5 m/s, los ingenieros pueden proteger las células de mamíferos del daño por cizallamiento mientras aseguran una adecuada mezcla y transferencia de oxígeno [1].
Métodos computacionales avanzados, como la Simulación de Grandes Vórtices (LES) y las técnicas de Lattice-Boltzmann, han demostrado su efectividad en la ampliación de procesos. Por ejemplo, en marzo de 2020, Regeneron Ireland DAC escaló con éxito un proceso de cultivo celular de un biorreactor de 2,000 L a un sistema de un solo uso de 5,000 L geométricamente distinto en el primer intento. Esto se logró utilizando predicciones de CFD multiparamétricas, eliminando la necesidad de extensas pruebas físicas [5]. Esta estrategia de "a la primera" no solo reduce los riesgos de contaminación, sino que también acorta el tiempo de comercialización, lo cual es crítico para el sector de la carne cultivada.
Métodos de validación experimental, como la Velocimetría de Imágenes de Partículas (PIV), confirman aún más la precisión de los modelos CFD [2]. Estos modelos validados ahora juegan un papel crucial en las decisiones de adquisición.Empresas como
Preguntas Frecuentes
¿Cómo apoya la Dinámica de Fluidos Computacional (CFD) la ampliación de biorreactores para la producción de carne cultivada?
La Dinámica de Fluidos Computacional (CFD) es un cambio de juego cuando se trata de escalar biorreactores para carne cultivada. Proporciona una comprensión profunda de dinámicas de flujo, esfuerzo cortante, eficiencia de mezcla, y tasas de transferencia de masa - todos factores críticos para crear el entorno ideal para el crecimiento celular.
Con CFD, los ingenieros pueden optimizar elementos esenciales como el diseño del impulsor, la velocidad de agitación y la dispersión de gas. Esto asegura que los biorreactores operen bajo las mejores condiciones posibles, protegiendo tanto la salud celular como la productividad.
Además, CFD hace posible pasar de configuraciones de laboratorio pequeñas a biorreactores a gran escala industrial sin comprometer la eficiencia o la consistencia. Esto significa que la producción de carne cultivada puede escalar sin problemas mientras se mantienen altos estándares.
¿Qué hace que las Simulaciones de Grandes Vórtices (LES) sean mejores que los métodos tradicionales para el modelado de biorreactores?
Las Simulaciones de Grandes Vórtices (LES) proporcionan una visión más profunda y precisa del flujo turbulento dentro de los biorreactores en comparación con métodos tradicionales como Reynolds-averaged Navier-Stokes (RANS).Al centrarse en los remolinos a gran escala y modelar solo los movimientos disipativos más pequeños, LES puede identificar puntos críticos de esfuerzo cortante, como zonas de alto esfuerzo cortante inducidas por vórtices, que de otro modo podrían pasarse por alto. Este nivel de detalle juega un papel clave en la reducción del daño celular y garantiza una mayor fiabilidad al escalar la producción de carne cultivada.
A diferencia de los métodos que dependen en gran medida de correlaciones empíricas, LES ofrece capacidades predictivas más sólidas al pasar de biorreactores a escala de laboratorio a escala industrial. Los avances en técnicas computacionales también han hecho que LES sea más accesible, permitiendo simulaciones detalladas sin la necesidad de recursos computacionales prohibitivos. Para las empresas que buscan integrar diseños impulsados por LES,
¿Por qué es importante mantener las longitudes de los remolinos de Kolmogorov por encima de 20 µm para la viabilidad de las células de mamíferos?
Mantener las longitudes de los remolinos de Kolmogorov por encima de aproximadamente 20 µm es crucial para proteger las células de mamíferos durante las operaciones de biorreactores. Cuando estos remolinos turbulentos se reducen por debajo del tamaño de las células, pueden exponer a las células a un estrés de cizallamiento excesivo, lo que arriesga dañar sus membranas y reducir la viabilidad celular.
Mantener las estructuras turbulentas más pequeñas más grandes que las células ayuda a reducir las posibilidades de daño mecánico. Esto no solo promueve cultivos celulares más saludables, sino que también mejora el rendimiento general del biorreactor. Esta consideración se vuelve aún más importante durante la ampliación del biorreactor, donde asegurar condiciones consistentes de estrés de cizallamiento es notablemente más difícil.











