Escalar biorreatores para a produção de carne cultivada - de sistemas pequenos (1–5 L) para grandes (1.000+ L) - traz desafios energéticos. Volumes maiores requerem mais energia para mistura, transferência de oxigênio e controle de calor, mas também oferecem eficiências. Por exemplo, passar de 5 m³ para 100 m³ pode reduzir o uso específico de energia em até 88%. No entanto, a mistura mais lenta em sistemas grandes pode criar desequilíbrios de oxigênio e nutrientes, afetando o crescimento celular. Sistemas de controle automatizados e estratégias como a operação no "ponto de inundação" ajudam a equilibrar o uso de energia e manter a viabilidade celular. Aqui está o que você precisa saber:
- Biorreatores de pequena escala: Alta energia por litro, mistura rápida, remoção de calor mais fácil, mas não ideal para produção em larga escala.
- Biorreatores de grande escala: Menor energia por litro, mistura mais lenta, gerenciamento de calor e gás mais complexo, mas melhor para produção comercial.
A eficiência energética melhora com a escala, mas manter a qualidade das células requer automação avançada e controle preciso da agitação, aeração e temperatura.
Design e Ampliação do Processo de Fermentação: Processamento Upstream (USP)
sbb-itb-ffee270
1. Biorreatores de Pequena Escala (1–5 L)
Biorreatores em escala de laboratório operam sob condições de energia muito diferentes em comparação com seus equivalentes industriais. Nesta escala menor, o desempenho dos processos é geralmente mais influenciado pela cinética celular do que pelos fenômenos de transporte [2]. A alta relação entre área de superfície e volume torna a remoção de calor mais simples, mas também significa que os parâmetros de agitação não podem ser escalados diretamente para sistemas maiores. Essa dinâmica muitas vezes leva a agitação a ser o principal fator de consumo de energia nesta fase.
Em sistemas de pequena escala, o uso de energia é amplamente ditado pela agitação e mistura.Para alcançar a mesma entrada de potência volumétrica (P/V) que biorreatores maiores, os menores precisam de velocidades de impelidor mais altas devido aos seus diâmetros de impelidor menores [2][9]. Para culturas de células de mamíferos - fundamentais na produção de carne cultivada - um P/V de 20–40 W/m³ é tipicamente ideal. Esta faixa apoia o crescimento celular enquanto minimiza a agregação celular [5].
A aeração adiciona outra camada de complexidade. O coeficiente de transferência de massa volumétrica (kLa) mede quão eficientemente o oxigênio alcança as células. No entanto, aumentar a agitação para melhorar o kLa também pode aumentar o estresse de cisalhamento hidromecânico. Para processos sensíveis ao cisalhamento, como a produção de lentivírus, os dispersores de tubo aberto são frequentemente preferidos, pois os micro-dispersores podem reduzir os títulos virais funcionais em até 25% [5].Operar próximo ao ponto de inundação, com menor agitação e maior aeração, pode ajudar a equilibrar o uso de energia enquanto atende às necessidades de transferência de oxigênio [1].
O gerenciamento térmico nesses biorreatores é tipicamente realizado por sistemas de resfriamento à base de água, como jaquetas ou serpentinas internas, para dissipar o excesso de calor. Cada watt de agitação mecânica gera calor que deve ser removido de forma eficiente. Além disso, a atividade metabólica microbiana produz cerca de 14,7 kJ de calor por grama de oxigênio consumido [7]. A potência de refrigeração necessária depende do calor total gerado e da eficiência do sistema de resfriamento, com um coeficiente de desempenho típico em torno de 0,6. Ajustar as configurações do agitador durante diferentes estágios de uma operação em batelada pode reduzir significativamente o consumo de energia [7].
Os biorreatores modernos de pequena escala estão equipados com sistemas de automação que utilizam sensores e algoritmos para regular dinamicamente o pH, os níveis de oxigênio e a temperatura. Esses sistemas garantem que apenas o resfriamento ou agitação necessários sejam aplicados durante cada fase de crescimento, reduzindo o desperdício de energia [6][10]. Para empresas de carne cultivada que adquirem equipamentos por meio de plataformas como
2.Biorreatores de Grande Escala (1.000+ L)
Ao aumentar a produção, os desafios crescem à medida que os tempos de mistura aumentam significativamente - de apenas 10 segundos em sistemas pequenos de 3 litros para um tempo muito maior de 80–180 segundos em grandes recipientes que variam de 5.000 a 20.000 litros. Esses tempos de mistura mais lentos criam obstáculos operacionais, como gradientes de oxigênio dissolvido e mudanças metabólicas, que podem reduzir a densidade celular viável em até 15% durante a fase estacionária [4]. Para culturas de células de mamíferos usadas na produção de carne cultivada, ultrapassar o limite de tempo de mistura de 90 segundos pode desencadear mudanças metabólicas, levando ao acúmulo de lactato [4]. Para resolver esses problemas, ajustes nas estratégias de agitação e aeração são essenciais em escalas maiores.
Nesses volumes maiores, as demandas de energia mudam. Inicialmente, a agitação desempenha um papel maior no uso de energia quando as taxas de transferência de oxigênio são baixas.No entanto, à medida que o crescimento celular acelera, a aeração torna-se o fator dominante, representando até 70% do consumo de energia. Operar próximo ao ponto de inundação - um ponto onde o fluxo de gás interrompe a mistura de líquidos - continua sendo crítico, mas nesta escala, trata-se principalmente de gerenciar a carga de energia da aeração. Aumentar a pressão do espaço livre é outra tática eficaz, pois aumenta a solubilidade do oxigênio e reduz a necessidade de altas velocidades de agitação quando as taxas de transferência de oxigênio são altas [9].
O gerenciamento térmico também se torna mais complexo em escala, mas oferece oportunidades para maior eficiência. Por exemplo, fermentações industriais mostram uma ampla gama de requisitos de energia: a fermentação de ácido itacônico tem uma média de 0,51 kW/m³, enquanto a produção de lisina, que demanda mais oxigênio, requer 2,61 kW/m³ [1]. Os sistemas de refrigeração geralmente alcançam uma eficiência de refrigeração em torno de 0.6, embora em condições ideais, os coeficientes de desempenho possam atingir até 8,6 [7].
Ampliar de 5 m³ para 100 m³ pode reduzir os requisitos específicos de energia em até 88%, desde que as operações sejam otimizadas [9]. Isso é crucial para a produção de carne cultivada, onde equilibrar eficiência energética com a manutenção da qualidade do produto é fundamental. A modelagem mecanicista agora permite que as equipes de produção prevejam a geração de calor e as necessidades de energia combinando dados de crescimento microbiano com modelos termodinâmicos [9][1]. Para empresas no setor de carne cultivada que buscam sistemas em larga escala por meio de plataformas como
Para capitalizar totalmente nas economias de energia, parâmetros físicos otimizados devem ser combinados com automação precisa. Sistemas de automação nessa escala devem equilibrar múltiplas demandas de forma eficaz. Uma estratégia envolve segmentar o processo de fermentação em intervalos onde a potência do agitador permanece constante enquanto o fluxo de ar se ajusta para corresponder à absorção de oxigênio, minimizando o uso de energia [7]. Sistemas de controle modernos também monitoram os níveis de oxigênio dissolvido em tempo real, ajustando dinamicamente as configurações mecânicas e pneumáticas para evitar as interrupções metabólicas que ocorrem quando os tempos de mistura ultrapassam os limites fisiológicos [4] .
Vantagens e Desvantagens
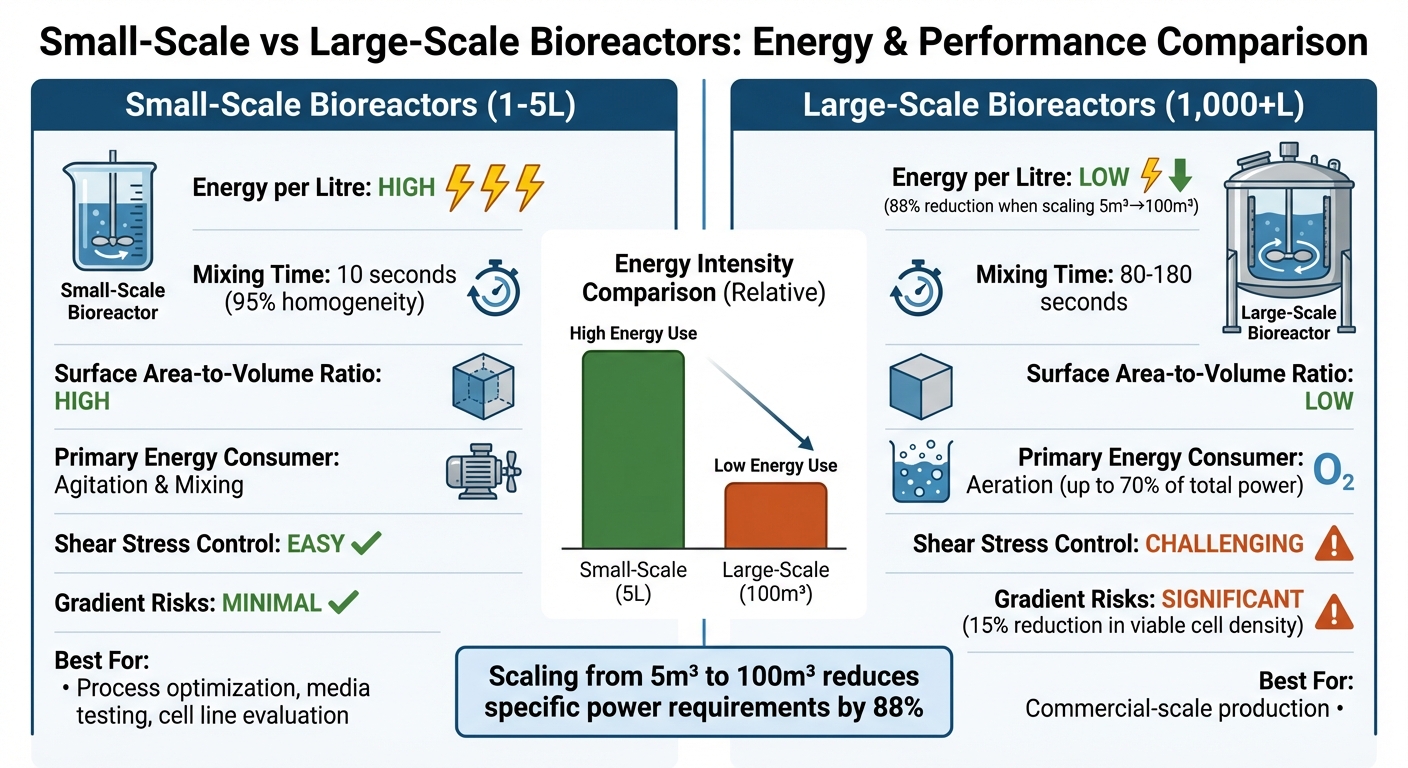
Comparação de Eficiência Energética entre Biorreatores de Pequena e Grande Escala
Decidir entre biorreatores de pequena e grande escala para produzir carne cultivada envolve avaliar a eficiência energética, a complexidade operacional e a adequação às necessidades de produção. Aqui está uma análise mais detalhada de como eles se comparam:
| Recurso | Biorreatores de Pequena Escala (1–5 L) | Biorreatores de Grande Escala (1.000+ L) |
|---|---|---|
| Intensidade de Energia por Litro | Alta; requer mais potência específica para manter a uniformidade e a transferência de oxigênio [9][8] | Baixa; a escala de 5 m³ para 100 m³ pode reduzir as necessidades de potência específica em 88% [9] |
| Eficiência de Mistura | Excelente; atinge 95% de homogeneidade em cerca de 10 segundos [4] | Pobre; leva de 80 a 180 segundos, aumentando o risco de gradientes [4] |
| Relação Área de Superfície-Volume | Alto; suporta remoção eficiente de calor e remoção de CO₂ [2] | Baixo; apresenta desafios no gerenciamento de calor e troca de gases [2] |
| Consumidor Primário de Energia | Agitação e mistura [9] | Aeração (até 70% da potência total durante alto crescimento celular) [9] |
| Gestão de Estresse de Cisalhamento | Mais fácil de controlar; células são menos expostas a forças danosas [3][4] | Mais difícil de gerenciar; alta agitação pode prejudicar células animais frágeis [3][4] |
| Riscos Relacionados a Gradientes | Mínimo; mistura rápida evita interrupções metabólicas | Significativo; gradientes de oxigênio em 90 segundos podem reduzir a densidade celular viável em 15% [4] |
| Adequação para Carne Cultivada | Ideal para otimizar processos, testar meios e avaliar linhagens celulares [3][8] | Crítico para produção em escala comercial; requer designs especializados de baixo cisalhamento [11][3] |
Biorreatores de bancada se destacam em alcançar mistura rápida e uniforme, tornando-os perfeitos para ajustar finamente as condições de cultura celular.No entanto, suas altas demandas de energia por litro os tornam menos práticos para produção em larga escala. Por outro lado, biorreatores de grande escala são muito mais eficientes em termos de energia por litro, mas apresentam desafios operacionais que podem afetar a viabilidade celular. Por exemplo, tempos de mistura mais lentos podem criar gradientes de oxigênio e nutrientes, o que pode interromper o crescimento de células sensíveis ao cisalhamento usadas em carne cultivada.
Para empresas que trabalham com fornecedores como
Conclusão
Ampliar biorreatores oferece uma grande redução no uso de energia por litro. Por exemplo, passar de um biorreator de 5 m³ para um de 100 m³ pode reduzir a demanda de energia específica em 88% [9], tornando a produção em larga escala muito mais econômica. No entanto, essa eficiência vem com um compromisso. Enquanto biorreatores menores alcançam mistura uniforme em cerca de 10 segundos, vasos industriais maiores demoram significativamente mais - cerca de 80 a 180 segundos. Essa mistura mais lenta pode criar gradientes prejudiciais de oxigênio dissolvido [4].
Essa mudança na eficiência também altera onde a energia é consumida. Em sistemas menores, a maior parte da energia é gasta na agitação. Mas em escala comercial, especialmente com altas densidades celulares, a aeração se torna o principal consumidor de energia, representando até 70% da demanda total de energia [9].
A automação é fundamental para enfrentar esses desafios. Ferramentas como CAE, CFD e IA permitem que os produtores modelem e otimizem o equilíbrio entre agitação e aeração antes de aumentar fisicamente a escala [3]. Além disso, sensores em tempo real que monitoram os níveis de oxigênio dissolvido e dióxido de carbono permitem ajustes dinâmicos através de sistemas de controle automatizados. Esses sistemas ajudam a prevenir mudanças metabólicas custosas, mantendo o uso de energia por quilograma de produto sob controle e abrindo caminho para estratégias de escalonamento mais inteligentes.
Para produtores que buscam expandir, operar próximo ao ponto de inundação é frequentemente a abordagem mais eficiente. Essa estratégia prioriza a intensa aeração em detrimento da agitação que consome muita energia [1]. Técnicas como pressurização do espaço de cabeça podem reduzir ainda mais a necessidade de agitação durante o pico de transferência de oxigênio [9].Ao adquirir equipamentos, plataformas como
Perguntas Frequentes
Como a automação melhora a eficiência energética em biorreatores de grande escala?
A automação desempenha um papel crucial no aumento da eficiência energética em biorreatores de grande escala, permitindo ajustes precisos e em tempo real de parâmetros críticos como agitação, aeração, temperatura e níveis de oxigênio dissolvido.Em vez de aderir a configurações rígidas e excessivamente cautelosas, os sistemas automatizados dependem de dados de sensores em tempo real para ajustar esses fatores, garantindo que a energia seja usada de forma eficiente para manter as condições ideais para o crescimento celular.
Esse controle dinâmico é particularmente benéfico durante as fases de inicialização e aumento de escala, onde a automação permite ajustes rápidos às condições de processo em mudança, reduzindo o uso desnecessário de energia. Ao alinhar os sistemas de controle com as características específicas dos designs de biorreatores - como sistemas de tanque agitado ou de elevação por ar - a automação não só melhora a consistência, mas também reduz a energia necessária para produzir cada quilograma de carne cultivada. Esses avanços são fundamentais para aumentar a produção de forma eficiente, mantendo o impacto ambiental sob controle.
Quais problemas podem surgir de tempos de mistura mais lentos em biorreatores de grande escala?
Em biorreatores de grande escala, a mistura mais lenta pode causar distribuição desigual de nutrientes e oxigênio, levando ao desenvolvimento de gradientes. Esses gradientes podem interromper o crescimento celular, resultar em acúmulo desigual de resíduos e reduzir a eficiência geral do sistema.
Para enfrentar esses problemas, os operadores frequentemente recorrem a entradas de energia mais altas. Embora essa abordagem ajude, ela também aumenta o consumo de energia e os custos operacionais. Encontrar soluções para esses desafios é essencial para manter a eficiência energética e alcançar o desempenho ideal durante a ampliação.
Por que operar próximo ao ponto de inundação é considerado eficiente em termos de energia durante a ampliação de biorreatores?
Operar próximo ao ponto de inundação durante a ampliação de biorreatores é frequentemente visto como uma abordagem eficiente em termos de energia.Este método otimiza a mistura gás-líquido, que é crítica para a transferência de massa eficaz. Ao maximizar a taxa de fluxo de gás sem levar o sistema à instabilidade, o biorreator pode funcionar eficientemente enquanto mantém o uso de energia sob controle.
Dito isso, operar próximo a esse limite requer monitoramento e controle cuidadosos. Ultrapassar o ponto de inundação pode desestabilizar o sistema ou levar a uma queda no desempenho, tornando a precisão um fator chave para manter a eficiência.











