La certificación de salas limpias es vital para la producción de carne cultivada, asegurando la seguridad y el cumplimiento con las regulaciones del Reino Unido como el Reglamento (CE) 853/2004. Sin certificación, las instalaciones corren el riesgo de contaminación, incumplimiento y problemas de calidad del producto. Aquí hay un resumen rápido del proceso:
- Por qué la Certificación es Importante: Previene la contaminación microbiana, se alinea con los principios HACCP y asegura una producción consistente.
- Normas Clave: ISO 14644-1 (limpieza del aire), EU GMP Anexo 1 (fabricación estéril) y EN 17141 (control microbiano).
-
Pasos para la Certificación:
- Diseño y Construcción: Instalar filtros HEPA, sistemas de flujo de aire y mantener diferenciales de presión adecuados.
- Calificación de Instalación (IQ): Verificar que la sala limpia cumpla con las especificaciones de diseño.
- Calificación Operacional (OQ): Probar el rendimiento bajo condiciones controladas.
- Calificación de Desempeño (PQ): Validar la funcionalidad durante las operaciones reales.
- Monitoreo Continuo: Revisiones regulares de partículas, presión, temperatura y humedad.
- Cumplimiento Continuo: Recalificación cada 6–12 meses o después de cambios importantes.
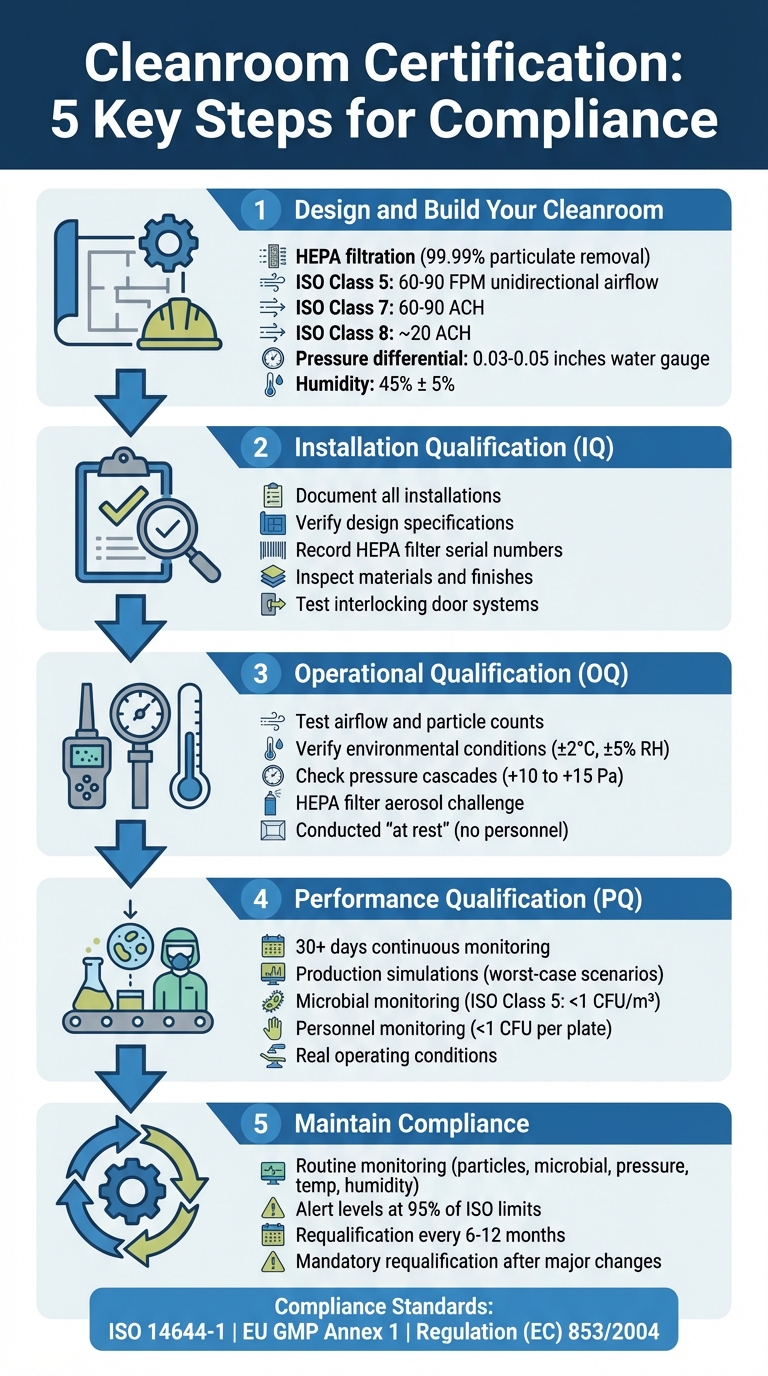
Proceso de Certificación de Salas Limpias en 5 Pasos para Instalaciones de Carne Cultivada
Diseño y Certificación de Salas Limpias
Paso 1: Diseña y Construye tu Sala Limpia
Construir una sala limpia para la producción de carne cultivada requiere una planificación cuidadosa en torno a tres sistemas principales: filtración HEPA, controles ambientales, y separación de flujo de trabajo. Estos elementos aseguran condiciones estériles y te ayudan a evitar modificaciones costosas más adelante.Una vez que estos sistemas estén en su lugar, concéntrese en optimizar su rendimiento durante la instalación.
Requisitos de Filtración HEPA y Flujo de Aire
El sistema de manejo de aire es la columna vertebral de su sala limpia y determina si cumple con la clasificación ISO requerida. Los filtros HEPA eliminan el 99.99% de las partículas[5], pero su efectividad depende de entregar aire a tasas y patrones específicos adaptados a cada zona de producción.
Para áreas de Clase ISO 5 - donde ocurren procesos asépticos como la cosecha de carne - necesitará flujo de aire unidireccional (laminar) a 60 a 90 pies por minuto (FPM) [5]. Esto implica unidades de filtro de ventilador montadas en el techo (FFUs) que dirigen el flujo de aire a través de ventilaciones de pared baja con un ángulo de descarga estrecho.
En zonas de Clase ISO 7 y 8, se utiliza un diseño de flujo de aire mixto. Aquí, el aire fresco de suministro se mezcla con el aire interno, requiriendo menos cambios de aire por hora (ACH).Las zonas de Clase ISO 7 necesitan 60–90 ACH, mientras que las zonas de Clase ISO 8 requieren alrededor de 20 ACH[1][6]. Para calcular ACH, divida el volumen de aire suministrado (por hora) por el volumen de la habitación. Tenga en cuenta que los techos más altos aumentan tanto las demandas de flujo de aire como los costos[3].
Los diferenciales de presión son clave para mantener los contaminantes fuera. Mantenga un diferencial de presión positivo de 0.03–0.05 pulgadas de columna de agua entre las salas limpias y las áreas adyacentes [7]. Sin embargo, no exceda 0.1 pulgadas de columna de agua a través de las puertas, ya que esto puede dificultar su apertura, requiriendo hasta 11 libras de fuerza en una puerta estándar de 3×7 pies[7].
Después de la instalación, pruebe la integridad del sistema de filtración utilizando pruebas de desafío de aerosol como las pruebas DOP o PAO para confirmar que no hay fugas o sellos débiles en las carcasas de los filtros HEPA[1].Los estudios de visualización de humo también pueden ayudar a verificar el flujo de aire laminar y asegurar que no haya turbulencias o reflujo en zonas sensibles.
Con la filtración en su lugar, el siguiente paso es asegurar condiciones ambientales consistentes.
Controles Ambientales para Producción
Mantener una temperatura, humedad y presión estables es crucial para minimizar los riesgos microbianos[9]. Su sistema HVAC debe mantener continuamente estos parámetros mientras apoya las altas tasas de cambio de aire requeridas para la clasificación ISO de su sala limpia.
El control de temperatura es especialmente importante. El sistema debe contrarrestar el calor de los biorreactores, la iluminación y el personal sin interrumpir los patrones de flujo de aire. La humedad relativa debe mantenerse en 45% ± 5%, lo que ayuda a prevenir cargas electrostáticas que atraen partículas y evita problemas de condensación. Esta gama también garantiza un entorno de trabajo cómodo para el personal con bata[7].
El monitoreo en tiempo real de parámetros ambientales como el pH y el oxígeno disuelto puede ayudar a detectar signos tempranos de crecimiento microbiano[9]. El monitoreo continuo del aire, las superficies y el agua es otra práctica esencial para detectar la contaminación antes de que se intensifique. Además, diseñe su sistema HVAC para un tiempo de recuperación corto: esto asegura que la sala limpia regrese rápidamente a su nivel de limpieza especificado después de un evento de contaminación, reduciendo el tiempo de inactividad[1].
Una vez que los controles ambientales estén en su lugar, concéntrese en gestionar cómo se mueven los materiales y las personas a través del espacio para minimizar los riesgos de contaminación.
Gestión del Flujo de Materiales y Personal
"Los trabajadores de salas limpias son la mayor fuente de contaminación de una sala limpia y todos los procesos críticos deben estar aislados de las puertas de acceso y caminos del personal." - Vincent A. Sakraida, Ingeniero[7]
El personal es el mayor riesgo de contaminación en las salas limpias, desprendiendo partículas de piel, cabello y otros desechos[7][6]. Para abordar esto, el diseño de su sala limpia debe separar físicamente los procesos críticos de las áreas de alto tráfico y puntos de acceso.
Los materiales deben moverse en una dirección - de zonas de menor grado a zonas de mayor grado - utilizando procesos de desinfección o esterilización validados en el camino[8].Los esterilizadores de doble extremo, como los autoclaves de doble puerta o los túneles de despirogenación, son ideales para transferir artículos a áreas de procesamiento aséptico sin comprometer la calidad del aire[8].
Las esclusas de aire actúan como amortiguadores entre áreas de diferentes niveles de limpieza. Las zonas ISO Clase 7 o más limpias deben incluir una antesala para vestirse, lo que evita que los contaminantes externos entren en las áreas de producción[6]. Para las zonas de Grado A y B, los sistemas de puertas interbloqueadas aseguran que solo se pueda abrir una puerta a la vez[8]. Si no es factible tener esclusas de aire separadas para el personal y los materiales, la separación temporal basada en procedimientos puede ayudar a evitar el movimiento simultáneo entre zonas[8].
Limite los espacios críticos a un solo punto de acceso para reducir los riesgos de contaminación cruzada[7].Las ventanas de observación o cámaras remotas pueden permitir a los supervisores monitorear las actividades sin entrar en la sala limpia, reduciendo el acceso innecesario[8].
Cada una de estas medidas juega un papel vital en lograr la certificación de la sala limpia y asegurar que su instalación cumpla con los estrictos estándares requeridos para la producción segura y conforme de carne cultivada.
Paso 2: Completar la Calificación de Instalación (IQ)
Una vez que se complete la construcción, el siguiente paso es la Calificación de Instalación (IQ). Este proceso asegura que cada componente de la sala limpia haya sido instalado correctamente antes de pasar a las pruebas operativas. Esencialmente, IQ actúa como el puente entre completar la construcción física y comenzar el balanceo de HVAC, confirmando que todo está listo para la siguiente fase.
"Las verificaciones de Calificación de Instalación (IQ) aseguran que el equipo, los componentes y la configuración de la sala limpia cumplan con las especificaciones del fabricante y que todo haya sido instalado correctamente." - Kjeld Lund, Especialista en Salas Limpias [11]
IQ se centra en el estado "tal como se construyó" - cuando la estructura de la sala limpia está terminada pero el equipo de producción aún no está en su lugar. El objetivo principal aquí es asegurar que lo que se ha construido coincida con el diseño original, con cualquier desviación debidamente documentada y abordada.
Documentar Todos los Pasos de Instalación
La documentación exhaustiva es clave durante esta fase. Necesitará registros detallados tal como se construyeron, que incluyan dibujos arquitectónicos actualizados, listas de equipos HVAC, secuencias de control y diagramas de cableado eléctrico. Estos registros deben reflejar cómo se construyó realmente la sala limpia, no solo cómo se planificó.
Para cada filtro HEPA o ULPA, registre el número de serie, la ubicación exacta y la fecha de instalación. Es crucial inspeccionar los filtros por daños de tránsito inmediatamente después de la instalación, ya que incluso las fugas menores pueden comprometer la integridad de la sala limpia. Etiquete cada pieza de equipo y sensor con un ID único que coincida con su lista de equipos, simplificando futuras auditorías y mantenimiento.
Los certificados de calibración para todos los instrumentos de monitoreo también deben archivarse. Esto incluye contadores de partículas, sensores de presión diferencial, sondas de temperatura y humedad, y dispositivos de flujo de aire. Como explica Toni Horsfield de ISO Cleanroom, "El certificado de calibración [para contadores de partículas] está incluido dentro de su informe de validación de sala limpia." [10]
Las inspecciones de materiales y acabados son igualmente importantes. Verifique que los paneles de pared, pisos, puertas, pasamuros y selladores cumplan con los estándares GMP.Las superficies deben ser no desprendibles, de bajo VOC y estar adecuadamente selladas. Las puertas y ventanas deben estar al ras con las paredes para mantener la integridad de la presión.
Mantenga un registro de desviaciones para cualquier variación de diseño, anotando las evaluaciones y acciones correctivas tomadas. Este registro formará parte de su informe de validación final, consolidando todos los hallazgos de la fase de instalación.
Verificar las Especificaciones de Diseño
Una vez que sus registros de instalación estén completos, el siguiente paso es asegurarse de que cada sistema se alinee con el diseño aprobado. Cruce la Especificación de Requisitos del Usuario (URS) con las instalaciones físicas para confirmar que no se pasó por alto nada durante el envío o ensamblaje.
Para los sistemas de HVAC y filtración, verifique que las unidades de manejo de aire, las conexiones de conductos y las posiciones de los difusores coincidan con los dibujos de diseño.Confirme que los filtros HEPA estén correctamente asentados en sus alojamientos y que todas las pruebas de presión de los conductos se hayan completado con éxito. Registre las especificaciones y hojas de datos para cada unidad de filtro de ventilador.
La verificación estructural incluye inspeccionar los enclavamientos, esclusas de aire y pasamuros para asegurar que funcionen como se pretende. Pruebe los sistemas de puertas enclavadas para garantizar que ambas puertas no puedan abrirse al mismo tiempo. Verifique que todos los sellos estén intactos y que la sala limpia pueda mantener las diferencias de presión requeridas.
Ejecute el sistema HVAC para lograr condiciones de estado estable antes de pasar a la siguiente etapa de pruebas.
Realizar la IQ con precisión es crucial, ya que sienta las bases para todas las etapas de calificación posteriores. Saltarse pasos o apresurarse en la documentación puede llevar a complicaciones durante las pruebas operativas y auditorías regulatorias. Al completar estas verificaciones a fondo, asegura una transición sin problemas a la calificación operativa.
Paso 3: Realizar la Calificación Operacional (OQ)
Una vez que la Calificación de Instalación confirma que todo está instalado correctamente, el siguiente paso es la Calificación Operacional (OQ). Esta fase asegura que su sala limpia opere como se pretende bajo condiciones definidas. Normalmente, estas pruebas se realizan "en reposo", lo que significa que el sistema HVAC está funcionando, pero no hay personal ni actividades de producción en curso.
"La validación proporciona una prueba objetiva de que la sala limpia hace lo que fue diseñada para hacer: mantener una atmósfera estable y libre de contaminantes tanto en condiciones estáticas (en reposo) como operativas." - Standard Tech [12]
Las pruebas de OQ son cruciales para demostrar el cumplimiento con las normas ISO 14644-1 y GMP. Para las instalaciones de carne cultivada, este paso es especialmente importante ya que los procesos biológicos dependen de un control estricto de partículas y microbios.Para asegurar resultados precisos, estabilice la sala limpia durante al menos 30 minutos antes de comenzar las pruebas para evitar conteos de partículas sesgados [12]. Estas verificaciones se basan en la fase de instalación, sentando las bases para ajustar sus controles ambientales.
Pruebe el Flujo de Aire y los Conteos de Partículas
El conteo de partículas en el aire es la piedra angular de la clasificación ISO. Usando un contador de partículas láser calibrado, mida la concentración de partículas en el aire para confirmar el cumplimiento con la clase ISO requerida. Para la Clase ISO 5, consulte los límites de partículas especificados en la tabla de estándares.
El número de ubicaciones de muestreo depende del tamaño de la sala limpia. ISO 14644-1 proporciona pautas claras: las salas más grandes requieren más puntos de muestreo, dispuestos en un patrón de cuadrícula [16]. Si está probando de dos a nueve ubicaciones, necesitará calcular el Límite Superior de Confianza (UCL) del 95% para determinar el cumplimiento.Para diez o más puntos de muestreo, este cálculo es innecesario [15].
Las mediciones de velocidad y volumen del flujo de aire aseguran que su tasa de cambio de aire cumpla con las especificaciones de diseño. Use un anemómetro para medir la velocidad en varios puntos, especialmente cerca de áreas críticas del proceso, y confirme que estos valores coincidan con sus objetivos de diseño.
Los estudios de humo ofrecen una forma visual de verificar la dirección del flujo de aire, asegurando que se mueva de zonas más limpias a menos limpias. Genere humo cerca de puertas, pasadizos y otras áreas vulnerables para detectar fugas o turbulencias que podrían interrumpir el flujo de aire [12]. Aunque los contadores de partículas son precisos, los estudios de humo pueden revelar problemas como zonas estancadas que de otro modo podrían pasar desapercibidas.
Los filtros HEPA y ULPA también deben ser revalidados durante la OQ. Use un desafío de aerosol para verificar fugas en los filtros o sus sellos.Incluso los errores menores de instalación pueden comprometer el rendimiento, por lo que siempre se debe volver a probar después de cualquier mantenimiento o reemplazo de filtro [12].
Una vez que se confirma el rendimiento del flujo de aire, el enfoque se desplaza a las condiciones ambientales que afectan tanto la calidad del producto como la comodidad del operador.
Verificar las Condiciones Ambientales
La temperatura y la humedad juegan un papel significativo en el mantenimiento de la calidad del producto y en garantizar un entorno de trabajo cómodo. Para las instalaciones de carne cultivada, los objetivos de validación son típicamente ±2°C para la temperatura y ±5% para la humedad relativa [12]. Se recomienda el monitoreo continuo durante al menos 24 horas, ya que los controles puntuales podrían pasar por alto fluctuaciones que podrían afectar la validación [12].
Las salas limpias para carne cultivada generalmente mantienen un rango de temperatura de 18–22°C y una humedad relativa entre 30–60% [14].Estas condiciones apoyan los procesos de cultivo celular mientras previenen la condensación, lo que podría fomentar el crecimiento microbiano. Use sensores térmicos calibrados y sondas de HR colocadas en toda la sala limpia para identificar cualquier variación en las condiciones.
Las cascadas de presión son otro factor crítico. Estas aseguran que el aire fluya de áreas más limpias a menos limpias, reduciendo los riesgos de contaminación. Verifique los diferenciales de presión - comúnmente de +10 a +15 Pa entre salas clasificadas adyacentes - utilizando manómetros calibrados. Tome mediciones en las puertas y pasadizos bajo condiciones de estado estable para confirmar las relaciones de presión adecuadas [12].
La prueba de tiempo de recuperación mide qué tan rápido la sala limpia vuelve a cumplir después de un evento de contaminación. Introduzca una fuente de partículas controlada, luego monitoree cuánto tiempo tarda en que los conteos de partículas regresen a la línea base.Tiempos de recuperación más rápidos indican un mejor diseño de flujo de aire y un control de contaminación más efectivo [1].
Para evitar retrasos o costosas repeticiones de pruebas, calibre todos los instrumentos inmediatamente antes de las pruebas de OQ. Registre todos los detalles relevantes, incluyendo la fecha, hora, ubicación, ID del instrumento y condiciones ambientales para cada prueba. Esta documentación es esencial para su informe de validación y será requerida durante las auditorías regulatorias [12].
sbb-itb-ffee270
Paso 4: Realizar la Calificación de Desempeño (PQ)
La Calificación de Desempeño (PQ) evalúa el rendimiento de su sala limpia bajo condiciones reales de producción, con el equipo en funcionamiento y el personal trabajando activamente [1][12].Basándose en las Calificaciones de Instalación y Operación, PQ proporciona confirmación de que la sala limpia funciona de manera consistente y confiable durante las operaciones reales.
"PQ valida el rendimiento de la sala limpia bajo condiciones operativas reales, incluyendo la operación de equipos y la actividad del personal." - G-CON [1]
Para asegurar pruebas exhaustivas, la fase de PQ debe incluir al menos 30 días de monitoreo continuo. Este período extendido ayuda a identificar variaciones, como fluctuaciones de temperatura durante los ciclos de producción o cambios en la contaminación microbiana debido al movimiento del personal, que pruebas más cortas podrían pasar por alto. Para las instalaciones de carne cultivada, donde el control estricto de la contaminación es crítico, PQ ofrece prueba documentada de que la sala limpia permanece en cumplimiento durante las operaciones rutinarias.
Ejecutar Simulaciones de Producción
Las simulaciones de producción deben replicar escenarios de peor caso.Estos pueden incluir la ocupación máxima, la operación simultánea de todo el equipo y los riesgos de contaminación temporal, como aperturas frecuentes de puertas o movimientos intensos [1][13]. Un enfoque basado en riesgos, como el uso del Análisis de Modo y Efectos de Falla (FMEA), puede ayudar a identificar ubicaciones de muestreo basadas en riesgos de contaminación, flujo de materiales y áreas de alto tráfico [16].
El monitoreo microbiano durante estas simulaciones es clave. Las unidades formadoras de colonias (UFC) deben ser rastreadas utilizando métodos de muestreo tanto activos como pasivos [14][17]. Para salas limpias de Clase ISO 5, el límite de acción para la contaminación microbiana es generalmente 1 UFC/m³ [14].
Dado que los humanos son la mayor fuente de partículas en las salas limpias, el monitoreo del personal es igualmente importante.El muestreo de la punta del dedo enguantado puede confirmar técnicas asépticas adecuadas, con un límite aceptable de menos de 1 UFC por placa [17]. Los operadores deben ser informados sobre los protocolos de vestimenta y movimiento de antemano para prevenir picos artificiales en los niveles de contaminación [12].
Además, pruebe qué tan rápido se recupera la sala limpia después de un desafío controlado de partículas. Introduzca una fuente de partículas y mida el tiempo que tarda en volver a las condiciones iniciales. Este proceso evalúa el flujo de aire y la efectividad de los sistemas de control de contaminación [1][12].
Configurar el Monitoreo Ambiental
Después de las pruebas de simulación, el monitoreo ambiental continuo asegura un rendimiento constante.Estos sistemas proporcionan datos en tiempo real sobre parámetros críticos como partículas en el aire, contaminación microbiana, temperatura, humedad y diferenciales de presión. Esto es esencial para detectar cambios de rendimiento antes de que conduzcan a problemas de cumplimiento [1]. Para la producción de carne cultivada, el monitoreo continuo es indispensable.
Durante la fase de calificación, realice muestreo de aire microbiano cada 1–2 horas en zonas críticas para confirmar un control efectivo de la contaminación [14]. Use Agar de Soya Tripticaseína (TSA) para detectar bacterias, incubando muestras a 30–35°C durante un mínimo de tres días, y Agar Dextrosa Sabouraud (SAB) para hongos y mohos, incubando a 20–25°C durante al menos siete días [17]. Evite usar aerosoles o desinfectantes cerca de los muestreadores de aire durante las pruebas.Si se han aplicado desinfectantes rotacionales o alcohol isopropílico al 70%, espere al menos cinco minutos antes de comenzar el muestreo de aire [17].
Establezca límites claros de alerta y acción para todos los parámetros monitoreados. Los niveles de alerta señalan la necesidad de investigación cuando los valores comienzan a desviarse, mientras que los límites de acción exigen una acción correctiva inmediata si los parámetros exceden los rangos aceptables [14]. Mantenga registros detallados de cada medición, incluyendo fecha, hora, ubicación, detalles del instrumento y condiciones ambientales. Esto asegura que siempre esté preparado para auditorías y pueda demostrar el cumplimiento con las normas ISO 14644 y GMP.
Paso 5: Mantener el Cumplimiento a Través del Monitoreo
Una vez que haya completado la Calificación de Desempeño, el trabajo no termina ahí. Mantener el cumplimiento requiere monitoreo continuo y recalificación periódica.La certificación de salas limpias no es un hito único: requiere un esfuerzo constante para mantener su instalación en un "estado de control". Para las instalaciones de carne cultivada, este proceso continuo asegura que cumpla con los estándares regulatorios y operativos, extendiendo las prácticas meticulosas de las fases de calificación a las operaciones diarias.
Implementar Monitoreo de Rutina
Para asegurar que su sala limpia cumpla con los estándares ISO 14644 y GMP, necesita monitorear regularmente los contaminantes microbianos y particulados. Los parámetros clave a vigilar incluyen:
- Conteo de partículas
- Niveles microbianos
- Presión
- Temperatura
- Humedad
- Flujo de aire
La frecuencia del monitoreo debe alinearse con la clasificación de su sala limpia y una evaluación de riesgos exhaustiva.Por ejemplo, las zonas de Clase ISO 5 a menudo requieren monitoreo continuo o por hora de partículas durante la producción, mientras que las áreas menos críticas podrían necesitar solo verificaciones diarias o semanales.
Establezca niveles de alerta al 95% de los límites ISO para detectar posibles problemas temprano. Estos niveles actúan como una advertencia cuando los parámetros comienzan a desviarse, lo que provoca investigaciones antes de que escalen. Por otro lado, los límites de acción exigen una acción correctiva inmediata si los parámetros exceden los rangos aceptables [14] .
Otra parte esencial del monitoreo es el muestreo de yema de dedo enguantada (GFS). Este método asegura que el personal mantenga técnicas asépticas adecuadas. El criterio estándar es típicamente menos de 1 UFC por placa [17]. Realizar GFS después de tareas asépticas críticas o al final de cada turno ayuda a identificar y abordar fallas en la técnica temprano.
Mientras que el monitoreo de rutina ayuda a mantener el control diario, la recualificación asegura que sus sistemas de sala limpia sigan siendo efectivos a largo plazo.
Programar Recualificación
La recualificación debe realizarse cada 6 a 12 meses. Sin embargo, ciertos eventos hacen que la recualificación sea obligatoria, como renovaciones estructurales, instalaciones de nuevos equipos, reemplazos de filtros HEPA o cambios significativos en el sistema HVAC [1][14].
Durante la recualificación, muchas de las pruebas de la fase de Calificación Operacional deberán repetirse. Estas incluyen:
- Conteo de partículas en el aire
- Prueba de integridad del filtro HEPA (demostrando una eficiencia del 99.99% para partículas ≥0.3 micrones)
- Mediciones de velocidad del flujo de aire
- Verificaciones de diferencial de presión
Una prueba particularmente crítica es la prueba de tiempo de recuperación, que mide qué tan rápido la sala limpia vuelve a su nivel de limpieza objetivo después de un evento de contaminación. Esta prueba verifica la capacidad de su sistema HVAC para manejar el estrés de manera efectiva [1].
Mantenga un Plan Maestro de Validación (VMP) para documentar todas las etapas de calificación (IQ, OQ, PQ) y su cronograma de recalificación. Asegúrese de que todos los instrumentos utilizados para las pruebas, como contadores de partículas y anemómetros, estén calibrados y tengan certificados trazables a estándares nacionales [1] [14]. Esto asegura precisión y fiabilidad en sus esfuerzos de cumplimiento.
Equipo de Sala Limpia para Cumplimiento
Encuentre Proveedores Verificados en Cellbase
Una vez que los estándares operativos y de rendimiento de su sala limpia estén establecidos y validados, el siguiente paso es obtener el equipo adecuado para mantener el cumplimiento. Para la producción de carne cultivada, esto significa trabajar con proveedores que entiendan las demandas únicas de la industria.
Asegure una Adquisición Cumpliente con GMP
Después de verificar el equipo, el proceso de adquisición también debe cumplir con estrictos estándares GMP.
Además, la plataforma prioriza materiales que cumplen con los requisitos de GMP. Por ejemplo, se destacan materiales de construcción como acero inoxidable 316L con superficies pulidas y que no desprenden partículas. Estos materiales son resistentes a la desinfección química repetida y apoyan protocolos validados de Limpieza en el Lugar (CIP) y Esterilización en el Lugar (SIP) [4]. Al verificar la compatibilidad de los materiales desde el principio, puede evitar costosos ajustes o ciclos de recualificación más adelante. Este enfoque proactivo ayuda a mantener el cumplimiento mientras ahorra tiempo y recursos.
Conclusión
Puntos Clave
Lograr la certificación de sala limpia es crucial para mantener la calidad del producto y cumplir con los estándares regulatorios. Comienza con el diseño de una sala limpia equipada con filtración HEPA, flujo de aire controlado y flujo de material eficiente. El proceso continúa con un enfoque de calificación de tres etapas: Calificación de Instalación (IQ), Calificación Operacional (OQ) y Calificación de Desempeño (PQ). Estas etapas aseguran que todos los sistemas operen efectivamente bajo condiciones de trabajo reales.
La certificación no termina ahí. El monitoreo continuo de factores como temperatura, humedad, presión y conteo de partículas es esencial para identificar cualquier problema de rendimiento. La revalidación regular asegura el cumplimiento con ISO 14644-1 y estándares GMP, creando un marco sólido para futuras mejoras.
Próximos pasos para su instalación
Para alinear su instalación con estos estándares, considere desarrollar un Plan Maestro de Validación (VMP). Este plan integra procesos de calificación con las necesidades operativas diarias, ayudándole a adelantarse a las demandas regulatorias [1]. Además, implementar un sistema de gestión de seguridad alimentaria basado en HACCP es clave. Al menos un miembro del equipo debe estar capacitado al Nivel 4 en principios HACCP para asegurar el cumplimiento [2].
Para necesidades de equipo, recurra a
Preguntas Frecuentes
¿Cuáles son los beneficios de la certificación de salas limpias para la producción de carne cultivada?
La certificación de salas limpias desempeña un papel crucial en la producción de carne cultivada al garantizar el cumplimiento de estrictas normas de seguridad y medioambientales. Las salas limpias certificadas están diseñadas para minimizar los riesgos de contaminación por microbios y partículas, manteniendo las condiciones estériles esenciales para la cultivación celular. Esto no solo protege la calidad y seguridad del producto final, sino que también asegura el cumplimiento de normas reconocidas internacionalmente, como las clasificaciones ISO y los grados GMP, requisitos clave para la aprobación regulatoria y la aceptación en el mercado.
Más allá del cumplimiento, la certificación mejora la fiabilidad operativa al validar sistemas críticos como el flujo de aire, la filtración y el monitoreo ambiental. Estos sistemas trabajan juntos para reducir los riesgos de contaminación, permitiendo una producción consistente y mejorando la eficiencia general del proceso.Un cuarto limpio certificado también infunde confianza entre las partes interesadas, simplifica las inspecciones regulatorias y apoya los esfuerzos de escalado al demostrar la adherencia a las mejores prácticas en la gestión de entornos controlados.
¿Con qué frecuencia deben ser recalificados los cuartos limpios para garantizar el cumplimiento?
Los cuartos limpios necesitan ser recalificados regularmente para asegurar que cumplen con los estándares de la industria. La frecuencia de esto depende de varios factores, incluyendo la clasificación del cuarto limpio, cómo se utiliza y los hallazgos de evaluaciones de riesgo o planes de monitoreo ambiental.
Por lo general, la recalificación se realiza una vez al año. Sin embargo, los entornos de alto riesgo o situaciones que implican cambios importantes, como actualizaciones de equipos o ajustes de diseño, pueden requerir verificaciones más frecuentes. El monitoreo continuo del rendimiento también es crucial para verificar que el flujo de aire, la filtración y los controles ambientales continúan cumpliendo con los estándares requeridos.
¿Qué factores ambientales deben ser monitoreados en una sala limpia para la producción de carne cultivada?
Para garantizar el cumplimiento y reducir los riesgos de contaminación en las instalaciones de carne cultivada, es crucial vigilar de cerca varios factores ambientales. Estos incluyen conteo de partículas, contaminación microbiana, patrones de flujo de aire, diferenciales de presión de aire, temperatura y niveles de humedad. El monitoreo regular de estos elementos ayuda a mantener los estándares GMP y crea un ambiente controlado esencial para la producción.
Al gestionar cuidadosamente estas condiciones, las instalaciones pueden proteger la calidad del producto mientras cumplen con los estrictos criterios requeridos para la certificación de salas limpias.











