A validação de meios de crescimento é uma etapa obrigatória para empresas de carne cultivada que buscam aprovação no mercado do Reino Unido. Este processo garante a segurança, qualidade e conformidade dos produtos sob rigorosos marcos regulatórios, como o Regulamento de Novos Alimentos do Reino Unido (UE 2015/2283). Aqui está o que você precisa saber:
- Requisitos Principais: Os meios de crescimento devem atender aos padrões de toxicologia, controle de contaminação, qualidade nutricional e alergenicidade.
- Regulamentos do Reino Unido: A Food Standards Agency (FSA) exige conformidade com os princípios HACCP e classificação sob Produtos de Origem Animal (POAO).
- Padrões Globais: Enquanto o Reino Unido e a UE compartilham estruturas semelhantes, os EUA seguem os regulamentos CGMP sob o FD&C Act.
- Processo de Validação: Inclui testes minuciosos de composição, pureza, funcionalidade e conformidade do fornecedor, juntamente com documentação robusta.
- Iniciativas de Apoio: O sandbox regulatório de £1,6 milhão do Reino Unido, lançado em 2025, ajuda as empresas a atender a esses padrões.
A validação adequada garante segurança, constrói confiança e está alinhada com os requisitos legais. O artigo aprofunda o processo passo a passo, incluindo métodos de teste, qualificações de fornecedores e dicas de submissão regulatória.
Padrões Regulatórios para Meios de Crescimento
Padrões e Diretrizes
Os meios de crescimento, um componente crítico na produção de carne cultivada, devem atender a rigorosos padrões regulatórios internacionais. Esses padrões variam entre as regiões, cada uma com requisitos específicos para composição, segurança e pureza.
No Reino Unido, os meios de crescimento são regulamentados sob o Regulamento de Novos Alimentos (Regulamento assimilado (UE) 2015/2283). Antes de serem aprovados para o mercado, é necessária uma avaliação de segurança completa [1]. A Food Standards Agency (FSA) classifica os produtos cultivados em células como Produtos de Origem Animal (POAO) sob o Regulamento (CE) 853/2004. Esta classificação exige que os produtores implementem sistemas de gestão de segurança alimentar baseados nos princípios da Análise de Perigos e Pontos Críticos de Controle (HACCP) [3]. A FSA também está em processo de desenvolvimento de orientações técnicas detalhadas sobre a composição dos meios de crescimento, com mais atualizações esperadas [1]. Esses frameworks fornecem a base para requisitos regulatórios mais específicos.
Nos Estados Unidos, a abordagem é diferente.Os componentes do meio de crescimento devem atender aos requisitos das Boas Práticas de Fabricação (CGMP) atuais, conforme descrito na Seção 501(a)(4)(B) do Federal Food, Drug, and Cosmetic Act (FD&C Act) [4]. A FDA categoriza os componentes do meio como "suprimentos e reagentes", que são regidos pelas partes 210 e 211 do 21 CFR. Esses componentes devem passar por verificação de qualidade para evitar contaminação [4]. Curiosamente, componentes sintéticos do meio de carne cultivada - como aminoácidos, vitaminas e sais - são frequentemente classificados como dispositivos médicos Classe I sob o 21 CFR 864.2220, isentando-os dos requisitos de notificação pré-mercado [6][7].
Na União Europeia, a estrutura regulatória se alinha de perto com a do Reino Unido, pois também segue o Regulamento (UE) 2015/2283.A Autoridade Europeia para a Segurança dos Alimentos (EFSA) supervisiona o processo de autorização [1]. De acordo com as diretrizes ICH Q6B, os componentes do meio de crescimento, incluindo antibióticos, indutores e outros constituintes, são tratados como impurezas relacionadas ao processo. Essas impurezas devem ser controladas e reduzidas a níveis aceitáveis [5]. Sempre que possível, excipientes e reagentes devem estar em conformidade com os padrões farmacopéicos [5].
| Jurisdição | Regulamento Primário | Classificação | Sistema de Segurança | Supervisão de Mídia |
|---|---|---|---|---|
| Reino Unido (GB) | Regulamento Assimilado (UE) 2015/2283 [1] | Produto de Origem Animal (POAO) [3] | HACCP (Reg 852/2004) [3] | Orientação Sandbox FSA/FSS [1] |
| União Europeia / NI | Regulamento (UE) 2015/2283 [1] | Produto de Origem Animal (POAO) [3] | HACCP (Reg 852/2004) [3] | Processo de Autorização da EFSA [1] |
| Estados Unidos | FD&C Act Seção 501(a)(4)(B) [4] | Novo Medicamento Veterinário / Alimento [4] | CGMP (21 CFR 210/211) [4] | FDA CVM / USDA-FSIS [4] |
Requisitos Regulatórios para Carne Cultivada
Os produtores de carne cultivada devem garantir que cada lote de meio de crescimento atenda a rigorosos padrões de segurança e qualidade.A validação do meio de crescimento é um aspecto chave do quadro regulatório mais amplo para esses produtos. Sob os princípios do HACCP (Regulamento (CE) 852/2004), o meio de crescimento é identificado como um insumo primário e uma potencial fonte de contaminação - química, microbiana ou de outra forma [3]. A FSA destaca essa preocupação:
"Os principais perigos na produção de produtos cultivados em células dizem respeito à identidade da linha celular (e consistência), perigos introduzidos durante o processo de produção (contaminação microbiológica, meio de crescimento e componentes residuais no produto final) e alérgenos." [3]
Se houver alterações na formulação do meio de crescimento, uma revisão imediata do HACCP é necessária [3].No Reino Unido, a validação deve ocorrer antes da implementação para garantir a precisão dos diagramas de fluxo e a eficácia das medidas de controle [3].
Nos Estados Unidos, a FDA exige que todos os reagentes e componentes de mídia atendam a padrões de qualidade rigorosos para evitar a introdução de agentes nocivos [4]. Fornecedores e laboratórios contratados devem aderir aos regulamentos CGMP, e qualquer fornecedor que não cumpra deve ser removido para evitar que os produtos sejam classificados como "adulterados" [4]. A FDA destaca a importância disso:
"Todos os novos medicamentos para animais, incluindo ACTPs, devem ser fabricados de acordo com CGMP para garantir que tais medicamentos atendam aos requisitos do Federal Food, Drug, and Cosmetic Act (FD&C Act) quanto à segurança." [4]
Atualmente, várias empresas que participam do sandbox regulatório do Reino Unido - como BlueNalu, Gourmey, Hoxton Farms, Mosa Meat, Roslin Technologies, Vital Meat, e Vow - estão colaborando com a FSA para aprimorar esses padrões técnicos [1]. Sob as regulamentações do Reino Unido, as empresas podem solicitar até cinco anos de proteção de dados para informações confidenciais submetidas durante o processo de autorização [1].
Etapas para Validação de Meios de Crescimento
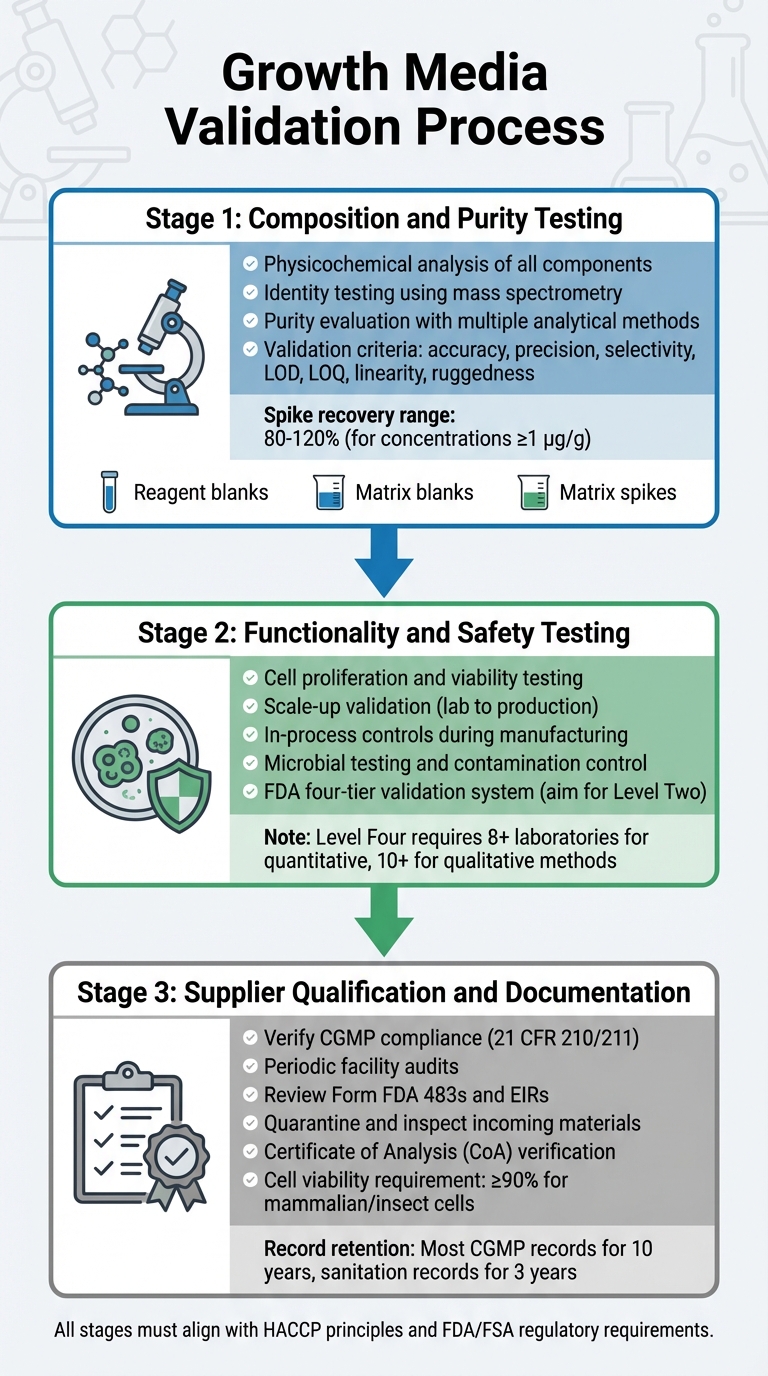
Processo de Validação de Meios de Crescimento para Aprovação Regulatória de Carne Cultivada
A validação de meios de crescimento envolve um processo detalhado que examina sua composição, funcionalidade, segurança e conformidade do fornecedor. Cada etapa se baseia na anterior, garantindo um processo de validação robusto que está alinhado com os requisitos regulatórios. Isso inclui testes de composição, funcionalidade e conformidade do fornecedor.
Testes de Composição e Pureza
A primeira etapa foca em uma análise físico-química completa de cada componente. Isso envolve identificar a composição precisa, propriedades físicas e estrutura molecular de ingredientes como aminoácidos, vitaminas e sais inorgânicos [5].Para confirmar estruturas moleculares, os testes de identidade empregam métodos altamente específicos, incluindo técnicas físico-químicas, biológicas e imunológicas. Ferramentas como a espectrometria de massa são usadas para verificar identidades moleculares através de seus padrões de fragmentação [8].
A avaliação de pureza requer múltiplos métodos analíticos para separar componentes desejados de impurezas. Esses testes devem abordar tanto impurezas relacionadas ao processo quanto ao produto [5]. As técnicas analíticas devem atender a critérios rigorosos de validação, incluindo precisão, exatidão, seletividade, limites de detecção (LOD), limites de quantificação (LOQ), linearidade e robustez [8]. Os protocolos de validação também devem incorporar:
- Brancos de reagentes para garantir que os reagentes estejam livres de analitos.
- Blanks de matriz para confirmar que o ambiente da amostra não interfere.
- Picos de matriz para estimar recuperação e precisão.
Para métodos quantitativos em concentrações de 1 µg/g (ppm), recuperações de pico aceitáveis geralmente variam entre 80% e 120% [8].
Para manter a consistência, os fabricantes devem estabelecer materiais de referência primários internos derivados de lotes representativos da produção. Estes servem como padrões rastreáveis para calibrar materiais de referência de trabalho [5]. Uma vez concluído o teste de pureza, o meio deve demonstrar sua capacidade de suportar o crescimento celular eficaz e atender aos padrões de segurança.
Testes de Funcionalidade e Segurança
Após confirmar a composição, o meio deve provar sua eficácia em apoiar a produção de carne cultivada. Isso inclui demonstrar que as células podem proliferar, manter a viabilidade e escalar das condições de laboratório para volumes de produção. A FDA exige controles em processo durante a fabricação, começando desde os estágios iniciais, como passagem e colheita de células, para garantir a consistência e segurança do produto [4].
A validação de segurança envolve testes microbianos rigorosos e controle de contaminação, conforme descrito nas avaliações pré-mercado da FDA [9].
A FDA usa um sistema de quatro níveis para validação de métodos químicos, variando do Nível Um (uso emergencial ou limitado) ao Nível Quatro (estudos colaborativos completos que atendem aos padrões AOAC/ISO) [8].Para testes regulatórios de rotina, mire na validação de laboratório único de Nível Dois, que inclui uma avaliação abrangente de desempenho [8]. Estudos colaborativos completos para métodos quantitativos exigem a participação de pelo menos oito laboratórios, enquanto métodos qualitativos precisam de dez [8]. Uma vez que o desempenho do meio é validado, é essencial garantir que todas as matérias-primas venham de fornecedores em conformidade.
Qualificação e Documentação de Fornecedores
Os fabricantes devem trabalhar com fornecedores verificados e em conformidade com CGMP. Os fornecedores devem atender aos padrões descritos no 21 CFR 210/211 [4]. A verificação envolve auditorias periódicas das instalações dos fornecedores para avaliar a adesão aos programas de qualidade, procedimentos e conformidade geral com CGMP [4].
Antes de firmar contratos, revise o histórico de conformidade de um fornecedor, incluindo os Formulários FDA 483 e Relatórios de Inspeção de Estabelecimento (EIRs) [4]. A FDA destaca esta obrigação:
"Antes de firmar qualquer contrato, acordo ou outro arranjo com outro estabelecimento para realizar qualquer etapa de fabricação para você, você deve verificar se o estabelecimento está em conformidade com as CGMPs regulatórias aplicáveis." [4]
Todos os materiais recebidos devem ser colocados em quarentena e inspecionados antes da liberação, garantindo que atendam às especificações principais [10]. Os fornecedores são obrigados a fornecer um Certificado de Análise (CoA) ou resultados de teste rastreáveis, em conformidade com CGMP/GLP [10].Para linhas celulares estáveis, a documentação deve incluir um histórico de clonagem rastreável [10]. Células de mamíferos ou insetos normalmente requerem pelo menos 90% de viabilidade para aceitação em projetos CGMP [10]. Os registros devem ser mantidos de acordo com as diretrizes regulatórias [4].
Os contratos devem delinear claramente as responsabilidades CGMP e exigir que os fornecedores notifiquem os fabricantes sobre quaisquer alterações propostas nos kits de teste ou metodologias [4]. Se o teste for terceirizado, certifique-se de que os laboratórios contratados usem métodos analíticos validados e sejam registrados na FDA [4].
Preparando Documentos de Submissão Regulatória
Uma vez que seu meio de crescimento tenha sido validado, o próximo passo é compilar um dossiê que demonstre conformidade com todos os padrões de segurança e qualidade exigidos pela FDA e USDA-FSIS. Este dossiê serve como um elo crítico entre validação e conformidade regulatória, proporcionando às autoridades uma visão clara da segurança e dos processos de produção do seu meio.
Elementos Necessários de um Dossiê de Submissão
Seu dossiê deve incluir uma descrição detalhada da composição do meio, listando todos os aminoácidos, vitaminas, sais inorgânicos e fatores de crescimento. As diretrizes da FDA enfatizam que o processo de revisão avalia não apenas o meio em si, mas todo o fluxo de trabalho de produção. Isso inclui o estabelecimento de linhagens e bancos celulares, implementação de controles de fabricação e verificação de todos os componentes e insumos [11].
Além disso, o dossiê deve apresentar uma avaliação completa de segurança e toxicologia, comprovando a segurança alimentar do material cultivado e de todos os seus insumos. Inclua registros de controle de fabricação, dados de validação de processos e documentação do programa de qualidade para demonstrar que sua produção é consistente e livre de contaminantes.
Você também deve fornecer registros de verificação de suprimentos e reagentes, mostrando validação para todos os materiais usados no meio, incluindo aqueles preparados internamente. Para produtos regulamentados pelo USDA-FSIS, inclua planos HACCP e protocolos de saneamento. O FDA aconselha a retenção da maioria dos registros CGMP por pelo menos 10 anos, enquanto os registros de limpeza e saneamento das instalações devem ser mantidos por um mínimo de 3 anos [4]. Isso está alinhado com os esforços de qualificação de fornecedores, garantindo que todos os insumos atendam aos requisitos CGMP e regulatórios.
Documentação de Conformidade das Instalações
Antes de produzir, processar ou armazenar carne cultivada para consumo humano, as instalações devem se registrar na FDA [12]. Sua documentação deve incluir um plano abrangente de segurança alimentar que aborde a análise de perigos (biológicos, químicos e físicos), controles preventivos (como saneamento, gestão de alérgenos e medidas da cadeia de suprimentos) e procedimentos de supervisão [12].
Simulações de preenchimento de mídia também são um requisito chave. Estas envolvem incubação de 14 dias e testes de promoção de crescimento para confirmar práticas assépticas.Conforme explica a FDA:
"O teste de enchimento deve avaliar a montagem asséptica e a operação do equipamento crítico (estéril), qualificar os operadores e avaliar sua técnica, além de demonstrar que os controles ambientais são adequados" [2].
Certifique-se de que seus registros incluam dados de qualificação de fornecedores, como testes realizados nos primeiros três lotes de meio de um fornecedor para confirmar que correspondem ao Certificado de Análise. Outros registros essenciais incluem logs de controle ambiental, cronogramas de calibração de equipamentos e dados de monitoramento de temperatura. Para processos regulamentados pelo USDA, prepare planos HACCP, procedimentos operacionais padrão de saneamento por escrito (SSOPs) e procedimentos de recall [12][13].
sbb-itb-ffee270
Usando Cellbase para Aquisição de Meios de Crescimento em Conformidade Regulamentar
Fornecedores Verificados para Carne Cultivada
Depois de validar sua formulação de meio de crescimento, o próximo passo é adquirir componentes que atendam aos padrões regulatórios. Isso não é tão simples quanto fazer pedidos de fornecedores genéricos. Para produtos cultivados em células, regulamentos rigorosos de higiene se aplicam, e cada componente do meio de crescimento deve vir com documentação específica para aprovação regulatória [3]. É aí que
Recursos de Aquisição
A plataforma também oferece preços transparentes e um recurso de mensagens diretas, permitindo que as equipes solicitem rapidamente cotações, certificados de análise e outros documentos regulatórios.Ao consolidar essas funções críticas de aquisição em um sistema adaptado para a produção de carne cultivada,
Conclusão
Validar meios de crescimento para aprovação regulatória não é apenas uma formalidade - é um requisito legal para a introdução de produtos de carne cultivada no mercado do Reino Unido. Isso envolve testes rigorosos de composição e pureza, implementação de um plano HACCP robusto e manutenção de documentação detalhada em cada etapa do processo.
"Os alimentos não devem ser colocados no mercado se forem inseguros. Isso significa que não são prejudiciais à saúde nem impróprios para o consumo humano." - Food Standards Agency [3]
A £1 da Food Standards Agency do Reino Unido.6 milhões Regulatory Sandbox destaca seu compromisso em trabalhar com os participantes da indústria para estabelecer diretrizes técnicas claras sobre a composição do meio de crescimento [1]. As empresas que priorizam a validação adequada agora estarão em uma posição mais forte quando essas diretrizes estiverem totalmente definidas.
Cumprir os padrões de conformidade não é apenas marcar caixas regulatórias - é sobre ganhar a confiança do consumidor e garantir a segurança do produto. Testes de qualidade rigorosos estão no coração tanto da aprovação regulatória quanto da aceitação no mercado. Para agilizar o processo de autorização, concentre-se em construir protocolos de validação sólidos, manter registros precisos e fazer parcerias com fornecedores confiáveis. Essas etapas não apenas simplificarão a aprovação, mas também abrirão caminho para uma maior confiança do consumidor.
FAQs
Quais são as principais etapas para validar meios de crescimento para aprovação regulatória?
Validar meios de crescimento para aprovação regulatória é tudo sobre provar que a formulação é segura, confiável e adequada para a produção de carne cultivada. Veja como o processo geralmente se parece:
- Avaliação de risco: Comece definindo a linha celular que você usará, os objetivos do produto e seus atributos críticos de qualidade (como pH ou composição de nutrientes). Identifique quaisquer riscos potenciais, como contaminação microbiana, e estabeleça medidas para controlar esses riscos.
- Testes e especificações: Defina critérios claros de aceitação para fatores como esterilidade, pureza e potência. Use métodos de teste estabelecidos para garantir que esses padrões sejam consistentemente atendidos.
- Estudos de validação: Conduza uma validação de processo completa, incluindo a qualificação de equipamentos e testes de múltiplos lotes, para confirmar que os resultados são reprodutíveis e consistentes.
- Teste de estabilidade: Verifique como o meio se mantém ao longo do tempo, avaliando sua qualidade durante toda a vida útil pretendida sob condições de armazenamento adequadas (tipicamente 2–8 °C).
- Documentação: Reúna tudo em um dossiê de validação abrangente. Isso deve incluir todos os resultados de testes e análises para atender aos requisitos regulatórios.
Ao abordar cuidadosamente cada uma dessas etapas, você reunirá as evidências necessárias para mostrar que o meio atende aos padrões de segurança e qualidade exigidos para a produção de carne cultivada.
Quais são as principais diferenças entre as regulamentações do Reino Unido e dos EUA para meios de crescimento usados em carne cultivada?
No Reino Unido, a regulamentação dos meios de crescimento para carne cultivada está sob o Regulamento de Novos Alimentos (Regulamento da UE 2015/2283), que foi mantido na legislação do Reino Unido. Qualquer meio de crescimento usado em produtos não comumente consumidos antes de 15 de maio de 1997 deve passar por uma avaliação formal de novos alimentos pela Food Standards Agency (FSA). Este processo exige a submissão de documentação detalhada, incluindo informações sobre a composição, origem e pureza do meio. Além disso, é necessária uma avaliação de risco baseada em HACCP para demonstrar como os contaminantes são controlados durante o processo de cultivo celular.
Desde dezembro de 2025, a FSA implementou um sandbox de Produtos Cultivados em Células. Esta iniciativa oferece orientação e apoia a coleta de dados mais rápida para aplicações de novos alimentos.Para obter a autorização final, as empresas devem enviar um dossiê abrangente que aborde a segurança do meio, a consistência e a validação da fabricação. Somente após essa aprovação o produto pode ser vendido na Grã-Bretanha.
Em contraste, os Estados Unidos não possuem uma estrutura específica de novos alimentos adaptada para meios de crescimento, tornando desafiadoras as comparações regulatórias diretas. Para empresas sediadas no Reino Unido, obter componentes de meios que já atendam a esses padrões rigorosos pode simplificar o processo de aprovação.Como o sandbox regulatório do Reino Unido apoia a validação de meios de crescimento?
O sandbox regulatório do Reino Unido para produtos cultivados oferece um ambiente bem organizado onde as empresas podem testar e refinar suas formulações de meios de crescimento. Supervisionado pela Food Standards Agency (FSA) e pela Food Standards Scotland (FSS), este programa ocorre em fases de seis meses. Durante esse período, as empresas podem realizar testes de segurança, realizar avaliações de risco e revisar a documentação enquanto recebem feedback valioso dos reguladores.
Essa abordagem prática permite testes práticos e melhorias passo a passo, acelerando a coleta de dados de segurança e ajudando as empresas a se alinharem aos requisitos regulatórios. Para aqueles que trabalham com carne cultivada, obter meios de crescimento pré-aprovados através de











