Escalar biorreactores para la producción de carne cultivada - desde sistemas pequeños (1–5 L) hasta grandes (1,000+ L) - presenta desafíos energéticos. Los volúmenes más grandes requieren más energía para la mezcla, la transferencia de oxígeno y el control del calor, pero también ofrecen eficiencias. Por ejemplo, pasar de 5 m³ a 100 m³ puede reducir el uso específico de energía hasta en un 88%. Sin embargo, la mezcla más lenta en sistemas grandes puede crear desequilibrios de oxígeno y nutrientes, afectando el crecimiento celular. Sistemas de control automatizados y estrategias como la operación en "punto de inundación" ayudan a equilibrar el uso de energía y mantener la viabilidad celular. Esto es lo que necesita saber:
- Biorreactores a pequeña escala: Alta energía por litro, mezcla rápida, eliminación de calor más fácil, pero no ideal para la producción a gran escala.
- Biorreactores a gran escala: Menor energía por litro, mezcla más lenta, gestión de calor y gas más compleja, pero mejor para la producción comercial.
La eficiencia energética mejora con la escala, pero mantener la calidad celular requiere automatización avanzada y un control preciso de la agitación, la aireación y la temperatura.
Diseño y Escalado del Proceso de Fermentación: Procesamiento Upstream (USP)
sbb-itb-ffee270
1. Biorreactores a Pequeña Escala (1–5 L)
Los biorreactores a escala de laboratorio operan bajo condiciones energéticas muy diferentes en comparación con sus contrapartes industriales. A esta escala más pequeña, el rendimiento de los procesos generalmente está más influenciado por la cinética celular que por los fenómenos de transporte [2]. La alta relación superficie-volumen hace que la eliminación de calor sea más sencilla, pero también significa que los parámetros de agitación no se pueden escalar directamente a sistemas más grandes. Esta dinámica a menudo lleva a que la agitación sea el principal impulsor del consumo de energía en esta etapa.
En sistemas a pequeña escala, el uso de energía está dictado en gran medida por la agitación y la mezcla.Para lograr la misma entrada de potencia volumétrica (P/V) que los biorreactores más grandes, los más pequeños necesitan velocidades de impulsor más altas debido a sus diámetros de impulsor más pequeños [2][9]. Para cultivos de células de mamíferos - clave en la producción de carne cultivada - un P/V de 20–40 W/m³ es típicamente óptimo. Este rango apoya el crecimiento celular mientras minimiza la agregación celular [5].
La aireación añade otra capa de complejidad. El coeficiente de transferencia de masa volumétrica (kLa) mide cuán eficientemente el oxígeno llega a las células. Sin embargo, aumentar la agitación para mejorar el kLa también puede aumentar el estrés de cizallamiento hidromecánico. Para procesos sensibles al cizallamiento, como la producción de lentivirus, a menudo se prefieren los dispersores de tubo abierto, ya que los micro-dispersores pueden reducir los títulos virales funcionales hasta en un 25% [5].Operar cerca del punto de inundación, con menor agitación y mayor aireación, puede ayudar a equilibrar el uso de energía mientras se satisfacen las necesidades de transferencia de oxígeno [1].
La gestión térmica en estos biorreactores se maneja típicamente mediante sistemas de enfriamiento a base de agua, como chaquetas o serpentines internos, para disipar el exceso de calor. Cada vatio de agitación mecánica genera calor que debe ser eliminado eficientemente. Además, la actividad metabólica microbiana produce alrededor de 14.7 kJ de calor por gramo de oxígeno consumido [7]. La potencia de refrigeración requerida depende del calor total generado y de la eficiencia del sistema de enfriamiento, con un coeficiente de rendimiento típico alrededor de 0.6. Ajustar la configuración del agitador durante diferentes etapas de una operación por lotes puede reducir significativamente el consumo de energía [7].
Los biorreactores modernos a pequeña escala están equipados con sistemas de automatización que utilizan sensores y algoritmos para regular dinámicamente el pH, los niveles de oxígeno y la temperatura. Estos sistemas aseguran que solo se aplique la refrigeración o agitación necesaria durante cada fase de crecimiento, reduciendo el desperdicio de energía [6][10]. Para las empresas de carne cultivada que adquieren equipos a través de plataformas como
2.Biorreactores a Gran Escala (más de 1,000 L)
Al aumentar la producción, los desafíos crecen a medida que los tiempos de mezcla aumentan significativamente, de solo 10 segundos en sistemas pequeños de 3 litros a un tiempo mucho más largo de 80 a 180 segundos en recipientes masivos que van de 5,000 a 20,000 litros. Estos tiempos de mezcla más lentos crean obstáculos operativos, como gradientes de oxígeno disuelto y cambios metabólicos, que pueden reducir la densidad celular viable hasta en un 15% durante la fase estacionaria [4]. Para los cultivos de células de mamíferos utilizados en la producción de carne cultivada, cruzar el umbral de tiempo de mezcla de 90 segundos puede desencadenar cambios metabólicos, llevando a la acumulación de lactato [4]. Para abordar estos problemas, son esenciales ajustes en las estrategias de agitación y aireación a escalas mayores.
En estos volúmenes mayores, las demandas de energía cambian. Inicialmente, la agitación juega un papel más importante en el uso de energía cuando las tasas de transferencia de oxígeno son bajas.Sin embargo, a medida que el crecimiento celular se acelera, la aireación se convierte en el factor dominante, representando hasta el 70% del consumo de energía. Operar cerca del punto de inundación - un punto donde el flujo de gas interrumpe la mezcla de líquidos - sigue siendo crítico, pero a esta escala, se trata principalmente de gestionar la carga energética de la aireación. Aumentar la presión del espacio de cabeza es otra táctica efectiva, ya que aumenta la solubilidad del oxígeno y reduce la necesidad de altas velocidades de agitación cuando las tasas de transferencia de oxígeno son altas [9].
La gestión térmica también se vuelve más compleja a escala, pero ofrece oportunidades para una mayor eficiencia. Por ejemplo, las fermentaciones industriales muestran un amplio rango de requerimientos de energía: la fermentación de ácido itacónico promedia 0.51 kW/m³, mientras que la producción de lisina, que demanda más oxígeno, requiere 2.61 kW/m³ [1]. Los sistemas de enfriamiento típicamente logran una eficiencia de refrigeración de alrededor de 0.6, aunque en condiciones ideales, los coeficientes de rendimiento pueden alcanzar hasta 8.6 [7].
Ampliar de 5 m³ a 100 m³ puede reducir los requisitos de energía específica hasta en un 88%, siempre que las operaciones estén optimizadas [9]. Esto es crucial para la producción de carne cultivada, donde equilibrar la eficiencia energética con el mantenimiento de la calidad del producto es clave. La modelización mecanicista ahora permite a los equipos de producción prever la generación de calor y las necesidades de energía combinando datos de crecimiento microbiano con modelos termodinámicos [9][1]. Para las empresas en el sector de la carne cultivada que adquieren sistemas a gran escala a través de plataformas como
Para capitalizar completamente en el ahorro de energía, los parámetros físicos optimizados deben combinarse con una automatización precisa. Los sistemas de automatización a esta escala deben manejar múltiples demandas de manera efectiva. Una estrategia implica segmentar el proceso de fermentación en intervalos donde la potencia del agitador permanece constante mientras el flujo de aire se ajusta para igualar la absorción de oxígeno, minimizando el uso de energía [7]. Los sistemas de control modernos también monitorean los niveles de oxígeno disuelto en tiempo real, ajustando dinámicamente tanto las configuraciones mecánicas como neumáticas para prevenir las interrupciones metabólicas que ocurren cuando los tiempos de mezcla superan los límites fisiológicos [4] .
Ventajas y Desventajas
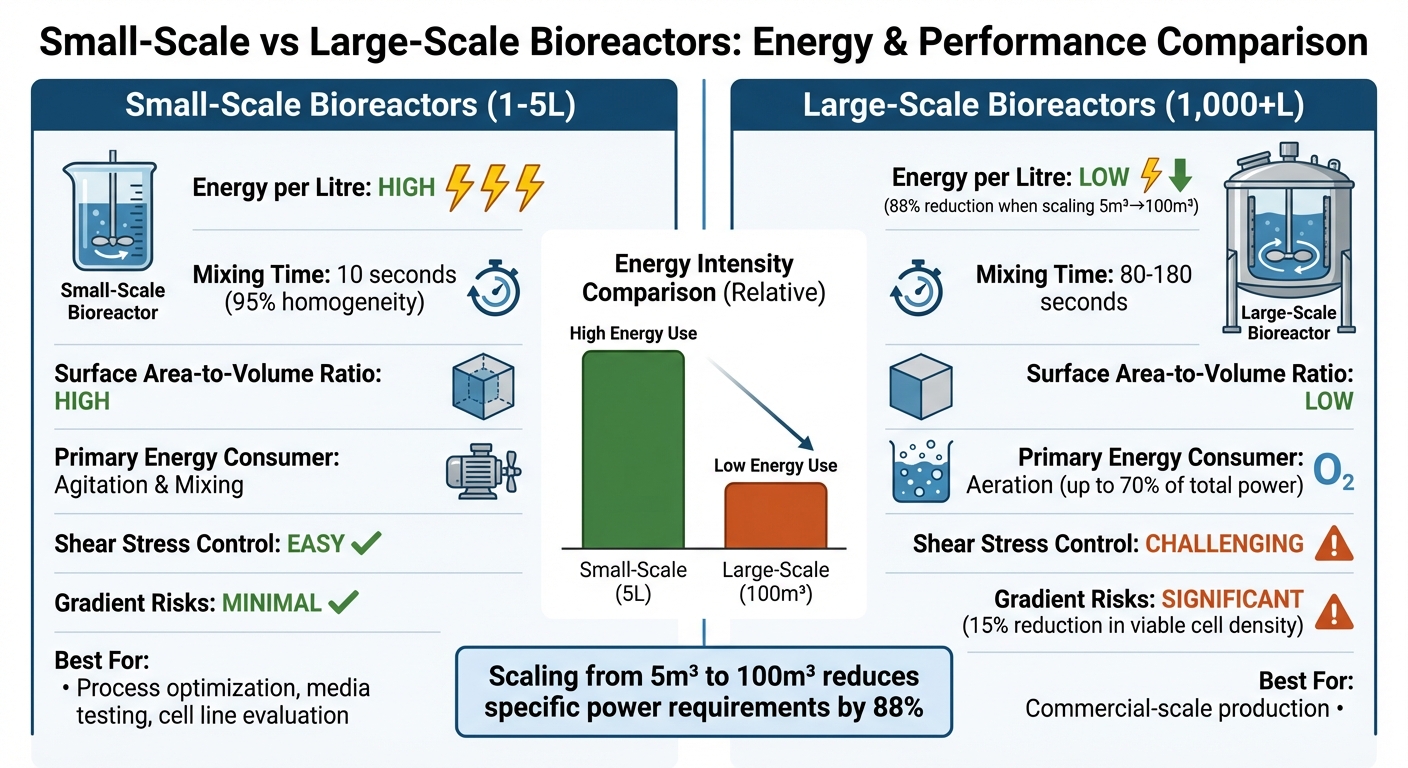
Comparación de Eficiencia Energética entre Biorreactores a Pequeña y Gran Escala
Decidir entre biorreactores a pequeña y gran escala para producir carne cultivada implica sopesar la eficiencia energética, la complejidad operativa y la idoneidad para las necesidades de producción. Aquí hay un vistazo más cercano a cómo se comparan:
| Característica | Biorreactores a Pequeña Escala (1–5 L) | Biorreactores a Gran Escala (1,000+ L) |
|---|---|---|
| Intensidad Energética por Litro | Alta; requiere más potencia específica para mantener la uniformidad y la transferencia de oxígeno [9][8] | Baja; escalar de 5 m³ a 100 m³ puede reducir las necesidades de potencia específica en un 88% [9] |
| Eficiencia de Mezcla | Excelente; logra un 95% de homogeneidad en aproximadamente 10 segundos [4] | Pobre; toma 80–180 segundos, aumentando el riesgo de gradientes [4] |
| Relación Superficie-Volumen | Alto; apoya la eliminación eficiente de calor y el despojo de CO₂ [2] | Bajo; plantea desafíos en la gestión del calor y el intercambio de gases [2] |
| Consumidor Primario de Energía | Agitación y mezcla [9] | Aireación (hasta el 70% de la potencia total durante el alto crecimiento celular) [9] |
| Gestión del Estrés de Cizallamiento | Más fácil de controlar; las células están menos expuestas a fuerzas dañinas [3][4] | Más difícil de gestionar; la alta agitación puede dañar células animales frágiles [3][4] |
| Riesgos Relacionados con Gradientes | Mínimo; la mezcla rápida evita interrupciones metabólicas | Significativo; los gradientes de oxígeno durante 90 segundos pueden reducir la densidad celular viable en un 15% [4] |
| Adecuación para Carne Cultivada | Ideal para optimizar procesos, probar medios y evaluar líneas celulares [3][8] | Crítico para la producción a escala comercial; requiere diseños especializados de bajo cizallamiento [11][3] |
Los biorreactores de sobremesa sobresalen en lograr una mezcla rápida y uniforme, lo que los hace perfectos para ajustar finamente las condiciones de cultivo celular.Sin embargo, sus altas demandas de energía por litro los hacen menos prácticos para la producción a gran escala. Por otro lado, los biorreactores a gran escala son mucho más eficientes energéticamente por litro, pero presentan desafíos operativos que pueden afectar la viabilidad celular. Por ejemplo, tiempos de mezcla más lentos pueden crear gradientes de oxígeno y nutrientes, lo que puede interrumpir el crecimiento de células sensibles al cizallamiento utilizadas en la carne cultivada.
Para las empresas que trabajan con proveedores como
Conclusión
Escalar biorreactores ofrece una gran reducción en el uso de energía por litro. Por ejemplo, pasar de un biorreactor de 5 m³ a uno de 100 m³ puede reducir la demanda de energía específica en un 88% [9], haciendo que la producción a gran escala sea mucho más rentable. Sin embargo, esta eficiencia viene con un compromiso. Mientras que los biorreactores más pequeños logran una mezcla uniforme en aproximadamente 10 segundos, los recipientes industriales más grandes tardan significativamente más, alrededor de 80 a 180 segundos. Esta mezcla más lenta puede crear gradientes perjudiciales de oxígeno disuelto [4].
Este cambio en la eficiencia también altera dónde se consume la energía. En sistemas más pequeños, la mayor parte de la energía se destina a la agitación. Pero a escala comercial, especialmente con altas densidades celulares, la aireación se convierte en el principal consumidor de energía, representando hasta el 70% de la demanda total de energía [9].
htmlLa automatización es clave para abordar estos desafíos. Herramientas como CAE, CFD e IA permiten a los productores modelar y optimizar el equilibrio entre agitación y aireación antes de escalar físicamente [3]. Además, sensores en tiempo real que monitorean los niveles de oxígeno disuelto y dióxido de carbono permiten ajustes dinámicos a través de sistemas de control automatizados. Estos sistemas ayudan a prevenir cambios metabólicos costosos, manteniendo el uso de energía por kilogramo de producto bajo control y allanando el camino para estrategias de escalado más inteligentes.
Para los productores que buscan expandirse, operar cerca del punto de inundación es a menudo el enfoque más eficiente. Esta estrategia prioriza la aireación intensa sobre la agitación que consume mucha energía [1] . Técnicas como la presurización del espacio de cabeza pueden reducir aún más la necesidad de agitación durante el pico de transferencia de oxígeno [9].
Cuando se adquiere equipo, plataformas como
Preguntas Frecuentes
¿Cómo mejora la automatización la eficiencia energética en biorreactores a gran escala?
La automatización juega un papel crucial en el aumento de la eficiencia energética en biorreactores a gran escala al permitir ajustes precisos y en tiempo real de parámetros críticos como la agitación, la aireación, la temperatura y los niveles de oxígeno disuelto.En lugar de adherirse a configuraciones rígidas y excesivamente cautelosas, los sistemas automatizados dependen de datos de sensores en tiempo real para ajustar estos factores, asegurando que la energía se use de manera eficiente para mantener las condiciones ideales para el crecimiento celular.
Este control dinámico es particularmente beneficioso durante las fases de inicio y escalado, donde la automatización permite ajustes rápidos a las condiciones cambiantes del proceso, reduciendo el uso innecesario de energía. Al alinear los sistemas de control con las características específicas de los diseños de biorreactores, como los sistemas de tanque agitado o de elevación por aire, la automatización no solo mejora la consistencia, sino que también reduce la energía requerida para producir cada kilogramo de carne cultivada. Estos avances son clave para escalar la producción de manera eficiente mientras se mantiene bajo control el impacto ambiental.
¿Qué problemas pueden surgir de tiempos de mezcla más lentos en biorreactores a gran escala?
En biorreactores a gran escala, una mezcla más lenta puede causar una distribución desigual de nutrientes y oxígeno, lo que lleva al desarrollo de gradientes. Estos gradientes pueden interrumpir el crecimiento celular, resultar en una acumulación desigual de desechos y reducir la eficiencia general del sistema.
Para abordar estos problemas, los operadores a menudo recurren a entradas de energía más altas. Si bien este enfoque ayuda, también aumenta el consumo de energía y los costos operativos. Encontrar soluciones a estos desafíos es esencial para mantener la eficiencia energética y lograr un rendimiento óptimo durante la ampliación.
¿Por qué se considera eficiente en términos de energía operar cerca del punto de inundación durante la ampliación de biorreactores?
Operar cerca del punto de inundación durante la ampliación de biorreactores a menudo se considera un enfoque eficiente en términos de energía. Este método optimiza la mezcla gas-líquido, lo cual es crítico para una transferencia de masa efectiva. Al maximizar la tasa de flujo de gas sin llevar el sistema a la inestabilidad, el biorreactor puede funcionar eficientemente mientras mantiene el uso de energía bajo control.
Dicho esto, operar cerca de este umbral requiere un monitoreo y control cuidadosos. Superar el punto de inundación puede interrumpir el sistema o llevar a una caída en el rendimiento, haciendo de la precisión un factor clave para mantener la eficiencia.











