La validación de los medios de cultivo es un paso obligatorio para las empresas de carne cultivada que buscan aprobación en el mercado del Reino Unido. Este proceso garantiza la seguridad, calidad y cumplimiento de los productos bajo estrictos marcos regulatorios como el Reglamento de Nuevos Alimentos del Reino Unido (UE 2015/2283). Esto es lo que necesita saber:
- Requisitos Clave: Los medios de cultivo deben cumplir con los estándares de toxicología, control de contaminación, calidad nutricional y alergenicidad.
- Regulaciones del Reino Unido: La Agencia de Normas Alimentarias (FSA) requiere el cumplimiento de los principios HACCP y la clasificación bajo Productos de Origen Animal (POAO).
- Estándares Globales: Aunque el Reino Unido y la UE comparten marcos similares, los EE. UU. siguen las regulaciones CGMP bajo el Acta FD&C.
- Proceso de Validación: Incluye pruebas exhaustivas de composición, pureza, funcionalidad y cumplimiento del proveedor, junto con una documentación sólida.
- Iniciativas de Apoyo: El sandbox regulatorio del Reino Unido de £1.6 millones, lanzado en 2025, ayuda a las empresas a cumplir con estos estándares.
Una validación adecuada garantiza la seguridad, genera confianza y se alinea con los requisitos legales. El artículo profundiza en el proceso paso a paso, incluidos los métodos de prueba, las calificaciones de los proveedores y consejos para la presentación regulatoria.
Normas Regulatorias para Medios de Crecimiento
Normas y Directrices
Los medios de crecimiento, un componente crítico en la producción de carne cultivada, deben cumplir con rigurosos estándares regulatorios internacionales. Estos estándares varían entre regiones, cada una con requisitos específicos para la composición, seguridad y pureza.
En el Reino Unido, los medios de cultivo están regulados bajo el Reglamento de Nuevos Alimentos (Reglamento (UE) 2015/2283 asimilado). Antes de ser aprobados para el mercado, se requiere una evaluación exhaustiva de seguridad [1]. La Agencia de Normas Alimentarias (FSA) clasifica los productos cultivados en células como Productos de Origen Animal (POAO) bajo el Reglamento (CE) 853/2004. Esta clasificación exige que los productores implementen sistemas de gestión de seguridad alimentaria basados en los principios de Análisis de Peligros y Puntos Críticos de Control (HACCP) [3]. La FSA también está en proceso de desarrollar una guía técnica detallada sobre la composición de los medios de cultivo, con más actualizaciones esperadas [1]. Estos marcos proporcionan la base para requisitos regulatorios más específicos.
En los Estados Unidos, el enfoque es diferente.Los componentes del medio de crecimiento deben cumplir con los requisitos de las Buenas Prácticas de Manufactura Actuales (CGMP) descritos en la Sección 501(a)(4)(B) de la Ley Federal de Alimentos, Medicamentos y Cosméticos (FD&C Act) [4]. La FDA categoriza los componentes del medio como "suministros y reactivos", que están regulados por las partes 210 y 211 de 21 CFR. Estos componentes deben someterse a verificación de calidad para prevenir la contaminación [4]. Curiosamente, los componentes sintéticos del medio de carne cultivada, como aminoácidos, vitaminas y sales, a menudo se clasifican como dispositivos médicos de Clase I bajo 21 CFR 864.2220, eximiéndolos de los requisitos de notificación previa a la comercialización [6][7].
En la Unión Europea, el marco regulatorio se alinea estrechamente con el del Reino Unido, ya que también sigue el Reglamento (UE) 2015/2283.La Autoridad Europea de Seguridad Alimentaria (EFSA) supervisa el proceso de autorización [1]. Según las directrices ICH Q6B, los componentes del medio de cultivo, incluidos antibióticos, inductores y otros constituyentes, se tratan como impurezas relacionadas con el proceso. Estas impurezas deben ser controladas y reducidas a niveles aceptables [5]. Siempre que sea posible, los excipientes y reactivos deben cumplir con los estándares farmacopeicos [5].
| Jurisdicción | Regulación Primaria | Clasificación | Sistema de Seguridad | Supervisión de Medios |
|---|---|---|---|---|
| Reino Unido (GB) | Reglamento Asimilado (UE) 2015/2283 [1] | Producto de Origen Animal (POAO) [3] | HACCP (Reg 852/2004) [3] | Guía de Sandbox FSA/FSS [1] |
| Unión Europea / NI | Reglamento (UE) 2015/2283 [1] | Producto de Origen Animal (POAO) [3] | HACCP (Reg 852/2004) [3] | Proceso de Autorización de EFSA [1] |
| Estados Unidos | FD&C Act Section 501(a)(4)(B) [4] | Nuevo Medicamento / Alimento para Animales [4] | CGMP (21 CFR 210/211) [4] | FDA CVM / USDA-FSIS [4] |
Requisitos Regulatorios para la Carne Cultivada
Los productores de carne cultivada deben asegurar que cada lote de medio de crecimiento cumpla con estrictos estándares de seguridad y calidad.La validación de medios de crecimiento es un aspecto clave del marco regulatorio más amplio para estos productos. Bajo los principios de HACCP (Reglamento (CE) 852/2004), los medios de crecimiento se identifican como un insumo primario y una fuente potencial de contaminación - química, microbiana o de otro tipo [3]. La FSA destaca esta preocupación:
"Los principales peligros en la producción de productos cultivados en células se refieren a la identidad de la línea celular (y su consistencia), peligros introducidos durante el proceso de producción (contaminación microbiológica, medios de crecimiento y componentes residuales en el producto final), y alérgenos." [3]
Si hay cambios en la formulación de los medios de crecimiento, se requiere una revisión inmediata de HACCP [3].En el Reino Unido, la validación debe realizarse antes de la implementación para garantizar la precisión de los diagramas de flujo y la efectividad de las medidas de control [3].
En los Estados Unidos, la FDA exige que todos los reactivos y componentes de medios cumplan con estrictos estándares de calidad para evitar la introducción de agentes nocivos [4]. Los proveedores y laboratorios contratados deben adherirse a las regulaciones CGMP, y cualquier proveedor que no cumpla debe ser eliminado para evitar que los productos sean clasificados como "adulterados" [4]. La FDA subraya la importancia de esto:
"Todos los nuevos medicamentos para animales, incluidos los ACTP, deben fabricarse de acuerdo con CGMP para garantizar que dichos medicamentos cumplan con los requisitos de la Ley Federal de Alimentos, Medicamentos y Cosméticos (Ley FD&C) en cuanto a seguridad." [4]
Actualmente, varias empresas que participan en el sandbox regulatorio del Reino Unido - como BlueNalu, Gourmey, Hoxton Farms, Mosa Meat, Roslin Technologies, Vital Meat, y Vow - están colaborando con la FSA para perfeccionar estos estándares técnicos [1]. Según las regulaciones del Reino Unido, las empresas pueden solicitar hasta cinco años de protección de datos para la información confidencial presentada durante el proceso de autorización [1].
Pasos para la Validación de Medios de Crecimiento
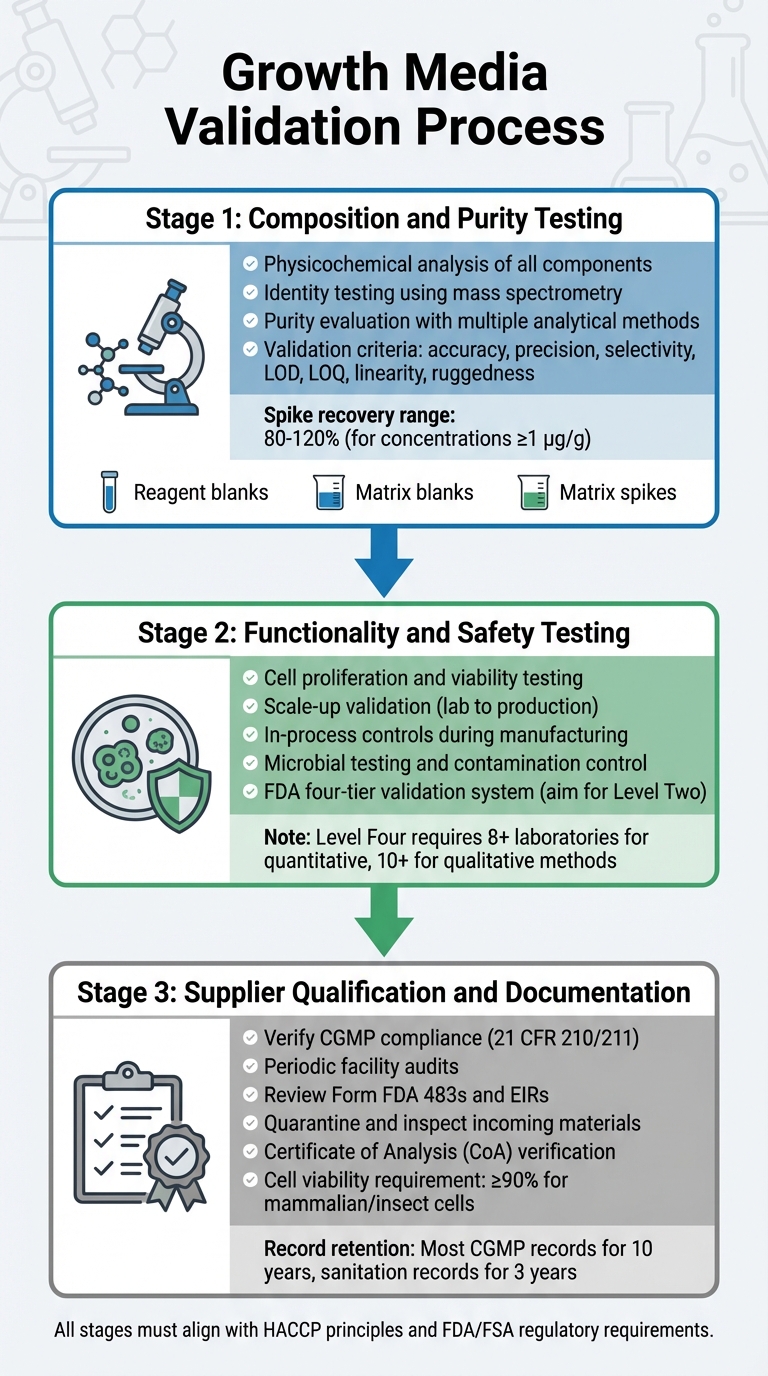
Proceso de Validación de Medios de Crecimiento para la Aprobación Regulatoria de Carne Cultivada
La validación de medios de crecimiento implica un proceso detallado que examina su composición, funcionalidad, seguridad y cumplimiento del proveedor. Cada paso se basa en el anterior, asegurando un proceso de validación robusto que se alinea con los requisitos regulatorios. Esto incluye pruebas de composición, funcionalidad y cumplimiento del proveedor.
Pruebas de Composición y Pureza
La primera etapa se centra en un análisis fisicoquímico exhaustivo de cada componente. Esto implica identificar la composición precisa, las propiedades físicas y la estructura molecular de ingredientes como aminoácidos, vitaminas y sales inorgánicas [5].Para confirmar las estructuras moleculares, las pruebas de identidad emplean métodos altamente específicos, incluyendo técnicas fisicoquímicas, biológicas e inmunoquímicas. Se utilizan herramientas como la espectrometría de masas para verificar las identidades moleculares a través de sus patrones de fragmentación [8].
La evaluación de la pureza requiere múltiples métodos analíticos para separar los componentes deseados de las impurezas. Estas pruebas deben abordar tanto las impurezas relacionadas con el proceso como las relacionadas con el producto [5]. Las técnicas analíticas deben cumplir con estrictos criterios de validación, incluyendo exactitud, precisión, selectividad, límites de detección (LOD), límites de cuantificación (LOQ), linealidad y robustez [8]. Los protocolos de validación también deben incorporar:
- Blancos de reactivos para asegurar que los reactivos estén libres de analitos.
- Blancos de matriz para confirmar que el entorno de la muestra no interfiere.
- Picos de matriz para estimar la recuperación y precisión.
Para métodos cuantitativos a concentraciones de 1 µg/g (ppm), las recuperaciones de picos aceptables generalmente oscilan entre el 80% y el 120% [8].
Para mantener la consistencia, los fabricantes deben establecer materiales de referencia primarios internos derivados de lotes representativos de la producción. Estos sirven como estándares trazables para calibrar materiales de referencia de trabajo [5]. Una vez que se completa la prueba de pureza, el medio debe demostrar su capacidad para apoyar el crecimiento celular efectivo y cumplir con los estándares de seguridad.
Pruebas de Funcionalidad y Seguridad
Después de confirmar la composición, el medio debe demostrar su efectividad en el apoyo a la producción de carne cultivada. Esto incluye demostrar que las células pueden proliferar, mantener la viabilidad y escalar desde condiciones de laboratorio hasta volúmenes de producción. La FDA requiere controles en proceso durante la fabricación, comenzando desde etapas tempranas como el pase de células y la cosecha, para asegurar la consistencia y seguridad del producto [4].
La validación de seguridad implica pruebas microbianas rigurosas y control de contaminación, como se describe en las evaluaciones previas al mercado de la FDA [9].
La FDA utiliza un sistema de cuatro niveles para la validación de métodos químicos, que va desde el Nivel Uno (uso de emergencia o limitado) hasta el Nivel Cuatro (estudios colaborativos completos que cumplen con los estándares AOAC/ISO) [8].Para las pruebas regulatorias de rutina, apunte a validación de un solo laboratorio de Nivel Dos, que incluye una evaluación de rendimiento integral [8]. Los estudios colaborativos completos para métodos cuantitativos requieren la participación de al menos ocho laboratorios, mientras que los métodos cualitativos necesitan diez [8]. Una vez que se valida el rendimiento del medio, es esencial asegurarse de que todas las materias primas provengan de proveedores conformes.
Calificación y Documentación de Proveedores
Los fabricantes deben trabajar con proveedores verificados y conformes con CGMP. Los proveedores deben cumplir con los estándares descritos en 21 CFR 210/211 [4]. La verificación implica auditorías periódicas de las instalaciones del proveedor para evaluar la adherencia a los programas de calidad, procedimientos y cumplimiento general de CGMP [4].
Antes de celebrar contratos, revise el historial de cumplimiento de un proveedor, incluidos los Formularios FDA 483 y los Informes de Inspección de Establecimientos (EIRs) [4]. La FDA subraya esta obligación:
"Antes de celebrar cualquier contrato, acuerdo u otro arreglo con otro establecimiento para realizar cualquier paso de fabricación para usted, debe verificar que el establecimiento cumpla con las CGMP reglamentarias aplicables." [4]
Todos los materiales entrantes deben ser puestos en cuarentena e inspeccionados antes de su liberación, asegurando que cumplan con las especificaciones maestras [10]. Se requiere que los proveedores proporcionen un Certificado de Análisis (CoA) o resultados de pruebas trazables, conformes con CGMP/GLP [10].Para líneas celulares estables, la documentación debe incluir un historial de clonación rastreable [10]. Las células de mamíferos o insectos generalmente requieren al menos un 90% de viabilidad para ser aceptadas en proyectos CGMP [10]. Los registros deben mantenerse según las pautas regulatorias [4].
Los contratos deben delinear claramente las responsabilidades CGMP y exigir a los proveedores que notifiquen a los fabricantes sobre cualquier cambio propuesto en los kits de prueba o metodologías [4]. Si las pruebas se subcontratan, asegúrese de que los laboratorios contratados utilicen métodos analíticos validados y estén registrados por la FDA [4].
Preparación de Documentos de Presentación Regulatoria
Una vez que su medio de cultivo ha sido validado, el siguiente paso es compilar un expediente que demuestre el cumplimiento de todas las normas de seguridad y calidad requeridas por la FDA y USDA-FSIS. Este expediente sirve como un enlace crítico entre la validación y el cumplimiento regulatorio, proporcionando a las autoridades una visión clara de la seguridad de su medio y los procesos de producción.
Elementos Requeridos de un Expediente de Presentación
Su expediente debe incluir un desglose detallado de la composición del medio, enumerando todos los aminoácidos, vitaminas, sales inorgánicas y factores de crecimiento. Las directrices de la FDA enfatizan que el proceso de revisión evalúa no solo el medio en sí, sino todo el flujo de trabajo de producción. Esto incluye el establecimiento de líneas y bancos celulares, la implementación de controles de fabricación y la verificación de todos los componentes e insumos [11].
Además, el expediente debe incluir una evaluación exhaustiva de seguridad y toxicología, demostrando la seguridad alimentaria del material cultivado y todos sus insumos. Incluya registros de control de fabricación, datos de validación de procesos y documentación del programa de calidad para demostrar que su producción es consistente y libre de contaminantes.
También debe proporcionar registros de verificación de suministros y reactivos, mostrando la validación de todos los materiales utilizados en el medio, incluidos los preparados internamente. Para productos regulados por el USDA-FSIS, incluya planes HACCP y protocolos de saneamiento. La FDA aconseja conservar la mayoría de los registros CGMP durante al menos 10 años, mientras que los registros de limpieza y saneamiento de las instalaciones deben mantenerse por un mínimo de 3 años [4]. Esto se alinea con los esfuerzos de calificación de proveedores, asegurando que todos los insumos cumplan con los requisitos CGMP y regulatorios.
Documentación de Cumplimiento de Instalaciones
Antes de producir, procesar o almacenar carne cultivada para el consumo humano, las instalaciones deben registrarse con la FDA [12]. Su documentación debe incluir un plan integral de seguridad alimentaria que aborde el análisis de peligros (biológicos, químicos y físicos), controles preventivos (como la gestión de la sanidad, alérgenos y medidas de la cadena de suministro), y procedimientos de supervisión [12].
Las simulaciones de llenado de medios también son un requisito clave. Estas implican una incubación de 14 días y pruebas de promoción de crecimiento para confirmar prácticas asépticas.Como explica la FDA:
"La prueba de llenado debe evaluar el montaje aséptico y la operación del equipo crítico (estéril), calificar a los operadores y evaluar su técnica, y demostrar que los controles ambientales son adecuados" [2].
Asegúrese de que sus registros incluyan datos de calificación de proveedores, como pruebas realizadas en los primeros tres lotes de medio de un proveedor para confirmar que coinciden con el Certificado de Análisis. Otros registros esenciales incluyen registros de control ambiental, cronogramas de calibración de equipos y datos de monitoreo de temperatura. Para procesos regulados por el USDA, prepare planes HACCP, procedimientos operativos estándar de saneamiento (SSOP) por escrito y procedimientos de retiro [12][13].
sbb-itb-ffee270
Uso de Cellbase para la Adquisición de Medios de Crecimiento Cumplidores con la Normativa
Proveedores Verificados para Carne Cultivada
Una vez que hayas validado tu formulación de medios de crecimiento, el siguiente paso es obtener componentes que cumplan con los estándares regulatorios. Esto no es tan simple como pedir a proveedores genéricos. Para los productos cultivados en células, se aplican estrictas regulaciones de higiene, y cada componente del medio de crecimiento debe venir con documentación específica para la aprobación regulatoria [3]. Ahí es donde entra
Características de Adquisición
La plataforma también proporciona precios transparentes y una función de mensajería directa, permitiendo a los equipos solicitar rápidamente cotizaciones, certificados de análisis y otros documentos regulatorios.Al consolidar estas funciones críticas de adquisición en un sistema adaptado para la producción de carne cultivada,
Conclusión
Validar los medios de crecimiento para la aprobación regulatoria no es solo un trámite - es un requisito legal para introducir productos de carne cultivada en el mercado del Reino Unido. Esto implica pruebas exhaustivas de composición y pureza, implementar un plan HACCP sólido y mantener documentación detallada en cada paso del proceso.
"Los alimentos no deben ser colocados en el mercado si no son seguros. Esto significa que no son perjudiciales para la salud ni inadecuados para el consumo humano." - Agencia de Normas Alimentarias [3]
La Agencia de Normas Alimentarias del Reino Unido £1.El Regulatory Sandbox de 6 millones destaca su compromiso de trabajar con los actores de la industria para establecer una guía técnica clara sobre la composición de medios de crecimiento [1]. Las empresas que prioricen la validación adecuada ahora estarán en una posición más fuerte cuando estas directrices estén completamente definidas.
Cumplir con los estándares de cumplimiento no se trata solo de marcar casillas regulatorias, sino de ganar la confianza del consumidor y garantizar la seguridad del producto. Las pruebas de calidad rigurosas son fundamentales tanto para la aprobación regulatoria como para la aceptación en el mercado. Para agilizar el proceso de autorización, concéntrese en construir protocolos de validación sólidos, mantener registros precisos y asociarse con proveedores confiables. Estos pasos no solo simplificarán la aprobación, sino que también allanarán el camino para una mayor confianza del consumidor.
Preguntas Frecuentes
¿Cuáles son los pasos principales para validar medios de cultivo para la aprobación regulatoria?
La validación de medios de cultivo para la aprobación regulatoria se centra en demostrar que la formulación es segura, confiable y adecuada para producir carne cultivada. Así es como suele ser el proceso:
- Evaluación de riesgos: Comience definiendo la línea celular que utilizará, los objetivos del producto y sus atributos críticos de calidad (como el pH o la composición de nutrientes). Identifique cualquier peligro potencial, como la contaminación microbiana, y establezca medidas para controlar estos riesgos.
- Pruebas y especificaciones: Establezca criterios de aceptación claros para factores como la esterilidad, pureza y potencia. Utilice métodos de prueba establecidos para garantizar que estos estándares se cumplan de manera consistente.
- Estudios de validación: Realice una validación de proceso exhaustiva, incluyendo la calificación de equipos y pruebas de múltiples lotes, para confirmar que los resultados son reproducibles y consistentes.
- Pruebas de estabilidad: Verifique cómo se mantiene el medio a lo largo del tiempo evaluando su calidad durante su vida útil prevista bajo condiciones de almacenamiento adecuadas (típicamente 2–8 °C).
- Documentación: Reúna todo en un expediente de validación integral. Esto debe incluir todos los resultados de las pruebas y análisis para cumplir con los requisitos regulatorios.
Al abordar cuidadosamente cada uno de estos pasos, reunirá la evidencia necesaria para demostrar que el medio cumple con los estándares de seguridad y calidad requeridos para la producción de carne cultivada.
¿Cuáles son las principales diferencias entre las regulaciones del Reino Unido y los EE. UU. para los medios de cultivo utilizados en la carne cultivada?
En el Reino Unido, la regulación de los medios de cultivo para la carne cultivada se rige por el Reglamento de Nuevos Alimentos (Reglamento de la UE 2015/2283), que se ha mantenido en la legislación de GB. Cualquier medio de cultivo utilizado en productos que no se consumían comúnmente antes del 15 de mayo de 1997 debe pasar por una evaluación formal de nuevos alimentos por parte de la Agencia de Normas Alimentarias (FSA). Este proceso requiere la presentación de documentación detallada, incluida información sobre la composición, origen y pureza del medio. Además, es necesaria una evaluación de riesgos basada en HACCP para demostrar cómo se controlan los contaminantes durante el proceso de cultivo celular.
Desde diciembre de 2025, la FSA ha implementado un sandbox de Productos Cultivados en Células. Esta iniciativa ofrece orientación y apoya la recopilación de datos más rápida para las aplicaciones de nuevos alimentos.Para obtener la autorización final, las empresas deben presentar un expediente completo que aborde la seguridad de los medios, la consistencia y la validación de la fabricación. Solo después de esta aprobación, el producto puede venderse en Gran Bretaña.
En contraste, Estados Unidos no tiene un marco específico de nuevos alimentos adaptado a los medios de crecimiento, lo que hace que las comparaciones regulatorias directas sean desafiantes. Para las empresas con sede en el Reino Unido, obtener componentes de medios que ya cumplan con estos estrictos estándares puede simplificar el proceso de aprobación.¿Cómo apoya el sandbox regulatorio del Reino Unido la validación de medios de crecimiento?
El sandbox regulatorio del Reino Unido para productos cultivados proporciona un entorno bien organizado donde las empresas pueden probar y refinar sus formulaciones de medios de crecimiento. Supervisado por la Agencia de Normas Alimentarias (FSA) y Food Standards Scotland (FSS), este programa se desarrolla en fases de seis meses. Durante este tiempo, las empresas pueden realizar pruebas de seguridad, llevar a cabo evaluaciones de riesgos y revisar documentación mientras reciben valiosos comentarios de los reguladores.
Este enfoque práctico permite ensayos prácticos y mejoras paso a paso, acelerando la recopilación de datos de seguridad y ayudando a las empresas a alinearse con los requisitos regulatorios. Para aquellos que trabajan en carne cultivada, obtener medios de crecimiento preaprobados a través de











