La cryoconservation est le processus de congélation et de stockage de cellules vivantes à des températures ultra-basses pour maintenir leur viabilité dans le temps. Cette méthode est essentielle pour la production de viande cultivée, garantissant des lignées cellulaires cohérentes et stables et protégeant contre les pertes dues à la contamination ou à des pannes d'équipement. Les étapes clés comprennent :
- Préparation : Récoltez les cellules pendant leur phase de croissance, vérifiez la viabilité (visez ≥90 %), et préparez-les dans un milieu de congélation avec des cryoprotecteurs comme le DMSO ou le glycérol.
- Congélation : Utilisez un taux de refroidissement contrôlé (-1°C à -3°C par minute) pour éviter les dommages causés par les cristaux de glace. Conservez les cellules dans la vapeur d'azote liquide (-135°C à -190°C) pour une préservation à long terme.
- Dégel : Dégelez rapidement les cellules dans un bain-marie à 37°C pour minimiser la toxicité des cryoprotecteurs, puis transférez-les dans un milieu de croissance pour la récupération.
- Contrôle de Qualité: Étiquetez les flacons avec précision, surveillez les conditions de stockage et testez la viabilité après décongélation pour garantir une préservation réussie.
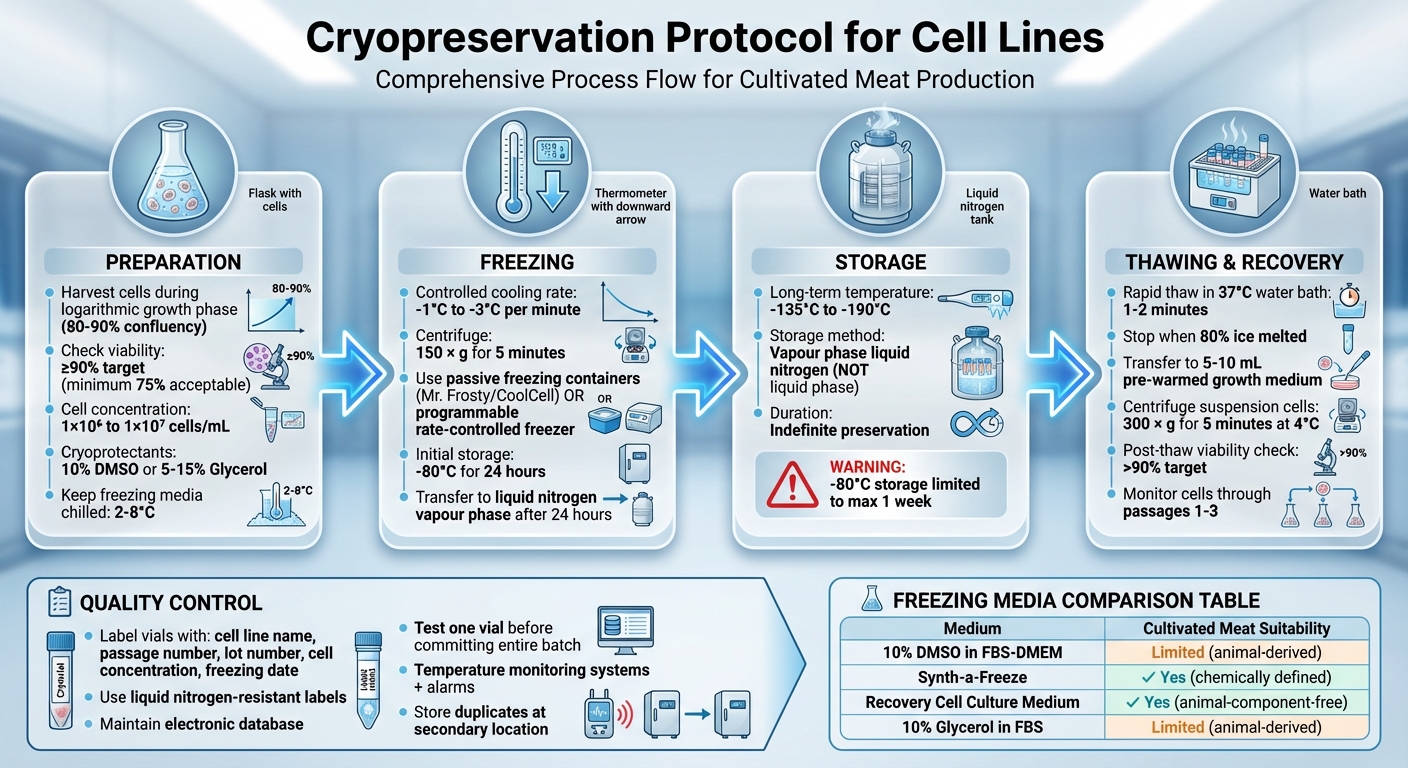
Protocole Complet de Cryoconservation pour Lignes Cellulaires : Processus en 4 Étapes de la Préparation au Stockage
Préparation des Cellules pour la Cryoconservation
Récolte des Cellules et Vérifications de Viabilité
Pour garantir la meilleure récupération après décongélation, récoltez les cellules pendant leur phase de croissance logarithmique (log). Pour les lignées cellulaires adhérentes, cela se produit généralement lorsqu'elles atteignent 80–90 % de confluence [2][3][6].
Vérifiez la viabilité des cellules en utilisant la méthode d'exclusion du Bleu de Trypan. Mélangez des parts égales (1:1) de 0,4 % de Bleu de Trypan avec la suspension cellulaire, puis comptez les cellules à l'aide d'un hémocytomètre.Les cellules viables excluront le colorant et apparaîtront brillantes sous le microscope, tandis que les cellules non viables se teinteront en bleu [4]. Idéalement, visez une viabilité d'au moins 90 % pour les meilleurs taux de récupération, bien que certains protocoles puissent accepter un minimum de 75 % [1][2][3][5].
Avant la récolte, utilisez un microscope pour vérifier la contamination bactérienne ou fongique. Les cellules de suspension saines devraient apparaître brillantes, rondes et réfractiles sous un microscope à contraste de phase inversé [2][3].
Une fois que les cellules répondent aux normes de viabilité requises, passez aux étapes de pré-congélation.
Préparations avant congélation
Pour les cellules adhérentes, utilisez des méthodes de dissociation douces, telles que la trypsine ou TrypLE Express, et limitez le temps d'incubation pour éviter d'endommager les membranes cellulaires [5]. Préparez les cellules à une concentration de 1 × 10⁶ à 1 × 10⁷ cellules/mL, selon la lignée cellulaire [1][6]. Lors de l'aliquotage, assurez-vous que la suspension cellulaire est mélangée fréquemment pour maintenir une distribution uniforme dans les cryovials [5].
Gardez le milieu de congélation réfrigéré entre 2°C et 8°C pendant la resuspension pour réduire la toxicité du cryoprotecteur avant le début du processus de congélation [5]. Une fois les cellules suspendues dans le milieu de congélation, passez rapidement au protocole de congélation [1].Toujours cryopréserver les cellules au nombre de passages le plus bas possible pour réduire le risque de dérive génétique ou de changements morphologiques [5][7].
Sélection des cryoprotecteurs et des milieux de congélation
Options de cryoprotecteurs et leurs fonctions
Le diméthylsulfoxyde (DMSO) est largement utilisé comme cryoprotecteur, généralement à une concentration de 10% [2]. Il agit en pénétrant les membranes cellulaires et en réduisant la formation de glace pendant la congélation. Cependant, le DMSO peut être toxique pour les cellules à température ambiante, donc un décongélation rapide est essentielle pour minimiser l'exposition et le diluer rapidement [1].
Le glycérol sert d'alternative utile pour les lignées cellulaires sensibles au DMSO, généralement utilisé à des concentrations allant de 5% à 15% [8].Il est particulièrement efficace pour les types de cellules où le DMSO pourrait provoquer une différenciation indésirable [3], et il tend à avoir une toxicité inférieure par rapport au DMSO.
Dans les applications de viande cultivée, les protocoles de congélation traditionnels utilisent souvent un mélange de 90 % de sérum bovin fœtal (FBS) et de 10 % de DMSO [1]. Cependant, la dépendance à des composants d'origine animale limite ces méthodes en termes d'évolutivité et d'approbation réglementaire [9]. Pour résoudre ces problèmes, les milieux chimiquement définis - comme Synth-a-Freeze ou Recovery Cell Culture Medium - offrent une alternative sans composants d'origine animale. Ces milieux maintiennent une haute viabilité cellulaire après décongélation tout en surmontant les défis associés aux composants d'origine animale [9].
Comparaison des milieux de congélation
Voici un aperçu des avantages et des limitations des différents milieux de congélation utilisés dans la production de viande cultivée :
| Milieu | Avantages | Inconvénients | Adaptabilité à la viande cultivée |
|---|---|---|---|
| 10% DMSO dans FBS-DMEM | Protocoles établis [1] | Contient des composants d'origine animale ; variabilité entre les lots [9] | Scalabilité limitée |
| Synth-a-Freeze | Chimiquement défini ; qualité constante ; sans composants animaux [9] | Coût initial plus élevé [9] | Oui |
| Milieu de culture cellulaire de récupération | Facile à utiliser ; conçu pour une récupération rapide [9] | Peut nécessiter une optimisation pour des lignées cellulaires spécifiques | Oui |
| 10 % de glycérol dans le FBS | Alternative pour les cellules sensibles au DMSO [1] | Repose sur du sérum d'origine animale [9] | Scalabilité limitée |
En février 2023, des chercheurs de l'Université Médicale des Femmes de Tokyo, dirigés par Hironobu Takahashi, ont démontré l'importance de choisir le bon milieu de congélation.En utilisant des options commerciales telles que CELLBANKER 1 et 2, ils ont réussi à cryoconserver des cellules myogéniques bovines primaires à –80°C pendant jusqu'à un an. Remarquablement, ces cellules ont conservé leur capacité à proliférer et à se différencier en tissu musculaire contractile avec des structures de sarcomères intactes après décongélation [10].
Pour la production de viande cultivée, des milieux chimiquement définis et conformes aux BPF sont de plus en plus privilégiés. Comme le souligne STEMCELL Technologies :
Dans des domaines hautement réglementés tels que la thérapie cellulaire et génique, il est recommandé d'utiliser un milieu de cryoconservation entièrement défini et fabriqué selon les BPF pour garantir que les produits sont systématiquement produits et contrôlés conformément aux normes de qualité [9].
Des plateformes comme
Procédure de cryoconservation et taux de refroidissement
Protocole de congélation étape par étape
La clé d'une cryoconservation réussie réside dans le maintien d'un taux de refroidissement constant de -1°C à -3°C par minute[2]. Ce processus progressif permet à l'eau de quitter les cellules lentement, empêchant la formation de cristaux de glace intracellulaires nuisibles qui pourraient rompre les membranes cellulaires[1].
Commencez par centrifuger les cellules à 150 x g pendant 5 minutes[3]. Une fois centrifugées, resuspendre le culot cellulaire dans un milieu de congélation froid contenant 10% DMSO à une concentration de 2–4×10⁶ cellules/mL[3].Pour réduire l'exposition au DMSO, passez rapidement à l'étape suivante - la congélation.
Distribuez la suspension cellulaire dans des flacons cryogéniques pré-étiquetés. Chaque flacon doit indiquer clairement des détails essentiels tels que le nom de la lignée cellulaire, le numéro de passage, le numéro de lot, la concentration cellulaire et la date de congélation[3]. Une fois les flacons préparés, il est temps de sélectionner et d'utiliser l'équipement de refroidissement approprié.
Équipement et techniques de refroidissement
Placez immédiatement les flacons dans un dispositif de refroidissement à taux contrôlé. Les conteneurs de congélation passifs, comme le Nalgene "Mr Frosty" (qui utilise de l'isopropanol) ou le Corning "CoolCell", sont des choix populaires. Ces outils peuvent atteindre un taux de refroidissement d'environ 1°C par minute lorsqu'ils sont placés dans un congélateur à -80°C[2].
Pour les opérations à plus grande échelle où la cohérence est essentielle, un congélateur à taux contrôlé programmable est la meilleure option. Comme l'indique Sigma-Aldrich:
ECACC utilise régulièrement un congélateur à taux contrôlé programmable. C'est le moyen le plus fiable et reproductible de congeler des cellules[3].
Après environ 24 heures à -80°C, transférez les flacons dans la phase vapeur de l'azote liquide, où les températures varient entre -135°C et -190°C, pour un stockage à long terme[4]. Évitez de stocker des cellules à -80°C pendant plus d'une semaine, car cela peut compromettre leur viabilité. Des températures inférieures à -135°C sont essentielles pour une préservation indéfinie[2]. Utiliser la phase vapeur au lieu de la phase liquide réduit le risque de contamination croisée tout en maintenant des températures suffisamment basses.
Protocoles de décongélation et de récupération
Processus de décongélation
Décongeler les cellules rapidement est crucial pour limiter l'exposition aux cryoprotecteurs toxiques et prévenir les dommages causés par les cristaux de glace. Assurez-vous de porter un visière intégrale et des gants isolants pour votre sécurité. Commencez par retirer le cryovial de l'azote liquide et desserrer légèrement le capuchon pour libérer toute pression accumulée. Ensuite, resserrez le capuchon.
Placez le flacon dans un bain-marie à 37°C, en veillant à ce que le capuchon reste au-dessus de la ligne d'eau. Laissez-le décongeler pendant 1 à 2 minutes, ou jusqu'à ce qu'il ne reste que quelques cristaux de glace. Une fois décongelé, essuyez l'extérieur du flacon avec de l'alcool à 70 % pour maintenir la stérilité.
Transférez le contenu du flacon dans un tube contenant 5 à 10 mL de milieu de culture préchauffé. Ajoutez le milieu lentement pour aider à réduire le choc osmotique. Si vous travaillez avec des lignées cellulaires en suspension, centrifugez immédiatement la suspension cellulaire à 300 × g pendant 5 minutes à 4°C.Cette étape aide à pélletiser les cellules et à éliminer le cryoprotecteur. Après centrifugation, resuspendre les cellules dans un milieu frais. Pour les cellules adhérentes, la centrifugation est généralement inutile. Au lieu de cela, ensemencez directement les cellules dans un récipient de culture approprié et éliminez tout DMSO résiduel lors du premier changement de milieu, généralement après 24 heures.
Évaluations post-dégel
Juste après le dégèle, vérifiez la viabilité cellulaire pour vous assurer que la récupération a été réussie. Utilisez la méthode d'exclusion de Trypan Blue pour cette évaluation. Idéalement, la viabilité cellulaire devrait dépasser 90% [11], mais un minimum de 75% est acceptable. Après 24 heures, inspectez les cellules au microscope à contraste de phase pour confirmer l'adhérence, évaluer la densité cellulaire et vérifier tout signe de contamination.
Continuez à surveiller les cellules à travers les passages 1–3 pour garantir une prolifération normale et qu'elles conservent leurs caractéristiques attendues.Pour les lignées cellulaires qui se rétablissent plus lentement, vous pouvez améliorer la survie en augmentant la concentration initiale de sérum bovin fœtal à environ 20 % v/v.
sbb-itb-ffee270
Conditions de stockage et viabilité à long terme
Conditions et durée de stockage
Pour maintenir la viabilité des lignées cellulaires à long terme, il est essentiel de les stocker à des températures inférieures à -135°C [7][2]. Cela garantit qu'elles restent préservées indéfiniment.La méthode préférée pour stocker les lignées cellulaires de viande cultivée est l'azote liquide en phase vapeur. Cette technique maintient des températures entre -135°C et -190°C, ce qui la rend idéale pour la préservation à long terme tout en offrant une sécurité accrue par rapport au stockage en phase liquide.
Si vous devez stocker des cellules à -80°C, limitez cela à une période de 24 heures à une semaine. Au-delà, la viabilité cellulaire peut diminuer.Pour un stockage temporaire à cette température, transférez les cellules dans un stockage à l'azote liquide dès que possible.
Utilisez des flacons cryogéniques stériles standard (1–2 mL) avec un filetage interne et un joint torique pour un stockage sûr [4][5]. Placez toujours les cryovials scellés dans la phase gazeuse plutôt que dans la phase liquide de l'azote pour réduire le risque d'explosions de flacons lors de la décongélation [5]. De plus, assurez-vous que les récipients d'azote liquide en vrac sont maintenus au moins à moitié pleins pour maintenir une marge de sécurité.
Enfin, des mesures de contrôle de qualité rigoureuses sont essentielles pour garantir la viabilité à long terme des cellules.
Contrôles de Qualité
Pour garantir la fiabilité des lignées cellulaires stockées, suivez des protocoles stricts de contrôle de qualité. Commencez par étiqueter avec précision chaque flacon avec des étiquettes résistantes à l'azote liquide.Incluez des détails essentiels tels que l'identité de la lignée cellulaire, le numéro de lot, le numéro de passage et la date de congélation. Maintenez une base de données électronique pour enregistrer l'emplacement exact de chaque flacon, ce qui réduit le temps pendant lequel les récipients de stockage doivent rester ouverts [7][2].
Avant de soumettre des lots entiers à un stockage à long terme, testez la viabilité d'un flacon après un stockage à court terme en phase gazeuse. Cette étape aide à confirmer que le processus de congélation a été réussi et identifie d'éventuels problèmes [4][7][2]. Pour des stocks cellulaires de grande valeur, il est judicieux de stocker des duplicatas à un emplacement secondaire pour se protéger contre les pannes d'équipement ou les catastrophes locales [7][2].
Équipez tous les récipients de stockage de systèmes de surveillance de la température et d'alarmes pour détecter les niveaux de liquide azote bas [7]. De plus, installez des alarmes d'oxygène dans les zones de stockage, réglées pour se déclencher à 18 % d'oxygène (v/v), afin de minimiser les risques d'asphyxie pour le personnel travaillant avec de l'azote liquide [7][2].
Protocole vidéo de cryoconservation des lignées cellulaires de mammifères
Conclusion et points clés
Voici un rapide récapitulatif des étapes essentielles et des recommandations pour une cryoconservation efficace dans la production de viande cultivée :
- Collecte des cellules : Collectez les cellules pendant leur phase de croissance logarithmique, en veillant à ce que la viabilité dépasse 90 %. Utilisez 10 % de DMSO comme cryoprotecteur, bien que le glycérol puisse être une alternative pour des lignées cellulaires plus délicates [11][1].
- Refroidissement et Stockage: Maintenez un taux de refroidissement contrôlé et transférez rapidement les flacons au stockage dans l'azote liquide en phase vapeur pour protéger l'intégrité cellulaire [11]
Une étude de Roka Kakehi et al. souligne l'importance de la précision dans la cryoconservation [10]:
"Assurer une source fiable et cohérente de cellules en utilisant la cryoconservation nous permettra d'augmenter l'approvisionnement stable de cellules prometteuses pour la production de viande cultivée." - Roka Kakehi et al., Université Médicale des Femmes de Tokyo
- Processus de Décongélation: Décongelez les cellules dans un bain-marie à 37°C pendant environ deux minutes, en vous arrêtant lorsque 80 % de la glace a fondu. Cela réduit la toxicité du DMSO et améliore la récupération cellulaire [1]. Suivez avec des vérifications de viabilité post-décongélation pour assurer le succès et affiner les procédures futures.
Ces méthodes fonctionnent main dans la main avec des pratiques strictes de contrôle de la qualité. Étiquetez toujours les flacons avec précision, maintenez des dossiers organisés et mettez en œuvre des vérifications approfondies avant le stockage à long terme [11]. Pour des besoins de cryoconservation spécialisés, des plateformes comme
FAQs
Quels sont les avantages d'utiliser des milieux chimiquement définis pour la cryoconservation des lignées cellulaires dans la production de viande cultivée ?
Les milieux chimiquement définis apportent de multiples avantages en ce qui concerne la cryoconservation des lignées cellulaires pour la production de viande cultivée. En éliminant les composants non définis, comme le sérum d'origine animale, ils garantissent des résultats cohérents et prévisibles - un facteur crucial pour maintenir la fiabilité à long terme des lignées cellulaires.
Un autre avantage clé est le risque réduit de contamination et de variabilité. Cela soutient non seulement des normes de qualité et de sécurité plus élevées, mais s'aligne également parfaitement avec la précision et l'évolutivité nécessaires pour répondre aux exigences réglementaires et aux attentes des consommateurs dans l'industrie de la viande cultivée.
Comment le choix du cryoprotecteur influence-t-il la survie cellulaire lors de la congélation et de la décongélation ?
Le choix du cryoprotecteur est un facteur clé pour préserver la santé cellulaire lors de la congélation et de la décongélation. Deux options largement utilisées sont le diméthylsulfoxyde (DMSO) et le glycérol, chacun ayant des caractéristiques distinctes. Le DMSO est connu pour sa capacité à pénétrer rapidement dans les cellules et à fournir une forte protection. Cependant, il présente un inconvénient : à des concentrations élevées ou avec une exposition prolongée, il peut devenir toxique, réduisant potentiellement la viabilité cellulaire.
Le glycérol, en revanche, est moins toxique et peut être appliqué directement.Son inconvénient réside dans son taux de pénétration cellulaire plus lent, ce qui peut entraîner une protection moins immédiate par rapport au DMSO.
Atteindre le bon équilibre est crucial. Ajuster correctement la concentration et le temps d'exposition du cryoprotecteur aide à protéger les cellules tout en minimisant le risque de toxicité. De plus, respecter les meilleures pratiques pour les taux de refroidissement et les conditions de stockage est essentiel pour garantir les taux de récupération les plus élevés possibles après décongélation.
Pourquoi est-il important de contrôler le taux de refroidissement pendant la cryoconservation ?
Maintenir un taux de refroidissement constant, généralement entre –1°C et –3°C par minute, est essentiel pour garder les cellules viables. Un refroidissement progressif permet aux cellules de se déshydrater à un rythme contrôlé, réduisant ainsi le risque de formation de cristaux de glace nuisibles, qui peuvent déchirer ou endommager les membranes cellulaires.
Cette approche mesurée protège la structure des cellules, augmentant leur survie et leur fonctionnalité une fois décongelées.Le respect de protocoles de refroidissement précis est essentiel pour garantir un stockage et une récupération réussis des lignées cellulaires.











