Les tests de stérilité sont essentiels pour la production de viande cultivée, où même une contamination mineure peut entraîner des échecs de lots coûteux. Ce processus garantit qu'aucun micro-organisme nuisible ne perturbe les opérations du bioréacteur, protégeant ainsi la qualité du produit et la viabilité financière. Avec des taux de contamination moyens de 11,2 % - et atteignant 19,5 % pour la production à grande échelle - les producteurs font face à des défis importants pour maintenir des environnements stériles.
Les points clés incluent:
- Principales Sources de Contamination: Le personnel, les matières premières et les opérations du bioréacteur sont des points d'entrée courants pour les microbes.
- Méthodes de Test: La filtration sur membrane pour les grands volumes, l'inoculation directe pour les petits échantillons, et les tests de bioburden pendant la production sont largement utilisés.
- Surveillance en Temps Réel: Des outils comme les capteurs d'oxygène dissous et l'analyse des gaz résiduels permettent une détection précoce de l'activité microbienne.
- Technologies Émergentes: La surveillance pilotée par l'IA, la stérilisation par plasma froid et les systèmes d'imagerie automatisés offrent une gestion de la contamination plus rapide et plus précise.
Pour les producteurs de viande cultivée, combiner les tests de stérilité traditionnels avec des solutions de surveillance avancées est essentiel pour réduire les risques et améliorer l'efficacité de la production.
Rocker Discover - Comment effectuer un test de stérilité ?
sbb-itb-ffee270
Sources de Contamination dans les Systèmes de Bioréacteurs
Pour éviter les échecs de lots dans les systèmes de bioréacteurs, il est crucial d'identifier l'origine de la contamination. Les contaminants se répartissent généralement en trois catégories principales : microbienne, particulaire et endotoxine. Chaque type présente des défis uniques pour la production de viande cultivée, rendant essentiel le développement de stratégies préventives spécifiques.
Le personnel est la principale source de contamination, introduisant souvent des contaminants par la desquamation de la peau, un habillage inapproprié ou une mauvaise hygiène des mains [4][7]. Même avec des protocoles stricts, de simples mouvements peuvent perturber le flux d'air, entraînant des turbulences ou des zones stagnantes où les contaminants peuvent s'accumuler [4][9]. La U.S. La Food and Drug Administration souligne les risques encourus, déclarant que "toute manipulation manuelle ou mécanique du médicament stérilisé, des composants, des contenants ou des fermetures avant ou pendant l'assemblage aseptique pose un risque de contamination et nécessite donc un contrôle minutieux" [4].
Les facteurs environnementaux jouent également un rôle important. Par exemple, ne pas maintenir une pression positive de 10 à 15 Pascals peut permettre à l'air non filtré de pénétrer dans les zones stériles [3][4]. De plus, des problèmes tels que les inefficacités des filtres HEPA - où la rétention des particules tombe en dessous de 99,97% - ou des filtres à gaz comprimé compromis peuvent rapidement compromettre la stérilité [4].
Contamination des Matières Premières et des Lignées Cellulaires
Les matières premières entrant dans le système de bioréacteur représentent un risque majeur de contamination. Les ingrédients non vérifiés, les composants des milieux de culture et les lignées cellulaires (disponibles via des places de marché B2B spécialisées) peuvent introduire des pathogènes opportunistes [2]. L'environnement riche en nutriments des milieux de culture cellulaire est particulièrement sensible à la contamination, rendant les processus de viande cultivée plus vulnérables par rapport aux bioprocédés microbiens [8].
Les ingrédients sensibles à la chaleur qui ne peuvent pas subir d'autoclavage sont particulièrement risqués, car ils nécessitent des méthodes de stérilisation alternatives comme la filtration [1] [8]. De plus, le processus d'inoculation lui-même comporte des risques inhérents. Même lorsque les membranes sont désinfectées avec de l'alcool ou que les procédures sont effectuées près d'une flamme nue, il n'y a aucune garantie absolue contre la contamination lors de l'introduction de la lignée cellulaire [8]. Ces risques soulignent l'importance d'une vérification approfondie des matières premières avant leur introduction dans le système.
Risques Opérationnels des Bioréacteurs
Les opérations quotidiennes au sein des bioréacteurs présentent de nombreuses opportunités de contamination. L'échantillonnage manuel est particulièrement à haut risque, car chaque point d'accès augmente la chance d'introduire des contaminants [1].Des problèmes tels que des joints compromis, des joints toriques endommagés ou des fermetures non stérilisées augmentent encore le risque [4][8]. De plus, le transfert de matériaux de zones moins classifiées vers des zones plus classifiées sans décontamination appropriée constitue une autre vulnérabilité critique [7].
Maintenir des contrôles environnementaux stricts est non négociable. Les différentiels de pression entre les zones de salle blanche doivent être surveillés en continu, et tout changement inhabituel doit être immédiatement investigué [4]. Dans les zones critiques de Classe 100 (ISO 5), le nombre de particules pour des tailles ≥0,5 μm doit rester inférieur à 3 520 particules par mètre cube pendant les opérations [4].De plus, l'aérosolisation de désinfectants ou d'alcool isopropylique à 70 % près des échantillonneurs d'air peut augmenter les lectures de particules, tandis que le condensat sur les filtres à gaz peut provoquer des blocages ou favoriser la croissance microbienne [4][7].
Ces risques opérationnels soulignent l'importance de mettre en œuvre des méthodes rigoureuses de test de stérilité pour protéger les processus de bioréacteurs.
Méthodes de Test de Stérilité pour les Bioréacteurs
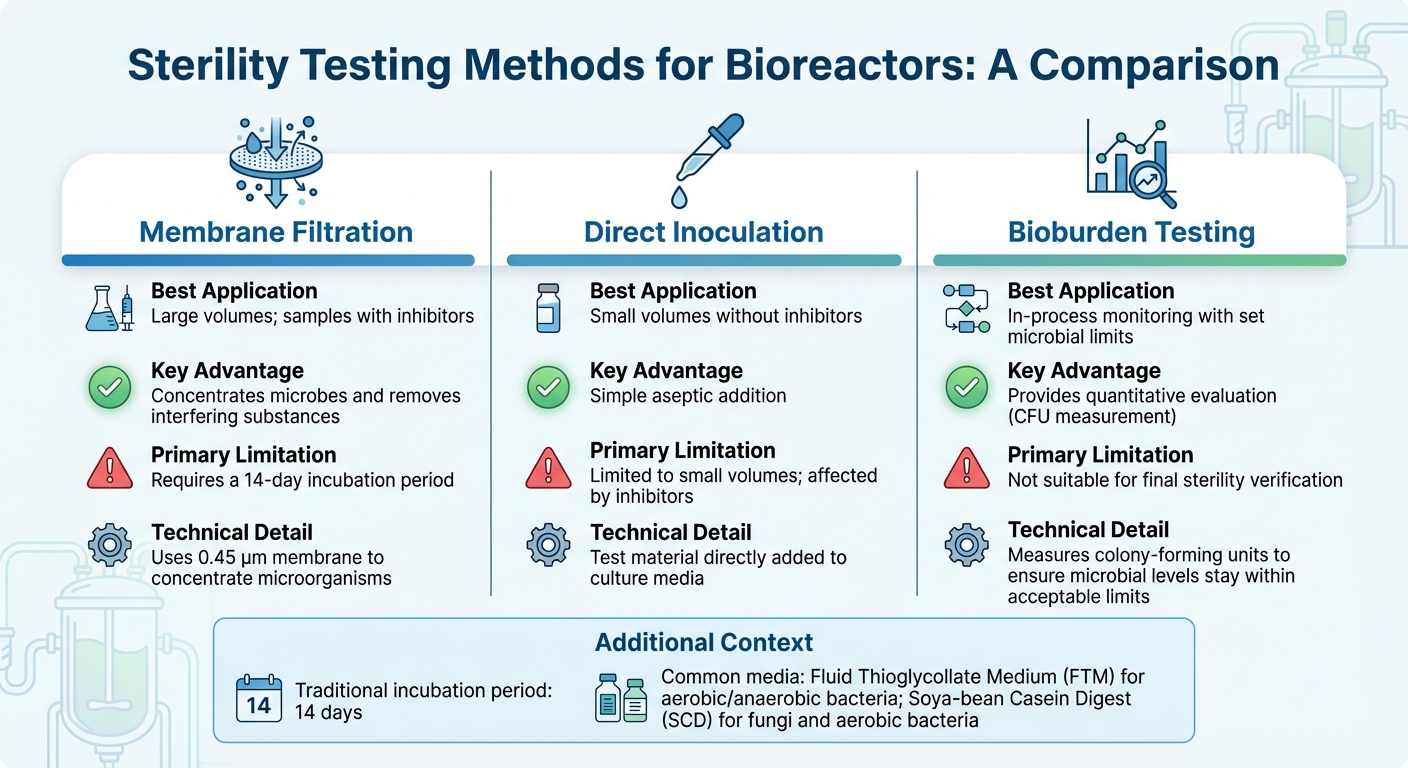
Comparaison des Méthodes de Test de Stérilité pour les Bioréacteurs
Le choix du bon test de stérilité pour les bioréacteurs dépend de facteurs tels que la taille du bioréacteur, le stade de production et les défis de mise à l'échelle, et la composition de l'échantillon - en particulier lorsque des inhibiteurs sont présents. Pour la plupart des applications industrielles, la filtration sur membrane est la méthode de référence [3] .Pendant ce temps, les techniques moléculaires comme la PCR offrent une détection plus rapide pour des contaminants spécifiques. Ci-dessous, nous explorerons des méthodes adaptées à la production de viande cultivée, en abordant les défis uniques des tests d'échantillons à la fois grands et petits.
Pour les échantillons de grand volume, courants dans les bioréacteurs à l'échelle industrielle, la filtration sur membrane utilise une membrane de 0,45 µm pour concentrer les micro-organismes, améliorant ainsi la sensibilité de détection [10] . Cette méthode est particulièrement efficace pour les échantillons contenant des antibiotiques, car le rinçage peut éliminer les inhibiteurs avant l'incubation. D'autre part, l'inoculation directe, où le matériel de test est directement ajouté au milieu de culture, fonctionne mieux pour les volumes d'échantillons plus petits mais a du mal à gérer les substances inhibitrices. Après avoir concentré les échantillons et éliminé les inhibiteurs, l'incubation et la validation garantissent l'exactitude des résultats.
Les tests de stérilité traditionnels reposent sur une période d'incubation de 14 jours pour confirmer visuellement la croissance microbienne [3]. Les milieux couramment utilisés incluent le milieu de thioglycolate de sodium (FTM) pour les bactéries aérobies et anaérobies, et le milieu de digestion de caséine de soja (SCD) pour les champignons et les bactéries aérobies. Avant de réaliser tout test de stérilité, il est crucial de valider que le produit n'inhibe pas la croissance microbienne par des tests de bactériostase et de fongistase.
Pour la surveillance continue des processus, le test quantitatif de la charge microbienne offre une solution plus pratique que les tests de stérilité binaires, en particulier dans la production de viande cultivée. Contrairement aux tests de stérilité qui fournissent un simple résultat de réussite/échec, le test de charge microbienne mesure les unités formant colonie (UFC) pour s'assurer que les niveaux microbiens restent dans les limites acceptables. Cette méthode est conforme aux normes émergentes de qualité alimentaire, trouvant un équilibre entre des contrôles pharmaceutiques stricts et les réalités économiques de la production alimentaire à grande échelle.
Pour les fournitures de tests de stérilité et les solutions de bioréacteurs, les professionnels de la viande cultivée peuvent se tourner vers des fournisseurs de confiance comme
| Méthode | Meilleure Application | Avantage Clé | Limitation Principale |
|---|---|---|---|
| Filtration sur Membrane | Grands volumes; échantillons avec inhibiteurs | Concentre les microbes et élimine les substances interférentes [3] | Nécessite une période d'incubation de 14 jours [3] |
| Inoculation Directe | Petits volumes sans inhibiteurs | Ajout aseptique simple | Limité aux petits volumes; affecté par les inhibiteurs [3] |
| Test de Charge Microbienne | Surveillance en cours de processus avec des limites microbiennes définies | Fournit une évaluation quantitative | Non adapté pour la vérification finale de la stérilité [3] |
Surveillance en temps réel et assurance de stérilité
Se fier aux tests de stérilité traditionnels de 14 jours comporte le risque de perdre des lots entiers si une contamination est découverte trop tard.La surveillance en temps réel offre une solution proactive en surveillant les paramètres critiques du processus au fur et à mesure qu'ils se produisent. Cela permet une action immédiate si quelque chose tourne mal. Dans la production de viande cultivée, où les cycles de bioréacteur durent des semaines et utilisent des milieux de culture coûteux, la détection précoce de la contamination peut économiser des milliers de livres et éviter des retards de production. En combinant les données en temps réel avec des tests de stérilité conventionnels, les producteurs peuvent combler le fossé entre la confirmation retardée et l'intervention rapide.
Surveillance Basée sur des Capteurs
Des indicateurs clés comme l'oxygène dissous (DO) et les niveaux de pH peuvent signaler une contamination tôt. Lorsque des bactéries ou des champignons infiltrent un bioréacteur, ils consomment rapidement de l'oxygène - provoquant une baisse des niveaux de DO - et libèrent des acides métaboliques qui abaissent considérablement le pH [12]. Ces changements peuvent être détectés des heures avant que la contamination ne devienne visuellement apparente. Bien que les tests de stérilité traditionnels confirment les résultats après le processus, la surveillance en temps réel agit comme une sauvegarde, garantissant que le processus reste sur la bonne voie et traitant les risques de contamination plus tôt.
Analyse des gaz résiduels, utilisant la spectrométrie de masse à secteur magnétique, mesure en continu les niveaux d'oxygène et de dioxyde de carbone dans le gaz d'échappement d'un bioréacteur. Dans des études de contamination contrôlée, cette méthode a identifié la croissance microbienne en 22,4 heures grâce aux changements d'oxygène, tandis que la détection basée sur le pH était en retard à 25,8 heures [13]. Les systèmes à secteur magnétique fournissent des mesures précises de l'oxygène avec une précision allant jusqu'à 0,003 % (v/v) sur sept jours, surpassant les détecteurs paramagnétiques traditionnels, qui ne sont précis qu'à ±0,2 % (v/v) [13].
Les capteurs spectroscopiques offrent une surveillance non invasive à travers les parois des bioréacteurs à usage unique, ce qui est essentiel pour maintenir la stérilité.La spectroscopie UV-vis peut détecter les dommages membranaires en mesurant l'absorption de la lumière à 350–400 nm, tandis que les matériaux intracellulaires fuyants apparaissent à 800–900 nm [14]. Les sondes de capacité, les seuls capteurs disponibles dans le commerce conçus pour mesurer la densité cellulaire viable, y parviennent en détectant les changements de polarisation membranaire [14]. Pour les installations gérant plusieurs bioréacteurs, des outils comme le Rapid Multi-Stream Sampler peuvent surveiller jusqu'à 16 flux de gaz simultanément [13].
Ces systèmes basés sur des capteurs, combinés avec des contrôles environnementaux, tels que la prévention de la contamination par HVAC, créent une défense robuste contre la contamination.
Contrôles Environnementaux et de Pression
Maintenir une pression positive entre les zones de salle blanche est crucial pour empêcher les contaminants d'entrer [3].Les systèmes à pression positive, lorsqu'ils sont associés à une filtration HEPA, agissent comme des barrières physiques contre l'intrusion microbienne. Les alarmes sonores ou visuelles sur les filtres HEPA peuvent immédiatement avertir le personnel si la pression tombe en dessous des niveaux acceptables [3].
Le comptage des particules non viables est une autre couche de défense. Les compteurs de particules laser vérifient en continu que l'environnement respecte les normes de propreté de l'air ISO pendant le fonctionnement. En surveillant à la fois les particules de 0,5 µm et de 5,0 µm, ces appareils garantissent que la qualité de l'air reste dans les limites requises [7]. Si des écarts inattendus se produisent - tels qu'une chute soudaine de l'OD ou une fluctuation du pH - l'isolement immédiat du bioréacteur affecté et l'arrêt des ajouts d'alimentation peuvent empêcher la propagation de la contamination [12].
Pour l'approvisionnement en capteurs spécialisés et en équipements adaptés aux opérations de viande cultivée, des entreprises comme
Nouvelles Technologies dans les Tests de Stérilité
Les méthodes traditionnelles de test de stérilité échouent souvent en raison de leurs longues périodes d'incubation de 14 jours et de leur dépendance à l'échantillonnage manuel, ce qui peut laisser des lacunes dans la détection. Les technologies plus récentes interviennent pour relever ces défis, offrant une détection de contamination plus rapide et plus précise. Cela est particulièrement crucial dans la production de viande cultivée, où le coût élevé des milieux de culture et les temps de culture prolongés rendent la contamination en fin de processus un cauchemar financier.
Systèmes de Surveillance Pilotés par l'IA
L'intelligence artificielle redéfinit la détection de la contamination en analysant les données en temps réel pour identifier les intrusions microbiennes.Lorsque des bactéries envahissent un bioréacteur, elles consomment de l'oxygène et produisent des acides métaboliques, entraînant des baisses notables des niveaux d'oxygène dissous et de pH. Les systèmes d'IA peuvent détecter ces écarts dans la consommation d'oxygène et de nutriments, signalant une contamination potentielle bien plus tôt que les tests de charge microbienne et protocoles de stérilité traditionnels ne peuvent fournir des résultats [12].
Ces plateformes d'IA intègrent également des modèles mathématiques pour identifier le moment exact où la contamination s'est produite et simuler comment les populations microbiennes se développent au fil du temps. Cela aide les opérateurs à retracer la contamination jusqu'à sa source, qu'il s'agisse d'une source d'alimentation défectueuse, d'une erreur opérationnelle ou d'un problème d'équipement. Des techniques comme l'analyse de probabilité de Poisson améliorent encore la précision des tests de charge microbienne, réduisant la probabilité de faux négatifs [12].
"Les modèles mathématiques aident à estimer le moment d'introduction de la contamination et la dynamique de croissance microbienne, améliorant ainsi la traçabilité de la contamination." - Naveenganesh Muralidharan, Senior Manager, MSAT, AGC Biologics [12]
Lorsque des anomalies sont signalées, une action immédiate - telle que l'isolement du bioréacteur et l'arrêt de toutes les additions d'alimentation - peut empêcher le problème de se propager [12]. Une approche systématique impliquant des tests de bioburden, l'identification moléculaire et l'analyse du taux de croissance est essentielle pour identifier la cause première et mettre en œuvre des mesures correctives. Ces outils d'IA comblent le fossé entre les méthodes traditionnelles et la gestion proactive de la contamination.
Stérilisation par plasma froid
La technologie du plasma froid offre une option de stérilisation non thermique particulièrement bien adaptée à la production de viande cultivée.Fonctionnant à température ambiante ou proche, il est idéal pour stériliser des composants sensibles comme les pièces de bioréacteur, les capteurs et les plastiques qui ne peuvent pas supporter la chaleur de l'autoclavage traditionnel [15][16] [17]. Cette méthode utilise des espèces réactives d'oxygène et d'azote, ainsi que la lumière UV, pour perturber les membranes microbiennes et l'ADN. Elle est efficace contre un large éventail de contaminants, y compris les spores bactériennes (Bacillus, Clostridium), les champignons, les virus et même les prions [15][17].
Une des caractéristiques remarquables du plasma froid est qu'il ne laisse aucun résidu toxique. Une fois l'alimentation coupée, les espèces réactives redeviennent rapidement de l'oxygène, éliminant ainsi le besoin d'une phase de désorption [16][18].Il est également économe en énergie, nécessitant seulement une prise électrique standard au lieu de sources de chaleur à base de combustibles fossiles [15][16]. Par exemple, des études montrent que le plasma froid peut atteindre une >réduction de 5 log de Bacillus cereus spores en 25 minutes à une puissance de 300W [15].
Cependant, la technologie n'est pas sans ses limites. Ses effets de stérilisation sont principalement superficiels, ce qui signifie qu'elle a du mal à pénétrer des géométries complexes où les microbes peuvent se cacher dans des fissures ou des rainures [15][16]. Une teneur élevée en protéines ou en matières grasses dans les environnements de bioréacteurs peut également protéger les microbes en capturant les espèces réactives, réduisant ainsi l'efficacité de la stérilisation [15][18].
| Caractéristique | Plasma Froid |
|---|---|
| Avantages | Non thermique, non toxique, économe en énergie, sans résidus, rapide [16] |
| Limites | Pénétration limitée, efficacité réduite dans les géométries complexes [15][16] |
Systèmes de Détection Automatisée Basés sur l'Image
En ajoutant au mélange, les systèmes d'imagerie automatisés fournissent un outil puissant pour la détection en temps réel de la contamination. Ces systèmes offrent des informations morphologiques détaillées sur la croissance cellulaire, ce qui est crucial pour repérer les schémas de contamination au fur et à mesure qu'ils se produisent [19].Contrairement à la microscopie traditionnelle hors ligne - qui nécessite un échantillonnage et une coloration manuels - l'imagerie automatisée s'intègre parfaitement dans les configurations de surveillance en ligne ou à la ligne. Cela permet aux opérateurs de surveiller la biomasse et la santé cellulaire sans compromettre la stérilité [19].
En réduisant les interventions manuelles, ces systèmes diminuent les erreurs humaines et améliorent la reproductibilité des processus de culture [19]. Les algorithmes avancés de traitement d'image peuvent suivre l'avancement de la fermentation, optimiser la production de métabolites et assurer la cohérence - un facteur critique lors de la mise à l'échelle des bioprocédés [19].
"La disponibilité de techniques d'échantillonnage avancées couplées à des outils de mesure automatisés...peut considérablement réduire le temps nécessaire pour la sélection des souches, le développement des procédés et le contrôle des procédés en diminuant le nombre d'étapes dans le processus de production/culture, en particulier les étapes manuelles, et en réduisant la propagation des erreurs." - A.C. Veloso et E.C. Ferreira, Université du Minho [19]
Malgré leurs avantages, l'intégration de ces systèmes n'est pas toujours simple. Les cultures cellulaires sont complexes, les matières premières varient, et les capteurs doivent résister à des méthodes de stérilisation sévères comme la vapeur ou l'irradiation gamma [19]. Pour les entreprises cherchant à adopter ces technologies, des plateformes comme
Conclusion
Assurer la stérilité des bioréacteurs dans la production de viande cultivée n'est pas une mince affaire, mais une stratégie intégrée de test de stérilité peut la rendre réalisable.Cette stratégie combine des méthodes traditionnelles, telles que la filtration sur membrane pour les volumes d'échantillons plus importants et l'inoculation directe pour les plus petits, avec des outils moléculaires modernes tels que la PCR et la qPCR pour un dépistage rapide des pathogènes. De plus, la surveillance environnementale - par échantillonnage de l'air et prélèvement de surface - ajoute une protection supplémentaire, en abordant les risques de contamination dans les systèmes HVAC, détectant une contamination potentielle avant qu'elle ne puisse affecter les cuves de production [11].
Le choix de l'approche de test dépend de facteurs tels que la taille de l'échantillon, la présence de substances pouvant interférer avec les résultats, et si l'accent est mis sur la validation complète de la stérilité ou simplement sur la surveillance de la charge microbienne. L'échantillonnage à partir de plusieurs points dans le bioréacteur - haut, milieu et bas - aide à créer un profil microbien complet et réduit le risque de manquer une contamination localisée [1].Cela est particulièrement critique étant donné que les risques de contamination dans la production de viande cultivée sont nettement plus élevés que dans la fabrication biopharmaceutique, soulignant la nécessité de protocoles de stérilité rigoureux [6].
La clé pour maintenir la stérilité des milieux dans les bioréacteurs est de se procurer le bon équipement. Des outils tels que les systèmes d'échantillonnage aseptique avec septa pré-stérilisés et les filtres HEPA capables de capturer 99,97 % des particules de plus de 0,3 μm sont essentiels [4]. Des plateformes telles que
À mesure que l'industrie se développe, les approches hybrides de stérilité deviennent de plus en plus importantes.L'application de contrôles de qualité pharmaceutique lors des premières étapes de la culture des semences, tout en adoptant des normes de qualité alimentaire pour la production à grande échelle, trouve un équilibre entre sécurité et rentabilité [5] [6]. Ces mesures intégrées seront la pierre angulaire d'une production de viande cultivée sûre et efficace à mesure que le domaine continue de progresser.
FAQs
Quelles sont les principales causes de contamination dans les systèmes de bioréacteurs utilisés pour la production de viande cultivée ?
La contamination dans les systèmes de bioréacteurs se produit lorsque l'environnement stérile est perturbé ou lorsque les milieux riches en nutriments offrent un cadre idéal pour la prolifération des microbes. Cela peut être causé par plusieurs facteurs, tels que des brèches lors de l'échantillonnage, de la maintenance ou de la récolte des cellules ; des filtres à gaz endommagés ou obstrués ; une contamination déjà présente dans le milieu de croissance ; ou des ouvertures temporaires créées lors de l'installation ou de l'entretien des capteurs.En plus de cela, l'équipement usé peut libérer des particules de microplastique, qui peuvent servir de foyer pour les micro-organismes.
Dans la production de viande cultivée, même la plus petite contamination peut compromettre à la fois la sécurité et le rendement d'un lot. Pour réduire ces risques, il est crucial d'investir dans des équipements de haute qualité tels que des filtres stériles, des bioréacteurs et des kits de capteurs qui respectent des normes aseptiques strictes. Des plateformes comme
Comment l'intelligence artificielle améliore-t-elle les tests de stérilité dans les bioréacteurs?
Les systèmes alimentés par l'IA transforment les tests de stérilité dans les bioréacteurs de viande cultivée en offrant des informations en temps réel grâce à une surveillance continue.Utilisant des biocapteurs avancés, ces systèmes suivent des facteurs critiques tels que pH, oxygène dissous, et des métabolites essentiels comme le glucose et les acides aminés. Tout cela se fait sans besoin de vérifications manuelles, ce qui réduit considérablement le risque de contamination.
Ce qui distingue ces systèmes, c'est leur capacité à analyser les données en utilisant des algorithmes qui comparent les relevés aux normes de stérilité établies. Cela signifie qu'ils peuvent détecter même les plus petits signes de croissance microbienne bien plus tôt que les méthodes traditionnelles. Au-delà de la simple détection, l'analyse prédictive entre en jeu, identifiant les risques potentiels tels que des problèmes lors de l'installation des capteurs ou l'entrée par les ports. Ces systèmes suggèrent même des mesures correctives pour aider les producteurs à éviter des pertes de lots coûteuses.
La microscopie alimentée par l'IA ajoute une autre couche d'efficacité en distinguant instantanément entre les cellules saines et les contaminants, accélérant les processus de vérification de la stérilité. Pour les producteurs, des plateformes comme
Quels défis limitent l'utilisation de la stérilisation par plasma froid dans les bioréacteurs pour la production de viande cultivée ?
La stérilisation par plasma froid est efficace pour neutraliser les microbes, mais elle présente un ensemble de défis lorsqu'elle est appliquée aux bioréacteurs dans la production de viande cultivée. Un problème majeur est la profondeur de pénétration limitée des espèces réactives produites par le plasma. Cela rend difficile la stérilisation complète de grands volumes ou de milieux densément emballés. De plus, obtenir une couverture uniforme du plasma sur l'ensemble d'un réacteur devient de plus en plus difficile à mesure que la taille du système augmente.
Le passage des systèmes de plasma froid des environnements de laboratoire aux bioréacteurs à l'échelle commerciale introduit des obstacles supplémentaires. Les réacteurs plus grands exigent des rapports puissance-volume plus élevés, ce qui peut entraîner des temps de stérilisation peu pratiques. De nombreux systèmes de plasma froid fonctionnent également sous vide ou dépendent de gaz réactifs, ajoutant des couches de complexité en termes de sécurité, de conformité réglementaire et de conception d'équipement. Ces facteurs rendent la méthode moins idéale pour les bioréacteurs à grande échelle généralement requis dans la production commerciale de viande cultivée.
Un autre problème est le potentiel de dommages causés par les espèces réactives de l'oxygène et de l'azote (RONS), qui sont essentielles pour l'inactivation microbienne. Ces espèces réactives peuvent nuire aux cellules mammifères sensibles ou dégrader les composants du milieu, nécessitant une optimisation minutieuse pour maintenir la viabilité cellulaire. En conséquence, le plasma froid est souvent utilisé en combinaison avec d'autres techniques de stérilisation plutôt que comme une solution autonome.











