Krioprezerwacja to proces mrożenia i przechowywania żywych komórek w ultra-niskich temperaturach, aby zachować ich żywotność w czasie. Metoda ta jest kluczowa dla produkcji mięsa hodowanego, zapewniając spójne, stabilne linie komórkowe i chroniąc przed stratami spowodowanymi zanieczyszczeniem lub awarią sprzętu. Kluczowe kroki obejmują:
- Przygotowanie: Zbieraj komórki w trakcie ich fazy wzrostu, sprawdź żywotność (dąż do ≥90%), a następnie przygotuj je w mediach mrożących z krioprotektantami, takimi jak DMSO lub glicerol.
- Mrożenie: Użyj kontrolowanej szybkości chłodzenia (-1°C do -3°C na minutę), aby zapobiec uszkodzeniom kryształów lodu. Przechowuj komórki w parze azotu ciekłego (-135°C do -190°C) w celu długoterminowej konserwacji.
- Odmrażanie: Szybko odmrażaj komórki w kąpieli wodnej o temperaturze 37°C, aby zminimalizować toksyczność krioprotektantów, a następnie przenieś je do mediów wzrostowych w celu regeneracji.
- Kontrola Jakości: Dokładnie etykietuj fiolki, monitoruj warunki przechowywania i testuj żywotność po rozmrożeniu, aby zapewnić skuteczną konserwację.
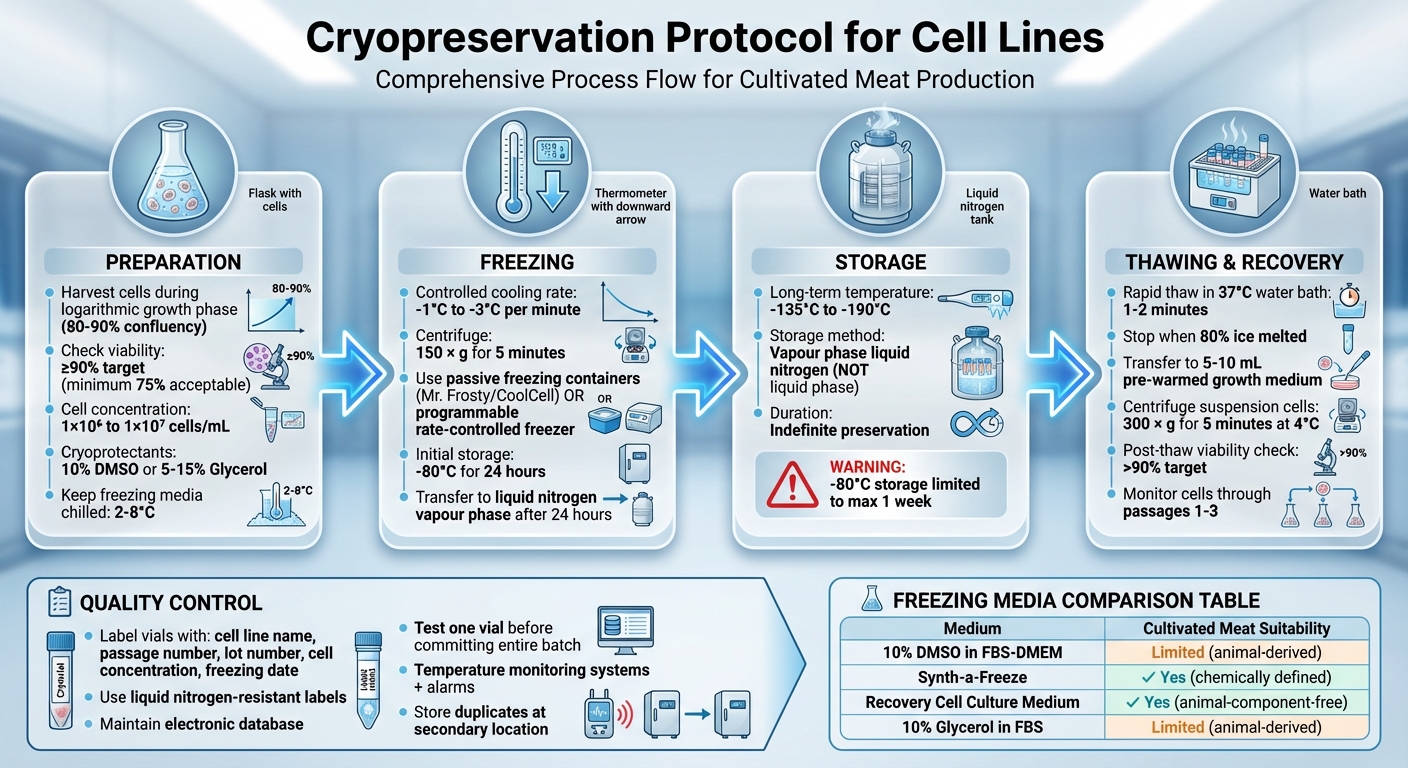
Kompletny protokół kriokonserwacji dla linii komórkowych: 4-etapowy proces od przygotowania do przechowywania
Przygotowanie komórek do kriokonserwacji
Zbiory komórek i kontrole żywotności
Aby zapewnić najlepszą regenerację po rozmrożeniu, zbieraj komórki w ich fazie wzrostu logarytmicznego (log). Dla linii komórkowych adherentnych zazwyczaj dzieje się to, gdy osiągną 80–90% konfluencji [2][3][6].
Sprawdź żywotność komórek za pomocą metody wykluczania błękitu Trypanu. Wymieszaj równe części (1:1) 0,4% błękitu Trypanu z zawiesiną komórkową, a następnie policz komórki za pomocą hemocytometru.Komórki żywe będą wykluczać barwnik i będą wyglądać jasno pod mikroskopem, podczas gdy komórki martwe będą barwić się na niebiesko [4]. Idealnie, dąż do co najmniej 90% żywotności dla najlepszych wskaźników odzysku, chociaż niektóre protokoły mogą akceptować minimum 75% [1][2][3][5].
Przed zbiorami, użyj mikroskopu, aby sprawdzić obecność zanieczyszczeń bakteryjnych lub grzybiczych. Zdrowe komórki w zawiesinie powinny wyglądać jasno, okrągło i mieć właściwości refrakcyjne pod odwróconym mikroskopem kontrastowym fazowym [2][3].
Gdy komórki spełnią wymagane standardy żywotności, przejdź do kroków przed zamrażaniem.
Przygotowania do mrożenia
Dla komórek adherentnych, użyj łagodnych metod dysocjacji, takich jak trypsyna lub TrypLE Express, i ogranicz czas inkubacji, aby uniknąć uszkodzenia błon komórkowych [5]. Przygotuj komórki w stężeniu od 1 × 10⁶ do 1 × 10⁷ komórek/mL, w zależności od linii komórkowej [1][6]. Podczas alikowania, upewnij się, że zawiesina komórkowa jest często mieszana, aby utrzymać jednolite rozmieszczenie w fiolkach kriogenicznych [5].
Utrzymuj medium mrożące w chłodnym stanie w temperaturze między 2°C a 8°C podczas resuspenzji, aby zredukować toksyczność krioprotektora przed rozpoczęciem procesu mrożenia [5]. Gdy komórki są zawieszone w medium mrożącym, szybko przejdź do protokołu mrożenia [1].Zawsze krioprezerwuj komórki przy najniższej możliwej liczbie passage, aby zredukować ryzyko dryfu genetycznego lub zmian morfologicznych [5][7].
Wybór krioprotektantów i mediów do mrożenia
Opcje krioprotektantów i ich funkcje
Dimetylosulfotlenek (DMSO) jest powszechnie stosowany jako krioprotektant, zazwyczaj w stężeniu 10% [2]. Działa poprzez przenikanie przez błony komórkowe i redukcję tworzenia lodu podczas mrożenia. Jednak DMSO może być toksyczny dla komórek w temperaturze pokojowej, dlatego szybkie rozmrażanie jest niezbędne, aby zminimalizować ekspozycję i szybko go rozcieńczyć [1].
Glicerol jest użyteczną alternatywą dla linii komórkowych wrażliwych na DMSO, zazwyczaj stosowany w stężeniach od 5% do 15% [8].Jest szczególnie skuteczny dla typów komórek, w których DMSO może powodować niepożądaną różnicowanie [3], a jego toksyczność jest zazwyczaj niższa w porównaniu do DMSO.
W zastosowaniach związanych z hodowlą mięsa, tradycyjne protokoły mrożenia często wykorzystują mieszankę 90% surowicy płodowej cieląt (FBS) i 10% DMSO [1]. Jednak poleganie na składnikach pochodzenia zwierzęcego ogranicza te metody pod względem skalowalności i zatwierdzenia regulacyjnego [9]. Aby rozwiązać te problemy, chemicznie zdefiniowane media - takie jak Synth-a-Freeze lub Recovery Cell Culture Medium - oferują alternatywę wolną od składników pochodzenia zwierzęcego. Te media utrzymują wysoką żywotność komórek po rozmrożeniu, jednocześnie pokonując wyzwania związane ze składnikami pochodzenia zwierzęcego [9].
Porównanie mediów do mrożenia
Oto zestawienie zalet i ograniczeń różnych mediów do mrożenia stosowanych w produkcji mięsa hodowanego:
| Medium | Zalety | Wady | Odpowiedniość do mięsa hodowanego |
|---|---|---|---|
| 10% DMSO w FBS-DMEM | Ustalone protokoły [1] | Zawiera składniki pochodzenia zwierzęcego; zmienność partii [9] | Ograniczona skalowalność |
| Synth-a-Freeze | Chemicznie zdefiniowane; stała jakość; wolne od składników zwierzęcych [9] | Wyższy koszt początkowy [9] | Tak |
| Medium do hodowli komórek po regeneracji | Łatwy w użyciu; zaprojektowany do szybkiej regeneracji [9] | Może wymagać optymalizacji dla specyficznych linii komórkowych | Tak |
| 10% Glicerol w FBS | Alternatywa dla komórek wrażliwych na DMSO [1] | Opiera się na surowicy pochodzenia zwierzęcego [9] | Ograniczona skalowalność |
W lutym 2023 roku badacze z Tokijskiego Uniwersytetu Medycznego dla Kobiet, pod kierownictwem Hironobu Takahashiego, wykazali znaczenie wyboru odpowiedniego medium do mrożenia.Używając opcji komercyjnych, takich jak CELLBANKER 1 i 2, skutecznie krioprezerwowane były pierwotne komórki myogeniczne bydła w temperaturze –80°C przez okres do roku. Co niezwykłe, komórki te zachowały zdolność do proliferacji i różnicowania się w kurczliwe tkanki mięśniowe z nienaruszonymi strukturami sarkomerów po rozmrożeniu [10].
Dla produkcji mięsa hodowanego, coraz częściej preferowane są media chemicznie zdefiniowane i zgodne z GMP. Jak podkreśla STEMCELL Technologies:
W ściśle regulowanych dziedzinach, takich jak terapia komórkowa i genowa, zaleca się stosowanie mediów krioprezerwacyjnych wytwarzanych zgodnie z GMP, w pełni zdefiniowanych, aby zapewnić, że produkty są konsekwentnie produkowane i kontrolowane zgodnie z normami jakości [9].
Platformy takie jak
Procedura krioprezerwacji i tempo chłodzenia
Protokół mrożenia krok po kroku
Kluczem do udanej krioprezerwacji jest utrzymanie stałego tempa chłodzenia wynoszącego -1°C do -3°C na minutę[2]. Ten stopniowy proces pozwala wodzie powoli opuszczać komórki, zapobiegając powstawaniu szkodliwych kryształów lodu wewnątrzkomórkowego, które mogłyby uszkodzić błony komórkowe[1].
Rozpocznij od wirowania komórek przy 150 x g przez 5 minut[3]. Po wirowaniu, zawiesić osad komórkowy w zimnym medium do mrożenia zawierającym 10% DMSO w stężeniu 2–4×10⁶ komórek/mL[3].Aby zredukować ekspozycję na DMSO, szybko przejdź do następnego kroku - mrożenia.
Rozdziel zawiesinę komórkową do wstępnie oznakowanych fiolkach kriogenicznych. Każda fiolka powinna wyraźnie wskazywać istotne szczegóły, takie jak nazwa linii komórkowej, numer pasażu, numer partii, stężenie komórek oraz datę mrożenia[3]. Gdy fiolki są przygotowane, czas wybrać i wykorzystać odpowiedni sprzęt chłodniczy.
Sprzęt i techniki chłodzenia
Umieść fiolki natychmiast w urządzeniu do kontrolowanego chłodzenia. Pasywne pojemniki do mrożenia, takie jak Nalgene "Mr Frosty" (który używa izopropanolu) lub Corning "CoolCell", są popularnymi wyborami. Te narzędzia mogą osiągnąć tempo chłodzenia wynoszące około 1°C na minutę, gdy są umieszczone w zamrażarce -80°C[2].
Dla operacji na większą skalę, gdzie spójność jest kluczowa, programowalna zamrażarka z kontrolą tempa to najlepsza opcja. Jak stwierdza Sigma-Aldrich:
ECACC rutynowo korzysta z programowalnej zamrażarki z kontrolą tempa. To najbardziej niezawodny i powtarzalny sposób na zamrażanie komórek[3].
Po około 24 godzinach w -80°C, przenieś fiolki do fazy parowej ciekłego azotu, gdzie temperatury wahają się między -135°C a -190°C, do długoterminowego przechowywania[4]. Unikaj przechowywania komórek w -80°C dłużej niż przez tydzień, ponieważ może to wpłynąć na ich żywotność. Temperatura poniżej -135°C jest niezbędna do nieograniczonego przechowywania[2]. Użycie fazy parowej zamiast fazy ciekłej zmniejsza ryzyko krzyżowego zanieczyszczenia, jednocześnie utrzymując wystarczająco niskie temperatury.
Protokół rozmrażania i regeneracji
Proces rozmrażania
Szybkie rozmrażanie komórek jest kluczowe, aby ograniczyć ekspozycję na toksyczne środki cryoprotekcyjne i zapobiec uszkodzeniom spowodowanym przez kryształy lodu. Upewnij się, że nosisz osłonę na twarz i rękawice izolacyjne dla bezpieczeństwa. Zacznij od usunięcia fiolki z ciekłego azotu i lekko poluzuj zakrętkę, aby uwolnić nagromadzone ciśnienie. Następnie ponownie dokręć zakrętkę.
Umieść fiolkę w kąpieli wodnej o temperaturze 37°C, upewniając się, że zakrętka pozostaje powyżej linii wody. Pozwól jej rozmrażać się przez 1–2 minuty, lub do momentu, gdy pozostanie tylko kilka kryształów lodu. Po rozmrożeniu, przetrzyj zewnętrzną stronę fiolki 70% alkoholem, aby zachować jałowość.
Przenieś zawartość fiolki do rurki zawierającej 5–10 mL podgrzanego podłoża hodowlanego. Dodawaj podłoże powoli, aby pomóc zredukować szok osmotyczny. Jeśli pracujesz z liniami komórkowymi w zawiesinie, natychmiast odwirować zawiesinę komórkową przy 300 × g przez 5 minut w 4°C.Ten krok pomaga w pelletowaniu komórek i usunięciu krioprotektantu. Po wirowaniu, zawiesić komórki w świeżym medium. W przypadku komórek adherentnych, wirowanie jest zazwyczaj niepotrzebne. Zamiast tego, bezpośrednio zasiej komórki do odpowiedniego naczynia hodowlanego i usuń wszelkie pozostałości DMSO podczas pierwszej zmiany medium, zazwyczaj po 24 godzinach.
Oceny po rozmrożeniu
Bezpośrednio po rozmrożeniu, sprawdź żywotność komórek, aby upewnić się, że regeneracja była udana. Użyj metody wykluczania Trypan Blue do tej oceny. Idealnie, żywotność komórek powinna przekraczać 90% [11], ale minimalnie 75% jest akceptowalne. Po 24 godzinach, zbadaj komórki pod mikroskopem kontrastowym, aby potwierdzić przyleganie, ocenić gęstość komórek i sprawdzić wszelkie oznaki kontaminacji.
Kontynuuj monitorowanie komórek przez passage 1–3, aby zapewnić normalną proliferację i że zachowują swoje oczekiwane cechy.Dla linii komórkowych, które regenerują się wolniej, można poprawić przeżywalność, zwiększając początkowe stężenie surowicy płodowej cieląt do około 20% v/v.
sbb-itb-ffee270
Warunki przechowywania i długoterminowa żywotność
Warunki i czas przechowywania
Aby utrzymać żywotność linii komórkowych w dłuższym okresie, niezbędne jest przechowywanie ich w temperaturach poniżej -135°C [7][2]. Zapewnia to ich nieograniczone zachowanie.Preferowaną metodą przechowywania linii komórkowych mięsa hodowanego jest ciekły azot w fazie parowej. Technika ta utrzymuje temperatury między -135°C a -190°C, co czyni ją idealną do długoterminowego przechowywania, oferując jednocześnie zwiększone bezpieczeństwo w porównaniu do przechowywania w fazie ciekłej.
Jeśli musisz przechowywać komórki w -80°C, ogranicz to do okresu od 24 godzin do jednego tygodnia. Po tym czasie żywotność komórek może się zmniejszyć.Aby tymczasowo przechować komórki w tej temperaturze, jak najszybciej przenieś je do przechowywania w ciekłym azocie.
Użyj standardowych sterylnych fiolek kriogenicznych (1–2 mL) z wewnętrznym gwintem i uszczelką O-ring dla bezpiecznego przechowywania [4][5]. Zawsze umieszczaj zamknięte fiolki kriogeniczne w fazie gazowej, a nie w fazie ciekłej azotu, aby zredukować ryzyko eksplozji fiolek podczas rozmrażania [5]. Dodatkowo, upewnij się, że zbiorniki z ciekłym azotem są utrzymywane przynajmniej w połowie pełne, aby zachować bufor bezpieczeństwa.
Wreszcie, rygorystyczne środki kontroli jakości są kluczowe dla zapewnienia długoterminowej żywotności komórek.
Kontrole Jakości
Aby zapewnić niezawodność przechowywanych linii komórkowych, stosuj ścisłe protokoły kontroli jakości. Rozpocznij od dokładnego oznakowania każdej fiolki etykietami odpornymi na ciekły azot.Zawiera istotne szczegóły, takie jak tożsamość linii komórkowej, numer partii, numer przejścia i data zamrażania. Utrzymuj elektroniczną bazę danych, aby zarejestrować dokładną lokalizację każdego fiolki, co skraca czas, w którym pojemniki do przechowywania muszą pozostawać otwarte [7][2].
Przed przekazaniem całych partii do długoterminowego przechowywania, przetestuj żywotność jednej fiolki po krótkoterminowym przechowywaniu w fazie gazowej. Ten krok pomaga potwierdzić, że proces zamrażania był udany i identyfikuje wszelkie potencjalne problemy [4][7][2]. Dla bardzo cennych zapasów komórkowych, rozsądnie jest przechowywać duplikaty w drugiej lokalizacji, aby zabezpieczyć się przed awariami sprzętu lub lokalnymi katastrofami [7][2].
Wyposaż wszystkie zbiorniki magazynowe w systemy monitorowania temperatury i alarmy do wykrywania niskiego poziomu ciekłego azotu [7]. Dodatkowo zainstaluj alarmy tlenowe w obszarach magazynowych, ustawione na uruchomienie przy 18% tlenu (v/v), aby zminimalizować ryzyko asfiksji dla personelu pracującego z ciekłym azotem [7][2].
Protokół wideo krioprezerwacji linii komórkowych ssaków
Podsumowanie i kluczowe wnioski
Oto szybkie podsumowanie kluczowych kroków i zaleceń dotyczących skutecznej krioprezerwacji w produkcji mięsa hodowanego:
- Zbieranie komórek: Zbieraj komórki w ich fazie wzrostu logarytmicznego, zapewniając, że ich żywotność przekracza 90%. Użyj 10% DMSO jako krioprotektantu, chociaż glicerol może być alternatywą dla bardziej delikatnych linii komórkowych [11][1].
- Chłodzenie i przechowywanie: Utrzymuj kontrolowaną szybkość chłodzenia i szybko przenieś fiolki do przechowywania w ciekłym azocie w fazie parowej, aby zabezpieczyć integralność komórek [11]
Badanie przeprowadzone przez Rokę Kakehi i in. podkreśla znaczenie precyzji w krioprezerwacji [10]:
"Zapewnienie niezawodnego i spójnego źródła komórek poprzez krioprezerwację pozwoli nam zwiększyć stabilną podaż obiecujących komórek do produkcji mięsa hodowanego." - Roka Kakehi i in., Tokijska Wyższa Szkoła Medyczna
- Proces rozmrażania: Rozmrażaj komórki w kąpieli wodnej o temperaturze 37°C przez około dwie minuty, zatrzymując się, gdy 80% lodu się roztopi. To zmniejsza toksyczność DMSO i poprawia regenerację komórek [1]. Następnie przeprowadź kontrole żywotności po rozmrożeniu, aby zapewnić sukces i dostosować przyszłe procedury.
Te metody współpracują ze sobą w ramach ścisłych praktyk kontroli jakości. Zawsze dokładnie oznaczaj fiolki, utrzymuj zorganizowane zapisy i wprowadzaj dokładne kontrole przed długoterminowym przechowywaniem [11]. W przypadku specjalistycznych potrzeb dotyczących krioprezerwacji, platformy takie jak
Najczęściej zadawane pytania
Jakie są zalety stosowania mediów chemicznie zdefiniowanych do krioprezerwacji linii komórkowych w produkcji mięsa hodowanego?
Media chemicznie zdefiniowane przynoszą wiele korzyści w kontekście krioprezerwacji linii komórkowych do produkcji mięsa hodowanego. Usuwając nieokreślone składniki, takie jak surowica pochodzenia zwierzęcego, zapewniają spójne i przewidywalne wyniki - kluczowy czynnik dla utrzymania długoterminowej niezawodności linii komórkowych.
Inną kluczową zaletą jest zmniejszone ryzyko kontaminacji i zmienności. Wspiera to nie tylko wyższe standardy jakości i bezpieczeństwa, ale także idealnie wpisuje się w precyzję i skalowalność potrzebną do spełnienia zarówno wymagań regulacyjnych, jak i oczekiwań konsumentów w przemyśle mięsa hodowanego.
Jak wybór krioprotektantu wpływa na przeżywalność komórek podczas mrożenia i rozmrażania?
Wybór krioprotektantu jest kluczowym czynnikiem w zachowaniu zdrowia komórek podczas mrożenia i rozmrażania. Dwie powszechnie stosowane opcje to dimetylosulfotlenek (DMSO) oraz glicerol, z których każda ma swoje charakterystyczne cechy. DMSO jest znany ze swojej zdolności do szybkiego przenikania do komórek i zapewniania silnej ochrony. Jednak wiąże się to z pewnym zastrzeżeniem: w wysokich stężeniach lub przy długotrwałym narażeniu może stać się toksyczny, co potencjalnie obniża przeżywalność komórek.
Glicerol, w przeciwieństwie do tego, jest mniej toksyczny i można go stosować bezpośrednio.Jego wadą jest wolniejsza prędkość penetracji komórek, co może skutkować mniejszą natychmiastową ochroną w porównaniu do DMSO.
Osiągnięcie odpowiedniej równowagi jest kluczowe. Odpowiednie dostosowanie stężenia i czasu ekspozycji krioprotektantu pomaga chronić komórki, minimalizując ryzyko toksyczności. Dodatkowo, przestrzeganie najlepszych praktyk dotyczących szybkości chłodzenia i warunków przechowywania jest niezbędne, aby zapewnić jak najwyższe wskaźniki regeneracji po rozmrożeniu.
Dlaczego kontrola szybkości chłodzenia jest ważna podczas krioprezerwacji?
Utrzymanie stałej szybkości chłodzenia, zazwyczaj między –1°C a –3°C na minutę, jest kluczowe dla zachowania żywotności komórek. Stopniowe chłodzenie pozwala komórkom na odwodnienie w kontrolowanym tempie, co zmniejsza szansę na powstawanie szkodliwych kryształów lodu, które mogą rozerwać lub uszkodzić błony komórkowe.
To przemyślane podejście chroni strukturę komórek, zwiększając ich przeżywalność i funkcjonalność po rozmrożeniu.Przestrzeganie precyzyjnych protokołów chłodzenia jest niezbędne, aby zapewnić udane długoterminowe przechowywanie i odzyskiwanie linii komórkowych.











