Skalowanie bioreaktorów do produkcji mięsa hodowlanego jest skomplikowane, zwłaszcza przy zarządzaniu naprężeniem ścinającym, siłą mechaniczną, która może uszkodzić komórki ssaków podczas skalowania. W przeciwieństwie do komórek mikroorganizmów, komórki ssaków są delikatne i wrażliwe na siły turbulencji i napowietrzania. Gdy naprężenie ścinające przekracza 3 Pa, komórki mogą pękać, co zmniejsza ich żywotność i produktywność.
Aby sprostać tym wyzwaniom, inżynierowie polegają na Obliczeniowej Dynamice Płynów (CFD) i modelach skalowania w dół, aby przewidzieć i zarządzać naprężeniem ścinającym przed pełnoskalową produkcją. CFD analizuje wzorce przepływu, strefy ścinania i efektywność mieszania w bioreaktorach, podczas gdy modele skalowania w dół weryfikują te przewidywania eksperymentalnie, minimalizując ryzyko podczas skalowania.
Kluczowe Wnioski:
- Limity Naprężenia Ścinającego: Komórki ssaków tolerują do 3 Pa; przekroczenie tej wartości uszkadza komórki.
- Narzędzia CFD: Zaawansowane metody, takie jak symulacje dużych wirów (LES) i symulacje Lattice-Boltzmann (LB-LES), umożliwiają precyzyjne modelowanie przepływu i turbulencji.
- Modele zmniejszone: Te modele odtwarzają warunki dużych bioreaktorów w mniejszych układach, aby zweryfikować przewidywania CFD.
-
Rozważania projektowe:
- Używaj mieszadeł z łopatkami nachylonymi pod kątem dla mniejszego ścinania.
- Utrzymuj długości wirów Kolmogorowa powyżej 20 μm, aby zapobiec uszkodzeniom komórek.
- Utrzymuj prędkości końcówek mieszadeł poniżej 1,5 m/s.
Kombinując wnioski z CFD z eksperymentalną walidacją, zespoły mogą optymalizować projekty bioreaktorów do produkcji mięsa hodowlanego, zapewniając przeżywalność komórek i efektywne skalowanie.
CFD Compass | Najlepsze Praktyki dla CFD w Bioreaktorach
Wykorzystanie Obliczeniowej Dynamiki Płynów (CFD) do Modelowania Naprężeń Ścinających
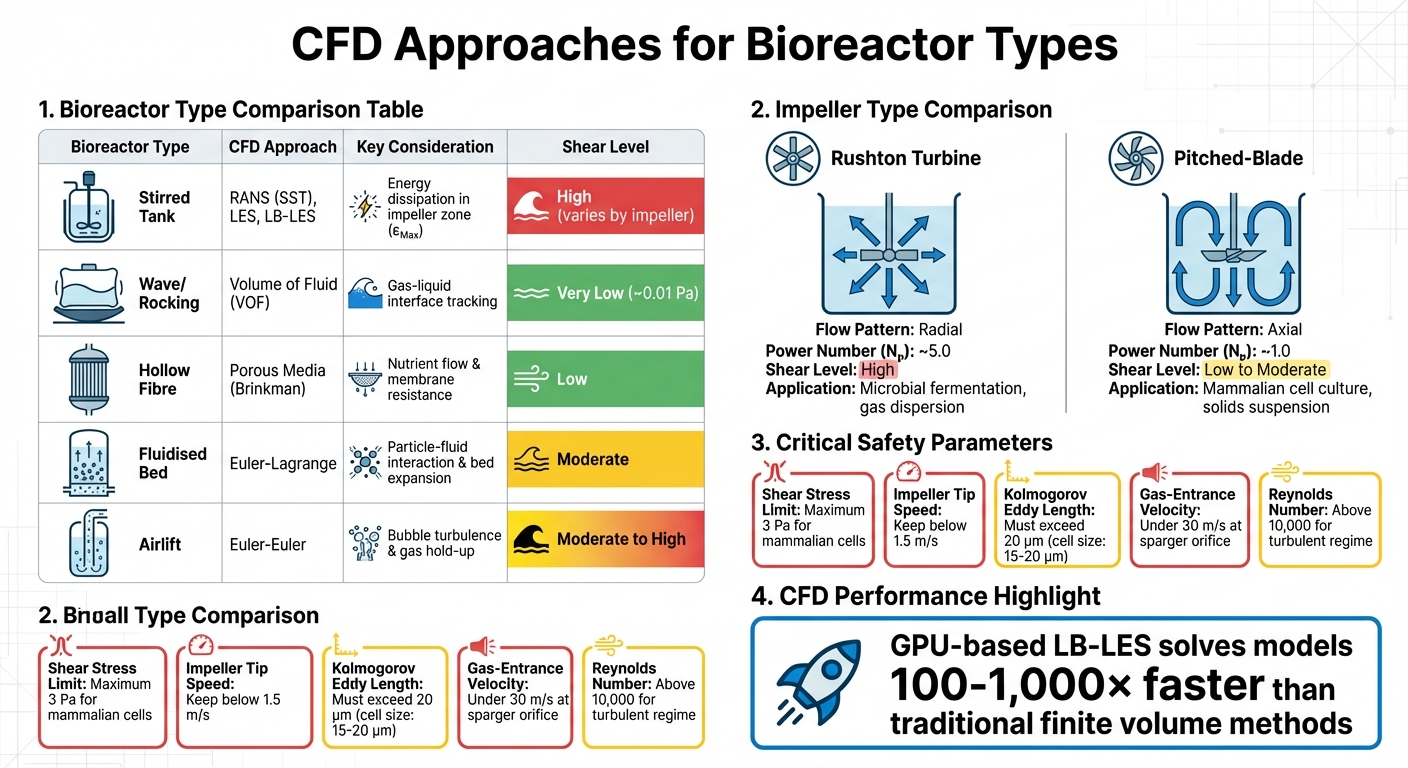
Metody CFD i Kluczowe Parametry dla Różnych Typów Bioreaktorów w Produkcji Mięsa Hodowlanego
Symulacje CFD dają inżynierom narzędzia do mapowania dynamiki płynów i sił ścinających w bioreaktorach, zanim zostaną one fizycznie zbudowane. Zamiast polegać na metodach prób i błędów w skali produkcyjnej, CFD pomaga przewidzieć kluczowe czynniki, takie jak strefy o wysokim ścinaniu, wiry turbulentne i żywotność komórek w określonych częściach naczynia. Jest to szczególnie ważne w produkcji mięsa hodowlanego, gdzie skale bioreaktorów mogą ostatecznie osiągnąć 200 000 litrów - znacznie większe niż tradycyjne naczynia biofarmaceutyczne [8]. Te przewidywalne spostrzeżenia kierują eksperymentami w mniejszej skali i wpływają na wybór sprzętu.
Ewolucja technik obliczeniowych była niezwykła. Podczas gdy modele Reynolds-Averaged Navier-Stokes (RANS), takie jak k-ε, pozostają szeroko stosowane w przemyśle, zaawansowane metody, takie jak symulacje Large Eddy (LES) i symulacje Lattice-Boltzmann zasilane przez GPU (LB-LES), przesuwają granice. Według profesora Miroslava Soosa z Uniwersytetu Chemii i Technologii w Pradze, LB-LES oparte na GPU mogą rozwiązywać modele „100 do 1 000 razy szybciej niż powszechnie stosowane solvery metod objętości skończonej” [2]. Ta przewaga prędkości pozwala inżynierom symulować ogromne naczynia z precyzją potrzebną do wykrywania wirów uszkadzających komórki.
Praktyczny przykład możliwości CFD pochodzi od badaczy z Regeneron Ireland DAC i Thermo Fisher Scientific. Z powodzeniem przeskalowali proces hodowli komórek z bioreaktora o pojemności 2000 litrów do geometrycznie innego bioreaktora jednorazowego o pojemności 5000 litrów.Zamiast polegać na empirycznych heurystykach, użyli CFD do analizy parametrów takich jak szybkości przenoszenia masy, czasy mieszania i szybkości ścinania. Takie podejście umożliwiło udane skalowanie już przy pierwszej próbie, unikając kosztownych niepowodzeń często związanych ze skalowaniem opartym na stosunku mocy do objętości [5].
Konfiguracja CFD dla bioreaktorów z mieszadłem mechanicznym
Aby skonfigurować CFD dla bioreaktorów z mieszadłem mechanicznym, zacznij od zdefiniowania geometrii naczynia - obejmuje to wymiary zbiornika, projekt wirnika (e.g., Rushton lub łopatki skośne) i rozmieszczenie przegrody. Wybór odpowiedniego modelu turbulencji jest kluczowy: model realizowalny k-ε dobrze sprawdza się w systemach gaz-ciecz, podczas gdy LB-LES oferuje wyższą rozdzielczość do identyfikacji szczytowych naprężeń, które mogą zaszkodzić komórkom. Badanie zbieżności siatki zapewnia, że wyniki nie zależą od rozmiaru siatki.
Warunki brzegowe muszą odzwierciedlać rzeczywiste parametry operacyjne, takie jak prędkość wirnika, szybkość napowietrzania gazem, gęstość płynu i lepkość. W zastosowaniach związanych z hodowanym mięsem często stosuje się konserwatywne modele oporu pęcherzyków do oszacowania naprężeń ścinających [8]. System powinien działać w pełni turbulentnym reżimie, z liczbami Reynoldsa przekraczającymi 10 000, aby zapewnić, że liczba mocy pozostaje stała niezależnie od prędkości wirnika [1].
Przewidywania CFD dotyczące transferu tlenu, czasów mieszania i naprężeń hydrodynamicznych powinny być zgodne z danymi eksperymentalnymi zebranymi za pomocą mikrosond wrażliwych na ścinanie lub agregatów nanocząsteczek [2]. Na przykład matematyczny model transferu masy kierował bezpośrednim skalowaniem procesu hodowli komórek CHO z 2-litrowej jednostki laboratoryjnej do 1500-litrowego przemysłowego bioreaktora w Sartorius.Korzystając z CFD do przewidywania zapotrzebowania na tlen i usuwania CO₂, zespół utrzymywał spójne atrybuty jakości produktu - takie jak N-glikany i warianty ładunku - w różnych skalach [6].
CFD dla innych typów bioreaktorów
Podczas gdy mieszane zbiorniki dominują w przemysłowej hodowli komórek, inne konstrukcje bioreaktorów wymagają dostosowanych podejść CFD. Na przykład, bioreaktory kołyszące się lub falowe opierają się na metodzie objętości płynu (VOF) do symulacji interfejsu gaz-ciecz, ponieważ ruch falowy napędza naprężenia ścinające w tych systemach. Te konstrukcje tworzą znacznie łagodniejsze środowiska ścinające - maksymalne naprężenie wynosi około 0,01 Pa w porównaniu do mieszanych zbiorników - ale ich skalowalność jest ograniczona dla produkcji mięsa hodowanego na dużą skalę [4].
Z drugiej strony, bioreaktory z włóknami pustymi wykorzystują modele mediów porowatych oparte na równaniach Brinkmana do symulacji dyfuzji składników odżywczych i oporu przepływu przez membrany.Systemy złoża fluidalnego wymagają modeli Euler-Lagrange do uchwycenia interakcji cząstek z cieczą i rozszerzania złoża, podczas gdy bioreaktory airlift wykorzystują metody Euler-Euler do analizy turbulencji wywołanej pęcherzykami i zatrzymania gazu [4]. Każdy projekt wiąże się z unikalnymi wyzwaniami: złoża fluidalne muszą równoważyć dystrybucję mikronośników z narażeniem na ścinanie, podczas gdy systemy airlift muszą zarządzać naprężeniami spowodowanymi pękającymi pęcherzykami, co jest główną przyczyną śmierci komórek w bioreaktorach z napowietrzaniem [1] [7].
Zrozumienie tych podejść CFD jest kluczowe dla kontrolowania naprężeń ścinających w różnych projektach bioreaktorów stosowanych w produkcji mięsa hodowlanego.
| Typ bioreaktora | Metoda CFD | Kluczowe zagadnienie |
|---|---|---|
| Zbiornik mieszany | RANS (SST), LES, LB-LES | Dysypacja energii w strefie wirnika (εMax) |
| Fala/Kołysanie | Objętość płynu (VOF) | Śledzenie interfejsu gaz-ciecz |
| Włókno puste | Media porowate (Brinkman) | Przepływ składników odżywczych i opór membrany |
| Złoże fluidalne | Euler-Lagrange | Interakcja między cząstkami a płynem, rozszerzenie złoża |
| Airlift | Euler-Euler | Turbulencja z bąbelków i zatrzymanie gazu |
Te zróżnicowane metody CFD podkreślają potrzebę dostosowanych strategii, które odgrywają kluczową rolę w doborze sprzętu i zarządzaniu naprężeniem ścinającym.
Modele zmniejszone i walidacja eksperymentalna
Chociaż obliczeniowa dynamika płynów (CFD) dostarcza cennych prognoz, nie może zastąpić potrzeby testów w rzeczywistych warunkach przy skalowaniu procesów. Walidacja eksperymentalna odgrywa kluczową rolę w zapewnieniu, że modele obliczeniowe dokładnie odzwierciedlają rzeczywiste warunki naprężeń ścinających. W tym miejscu wkraczają modele zmniejszone, które naśladują środowisko hydrodynamiczne dużych bioreaktorów produkcyjnych w mniejszych, łatwiejszych do zarządzania systemach. Dzięki temu zmniejszają ryzyko kosztownych błędów przy przechodzeniu z małej skali do operacji przemysłowych. Ten krok nie tylko potwierdza prognozy CFD, ale także zapewnia bardziej niezawodny i skuteczny proces skalowania.
Tworzenie modeli zmniejszonych
Projektowanie modelu zmniejszonego zaczyna się od zachowania podobieństwa geometrycznego.Oznacza to utrzymanie tych samych proporcji między kluczowymi komponentami, takimi jak wysokość naczynia do średnicy oraz średnica mieszadła do średnicy zbiornika [11]. Gdy geometria jest dopasowana, inżynierowie wybierają kryterium skalowania. Do powszechnych wyborów należą moc na jednostkę objętości (P/V), prędkość końcówki mieszadła lub wskaźnik rozpraszania energii (EDR). Jednak skupienie się na lokalnym EDR zamiast średniego P/V zapewnia lepsze zrozumienie heterogeniczności ścinania, co jest kluczowe dla dokładnego modelowania.
Bardziej zaawansowane podejście obejmuje symulatory wielokomorowe. Na przykład w lutym 2021 roku Emmanuel Anane i jego zespół opracowali symulator dwukomorowy łączący reaktor z mieszadłem (STR) i reaktor przepływowy (PFR). Model ten został użyty do badania, jak komórki CHO reagują na gradienty rozpuszczonego tlenu. Ich badania ujawniły krytyczny próg czasu przebywania wynoszący 90 sekund.Poza tym punktem, komórki CHO wykazały 15% spadek gęstości żywych komórek i wzrost akumulacji mleczanu [10]. To odkrycie stanowi wyraźny punkt odniesienia dla projektowania bioreaktorów przemysłowych, które utrzymują żywotność komórek.
Aby chronić wzrost komórek, inżynierowie często dążą do utrzymania prędkości końcówek mieszadeł poniżej 1,5 m/s [1]. Dodatkowo, długość mikroeddy Kolmogorova - miara turbulencji - powinna przekraczać rozmiar komórek, zazwyczaj 20 μm lub więcej dla komórek ssaków, aby uniknąć uszkodzeń hydrodynamicznych [1][3]. Na przykład, przy wkładzie energii 0,1 W/kg w hodowlach komórek zwierzęcych, najmniejsze wiry mają około 60 μm, co zapewnia bezpieczny margines [3].
Walidacja prognoz CFD poprzez eksperymenty
Gdy model w skali zmniejszonej jest gotowy, metody eksperymentalne są niezbędne do walidacji parametrów uzyskanych z CFD. Technika PIV (Particle Image Velocimetry) jest powszechnie stosowana w tym celu. Śledząc cząstki w płynie, PIV pomaga potwierdzić, czy wzorce przepływu i pola prędkości w modelu w skali zmniejszonej są zgodne z prognozami CFD [12][4].
Metody wtrysku znaczników i odbarwiania są również stosowane do walidacji czasów mieszania. W tym procesie znaczniki, takie jak kwasy, zasady lub roztwory soli, są wprowadzane w pobliżu wirnika, a ich dystrybucja jest monitorowana, aż do osiągnięcia 95% jednorodności [12][3]. Dla dużych bioreaktorów komórek ssaków (5 000 L do 20 000 L), czasy mieszania zazwyczaj wynoszą od 80 do 180 sekund [10].
W marcu 2020 roku James Scully i jego zespół w Regeneron Ireland DAC z powodzeniem przeskalowali proces hodowli komórek z bioreaktora o pojemności 2000 L do jednorazowego bioreaktora o pojemności 5000 L o innej geometrii. Polegali na CFD, aby przewidzieć kluczowe parametry, takie jak szybkości przenoszenia masy, czasy mieszania i szybkości ścinania. Te przewidywania zostały następnie zweryfikowane poprzez eksperymenty jednofazowe i wielofazowe, co umożliwiło udaną pierwszą próbę skalowania bez potrzeby przeprowadzania dużych prób pilotażowych [5].
"Symulacje CFD są coraz częściej wykorzystywane do uzupełniania klasycznych badań inżynierii procesowej w laboratorium o wyniki rozdzielcze przestrzennie i czasowo, a nawet do ich zastępowania, gdy badania laboratoryjne nie są możliwe." - Stefan Seidel, School of Life Sciences, ZHAW [12]
Dodatkowe techniki walidacji obejmują pomiar momentu obrotowego w celu potwierdzenia specyficznego wprowadzenia mocy (P/V) oraz bezwymiarowych liczb mocy przy określonych prędkościach mieszadła [12][3]. Wskaźniki transferu tlenu są weryfikowane za pomocą metod takich jak technika odgazowywania lub technika siarczynowa, które określają objętościowy współczynnik przenoszenia masy tlenu (kLa) [12][7]. Dla systemów wykorzystujących mikronośniki stosuje się metody tłumienia światła lub oparte na kamerach, aby znaleźć minimalną prędkość potrzebną do zawieszenia wszystkich cząstek, co zapewnia dokładność przewidywań CFD dotyczących rozkładu fazy stałej [12][4].
sbb-itb-ffee270
Czynniki Wpływające na Naprężenie Ścinające w Bioreaktorach
Aby chronić żywotność komórek podczas skalowania, zrozumienie fizycznych czynników wpływających na naprężenie ścinające jest kluczowe. Przewidywania za pomocą Obliczeniowej Dynamiki Płynów (CFD) i walidacje w mniejszej skali ujawniają, że kluczową rolę odgrywa wskaźnik rozpraszania energii (EDR). EDR mierzy, jak energia kinetyczna mieszadła przekształca się w ciepło, prowadząc do nierównomiernego rozkładu energii. Na przykład w mieszadłach z łopatkami ustawionymi pod kątem energia ma tendencję do koncentrowania się wokół mieszadła, tworząc strefy wysokiego naprężenia ścinającego, które mogą uszkodzić komórki, jeśli nie są odpowiednio zarządzane.
Projekt Mieszadła i Wkład Mocy
Rodzaj używanego mieszadła znacząco wpływa na wzorce przepływu i intensywność ścinania. Turbiny Rushtona, na przykład, generują przepływ radialny i wysokie naprężenie ścinające, co czyni je idealnymi do fermentacji mikrobiologicznej, ale mniej odpowiednimi dla wrażliwych na ścinanie komórek ssaczych.Z drugiej strony, mieszadła z łopatkami nachylonymi tworzą przepływ osiowy z mniejszym ścinaniem i lepszą wydajnością pompowania przy tym samym zużyciu energii. Dzięki temu są preferowanym wyborem do zastosowań takich jak produkcja mięsa hodowlanego, gdzie priorytetem jest żywotność komórek.
| Typ mieszadła | Wzór przepływu | Liczba mocy (Nₚ) | Poziom ścinania | Główne zastosowanie |
|---|---|---|---|---|
| Turbina Rushtona | Promieniowy | ~5.0 | Wysoki | Fermentacja mikrobiologiczna; dyspersja gazu[3] |
| Łopatki nachylone | Osiowy | ~1.0 | Niski do umiarkowanego | Hodowla komórek ssaków; zawiesina ciał stałych [3] |
Strategie skalowania często opierają się na utrzymaniu stałego wkładu mocy na jednostkę objętości (P/V). Jednak wraz ze wzrostem rozmiaru reaktora może to prowadzić do wyższych prędkości końcówek mieszadeł. Dla komórek ssaków prędkości końcówek powinny pozostawać poniżej 1,5 m/s, aby uniknąć problemów z wzrostem [1]. W reaktorach wielkoskalowych napowietrzanie może wprowadzać jeszcze większy stres hydrodynamiczny niż mieszadła, zwłaszcza w zbiornikach przekraczających 20 m³ [9]. Czynniki te są ściśle związane z turbulencją, co jest dalej omówione w dyskusji na temat skali Kołmogorowa.
Skala Kołmogorowa i modelowanie turbulencji
Skala Kołmogorowa (λ) definiuje rozmiar najmniejszych wirów turbulentnych, gdzie energia rozprasza się w postaci ciepła.Jeśli te wiry są mniejsze niż średnica komórki, uszkodzenia mechaniczne stają się problemem. Dla komórek ssaków, które zazwyczaj mają rozmiar 15–20 μm, długość wiru musi przekraczać 20 μm, aby uniknąć uszkodzeń [1][3]. Na przykład, przy wkładzie energii wynoszącym 0,1 W/kg, średnica wiru Kolmogorowa wynosi około 60 μm, co zapewnia bezpieczny margines [3].
"Jeśli biologiczne jednostki (e.g., komórki ssaków) są mniejsze niż λ [skala Kolmogorowa] w bioreaktorze, to uszkodzenia ścinające takich jednostek nie wystąpią." - Muhammad Arshad Chaudhry [3]
W sierpniu 2024 roku, badacze z Boehringer Ingelheim Pharma oraz Uniwersytetu Chemii i Technologii w Pradze wykorzystali symulacje Lattice-Boltzmann Large Eddy (LB-LES) do walidacji prognoz CFD w przemysłowym bioreaktorze o pojemności 12 500 L.Korzystając z agregatów nanocząsteczek wrażliwych na ścinanie, zmierzono maksymalne naprężenie hydrodynamiczne i wykazano, że LB-LES może rozwiązywać skale turbulentne 100–1,000 razy szybciej niż tradycyjne metody [2]. Te odkrycia są kluczowe w opracowywaniu strategii minimalizujących naprężenie ścinające.
Redukcja naprężenia ścinającego za pomocą danych modelowania
Modelowanie CFD umożliwia inżynierom zidentyfikowanie stref o wysokim naprężeniu ścinającym i odpowiednie dostosowanie warunków operacyjnych. Jednym z efektywnych podejść jest wprowadzenie substratów, baz pH lub środków przeciwpieniących w pobliżu strefy wirnika, a nie na powierzchni cieczy. Zapewnia to szybkie rozprowadzenie i minimalizuje lokalne gradienty stężenia [3]. W produkcji mięsa hodowlanego nadmierne ścinanie może odrywać komórki od mikronośników, podczas gdy niewystarczające mieszanie prowadzi do osadzania się mikronośników i nierównowagi składników odżywczych [9].
Dodatki ochronne, takie jak Pluronic F-68 (Poloxamer 188), są powszechnie stosowane do ochrony komórek przed siłami ścinającymi, szczególnie tymi spowodowanymi pękaniem bąbelków na powierzchni cieczy - głównym czynnikiem przyczyniającym się do śmierci komórek w bioreaktorach [1]. Dzięki tym surfaktantom zgłaszano, że nakłady energii sięgające 100 000 W/m³ nie mają śmiertelnych skutków [1]. Dodatkowo, utrzymanie prędkości wejścia gazu w otworze dyfuzora poniżej 30 m/s pomaga zmniejszyć straty produktywności i śmiertelność komórek [1].
Znajdowanie sprzętu do skalowania bioreaktorów
Jak Cellbase wspiera zakup bioreaktorów
Skalowanie bioreaktorów do produkcji mięsa hodowlanego wiąże się z własnym zestawem wyzwań. W tym miejscu wkracza
Korzystając z
Skuteczne skalowanie bioreaktorów stosowanych w przemyśle biofarmaceutycznym odgrywa dużą rolę w jakości i czasie wprowadzenia tych produktów na rynek [5].
Dzięki wykorzystaniu danych wspieranych przez CFD, zespoły mogą usprawnić wybór sprzętu i zminimalizować potrzebę powtarzania prób [5]. Te spostrzeżenia są kluczowe przy wyborze bioreaktorów zaprojektowanych z myślą o optymalnym zarządzaniu naprężeniem ścinającym.
Wybór sprzętu do kontroli naprężenia ścinającego
Aby skutecznie kontrolować naprężenie ścinające, szczególnie ważne są określone specyfikacje sprzętu. Geometria wirnika jest kluczowym czynnikiem. Na przykład, wirniki z łopatkami ustawionymi pod kątem generują przepływ osiowy z liczbą mocy (Np) około 1,0, podczas gdy turbiny Rushtona mają znacznie wyższe Np, około 5,0.Oznacza to, że konstrukcje z łopatkami skośnymi wytwarzają znacznie mniej mocy, a tym samym mniej ścinania przy tej samej prędkości obrotowej [3]. W przypadku zastosowań z komórkami ssaczymi używanymi w mięsie hodowlanym, utrzymanie prędkości końcówki wirnika poniżej 1,5 m/s jest niezbędne, aby uniknąć uszkodzenia komórek [1].
Konfiguracja spargera to kolejna kluczowa kwestia. Aby zapobiec nadmiernemu ścinaniu, sprzęt powinien zapewniać, że prędkość wejścia gazu w otworze spargera pozostaje poniżej 30 m/s, a liczba Reynoldsa otworu nie przekracza 2000. Przekroczenie tych progów może prowadzić do "reżimu strumieniowego", gdzie bąbelki rozpraszają się nierównomiernie i tworzą lokalne strefy ścinania [1]. Spargery z otworami wierconymi lub otwartymi rurami są lepiej dostosowane do komórek wrażliwych na ścinanie w porównaniu do mikrospargerów. Dodatkowo, sprzęt powinien wspierać kompatybilność z mniejszymi skalami. Dostawcy oferujący modele stołowe (e.g., 3 L systemy) które są geometrycznie podobne do systemów na dużą skalę (2,000 L lub więcej) pozwalają zespołom na weryfikację przewidywań CFD w mniejszej skali przed przejściem do produkcji na pełną skalę [1][2].
Wniosek
Skalowanie bioreaktorów do produkcji mięsa hodowlanego wymaga odejścia od tradycyjnych metod prób i błędów i przyjęcia strategii opartych na modelach, aby rozwiązać lokalne różnice w ścinaniu. Obliczeniowa dynamika płynów (CFD) stała się kluczowym narzędziem w tym procesie, pozwalając inżynierom przewidywać środowiska hydrodynamiczne i wizualizować strefy ścinania poza prostymi wskaźnikami mocy na objętość [1]. Przestrzegając krytycznych parametrów - takich jak utrzymywanie długości wirów Kolmogorova powyżej 20 μm i prędkości końcówek mieszadeł poniżej 1,5 m/s - inżynierowie mogą chronić komórki ssaków przed uszkodzeniami ścinającymi, zapewniając jednocześnie odpowiednie mieszanie i transfer tlenu [1].
Zaawansowane metody obliczeniowe, takie jak symulacja dużych wirów (LES) i techniki Lattice-Boltzmann, wykazały swoją skuteczność w skalowaniu procesów. Na przykład w marcu 2020 roku firma Regeneron Ireland DAC z powodzeniem przeskalowała proces hodowli komórek z bioreaktora o pojemności 2 000 L do geometrycznie odmiennego systemu jednorazowego o pojemności 5 000 L przy pierwszej próbie. Osiągnięto to dzięki wieloparametrowym prognozom CFD, eliminując potrzebę przeprowadzania rozległych prób fizycznych [5]. Ta strategia "za pierwszym razem" nie tylko zmniejsza ryzyko zanieczyszczeń, ale także skraca czas wprowadzenia na rynek - co jest kluczowe dla sektora mięsa hodowlanego.
Metody walidacji eksperymentalnej, takie jak obrazowanie prędkości cząstek (PIV), dodatkowo potwierdzają dokładność modeli CFD [2]. Te zweryfikowane modele odgrywają teraz kluczową rolę w decyzjach zakupowych.Firmy takie jak
Najczęściej zadawane pytania
W jaki sposób obliczeniowa dynamika płynów (CFD) wspiera skalowanie bioreaktorów do produkcji mięsa hodowlanego?
Obliczeniowa dynamika płynów (CFD) to przełom w skalowaniu bioreaktorów do produkcji mięsa hodowlanego. Zapewnia dogłębne zrozumienie dynamiki przepływu, naprężeń ścinających, efektywności mieszania i wskaźników przenoszenia masy - wszystkich kluczowych czynników dla stworzenia idealnego środowiska do wzrostu komórek.
Dzięki CFD inżynierowie mogą optymalizować kluczowe elementy, takie jak projekt wirnika, prędkość mieszania i napowietrzanie gazem. To zapewnia, że bioreaktory działają w najlepszych możliwych warunkach, chroniąc zarówno zdrowie komórek, jak i produktywność.
Co więcej, CFD umożliwia przejście od małych ustawień laboratoryjnych do dużych bioreaktorów przemysłowych bez kompromisów w zakresie wydajności lub spójności. Oznacza to, że produkcja mięsa hodowlanego może się płynnie zwiększać, zachowując wysokie standardy.
Co sprawia, że symulacje dużych wirów (LES) są lepsze od tradycyjnych metod modelowania bioreaktorów?
Symulacje dużych wirów (LES) zapewniają głębszy i bardziej precyzyjny wgląd w turbulentny przepływ w bioreaktorach w porównaniu do tradycyjnych metod, takich jak uśrednione przez Reynoldsa równania Naviera-Stokesa (RANS).Koncentrując się na dużych wirach i modelując jedynie najmniejsze ruchy dyssypacyjne, LES może wskazać krytyczne miejsca naprężeń ścinających, takie jak strefy wysokiego ścinania wywołane wirami, które w przeciwnym razie mogłyby zostać przeoczone. Ten poziom szczegółowości odgrywa kluczową rolę w redukcji uszkodzeń komórek i zapewnieniu większej niezawodności przy skalowaniu produkcji mięsa hodowlanego.
W przeciwieństwie do metod, które w dużym stopniu opierają się na korelacjach empirycznych, LES oferuje silniejsze możliwości przewidywania przy przechodzeniu z bioreaktorów laboratoryjnych do przemysłowych. Postępy w technikach obliczeniowych uczyniły również LES bardziej dostępnym, umożliwiając szczegółowe symulacje bez potrzeby korzystania z kosztownych zasobów obliczeniowych. Dla firm dążących do integracji projektów opartych na LES,
Dlaczego ważne jest utrzymanie długości wirów Kolmogorowa powyżej 20 µm dla żywotności komórek ssaków?
Utrzymanie długości wirów Kolmogorowa powyżej około 20 µm jest kluczowe dla ochrony komórek ssaków podczas operacji w bioreaktorze. Gdy te turbulentne wiry zmniejszają się poniżej rozmiaru komórek, mogą narażać komórki na nadmierny stres ścinający, co grozi uszkodzeniem ich błon i obniżeniem żywotności komórek.
Utrzymywanie najmniejszych struktur turbulentnych większych niż komórki pomaga zmniejszyć ryzyko uszkodzeń mechanicznych. To nie tylko sprzyja zdrowszym hodowlom komórkowym, ale także poprawia ogólną wydajność bioreaktora. To zagadnienie staje się jeszcze ważniejsze podczas skali bioreaktora, gdzie zapewnienie spójnych warunków stresu ścinającego jest szczególnie trudne.











