Le dimensionnement des bioréacteurs pour la production de viande cultivée est complexe, surtout lorsqu'il s'agit de gérer le stress de cisaillement, une force mécanique qui peut endommager les cellules de mammifères lors de la montée en échelle. Contrairement aux cellules microbiennes, les cellules de mammifères sont fragiles et sensibles aux forces de turbulence et d'aération. Lorsque le stress de cisaillement dépasse 3 Pa, les cellules peuvent se rompre, réduisant ainsi la viabilité et la productivité.
Pour relever ces défis, les ingénieurs s'appuient sur la dynamique des fluides numérique (CFD) et sur des modèles réduits pour prédire et gérer le stress de cisaillement avant la production à grande échelle. La CFD analyse les schémas d'écoulement, les zones de cisaillement et l'efficacité du mélange dans les bioréacteurs, tandis que les modèles réduits valident ces prédictions expérimentalement, minimisant les risques lors de la montée en échelle.
Points Clés:
- Limites du Stress de Cisaillement: Les cellules de mammifères tolèrent jusqu'à 3 Pa; dépasser cette limite endommage les cellules. html
- Outils CFD: Des méthodes avancées comme les simulations de grandes échelles (LES) et les simulations de Lattice-Boltzmann (LB-LES) permettent une modélisation précise de l'écoulement et de la turbulence.
- Modèles à échelle réduite: Ceux-ci reproduisent les conditions des grands bioréacteurs dans des configurations plus petites pour valider les prédictions CFD.
-
Considérations de conception:
- Utilisez des turbines à pales inclinées pour réduire le cisaillement.
- Maintenez les longueurs d'eddy de Kolmogorov au-dessus de 20 μm pour éviter d'endommager les cellules.
- Gardez les vitesses de pointe des turbines en dessous de 1,5 m/s.
En combinant les informations CFD avec la validation expérimentale, les équipes peuvent optimiser les conceptions de bioréacteurs pour la production de viande cultivée, assurant la survie des cellules et une mise à l'échelle efficace.
CFD Compass | Meilleures pratiques pour la CFD des bioréacteurs
Utilisation de la dynamique des fluides numérique (CFD) pour modéliser le stress de cisaillement
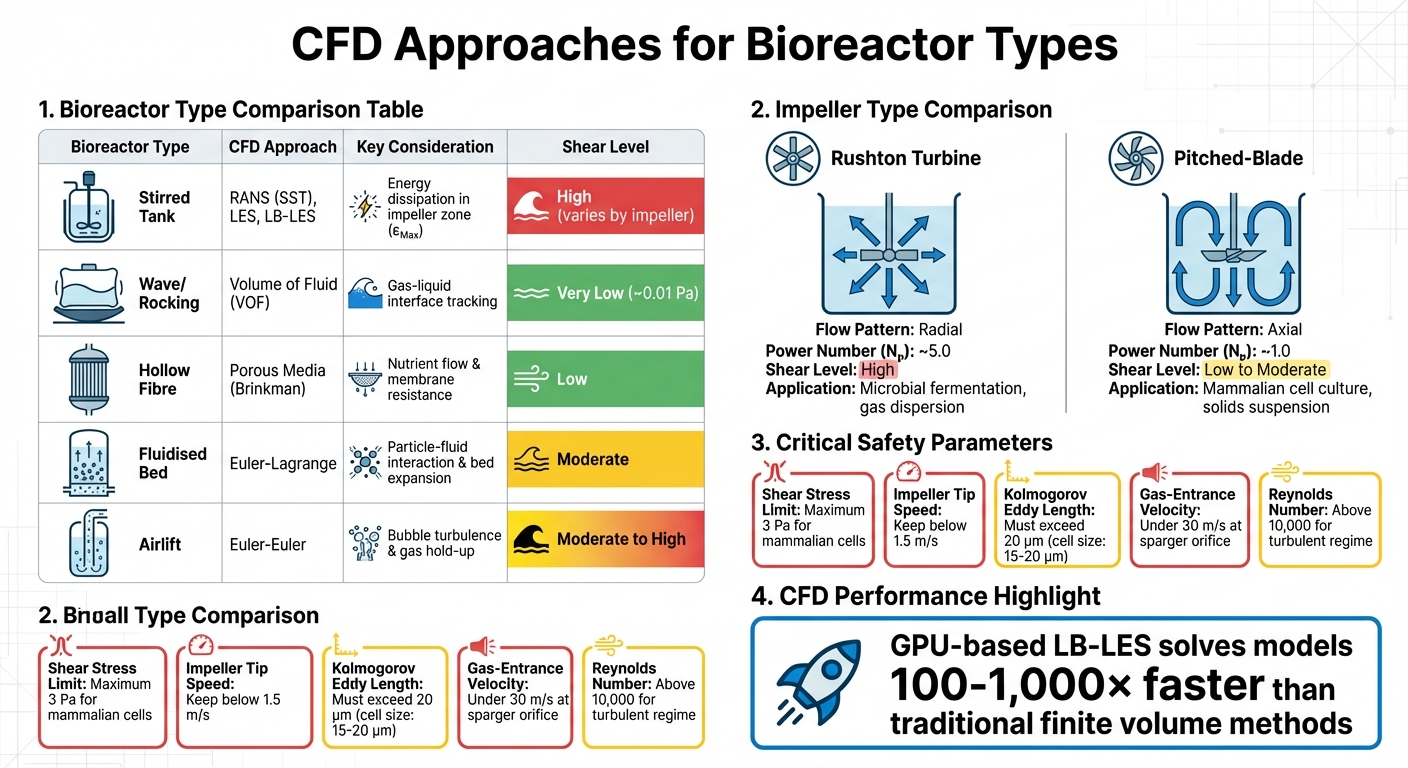
Approches CFD et paramètres clés pour différents types de bioréacteurs dans la production de viande cultivée
Les simulations CFD donnent aux ingénieurs les outils pour cartographier la dynamique des fluides et les forces de cisaillement à l'intérieur des bioréacteurs avant qu'ils ne soient physiquement construits. Au lieu de s'appuyer sur des méthodes d'essais et d'erreurs à l'échelle de production, la CFD aide à prédire des facteurs critiques tels que les zones de cisaillement élevé, les tourbillons turbulents et la viabilité cellulaire dans des parties spécifiques du récipient. Cela est particulièrement important dans la production de viande cultivée, où les échelles de bioréacteurs pourraient éventuellement atteindre 200 000 litres - bien plus grandes que les récipients biopharmaceutiques traditionnels [8]. Ces informations prédictives guident les expériences de réduction d'échelle et influencent la sélection des équipements.
L'évolution des techniques de calcul a été remarquable. Bien que les modèles de Reynolds-Averaged Navier-Stokes (RANS), tels que k-ε, restent largement utilisés dans l'industrie, des méthodes avancées comme les simulations de grandes échelles (LES) et les simulations Lattice-Boltzmann alimentées par GPU (LB-LES) repoussent les limites. Selon le professeur Miroslav Soos de l'Université de Chimie et de Technologie de Prague, le LB-LES basé sur GPU peut résoudre des modèles "100 à 1 000 fois plus rapidement que les solveurs de méthode de volumes finis couramment utilisés" [2]. Cet avantage de vitesse permet aux ingénieurs de simuler des réacteurs massifs avec la précision nécessaire pour détecter les tourbillons endommageant les cellules.
Un exemple pratique des capacités de la CFD provient des chercheurs de Regeneron Ireland DAC et Thermo Fisher Scientific. Ils ont réussi à faire évoluer un processus de culture cellulaire d'un bioréacteur de 2 000 litres à un bioréacteur à usage unique de 5 000 litres géométriquement différent.Au lieu de se fier à des heuristiques empiriques, ils ont utilisé la CFD pour analyser des paramètres tels que les taux de transfert de masse, les temps de mélange et les taux de cisaillement. Cette approche a permis une mise à l'échelle réussie dès la première tentative, évitant ainsi les échecs coûteux souvent associés à la mise à l'échelle basée sur le rapport puissance/volume [5].
Configuration de la CFD pour les bioréacteurs à cuve agitée
Pour configurer la CFD pour les bioréacteurs à cuve agitée, commencez par définir la géométrie du récipient - cela inclut les dimensions de la cuve, la conception de l'agitateur (e.g., Rushton ou à pales inclinées), et le placement des déflecteurs. Choisir le bon modèle de turbulence est crucial : le modèle k-ε réalisable fonctionne bien pour les systèmes gaz-liquide, tandis que le LB-LES offre une résolution plus élevée pour identifier les contraintes maximales qui pourraient nuire aux cellules. Une étude de convergence de grille garantit que les résultats ne dépendent pas de la taille du maillage.
Les conditions aux limites doivent refléter les paramètres d'exploitation du monde réel, tels que la vitesse de l'impulseur, les taux de barbotage de gaz, la densité du fluide et la viscosité. Pour les applications de viande cultivée, des modèles conservateurs de traînée de bulles sont souvent utilisés pour estimer le stress de cisaillement [8]. Le système doit fonctionner dans un régime entièrement turbulent, avec des nombres de Reynolds dépassant 10 000 pour garantir que le nombre de puissance reste constant quel que soit la vitesse de l'impulseur [1].
Les prévisions CFD pour le transfert d'oxygène, les temps de mélange et le stress hydrodynamique doivent s'aligner avec les données expérimentales collectées à l'aide de micro-sondes sensibles au cisaillement ou d'agrégats de nanoparticules [2]. Par exemple, un modèle mathématique de transfert de masse a guidé l'augmentation directe d'échelle d'un processus de culture de cellules CHO d'une unité de paillasse de 2 litres à un bioréacteur industriel de 1 500 litres chez Sartorius.En utilisant la CFD pour prédire la demande en oxygène et l'élimination du CO₂, l'équipe a maintenu des attributs de qualité de produit constants - tels que les N-glycanes et les variantes de charge - à travers les échelles [6].
CFD pour d'autres types de bioréacteurs
Bien que les cuves agitées dominent la culture cellulaire industrielle, d'autres conceptions de bioréacteurs nécessitent des approches CFD sur mesure. Par exemple, les bioréacteurs à bascule ou à onde reposent sur la méthode du Volume de Fluide (VOF) pour simuler l'interface gaz-liquide, car le mouvement des vagues génère un stress de cisaillement dans ces systèmes. Ces conceptions créent des environnements de cisaillement beaucoup plus doux - le stress maximum est d'environ 0,01 Pa comparé aux cuves agitées - mais leur évolutivité est limitée pour la production de viande cultivée à grande échelle [4].
Les bioréacteurs à fibres creuses, en revanche, utilisent des modèles de milieux poreux basés sur les équations de Brinkman pour simuler la diffusion des nutriments et la résistance à l'écoulement à travers les membranes. Les systèmes à lit fluidisé nécessitent des modèles Euler-Lagrange pour capturer les interactions particule-fluide et l'expansion du lit, tandis que les bioréacteurs à circulation utilisent des méthodes Euler-Euler pour analyser la turbulence induite par les bulles et la rétention de gaz [4]. Chaque conception présente des défis uniques : les lits fluidisés doivent équilibrer la distribution des microporteurs contre l'exposition au cisaillement, tandis que les systèmes à circulation doivent gérer les contraintes causées par l'éclatement des bulles, une cause principale de la mort cellulaire dans les bioréacteurs à bulles [1] [7].
Comprendre ces approches CFD est essentiel pour contrôler le stress de cisaillement à travers différents designs de bioréacteurs utilisés dans la production de viande cultivée.
| Type de Bioréacteur | Approche CFD | Considération Clé |
|---|---|---|
| Cuve Agitée | RANS (SST), LES, LB-LES | Dissipation d'énergie dans la zone de l'impulseur (εMax) |
| Vague/Balancement | Volume de Fluide (VOF) | Suivi de l'interface gaz-liquide |
| Fibre Creuse | Média Poreux (Brinkman) | Flux de nutriments et résistance de la membrane |
| Lit Fluidisé | Euler-Lagrange | Interaction entre les particules et le fluide, expansion du lit |
| Airlift | Euler-Euler | Turbulence des bulles et rétention de gaz |
Ces méthodes CFD variées soulignent la nécessité de stratégies personnalisées, qui jouent un rôle crucial dans la sélection de l'équipement et la gestion des contraintes de cisaillement.
Modèles à échelle réduite et validation expérimentale
Bien que la dynamique des fluides numérique (CFD) fournisse des prédictions précieuses, elle ne peut remplacer le besoin de tests en conditions réelles lors de la mise à l'échelle des processus. La validation expérimentale joue un rôle crucial pour s'assurer que les modèles informatiques représentent avec précision les conditions de contrainte de cisaillement réelles. C'est là que les modèles à échelle réduite entrent en jeu, imitant l'environnement hydrodynamique des grands bioréacteurs de production dans des systèmes plus petits et plus faciles à gérer. Ce faisant, ils réduisent le risque d'erreurs coûteuses lors du passage d'opérations à petite échelle à des opérations à l'échelle industrielle. Cette étape confirme non seulement les prédictions CFD, mais garantit également un processus de mise à l'échelle plus fiable et efficace.
Création de modèles à échelle réduite
La conception d'un modèle à échelle réduite commence par le maintien de la similarité géométrique.Cela signifie maintenir les mêmes ratios d'aspect entre les composants clés, tels que la hauteur du récipient par rapport au diamètre et le diamètre de l'agitateur par rapport au diamètre du réservoir [11]. Une fois la géométrie alignée, les ingénieurs sélectionnent un critère d'échelle. Les choix courants incluent la puissance par volume (P/V), la vitesse de pointe de l'agitateur ou le taux de dissipation d'énergie (EDR). Cependant, se concentrer sur l'EDR localisé plutôt que sur la P/V moyenne offre une meilleure compréhension de l'hétérogénéité du cisaillement, ce qui est crucial pour une modélisation précise.
Une approche plus avancée implique des simulateurs multi-compartiments. Par exemple, en février 2021, Emmanuel Anane et son équipe ont développé un simulateur de réduction d'échelle à deux compartiments combinant un réacteur à cuve agitée (STR) et un réacteur à flux piston (PFR). Ce modèle a été utilisé pour étudier comment les cellules CHO réagissent aux gradients d'oxygène dissous. Leur recherche a révélé un seuil critique de temps de résidence de 90 secondes.Au-delà de ce point, les cellules CHO ont montré une diminution de 15 % de la densité cellulaire viable et une augmentation de l'accumulation de lactate [10]. Cette découverte offre un point de référence clair pour concevoir des bioréacteurs industriels qui maintiennent la viabilité cellulaire.
Pour protéger la croissance cellulaire, les ingénieurs visent souvent à maintenir les vitesses de pointe des hélices en dessous de 1,5 m/s [1]. De plus, la longueur des microtourbillons de Kolmogorov - une mesure de la turbulence - doit dépasser la taille des cellules, généralement 20 μm ou plus pour les cellules de mammifères, afin d'éviter les dommages hydrodynamiques [1][3]. Par exemple, à une entrée d'énergie de 0,1 W/kg dans les cultures de cellules animales, les plus petits tourbillons mesurent environ 60 μm, offrant une marge de sécurité [3].
Validation des Prédictions CFD par des Expériences
Une fois qu'un modèle réduit est en place, les méthodes expérimentales sont essentielles pour valider les paramètres dérivés de la CFD. La vélocimétrie par image de particules (PIV) est une technique largement utilisée à cette fin. En suivant les particules dans le fluide, la PIV aide à confirmer si les schémas d'écoulement et les champs de vitesse dans le modèle réduit s'alignent avec les prédictions CFD [12][4].
Les méthodes d'injection de traceurs et de décoloration sont également utilisées pour valider les temps de mélange. Dans ce processus, des traceurs comme des acides, des bases ou des solutions salines sont introduits près de l'agitateur, et leur distribution est surveillée jusqu'à ce que 95% d'homogénéité soit atteinte [12][3]. Pour les bioréacteurs à cellules de mammifères à grande échelle (5 000 L à 20 000 L), les temps de mélange varient généralement de 80 à 180 secondes [10].
En mars 2020, James Scully et son équipe chez Regeneron Ireland DAC ont réussi à faire passer un processus de culture cellulaire d'un bioréacteur de 2 000 L à un bioréacteur à usage unique de 5 000 L avec une géométrie différente. Ils se sont appuyés sur la CFD pour prédire des paramètres clés tels que les taux de transfert de masse, les temps de mélange et les taux de cisaillement. Ces prédictions ont ensuite été validées par des expériences en phase unique et multiphase, permettant une première tentative réussie de mise à l'échelle sans avoir besoin de tests pilotes à grande échelle [5].
"Les simulations CFD sont de plus en plus utilisées pour compléter les investigations classiques d'ingénierie des procédés en laboratoire avec des résultats résolus spatialement et temporellement, ou même pour les remplacer lorsque les investigations en laboratoire ne sont pas possibles." - Stefan Seidel, School of Life Sciences, ZHAW [12]
Les techniques de validation supplémentaires incluent la mesure du couple pour confirmer la puissance spécifique (P/V) et les nombres de puissance sans dimension à des vitesses d'agitation spécifiques [12][3]. Les taux de transfert d'oxygène sont vérifiés à l'aide de méthodes telles que les techniques de dégazage ou de sulfite, qui déterminent le coefficient de transfert de masse volumétrique d'oxygène (kLa) [12][7]. Pour les systèmes utilisant des microporteurs, des méthodes d'atténuation de la lumière ou basées sur des caméras sont employées pour trouver la vitesse minimale nécessaire pour suspendre toutes les particules, garantissant que les prédictions CFD de la distribution de la phase solide sont précises [12][4].
sbb-itb-ffee270
Facteurs qui influencent le stress de cisaillement dans les bioréacteurs
Pour protéger la viabilité cellulaire lors de la montée en échelle, il est essentiel de comprendre les facteurs physiques qui entraînent le stress de cisaillement. Les prédictions de la dynamique des fluides computationnelle (CFD) et les validations à échelle réduite révèlent que le taux de dissipation d'énergie (EDR) joue un rôle clé. L'EDR mesure comment l'énergie cinétique de l'agitateur se convertit en chaleur, conduisant à une distribution inégale de l'énergie. Par exemple, dans les agitateurs à pales inclinées, l'énergie a tendance à se concentrer autour de l'agitateur, créant des zones de cisaillement élevé qui peuvent endommager les cellules si elles ne sont pas correctement gérées.
Conception de l'agitateur et apport de puissance
Le type d'agitateur utilisé influence considérablement les schémas d'écoulement et l'intensité du cisaillement. Les turbines Rushton, par exemple, génèrent un écoulement radial et un cisaillement élevé, ce qui les rend idéales pour la fermentation microbienne mais moins adaptées aux cellules mammifères sensibles au cisaillement.D'autre part, les hélices à pales inclinées créent un flux axial avec un cisaillement plus faible et une meilleure efficacité de pompage à la même puissance d'entrée. Cela en fait le choix préféré pour des applications comme la production de viande cultivée, où la viabilité cellulaire est une priorité.
| Type d'hélice | Schéma de flux | Nombre de puissance (Nₚ) | Niveau de cisaillement | Application principale |
|---|---|---|---|---|
| Turbine Rushton | Radial | ~5.0 | Élevé | Fermentation microbienne; dispersion de gaz[3] |
| Pales inclinées | Axial | ~1.0 | Faible à Modéré | Culture de cellules de mammifères; suspension de solides [3] |
Les stratégies de mise à l'échelle reposent souvent sur le maintien d'une puissance constante par volume (P/V). Cependant, à mesure que la taille du réacteur augmente, cela peut entraîner des vitesses de pointe d'hélice plus élevées. Pour les cellules de mammifères, les vitesses de pointe doivent rester en dessous de 1,5 m/s pour éviter les problèmes de croissance [1]. Dans les réacteurs à grande échelle, le barbotage peut introduire encore plus de stress hydrodynamique que les hélices, surtout dans les cuves dépassant 20 m³ [9]. Ces facteurs sont étroitement liés à la turbulence, qui est explorée plus en détail dans la discussion sur l'échelle de Kolmogorov.
Échelle de Kolmogorov et Modélisation de la Turbulence
L'échelle de Kolmogorov (λ) définit la taille des plus petits tourbillons turbulents où l'énergie se dissipe sous forme de chaleur.Si ces tourbillons sont plus petits que le diamètre de la cellule, les dommages mécaniques deviennent une préoccupation. Pour les cellules de mammifères, qui mesurent généralement 15 à 20 μm, la longueur du tourbillon doit dépasser 20 μm pour éviter les dommages [1][3]. Par exemple, à une entrée d'énergie de 0,1 W/kg, le diamètre du tourbillon de Kolmogorov est d'environ 60 μm, offrant une marge de sécurité [3].
"Si les entités biologiques (e.g., cellules de mammifères) sont plus petites que λ [échelle de Kolmogorov] dans un bioréacteur, alors les dommages de cisaillement à ces entités ne se produiront pas." - Muhammad Arshad Chaudhry [3]
En août 2024, des chercheurs de Boehringer Ingelheim Pharma et de l'Université de Chimie et de Technologie de Prague ont utilisé des simulations de grandes échelles de tourbillons de Lattice-Boltzmann (LB-LES) pour valider les prédictions CFD dans un bioréacteur industriel de 12 500 L.En utilisant des agrégats de nanoparticules sensibles au cisaillement, ils ont mesuré le stress hydrodynamique maximal et ont démontré que LB-LES pouvait résoudre des échelles turbulentes 100 à 1 000 fois plus rapidement que les méthodes traditionnelles [2]. Ces découvertes sont essentielles pour développer des stratégies visant à minimiser le stress de cisaillement.
Réduction du stress de cisaillement à l'aide de données de modélisation
La modélisation CFD permet aux ingénieurs d'identifier les zones de fort cisaillement et d'ajuster les conditions de fonctionnement en conséquence. Une approche efficace consiste à introduire des substrats, des bases de pH ou des antimoisissures près de la zone de l'agitateur plutôt qu'à la surface du liquide. Cela assure une distribution rapide et minimise les gradients de concentration localisés [3]. Dans la production de viande cultivée, un cisaillement excessif peut détacher les cellules des microporteurs, tandis qu'une agitation insuffisante entraîne la sédimentation des microporteurs et des déséquilibres nutritionnels [9].
Les additifs protecteurs comme Pluronic F-68 (Poloxamer 188) sont couramment utilisés pour protéger les cellules des forces de cisaillement, en particulier celles causées par l'éclatement de bulles à la surface du liquide - un contributeur majeur à la mort cellulaire dans les bioréacteurs [1]. Avec ces surfactants, des apports énergétiques aussi élevés que 100 000 W/m³ ont été rapportés sans effets létaux [1]. De plus, maintenir la vitesse d'entrée du gaz à l'orifice du diffuseur en dessous de 30 m/s aide à réduire les pertes de productivité et la mortalité cellulaire [1].
Recherche d'équipement pour l'échelle de bioréacteur
Comment Cellbase soutient l'acquisition de bioréacteurs
Le passage à l'échelle des bioréacteurs pour la production de viande cultivée présente ses propres défis. C'est là que
Lors de l'utilisation de
La mise à l'échelle réussie des bioréacteurs utilisés dans l'industrie biopharmaceutique joue un rôle important dans la qualité et le temps de mise sur le marché de ces produits [5].
En s'appuyant sur des données soutenues par CFD, les équipes peuvent rationaliser la sélection des équipements et minimiser le besoin de répétitions d'essais [5]. Ces informations sont cruciales pour choisir des bioréacteurs conçus avec une gestion optimale du stress de cisaillement à l'esprit.
Choisir l'équipement pour le contrôle du stress de cisaillement
Pour contrôler efficacement le stress de cisaillement, certaines spécifications d'équipement sont particulièrement importantes. La géométrie de l'hélice est un facteur clé. Par exemple, les hélices à pales inclinées génèrent un flux axial avec un nombre de puissance (Np) d'environ 1,0, tandis que les turbines Rushton ont un Np beaucoup plus élevé d'environ 5,0.Cela signifie que les conceptions à pales inclinées produisent significativement moins de puissance et, par conséquent, moins de cisaillement à la même vitesse de rotation [3]. Pour les applications impliquant des cellules de mammifères utilisées dans la viande cultivée, il est essentiel de maintenir la vitesse de pointe de l'hélice en dessous de 1,5 m/s pour éviter d'endommager les cellules [1].
La configuration du sparger est une autre considération critique. Pour éviter un cisaillement excessif, l'équipement doit s'assurer que la vitesse d'entrée du gaz à l'orifice du sparger reste inférieure à 30 m/s, et que le nombre de Reynolds de l'orifice reste en dessous de 2 000. Dépasser ces seuils peut conduire au "régime de jet", où les bulles se dispersent de manière inégale et créent des zones de cisaillement localisées [1]. Les spargers à trous percés ou à tuyaux ouverts conviennent mieux aux cellules sensibles au cisaillement par rapport aux microspargers. De plus, l'équipement doit prendre en charge la compatibilité à l'échelle réduite. Les fournisseurs proposant des modèles de paillasse (e.g., des systèmes de 3 L) qui sont géométriquement similaires aux systèmes à grande échelle (2 000 L ou plus) permettent aux équipes de valider les prédictions CFD à une échelle plus petite avant de passer à la production à grande échelle [1][2].
Conclusion
Le dimensionnement des bioréacteurs pour la production de viande cultivée nécessite de s'éloigner des méthodes traditionnelles d'essais-erreurs et d'adopter des stratégies basées sur des modèles pour aborder les différences de cisaillement localisées. La dynamique des fluides numérique (CFD) est devenue un outil clé dans ce processus, permettant aux ingénieurs de prédire les environnements hydrodynamiques et de visualiser les zones de cisaillement au-delà des simples ratios de puissance par volume [1]. En respectant des paramètres critiques - comme maintenir les longueurs d'édies de Kolmogorov au-dessus de 20 μm et les vitesses de pointe des agitateurs en dessous de 1,5 m/s - les ingénieurs peuvent protéger les cellules mammifères des dommages de cisaillement tout en assurant un mélange et un transfert d'oxygène appropriés [1].
Les méthodes de calcul avancées, telles que la simulation des grandes échelles (LES) et les techniques de Lattice-Boltzmann, ont démontré leur efficacité dans l'augmentation des processus. Par exemple, en mars 2020, Regeneron Ireland DAC a réussi à augmenter un processus de culture cellulaire d'un bioréacteur de 2 000 L à un système à usage unique de 5 000 L géométriquement distinct dès la première tentative. Cela a été réalisé en utilisant des prédictions CFD multiparamètres, éliminant le besoin d'essais physiques étendus [5]. Cette stratégie "dès le premier coup" réduit non seulement les risques de contamination mais raccourcit également le temps de mise sur le marché - crucial pour le secteur de la viande cultivée.
Les méthodes de validation expérimentale, telles que la vélocimétrie par image de particules (PIV), confirment davantage la précision des modèles CFD [2]. Ces modèles validés jouent désormais un rôle crucial dans les décisions d'approvisionnement.Des entreprises comme
FAQ
Comment la dynamique des fluides numérique (CFD) soutient-elle la montée en échelle des bioréacteurs pour la production de viande cultivée ?
La dynamique des fluides numérique (CFD) est une révolution lorsqu'il s'agit de monter en échelle des bioréacteurs pour la viande cultivée. Elle offre une compréhension approfondie des dynamique des flux, contraintes de cisaillement, efficacité de mélange, et taux de transfert de masse - tous des facteurs critiques pour créer l'environnement idéal pour la croissance cellulaire.
Avec la CFD, les ingénieurs peuvent optimiser des éléments essentiels tels que la conception de l'impulseur, la vitesse d'agitation et l'injection de gaz. Cela garantit que les bioréacteurs fonctionnent dans les meilleures conditions possibles, protégeant à la fois la santé cellulaire et la productivité.
De plus, la CFD permet de passer de petites configurations de laboratoire à de grands bioréacteurs industriels sans compromettre l'efficacité ou la cohérence. Cela signifie que la production de viande cultivée peut s'intensifier en douceur tout en maintenant des normes élevées.
Qu'est-ce qui rend les simulations de grandes échelles (LES) meilleures que les méthodes traditionnelles pour la modélisation des bioréacteurs ?
Les simulations de grandes échelles (LES) offrent une vision plus approfondie et plus précise de l'écoulement turbulent dans les bioréacteurs par rapport aux méthodes traditionnelles comme les équations de Navier-Stokes moyennées de Reynolds (RANS).En se concentrant sur les grandes échelles et en modélisant uniquement les plus petits mouvements dissipatifs, LES peut identifier des points critiques de contrainte de cisaillement, tels que les zones de cisaillement élevé induites par les vortex, qui pourraient autrement être négligés. Ce niveau de détail joue un rôle clé dans la réduction des dommages cellulaires et assure une plus grande fiabilité lors de l'augmentation de la production de viande cultivée.
Contrairement aux méthodes qui dépendent fortement des corrélations empiriques, LES offre des capacités prédictives plus solides lors du passage des bioréacteurs à l'échelle de laboratoire à l'échelle industrielle. Les avancées dans les techniques de calcul ont également rendu LES plus accessible, permettant des simulations détaillées sans nécessiter de ressources informatiques prohibitives. Pour les entreprises cherchant à intégrer des conceptions basées sur LES,
Pourquoi est-il important de maintenir les longueurs d'eddy de Kolmogorov au-dessus de 20 µm pour la viabilité des cellules de mammifères ?
Maintenir les longueurs d'eddy de Kolmogorov au-dessus d'environ 20 µm est crucial pour protéger les cellules de mammifères lors des opérations de bioréacteur. Lorsque ces tourbillons turbulents deviennent plus petits que la taille des cellules, ils peuvent exposer les cellules à un stress de cisaillement excessif, ce qui risque d'endommager leurs membranes et de réduire la viabilité cellulaire.
Garder les plus petites structures turbulentes plus grandes que les cellules aide à réduire les risques de dommages mécaniques. Cela favorise non seulement des cultures cellulaires plus saines, mais améliore également la performance globale du bioréacteur. Cette considération devient encore plus importante lors de l'augmentation de l'échelle du bioréacteur, où assurer des conditions de stress de cisaillement cohérentes est particulièrement difficile.











