Maintenir un pH et une température précis est crucial pour la culture de cellules de mammifères, en particulier dans la production de viande cultivée. Les cellules ont besoin d'un environnement contrôlé pour se multiplier (prolifération) et se développer en fibres musculaires (différenciation). Voici le point clé à retenir:
- Conditions Optimales : le pH doit rester entre 7,2 et 7,4, et la température à 37 °C. Même de petites déviations (e.g., une baisse du pH de 0,3 unité) peuvent ralentir la croissance et réduire la productivité.
- Pourquoi c'est important : Les cellules dépensent de l'énergie supplémentaire pour corriger les déséquilibres, ce qui impacte leur efficacité de croissance. Les cultures à haute densité sont particulièrement sujettes aux baisses de pH dues à l'accumulation d'acide lactique.
- Défis à grande échelle : Les bioréacteurs plus grands rencontrent des conditions inégales, comme des pics de pH ou une accumulation de CO₂, rendant le contrôle précis plus difficile.
- Solutions: Des bioréacteurs avancés avec des systèmes automatisés et des capteurs fiables aident à maintenir la stabilité, améliorant la croissance cellulaire et la cohérence.
Que vous cultiviez des cellules dans un laboratoire ou que vous passiez à la production, maintenir la stabilité du pH et de la température est indispensable pour réussir.
Capteurs dans les bioréacteurs
Comment le pH et la température affectent la croissance cellulaire
Les rôles du pH et de la température dans la conception des bioréacteurs vont au-delà de l'importance théorique - ils influencent directement le métabolisme et la croissance des cellules. Cette section explore comment ces deux facteurs façonnent le comportement et la productivité cellulaires.
Effets du pH sur le métabolisme et la viabilité des cellules
Lorsque les niveaux de pH s'écartent des plages optimales, les cellules doivent travailler plus dur pour maintenir l'équilibre. Par exemple, elles activent des mécanismes comme les antiporteurs Na⁺/H⁺, qui consomment de l'énergie qui autrement alimenterait la croissance [3]. Cette redirection d'énergie peut entraîner des changements majeurs dans l'activité des gènes. Dans une étude, abaisser le pH du milieu à 6,7 a provoqué un changement des niveaux d'expression de plus de 2 000 gènes en seulement 24 heures [3].
L'interaction entre le pH et le métabolisme peut créer un cercle vicieux. Une activité glycolytique élevée génère de l'acide lactique, ce qui abaisse le pH du milieu. Dans certaines cultures à haute densité, jusqu'à 90 % du glucose est converti en lactate [2], entraînant une acidification rapide. Bien que cette acidification finisse par arrêter la production d'acide lactique, elle se fait au détriment d'une croissance cellulaire significativement réduite [5].
Les extrêmes acides et alcalins sont tous deux nocifs. Bien que les conditions acides en dessous d'un pH de 7,1 soient largement connues pour entraver la croissance, les conditions alcalines - allant de pH 7,7 à 9.0 - peut également ralentir la prolifération et réduire les rendements des produits [2][4]. Pour la plupart des cellules de mammifères, la limite inférieure critique de pH se situe entre 6,6 et 6,8. Au-delà de cette plage, les cellules font face à des risques accrus d'apoptose ou de nécrose [5].
Ces perturbations métaboliques induites par le pH préparent le terrain pour le rôle de la température dans l'influence du comportement cellulaire.
Effets de la Température sur la Prolifération et la Différenciation Cellulaires
La température joue un rôle crucial dans l'activité métabolique et la solubilité des gaz. Bien que 37 °C soit la norme pour la plupart des cultures, même de légères déviations peuvent affecter la croissance et la production de protéines [3][5]. Une étude menée à la Université de Technologie de Vienne en 2017 a démontré cet effet. Les chercheurs ont utilisé des cellules CHO dans un bioréacteur agité de 10–12 m³ pour simuler des inhomogénéités de pH.L'exposition temporaire à des zones de pH 9,0 pendant la phase de croissance exponentielle a considérablement réduit à la fois la densité cellulaire viable maximale et le rendement final du produit [4].
Dans le domaine de la production de viande cultivée, le contrôle de la température sert à deux fins. Pendant la phase de prolifération, maintenir une température constante de 37 °C assure une multiplication cellulaire efficace. Cependant, des systèmes avancés sensibles à la température ont été développés pour faciliter la superposition de tissus sans échafaudage en contrôlant l'adhésion et le détachement des cellules [6].
Il est clair que la régulation précise de la température est tout aussi cruciale que le maintien d'un pH optimal pour la croissance et la différenciation cellulaire réussies.
Effets combinés du pH et de la température
L'interaction entre le pH et la température est étroitement liée à la chimie du CO₂.Les changements de température affectent la solubilité du CO₂, ce qui influence à son tour l'équilibre acido-basique dans les systèmes tamponnés au bicarbonate [3]. Des températures plus élevées accélèrent le métabolisme cellulaire, augmentant la production de sous-produits comme l'acide lactique et le CO₂. Cela acidifie davantage le milieu, augmentant le stress sur les cellules [2][3].
"La solubilité des gaz dissous, et donc l'influence du CO₂ sur la chimie acido-basique, dépend fortement de la température, de l'osmolarité, de l'humidité et de la pression." - Shannon G. Klein et al., King Abdullah University of Science and Technology [3]
Lorsque le pH et la température dévient simultanément, le stress métabolique résultant peut gravement perturber à la fois la prolifération et la différenciation cellulaires. Par exemple, les cultures en batch standard montrent souvent un décalage médian de pH de 0,425 unités [3].Dans les cultures à haute densité, ce changement peut atteindre 0,9 unité, accompagné par des niveaux de CO₂ s'élevant à 10,45% [3]. Ces conditions obligent les cellules à dépenser encore plus d'énergie pour maintenir l'homéostasie, réduisant ainsi leur efficacité dans la production de biomasse.
Pour minimiser ces stress, les milieux fraîchement préparés doivent être équilibrés dans un incubateur à CO₂ pendant au moins une heure avant utilisation. Cela permet à la réaction inverse lente de l'hydratation du CO₂ de se stabiliser [2]. De telles précautions sont essentielles pour atteindre une croissance cellulaire et une productivité optimales.
Méthodes pour Contrôler le pH et la Température dans les Bioréacteurs
Maintenir le pH et la température stables dans les bioréacteurs implique un mélange de matériel, de capteurs et de stratégies de contrôle. La technologie choisie dépend souvent de l'échelle de production, du type de cellules utilisées pour la viande cultivée, et si le processus s'oriente davantage vers l'automatisation ou la gestion manuelle.
Conception et méthodes de contrôle des bioréacteurs
Les bioréacteurs utilisés dans la production de viande cultivée reposent sur des systèmes d'échange de chaleur pour maintenir une température de 37 °C [1]. Les niveaux de pH sont généralement régulés par barbotage de CO₂, qui ajuste la concentration de CO₂ et le flux de l'espace de tête [9], ou par des pompes à seringue automatisées qui ajoutent des acides ou des bases selon les besoins [8].
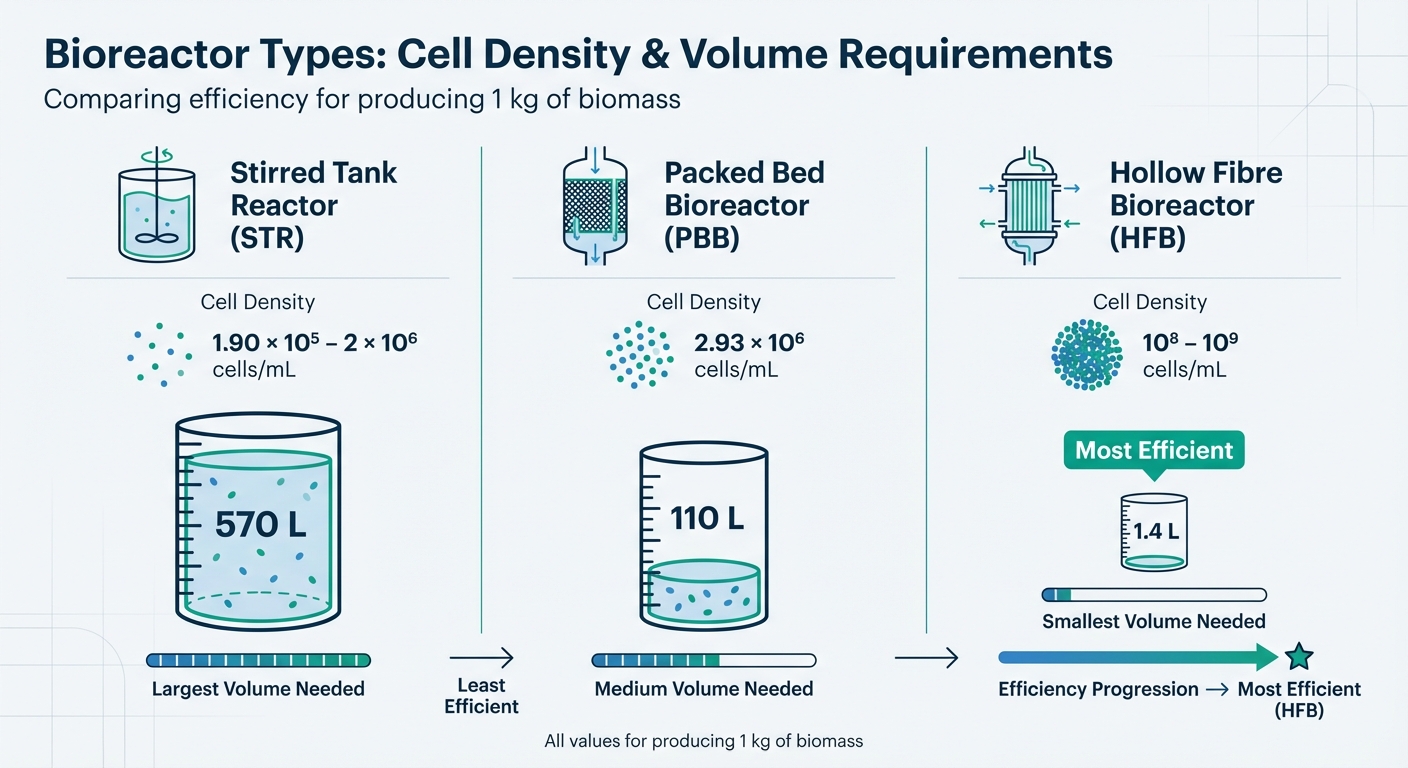
Les bioréacteurs à usage unique (SUBs) offrent une solution pratique en éliminant le besoin de nettoyage et en réduisant les risques de contamination. Ces systèmes peuvent être mis à l'échelle jusqu'à 2 000 L. Cependant, les volumes de travail nécessaires pour produire 1 kg de biomasse varient considérablement en fonction de la conception du bioréacteur : environ 570 L pour les réacteurs à cuve agitée (STRs), 110 L pour les bioréacteurs à lit fixe (PBBs), et seulement 1,4 L pour les bioréacteurs à fibres creuses (HFBs) [1].
Technologies de capteurs pour la surveillance
Une fois le bioréacteur installé, des capteurs précis jouent un rôle essentiel dans la surveillance du pH et de la température en temps réel. Pour la mesure du pH, les capteurs électrochimiques, en particulier les électrodes en verre, sont largement utilisés en raison de leur durabilité et de leur efficacité [7]. En ce qui concerne la température, les thermomètres à résistance sont la norme de l'industrie [7].
Ces dernières années, les capteurs optiques ont gagné en popularité, surtout dans les systèmes à usage unique. Ces capteurs utilisent des colorants fluorescents - tels que le sel disodique de l'acide 6,8-dihydroxypyrene-1,3-disulfonique - intégrés dans des patchs d'hydrogel. Ils sont compacts et aident à minimiser les risques de contamination [7].
Les capteurs sans contact sont une autre option, utilisant des membranes perméables comme la cellulose pour mesurer le pH de manière externe, ce qui réduit encore les risques de contamination [7]. Pendant ce temps, les systèmes colorimétriques suivent le pH en détectant les changements de couleur dans les indicateurs de rouge de phénol au sein du milieu. Ces systèmes utilisent des sources de lumière LED et des capteurs de lumière ambiante pour la détection [8]. Bien que les capteurs optiques soient moins invasifs, ils peuvent parfois être affectés par des problèmes tels que la liaison indicateur-protéine ou la turbidité du milieu. En revanche, les capteurs électrochimiques, bien que plus volumineux, sont plus robustes et fiables dans de tels scénarios [7].
Automatisation et systèmes de rétroaction
L'automatisation a révolutionné le contrôle des bioréacteurs, réduisant les erreurs humaines et améliorant la cohérence.Les systèmes automatisés avec des contrôles en boucle fermée sont particulièrement précieux pour la production de viande cultivée à long terme [8]. Par exemple, une étude de 2022 de l'Université de Chiang Mai a introduit un bioréacteur automatique imprimé en 3D avec surveillance colorimétrique du pH. Ce système a maintenu un pH de 7,4 ± 0,2 et a atteint plus de 80 % de viabilité cellulaire, améliorant significativement la prolifération cellulaire sur 72 heures par rapport aux changements manuels de milieu [8].
Un autre exemple notable vient de Merck Biodevelopment à Martillac, France. En décembre 2013, l'équipe a testé le Mobius CellReady 3L bioréacteur à usage unique pour les processus de perfusion. En utilisant la technologie Alternative Tangential Flow (ATF) pour la rétention cellulaire automatisée et l'échange de milieu, ils ont obtenu une augmentation de 2,9 fois de la production d'anticorps monoclonaux par rapport au mode batch.Les chercheurs Aurore Polès-Lahille et Flavien Thuet ont rapporté que ce système automatisé supportait des densités cellulaires de 33 millions de cellules/mL tout en maintenant des niveaux de pH entre 6,80 et 7,10 [10]. Ces systèmes fournissent des données continues, permettant des ajustements en temps réel pour optimiser la croissance et la productivité des cellules [8].
Des bioréacteurs avancés, des capteurs et des systèmes de contrôle pour la production de viande cultivée sont disponibles auprès de fournisseurs tels que
sbb-itb-ffee270
Résultats de l'étude : Résultats du contrôle du pH et de la température
Systèmes de contrôle automatisés vs manuels
En avril 2022, les chercheurs Suruk Udomsom, Pathinan Paengnakorn et leur équipe de l'Université de Chiang Mai ont testé un bioréacteur programmable automatisé utilisant des cellules de fibroblastes de souris L929. Ce système effectuait des rafraîchissements partiels du milieu toutes les 6 heures sur une période de 72 heures.Les résultats ? La prolifération cellulaire était significativement plus élevée dans le système automatisé par rapport aux méthodes de culture manuelles traditionnelles. Le bioréacteur a maintenu un pH stable de 7,4 ± 0,2, avec une viabilité cellulaire constamment supérieure à 80 % tout au long de l'expérience [8].
Les systèmes manuels, en revanche, rencontrent des défis. Lorsque le milieu est retiré d'un incubateur à CO₂ pour inspection, il commence à s'alcaliniser presque immédiatement, avec une constante de temps de 2 à 3 heures. Une fois remis dans l'incubateur, il faut environ 45 minutes pour revenir au pH correct [2]. Ces fluctuations peuvent déstabiliser les cellules. Les systèmes automatisés, cependant, sont conçus pour éliminer ces incohérences, assurant un environnement plus stable pour la croissance cellulaire.
Test des Différentes Plages de pH et de Température
En avril 2019, Johanna Michl et son équipe à l'Université d'Oxford ont exploré l'activité métabolique des cellules DLD1 sur une période d'incubation de 6 jours. Lorsque les niveaux de glucose étaient maintenus au-dessus de 12 mM, les cellules produisaient environ 20 mM d'acide lactique, entraînant une acidification du milieu. L'étude a révélé que même de légères déviations par rapport au pH optimal de 7,4 - spécifiquement, des variations supérieures à 0,3 unités - réduisaient les taux de prolifération à travers trois lignées cellulaires de mammifères : NCI-H747, DLD1 et Caco2 [2][3].
"La croissance cellulaire... était optimale à pH 7,4, mais lorsque le pH du milieu s'écartait de 7,4 de > 0,3 unités, les trois lignées cellulaires présentaient des taux de prolifération réduits." – Shannon G. Klein et al. [3]
Dans les cultures en lots standard, les changements de pH sont courants en raison de l'activité métabolique. Les cultures à haute densité, en particulier, peuvent voir les niveaux d'oxygène dissous chuter jusqu'à 0,95 % [3]. Ces résultats soulignent l'importance de maintenir la stabilité environnementale, surtout lors de l'augmentation de la production de viande cultivée.
Résultats pour les types de cellules de viande cultivée
En s'appuyant sur des études contrôlées, les simulations à échelle réduite ont mis en lumière les défis de maintenir la stabilité du pH et de la température dans les grands systèmes de bioréacteurs. En juillet 2017, des chercheurs de l'Université de Technologie de Vienne, dirigés par Matthias Brunner et Jens Fricke, ont utilisé un modèle à deux compartiments à échelle réduite pour simuler les conditions dans un bioréacteur agité de 10 à 12 m³. Ils ont exposé des cellules CHO à de brèves périodes de pH 9,0 pour simuler les inhomogénéités causées par l'ajout de base dans les systèmes à grande échelle.Même une exposition à court terme à de tels niveaux de pH élevés a perturbé le taux de croissance spécifique pendant la phase exponentielle, entraînant une densité cellulaire viable maximale réduite et un rendement de produit inférieur [4].
"Même une exposition à court terme des cellules à des valeurs de pH élevées lors de processus à grande échelle peut affecter la physiologie cellulaire et la performance globale du processus." – Matthias Brunner et al. [4]
Dans certaines cultures de cellules de mammifères, environ 90 % du glucose est métabolisé en lactate, ce qui souligne la nécessité d'un tamponnement actif du pH. Ces résultats soulignent le rôle crucial d'un contrôle environnemental précis tout au long du processus de production pour garantir une croissance cellulaire et une productivité optimales.
Sélection de l'équipement et mise à l'échelle des bioréacteurs
Comparaison des types de bioréacteurs pour la production de viande cultivée
Exigences de conception pour le contrôle du pH et de la température
Les bioréacteurs utilisés pour la production de viande cultivée doivent avoir des systèmes de contrôle précis pour maintenir une plage de pH étroite de 7,2 à 7,4 [1]. Des systèmes avancés comme les contrôleurs prédictifs non linéaires (NMPC) et les contrôleurs adaptatifs sont particulièrement efficaces pour réguler les taux d'alimentation tout en maintenant le pH et la température stables [12]. Les systèmes de rétroaction automatisés jouent également un rôle clé dans l'élimination des incohérences causées par les ajustements manuels.
Pour une régulation stable du pH, le tamponnage au CO₂/bicarbonate est très efficace.Le CO₂ agit comme un agent auto-tamponnant près du pH neutre et est non corrosif, ce qui en fait un choix approprié [1][2][11]. Pour gérer la chaleur métabolique produite pendant la croissance cellulaire, les bioréacteurs doivent être équipés d'échangeurs de chaleur ou de systèmes de circulation de fluide de service [1][12].
Les cellules de viande cultivée, en particulier les précurseurs de myocytes, sont très sensibles au stress hydrodynamique en raison de leur nature dépendante de l'ancrage. Ces cellules sont beaucoup plus fragiles que les cellules adaptées à la suspension [1]. Pour les protéger, des méthodes d'aération sans bulles comme les tubes en silicone perméables aux gaz sont préférées aux techniques de barbotage traditionnelles, qui peuvent causer un stress de cisaillement dommageable [1][11].De plus, l'intégration de capteurs de haute qualité - tels que des sondes en ligne pour le pH et l'oxygène dissous (pO₂), ainsi que des capteurs de gaz résiduels pour surveiller la tension de dioxyde de carbone (pCO₂) - permet un contrôle environnemental en temps réel [13].
Bien que ces stratégies de contrôle fonctionnent bien dans les systèmes plus petits, maintenir le même niveau de précision devient de plus en plus complexe à mesure que la taille du bioréacteur augmente.
Défis de mise à l'échelle dans les bioréacteurs plus grands
Le passage des bioréacteurs des environnements de laboratoire à la production commerciale introduit une série de défis. À des volumes plus importants, des gradients de concentration d'ions hydrogène, de dioxyde de carbone et d'oxygène dissous peuvent apparaître, entraînant des conditions environnementales inégales [13][14]. Ces incohérences sont particulièrement problématiques pour la viande cultivée, où une croissance cellulaire uniforme est essentielle.Par exemple, dans les processus fed-batch à grande échelle, les niveaux de CO₂ dissous (dCO₂) peuvent atteindre 75–225 mg/L, tandis que l'oxygène dissous reste en dessous de 8,0 mg/L [11]. Cette accumulation de CO₂ peut entraîner une baisse des niveaux de pH jusqu'à 6,8 [13].
"La compréhension des interactions des paramètres de processus est particulièrement utile lors de l'augmentation de l'échelle du processus, où des variations indésirables de pH, de tension d'oxygène dissous (pO₂) et de tension de dioxyde de carbone (pCO₂) sont les plus susceptibles de se produire." – Matthias Brunner et al. [13]
Maintenir une température constante de 37°C est un autre facteur critique, nécessitant l'élimination continue de la chaleur métabolique [1]. Atteindre cet équilibre implique une agitation suffisante pour assurer l'homogénéité, mais des vitesses d'hélice excessives peuvent endommager les cellules sensibles au cisaillement [1].Pour résoudre ces problèmes à des échelles commerciales, il peut être nécessaire de découpler le contrôle du pH et du pCO₂. Par exemple, utiliser HCl ou NaOH pour les ajustements de pH au lieu de se fier uniquement au gaz CO₂ peut prévenir la toxicité du CO₂ tout en maintenant des niveaux de pH stables [13].
| Type de Bioréacteur | Densité Cellulaire Atteignable (cellules/mL) | Volume de Travail pour 1 kg de Biomasse |
|---|---|---|
| Cuve Agitée (STR) | 1,90 × 10⁵ – 2 × 10⁶ | 570 L |
| Lit Fixe (PBB) | 2,93 × 10⁶ | 110 L |
| Fibre Creuse (HFB) | 10⁸ – 10⁹ | 1.4 L |
Approvisionnement en Équipement Grâce à Cellbase
Trouver des bioréacteurs qui répondent aux exigences spécifiques de la production de viande cultivée peut être une tâche ardue.
Contrairement aux plateformes générales de fourniture de laboratoire,
Conclusion
Maintenir un contrôle précis du pH et de la température est absolument crucial dans la production de viande cultivée. Ces facteurs impactent directement la viabilité cellulaire et la cohérence de la croissance. Même une légère déviation - seulement 0,3 unités de pH en dehors de la plage optimale - peut entraver significativement la prolifération cellulaire [3]. De même, une température stable est essentielle pour préserver l'équilibre métabolique qui soutient la croissance cellulaire.Johanna Michl de l'Université d'Oxford souligne cette sensibilité, notant :
"Les processus biologiques sont extrêmement sensibles à la chimie acide-base" [2]
Cette précision devient encore plus difficile à atteindre à des échelles commerciales, où le maintien de l'homéostasie sur de grands volumes introduit des défis d'ingénierie significatifs.
Le passage des méthodes de laboratoire manuelles aux bioprocédés automatisés est une étape clé pour rendre la production de viande cultivée financièrement durable et reproductible. L'automatisation élimine les incohérences liées à la surveillance manuelle. Les systèmes de bioréacteurs avancés - allant des cuves agitées aux configurations à fibres creuses - offrent des capacités de densité cellulaire variées tout en affectant l'empreinte physique de l'installation et l'efficacité des milieux.
Cependant, le passage à l'échelle supérieure apporte son propre lot de complications.Les bioréacteurs à grande échelle, souvent dans la gamme de 10 à 12 m³, sont particulièrement sujets aux incohérences de pH. Par exemple, des pics de pH localisés peuvent atteindre jusqu'à 9,0 lors des ajouts de base [4], soulignant la nécessité de mécanismes de contrôle robustes. Shannon G. Klein du Centre de recherche de la mer Rouge souligne l'importance de maintenir des conditions stables :
"Maintenir des conditions physiologiques pertinentes dans les cultures cellulaires est d'une importance capitale pour assurer la reproductibilité des résultats publiés et la pertinence translationnelle des données expérimentales pour les applications cliniques" [3]
Pour relever ces défis, des équipements spécialisés et des systèmes de surveillance avancés sont essentiels. Des plateformes comme
Avec plus de 175 entreprises désormais actives dans l'industrie de la viande cultivée à travers six continents et des investissements dépassant 2,4 milliards de livres sterling [15], le maintien de conditions optimales de pH et de température est essentiel pour le succès commercial. Les innovations dans la conception des bioréacteurs, l'automatisation et l'approvisionnement spécialisé permettent à l'industrie de passer des laboratoires de recherche aux installations de production à grande échelle. Ces avancées façonnent l'avenir de la viande cultivée, aidant le secteur à surmonter ses défis les plus pressants.
FAQ
Pourquoi est-il important de contrôler le pH et la température lors de la production de viande cultivée ?
Un contrôle précis du pH et de la température est absolument crucial lors de la production de viande cultivée, car les cellules de mammifères sont très sensibles même aux changements environnementaux mineurs. La plupart des lignées cellulaires utilisées dans ce processus prospèrent à une température optimale d'environ 37°C. Cependant, même de légères fluctuations - telles que des températures dépassant 38°C ou tombant trop bas - peuvent avoir un impact significatif sur la viabilité cellulaire, ralentir leur croissance ou interférer avec les fonctions métaboliques. De même, maintenir le pH stable dans la plage de 7,0 à 7,4 est tout aussi important. Les variations dans cette plage, souvent causées par des sous-produits métaboliques comme le CO₂ ou le lactate, peuvent nuire à la croissance cellulaire et compromettre la qualité des tissus.
Dans les bioréacteurs à grande échelle, maintenir un pH et une température uniformes dans tout le système devient encore plus critique.Une régulation cohérente à travers le bioréacteur assure un développement cellulaire prévisible et soutient la croissance, la différenciation et la texture du produit final. Elle aide également à minimiser les ajustements coûteux par essais et erreurs pendant la production. Pour les chercheurs et les fabricants de l'industrie de la viande cultivée, des plateformes telles que
Comment les bioréacteurs automatisés améliorent-ils la croissance cellulaire par rapport aux systèmes manuels ?
Les bioréacteurs automatisés apportent un nouveau niveau de précision dans la gestion des paramètres clés tels que la température, le pH, et l'oxygène dissous, garantissant les conditions idéales pour la croissance cellulaire. Par exemple, ces systèmes maintiennent généralement des températures autour de 37°C et des niveaux de pH entre 7,0 et 7,4.Équipés de capteurs avancés, ils surveillent en continu ces variables et effectuent des ajustements rapides - qu'il s'agisse de chauffage, de refroidissement, de régulation du débit de gaz ou d'équilibrage des niveaux d'acide et de base. Cette réponse quasi-instantanée élimine les retards et les inexactitudes souvent observés avec les interventions manuelles. Le résultat ? Un environnement stable qui minimise le stress cellulaire, améliore l'efficacité métabolique et favorise des taux de croissance et des densités cellulaires plus élevés.
En plus de cela, les bioréacteurs modernes utilisent des analyses basées sur le cloud pour suivre les performances, optimiser les calendriers d'alimentation et affiner les processus à travers différentes séries de production. Dans le contexte de la viande cultivée, ces innovations signifient des rendements cellulaires plus élevés, un développement tissulaire accéléré et des coûts de production réduits. Pour ceux dans le domaine, des plateformes comme
Quels sont les principaux défis de l'augmentation de l'échelle des bioréacteurs pour la production de viande cultivée ?
Augmenter l'échelle des bioréacteurs pour produire de la viande cultivée n'est pas une mince affaire. À mesure que la taille de ces réacteurs augmente, maintenir un contrôle strict sur des facteurs tels que pH, température, et gaz dissous devient de plus en plus difficile. Ces fluctuations peuvent entraîner une croissance cellulaire inégale et des incohérences dans le produit final. Les obstacles courants incluent un mélange inefficace, un transfert d'oxygène limité et des réponses de capteurs plus lentes, qui peuvent tous perturber l'équilibre délicat nécessaire pour une culture cellulaire optimale.
Une autre couche de complexité provient de l'utilisation de lignées cellulaires adhérentes. Ces cellules nécessitent soit de grandes surfaces, soit des systèmes de micro-supports spécialisés pour prospérer. À mesure que les systèmes augmentent en échelle, il est crucial de soutenir correctement ces cellules sans les soumettre à un stress mécanique qui pourrait causer des dommages. En plus de cela, les bioréacteurs à l'échelle industrielle doivent assurer une distribution uniforme de la température, maintenir la stérilité et respecter des normes strictes de sécurité alimentaire - tout en gardant les coûts gérables.
Pour relever ces défis, des plateformes comme











