Le passage à l'échelle des bioréacteurs pour la production de viande cultivée - des petits systèmes (1–5 L) aux grands systèmes (1 000+ L) - pose des défis énergétiques. Les volumes plus importants nécessitent plus de puissance pour le mélange, le transfert d'oxygène et le contrôle de la chaleur, mais ils offrent également des gains d'efficacité. Par exemple, passer de 5 m³ à 100 m³ peut réduire la consommation d'énergie spécifique jusqu'à 88 %. Cependant, un mélange plus lent dans les grands systèmes peut créer des déséquilibres en oxygène et en nutriments, affectant la croissance cellulaire. Les systèmes de contrôle automatisés et des stratégies comme l'opération "point de saturation" aident à équilibrer l'utilisation de l'énergie et à maintenir la viabilité cellulaire. Voici ce que vous devez savoir :
- Petits bioréacteurs : Haute énergie par litre, mélange rapide, élimination de la chaleur plus facile, mais pas idéal pour la production à grande échelle.
- Grands bioréacteurs : Moins d'énergie par litre, mélange plus lent, gestion de la chaleur et des gaz plus complexe, mais mieux pour la production commerciale.
L'efficacité énergétique s'améliore avec l'échelle, mais maintenir la qualité des cellules nécessite une automatisation avancée et un contrôle précis de l'agitation, de l'aération et de la température.
Conception et mise à l'échelle du processus de fermentation : Traitement en amont (USP)
sbb-itb-ffee270
1. Bioréacteurs à petite échelle (1–5 L)
Les bioréacteurs à l'échelle de laboratoire fonctionnent dans des conditions énergétiques très différentes de celles de leurs homologues industriels. À cette plus petite échelle, la performance des processus est généralement plus influencée par la cinétique cellulaire que par les phénomènes de transport [2]. Le rapport surface/volume élevé rend l'élimination de la chaleur plus simple, mais cela signifie également que les paramètres d'agitation ne peuvent pas être directement mis à l'échelle pour des systèmes plus grands. Cette dynamique conduit souvent à ce que l'agitation soit le principal moteur de la consommation d'énergie à ce stade.
Dans les systèmes à petite échelle, l'utilisation d'énergie est largement dictée par l'agitation et le mélange.Pour atteindre la même puissance volumétrique (P/V) que les bioréacteurs plus grands, les plus petits nécessitent des vitesses d'agitation plus élevées en raison de leurs diamètres d'hélice plus petits [2][9]. Pour les cultures de cellules de mammifères - essentielles dans la production de viande cultivée - une P/V de 20–40 W/m³ est généralement optimale. Cette plage soutient la croissance cellulaire tout en minimisant l'agrégation cellulaire [5].
L'aération ajoute une autre couche de complexité. Le coefficient de transfert de masse volumétrique (kLa) mesure l'efficacité avec laquelle l'oxygène atteint les cellules. Cependant, augmenter l'agitation pour améliorer le kLa peut également augmenter le stress de cisaillement hydromécanique. Pour les processus sensibles au cisaillement, comme la production de lentivirus, les diffuseurs à tuyau ouvert sont souvent préférés, car les micro-diffuseurs peuvent réduire les titres viraux fonctionnels jusqu'à 25% [5].En opérant près du point d'inondation, avec une agitation plus faible et une aération plus élevée, on peut aider à équilibrer l'utilisation d'énergie tout en répondant aux besoins de transfert d'oxygène [1].
La gestion thermique dans ces bioréacteurs est généralement assurée par des systèmes de refroidissement à base d'eau, tels que des gaines ou des serpentins internes, pour dissiper l'excès de chaleur. Chaque watt d'agitation mécanique génère de la chaleur qui doit être éliminée efficacement. De plus, l'activité métabolique microbienne produit environ 14,7 kJ de chaleur par gramme d'oxygène consommé [7]. La puissance de réfrigération requise dépend de la chaleur totale générée et de l'efficacité du système de refroidissement, avec un coefficient de performance typique d'environ 0,6. Ajuster les réglages de l'agitateur pendant les différentes étapes d'une opération par lots peut réduire considérablement la consommation d'énergie [7].
Les bioréacteurs modernes à petite échelle sont équipés de systèmes d'automatisation qui utilisent des capteurs et des algorithmes pour réguler dynamiquement le pH, les niveaux d'oxygène et la température. Ces systèmes garantissent que seul le refroidissement ou l'agitation nécessaire est appliqué pendant chaque phase de croissance, réduisant ainsi le gaspillage d'énergie [6][10]. Pour les entreprises de viande cultivée qui s'approvisionnent en équipements via des plateformes comme
2.Grands Bioréacteurs (1 000+ L)
Lors de l'augmentation de la production, les défis augmentent à mesure que les temps de mélange augmentent considérablement - passant de seulement 10 secondes dans de petits systèmes de 3 litres à un temps beaucoup plus long de 80 à 180 secondes dans des cuves massives allant de 5 000 à 20 000 litres. Ces temps de mélange plus lents créent des obstacles opérationnels, tels que des gradients d'oxygène dissous et des changements métaboliques, qui peuvent réduire la densité cellulaire viable jusqu'à 15 % pendant la phase stationnaire [4]. Pour les cultures de cellules de mammifères utilisées dans la production de viande cultivée, franchir le seuil de 90 secondes de temps de mélange peut déclencher des changements métaboliques, entraînant l'accumulation de lactate [4]. Pour résoudre ces problèmes, des ajustements des stratégies d'agitation et d'aération sont essentiels à plus grande échelle.
À ces volumes plus importants, les besoins énergétiques évoluent. Initialement, l'agitation joue un rôle plus important dans l'utilisation de l'énergie lorsque les taux de transfert d'oxygène sont faibles.Cependant, à mesure que la croissance cellulaire s'accélère, l'aération devient le facteur dominant, représentant jusqu'à 70 % de la consommation d'énergie. Opérer près du point de débordement - un point où le flux de gaz perturbe le mélange liquide - reste critique, mais à cette échelle, il s'agit principalement de gérer la charge énergétique de l'aération. Augmenter la pression de l'espace libre est une autre tactique efficace, car elle augmente la solubilité de l'oxygène et réduit le besoin de vitesses d'agitation élevées lorsque les taux de transfert d'oxygène sont élevés [9].
La gestion thermique devient également plus complexe à grande échelle mais offre des opportunités pour une plus grande efficacité. Par exemple, les fermentations industrielles montrent une large gamme de besoins en énergie : la fermentation de l'acide itaconique nécessite en moyenne 0,51 kW/m³, tandis que la production de lysine, qui demande plus d'oxygène, nécessite 2,61 kW/m³ [1]. Les systèmes de refroidissement atteignent généralement une efficacité de réfrigération d'environ 0.6, bien que dans des conditions idéales, les coefficients de performance puissent atteindre jusqu'à 8,6 [7].
Passer de 5 m³ à 100 m³ peut réduire les besoins en énergie spécifique jusqu'à 88 %, à condition que les opérations soient optimisées [9]. Cela est crucial pour la production de viande cultivée, où l'équilibre entre l'efficacité énergétique et le maintien de la qualité du produit est essentiel. La modélisation mécaniste permet désormais aux équipes de production de prévoir la génération de chaleur et les besoins en énergie en combinant les données de croissance microbienne avec des modèles thermodynamiques [9][1]. Pour les entreprises du secteur de la viande cultivée qui recherchent des systèmes à grande échelle via des plateformes comme
Pour tirer pleinement parti des économies d'énergie, les paramètres physiques optimisés doivent être associés à une automatisation précise. Les systèmes d'automatisation à cette échelle doivent jongler efficacement avec de multiples exigences. Une stratégie consiste à segmenter le processus de fermentation en intervalles où la puissance de l'agitateur reste constante tandis que le débit d'air s'ajuste pour correspondre à l'absorption d'oxygène, minimisant ainsi l'utilisation d'énergie [7]. Les systèmes de contrôle modernes surveillent également les niveaux d'oxygène dissous en temps réel, ajustant dynamiquement les réglages mécaniques et pneumatiques pour éviter les perturbations métaboliques qui se produisent lorsque les temps de mélange dépassent les limites physiologiques [4].
Avantages et Inconvénients
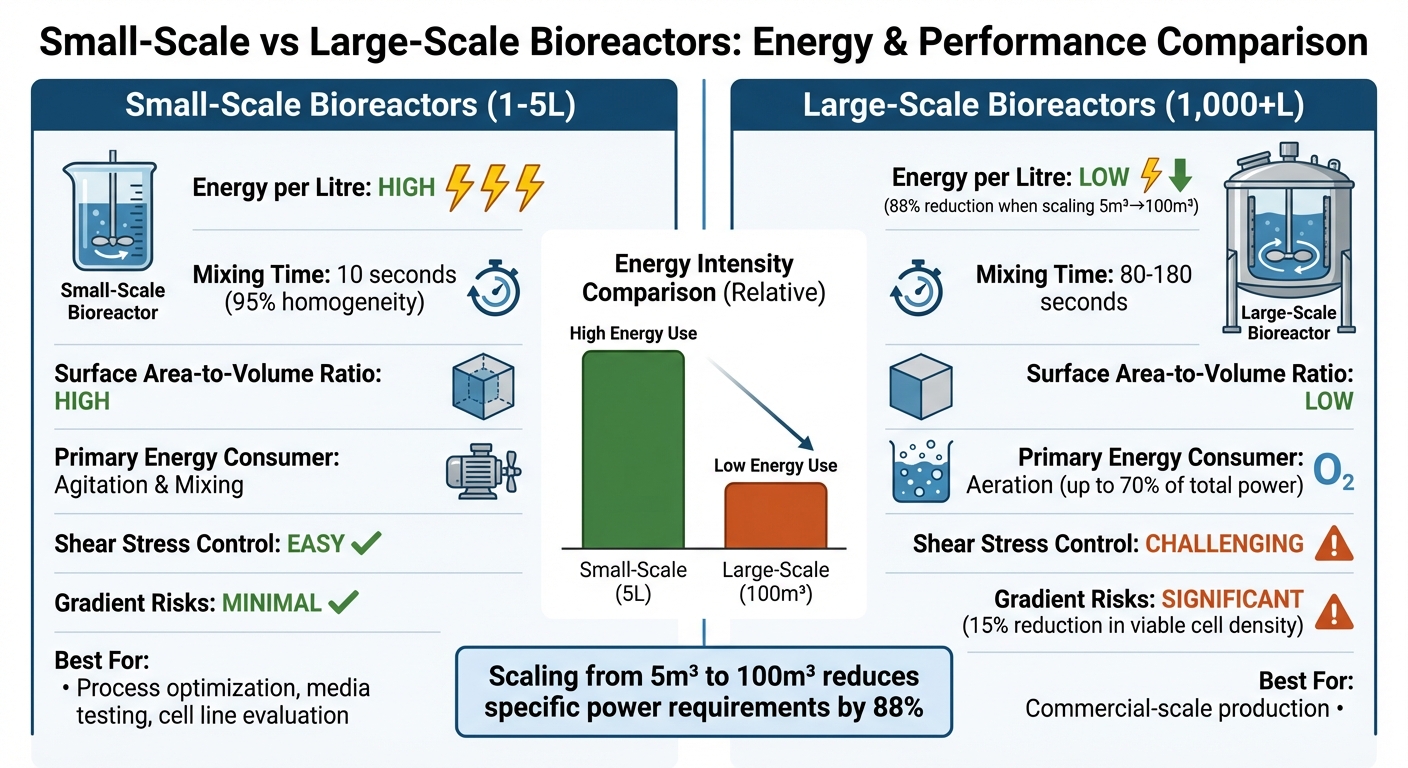
Comparaison de l'Efficacité Énergétique des Bioréacteurs à Petite et Grande Échelle
Choisir entre des bioréacteurs à petite et grande échelle pour produire de la viande cultivée implique de peser l'efficacité énergétique, la complexité opérationnelle et l'adéquation aux besoins de production. Voici un aperçu plus détaillé de leur comparaison :
| Caractéristique | Bioprocédés à petite échelle (1–5 L) | Bioprocédés à grande échelle (1 000+ L) |
|---|---|---|
| Intensité énergétique par litre | Élevée ; nécessite plus de puissance spécifique pour maintenir l'uniformité et le transfert d'oxygène [9][8] | Basse ; le passage de 5 m³ à 100 m³ peut réduire les besoins en puissance spécifique de 88 % [9] |
| Efficacité de mélange | E |
Pauvre ; prend 80–180 secondes, augmentant le risque de gradients [4] |
| Rapport surface/volume | Élevé; favorise l'élimination efficace de la chaleur et le dépouillement du CO₂ [2] | Faible; pose des défis dans la gestion de la chaleur et des échanges gazeux [2] |
| Consommateur d'énergie principal | Agitation et mélange [9] | Aération (jusqu'à 70 % de la puissance totale pendant la forte croissance cellulaire) [9] |
| Gestion du stress de cisaillement | Plus facile à contrôler; les cellules sont moins exposées aux forces dommageables [3][4] | Plus difficile à gérer; une agitation élevée peut nuire aux cellules animales fragiles [3][4] |
| Risques liés aux gradients | Minimaux; le mélange rapide évite les perturbations métaboliques | Significatif ; les gradients d'oxygène sur 90 secondes peuvent réduire la densité cellulaire viable de 15% [4] |
| Adaptabilité de la viande cultivée | Idéal pour optimiser les processus, tester les milieux et évaluer les lignées cellulaires [3][8] | Critique pour la production à l'échelle commerciale ; nécessite des conceptions spécialisées à faible cisaillement [11][3] |
Les bioréacteurs de paillasse excellent dans l'obtention d'un mélange rapide et uniforme, ce qui les rend parfaits pour affiner les conditions de culture cellulaire.Cependant, leurs exigences énergétiques élevées par litre les rendent moins pratiques pour une production à grande échelle. D'autre part, les bioréacteurs à grande échelle sont beaucoup plus économes en énergie par litre, mais ils présentent des défis opérationnels qui peuvent affecter la viabilité cellulaire. Par exemple, des temps de mélange plus lents peuvent créer des gradients d'oxygène et de nutriments, ce qui peut perturber la croissance des cellules sensibles au cisaillement utilisées dans la viande cultivée.
Pour les entreprises travaillant avec des fournisseurs comme
Conclusion
Le passage à des bioréacteurs de plus grande taille offre une réduction considérable de la consommation d'énergie par litre. Par exemple, passer d'un bioréacteur de 5 m³ à un bioréacteur de 100 m³ peut réduire la demande de puissance spécifique de 88% [9], rendant la production à grande échelle beaucoup plus rentable. Cependant, cette efficacité s'accompagne d'un compromis. Alors que les petits bioréacteurs réalisent un mélange uniforme en environ 10 secondes, les grands récipients industriels prennent beaucoup plus de temps - environ 80 à 180 secondes. Ce mélange plus lent peut créer des gradients d'oxygène dissous nuisibles [4].
Ce changement d'efficacité modifie également l'endroit où l'énergie est consommée. Dans les petits systèmes, la majeure partie de l'énergie est consacrée à l'agitation. Mais à l'échelle commerciale, en particulier avec des densités cellulaires élevées, l'aération devient le principal consommateur d'énergie, représentant jusqu'à 70% de la demande énergétique totale [9].
L'automatisation est essentielle pour relever ces défis. Des outils comme CAE, CFD et IA permettent aux producteurs de modéliser et d'optimiser l'équilibre entre l'agitation et l'aération avant de passer à l'échelle physique [3]. De plus, les capteurs en temps réel qui surveillent les niveaux d'oxygène dissous et de dioxyde de carbone permettent des ajustements dynamiques grâce à des systèmes de contrôle automatisés. Ces systèmes aident à prévenir les changements métaboliques coûteux, en maintenant l'utilisation d'énergie par kilogramme de produit sous contrôle et en ouvrant la voie à des stratégies de mise à l'échelle plus intelligentes.
Pour les producteurs cherchant à s'étendre, fonctionner près du point de débordement est souvent l'approche la plus efficace. Cette stratégie privilégie une aération intense par rapport à une agitation énergivore [1] . Des techniques comme la pressurisation de l'espace de tête peuvent encore réduire le besoin d'agitation lors du transfert d'oxygène maximal [9]. Lors de l'approvisionnement en équipements, des plateformes telles que
FAQs
Comment l'automatisation améliore-t-elle l'efficacité énergétique dans les bioréacteurs à grande échelle ?
L'automatisation joue un rôle crucial dans l'amélioration de l'efficacité énergétique dans les bioréacteurs à grande échelle en permettant des ajustements précis et en temps réel des paramètres critiques tels que l'agitation, l'aération, la température et les niveaux d'oxygène dissous.Au lieu de s'en tenir à des réglages rigides et excessivement prudents, les systèmes automatisés s'appuient sur des données de capteurs en temps réel pour affiner ces facteurs, garantissant que l'énergie est utilisée efficacement pour maintenir les conditions idéales pour la croissance cellulaire.
Ce contrôle dynamique est particulièrement bénéfique lors des phases de démarrage et de montée en échelle, où l'automatisation permet des ajustements rapides aux conditions de processus changeantes, réduisant ainsi l'utilisation inutile d'énergie. En alignant les systèmes de contrôle avec les caractéristiques spécifiques des conceptions de bioréacteurs - tels que les systèmes à cuve agitée ou à circulation d'air - l'automatisation améliore non seulement la cohérence mais réduit également l'énergie nécessaire pour produire chaque kilogramme de viande cultivée. Ces avancées sont essentielles pour augmenter la production de manière efficace tout en gardant l'impact environnemental sous contrôle.
Quels problèmes peuvent survenir en raison de temps de mélange plus lents dans les bioréacteurs à grande échelle ?
Dans les bioréacteurs à grande échelle, un mélange plus lent peut entraîner une distribution inégale des nutriments et de l'oxygène, conduisant au développement de gradients. Ces gradients peuvent perturber la croissance cellulaire, entraîner une accumulation inégale des déchets et réduire l'efficacité globale du système.
Pour résoudre ces problèmes, les opérateurs ont souvent recours à des apports énergétiques plus élevés. Bien que cette approche aide, elle augmente également la consommation d'énergie et les coûts d'exploitation. Trouver des solutions à ces défis est essentiel pour maintenir l'efficacité énergétique et atteindre des performances optimales lors de la montée en échelle.
Pourquoi le fonctionnement proche du point de débordement est-il considéré comme économe en énergie lors de la montée en échelle des bioréacteurs ?
Le fonctionnement proche du point de débordement lors de la montée en échelle des bioréacteurs est souvent considéré comme une approche économe en énergie. Cette méthode optimise le mélange gaz-liquide, ce qui est crucial pour un transfert de masse efficace. En maximisant le débit de gaz sans pousser le système vers l'instabilité, le bioréacteur peut fonctionner efficacement tout en maîtrisant la consommation d'énergie.
Cela dit, fonctionner près de ce seuil nécessite une surveillance et un contrôle attentifs. Dépasser le point de débordement peut perturber le système ou entraîner une baisse de performance, faisant de la précision un facteur clé pour maintenir l'efficacité.
Articles de Blog Connexes
- Utilisation de l'Énergie dans les Bioréacteurs : Stratégies d'Optimisation
- Analyse des Coûts : Mise à l'Échelle des Lignées Cellulaires pour la Culture en Bioréacteur
- Meilleurs Capteurs QA pour la Surveillance des Bioréacteurs
- Contrôle du pH et de la Température : Impact sur la Croissance Cellulaire











