La validation des milieux de culture est une étape obligatoire pour les entreprises de viande cultivée cherchant à obtenir l'approbation sur le marché britannique. Ce processus garantit la sécurité, la qualité et la conformité des produits sous des cadres réglementaires stricts tels que le Règlement sur les nouveaux aliments du Royaume-Uni (UE 2015/2283). Voici ce que vous devez savoir:
- Exigences clés : Les milieux de culture doivent répondre aux normes de toxicologie, de contrôle de la contamination, de qualité nutritionnelle et d'allergénicité.
- Réglementations britanniques : La Food Standards Agency (FSA) exige la conformité aux principes HACCP et la classification sous Produits d'Origine Animale (POAO).
- Normes mondiales : Bien que le Royaume-Uni et l'UE partagent des cadres similaires, les États-Unis suivent les réglementations CGMP en vertu de la loi FD&C.
- Processus de Validation : Inclut des tests approfondis de composition, de pureté, de fonctionnalité et de conformité des fournisseurs, accompagnés d'une documentation solide.
- Initiatives de Soutien : Le bac à sable réglementaire de 1,6 million de livres sterling du Royaume-Uni, lancé en 2025, aide les entreprises à respecter ces normes.
Une validation appropriée garantit la sécurité, renforce la confiance et s'aligne sur les exigences légales. L'article explore plus en détail le processus étape par étape, y compris les méthodes de test, les qualifications des fournisseurs et les conseils pour la soumission réglementaire.
Normes Réglementaires pour les Milieux de Croissance
Normes et Lignes Directrices
Les milieux de croissance, un composant essentiel dans la production de viande cultivée, doivent répondre à des normes réglementaires internationales rigoureuses. Ces normes varient selon les régions, chacune ayant des exigences spécifiques en matière de composition, de sécurité et de pureté.
Au Royaume-Uni, les milieux de culture sont réglementés par le Règlement sur les nouveaux aliments (Règlement (UE) 2015/2283 assimilé). Avant d'être approuvés pour le marché, une évaluation approfondie de la sécurité est requise [1]. La Food Standards Agency (FSA) classe les produits cultivés en cellules comme des Produits d'Origine Animale (POAO) selon le Règlement (CE) 853/2004. Cette classification oblige les producteurs à mettre en œuvre des systèmes de gestion de la sécurité alimentaire basés sur les principes de l'Analyse des Dangers et des Points Critiques pour leur Maîtrise (HACCP) [3]. La FSA est également en train de développer des directives techniques détaillées sur la composition des milieux de culture, avec d'autres mises à jour attendues [1]. Ces cadres fournissent la base pour des exigences réglementaires plus spécifiques.
Aux États-Unis, l'approche diffère.Les composants des milieux de culture doivent répondre aux exigences des Bonnes Pratiques de Fabrication actuelles (CGMP) décrites dans la Section 501(a)(4)(B) de la Federal Food, Drug, and Cosmetic Act (FD&C Act) [4]. La FDA catégorise les composants des milieux comme des "fournitures et réactifs", régis par les parties 210 et 211 du 21 CFR. Ces composants doivent subir une vérification de qualité pour prévenir la contamination [4]. Fait intéressant, les composants synthétiques des milieux de viande cultivée - tels que les acides aminés, les vitamines et les sels - sont souvent classés comme dispositifs médicaux de Classe I sous le 21 CFR 864.2220, les exemptant des exigences de notification préalable à la mise sur le marché [6][7].
Dans l'Union européenne, le cadre réglementaire s'aligne étroitement avec celui du Royaume-Uni, car il suit également le Règlement (UE) 2015/2283.L'Autorité européenne de sécurité des aliments (EFSA) supervise le processus d'autorisation [1]. Selon les directives ICH Q6B, les composants des milieux de culture, y compris les antibiotiques, les inducteurs et d'autres constituants, sont traités comme des impuretés liées au processus. Ces impuretés doivent être contrôlées et réduites à des niveaux acceptables [5]. Dans la mesure du possible, les excipients et les réactifs doivent être conformes aux normes pharmacopéiques [5].
| Juridiction | Réglementation principale | Classification | Système de sécurité | Surveillance des médias |
|---|---|---|---|---|
| Royaume-Uni (GB) | Règlement assimilé (UE) 2015/2283 [1] | Produit d'origine animale (POAO) [3] | HACCP (Reg 852/2004) [3] | Guide de la sandbox FSA/FSS [1] |
| Union Européenne / NI | Règlement (UE) 2015/2283 [1] | Produit d'origine animale (POAO) [3] | HACCP (Reg 852/2004) [3] | Processus d'autorisation de l'EFSA [1] |
| États-Unis | FD&C Act Section 501(a)(4)(B) [4] | Nouveau médicament vétérinaire / Aliment [4] | CGMP (21 CFR 210/211) [4] | FDA CVM / USDA-FSIS [4] |
Exigences réglementaires pour la viande cultivée
Les producteurs de viande cultivée doivent s'assurer que chaque lot de milieu de culture respecte des normes strictes de sécurité et de qualité.La validation des milieux de culture est un aspect clé du cadre réglementaire plus large pour ces produits. Selon les principes HACCP (Règlement (CE) 852/2004), le milieu de culture est identifié comme un intrant principal et une source potentielle de contamination - chimique, microbienne ou autre [3]. La FSA souligne cette préoccupation:
"Les principaux dangers dans la production de produits cultivés en cellules concernent l'identité de la lignée cellulaire (et sa cohérence), les dangers introduits lors du processus de production (contamination microbiologique, milieux de culture et composants résiduels dans le produit final), et les allergènes." [3]
Si des modifications sont apportées à la formulation du milieu de culture, un examen HACCP immédiat est requis [3].Au Royaume-Uni, la validation doit avoir lieu avant la mise en œuvre pour garantir l'exactitude des diagrammes de flux et l'efficacité des mesures de contrôle [3].
Aux États-Unis, la FDA exige que tous les réactifs et composants de milieu répondent à des normes de qualité strictes pour éviter l'introduction d'agents nocifs [4]. Les fournisseurs et les laboratoires sous contrat doivent se conformer aux réglementations CGMP, et tout fournisseur ne respectant pas ces normes doit être retiré pour éviter que les produits ne soient classés comme "adultérés" [4]. La FDA souligne l'importance de cela:
"Tous les nouveaux médicaments vétérinaires, y compris les ACTP, doivent être fabriqués conformément aux CGMP pour garantir que ces médicaments répondent aux exigences de la Federal Food, Drug, and Cosmetic Act (FD&C Act) en matière de sécurité." [4]
Actuellement, plusieurs entreprises participant au bac à sable réglementaire du Royaume-Uni - telles que BlueNalu, Gourmey, Hoxton Farms, Mosa Meat, Roslin Technologies, Vital Meat, et Vow - collaborent avec la FSA pour affiner ces normes techniques [1]. Selon la réglementation britannique, les entreprises peuvent demander jusqu'à cinq ans de protection des données pour les informations confidentielles soumises lors du processus d'autorisation [1].
Étapes pour la Validation des Milieux de Croissance
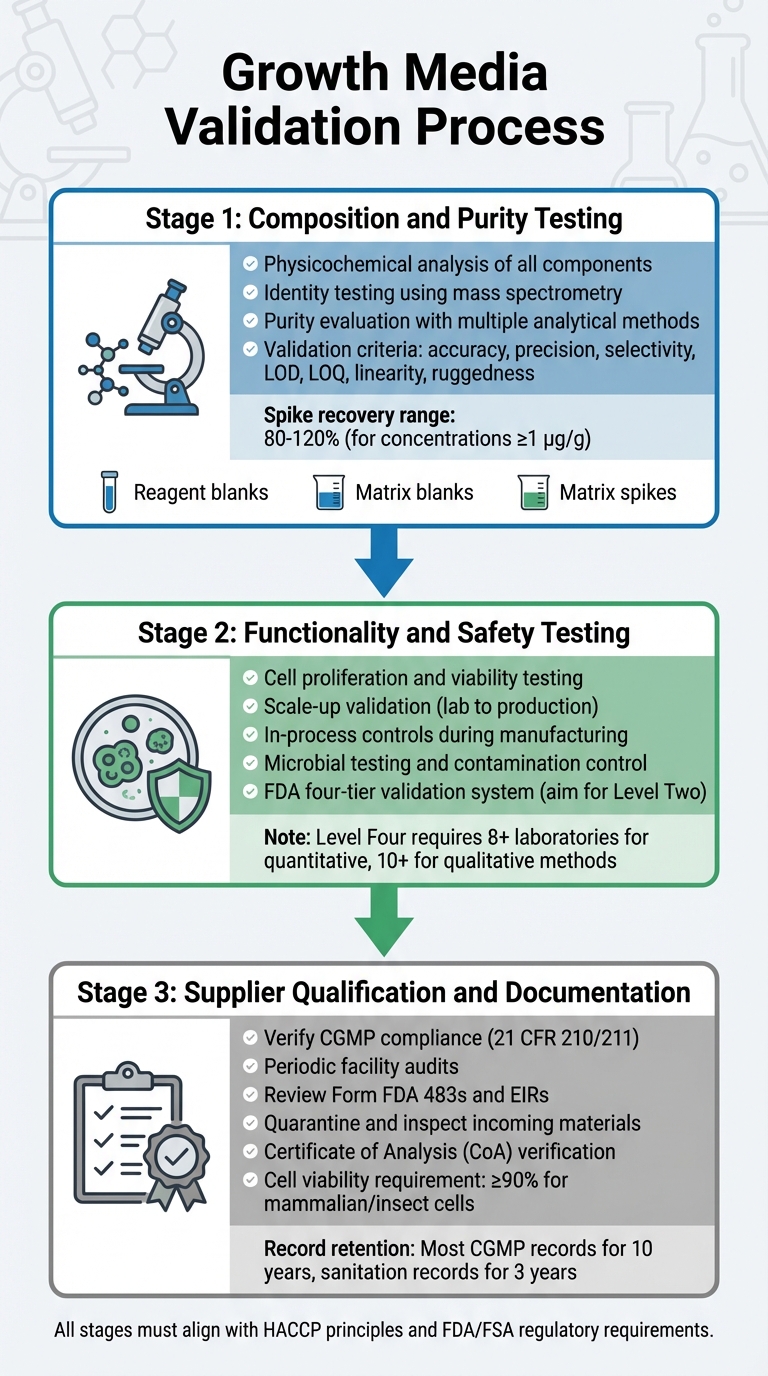
Processus de Validation des Milieux de Croissance pour l'Approbation Réglementaire de la Viande Cultivée
La validation des milieux de croissance implique un processus détaillé qui examine sa composition, sa fonctionnalité, sa sécurité et la conformité des fournisseurs. Chaque étape s'appuie sur la précédente, garantissant un processus de validation robuste conforme aux exigences réglementaires. Cela inclut des tests de composition, de fonctionnalité et de conformité des fournisseurs.
Tests de Composition et de Pureté
La première étape se concentre sur une analyse physico-chimique approfondie de chaque composant. Cela implique d'identifier la composition précise, les propriétés physiques et la structure moléculaire des ingrédients tels que les acides aminés, les vitamines et les sels inorganiques [5].Pour confirmer les structures moléculaires, les tests d'identité utilisent des méthodes hautement spécifiques, y compris des techniques physico-chimiques, biologiques et immunochimiques. Des outils comme la spectrométrie de masse sont utilisés pour vérifier les identités moléculaires à travers leurs schémas de fragmentation [8].
L'évaluation de la pureté nécessite plusieurs méthodes analytiques pour séparer les composants désirés des impuretés. Ces tests doivent aborder à la fois les impuretés liées au processus et celles liées au produit [5]. Les techniques analytiques doivent répondre à des critères de validation stricts, y compris l'exactitude, la précision, la sélectivité, les limites de détection (LOD), les limites de quantification (LOQ), la linéarité et la robustesse [8]. Les protocoles de validation doivent également incorporer :
- Blancs de réactifs pour s'assurer que les réactifs sont exempts d'analytes.
- Blancs de matrice pour confirmer que l'environnement de l'échantillon n'interfère pas.
- Pics de matrice pour estimer la récupération et la précision.
Pour les méthodes quantitatives à des concentrations de 1 µg/g (ppm), les récupérations de pics acceptables se situent généralement entre 80 % et 120 % [8].
Pour maintenir la cohérence, les fabricants doivent établir des matériaux de référence primaires internes dérivés de lots représentatifs de la production. Ceux-ci servent de normes traçables pour l'étalonnage des matériaux de référence de travail [5]. Une fois les tests de pureté terminés, le milieu doit démontrer sa capacité à soutenir une croissance cellulaire efficace et à répondre aux normes de sécurité.
Tests de fonctionnalité et de sécurité
Après avoir confirmé la composition, le milieu doit prouver son efficacité à soutenir la production de viande cultivée. Cela inclut la démonstration que les cellules peuvent proliférer, maintenir leur viabilité et passer des conditions de laboratoire à des volumes de production. La FDA exige des contrôles en cours de fabrication, dès les premières étapes comme le passage et la récolte des cellules, pour garantir la cohérence et la sécurité du produit [4].
La validation de la sécurité implique des tests microbiens rigoureux et un contrôle de la contamination, comme indiqué dans les évaluations pré-commercialisation de la FDA [9].
La FDA utilise un système à quatre niveaux pour la validation des méthodes chimiques, allant du Niveau Un (utilisation d'urgence ou limitée) au Niveau Quatre (études collaboratives complètes répondant aux normes AOAC/ISO) [8].Pour les tests réglementaires de routine, visez la validation de niveau deux en laboratoire unique, qui inclut une évaluation complète des performances [8]. Les études collaboratives complètes pour les méthodes quantitatives nécessitent la participation d'au moins huit laboratoires, tandis que les méthodes qualitatives en nécessitent dix [8]. Une fois la performance du média validée, il est essentiel de s'assurer que toutes les matières premières proviennent de fournisseurs conformes.
Qualification et documentation des fournisseurs
Les fabricants doivent travailler avec des fournisseurs vérifiés et conformes aux CGMP. Les fournisseurs doivent répondre aux normes décrites dans 21 CFR 210/211 [4]. La vérification implique des audits périodiques des installations des fournisseurs pour évaluer l'adhérence aux programmes de qualité, aux procédures et à la conformité globale aux CGMP [4].
Avant de conclure des contrats, examinez l'historique de conformité d'un fournisseur, y compris les formulaires FDA 483 et les rapports d'inspection d'établissement (EIR) [4]. La FDA souligne cette obligation:
"Avant de conclure tout contrat, accord ou autre arrangement avec un autre établissement pour effectuer une étape de fabrication pour vous, vous devez vérifier que l'établissement est conforme aux CGMP réglementaires applicables." [4]
Tous les matériaux entrants doivent être mis en quarantaine et inspectés avant d'être libérés, garantissant qu'ils répondent aux spécifications maîtresses [10]. Les fournisseurs sont tenus de fournir un certificat d'analyse (CoA) ou des résultats de test traçables, conformes aux CGMP/GLP [10].Pour les lignées cellulaires stables, la documentation doit inclure un historique de clonage traçable [10]. Les cellules de mammifères ou d'insectes nécessitent généralement au moins 90 % de viabilité pour être acceptées dans les projets CGMP [10]. Les dossiers doivent être conservés conformément aux directives réglementaires [4].
Les contrats doivent clairement définir les responsabilités CGMP et exiger que les fournisseurs informent les fabricants de tout changement proposé aux kits de test ou aux méthodologies [4]. Si les tests sont externalisés, assurez-vous que les laboratoires sous contrat utilisent des méthodes analytiques validées et sont enregistrés auprès de la FDA [4].
Préparation des documents de soumission réglementaire
Une fois que votre milieu de culture a été validé, l'étape suivante consiste à compiler un dossier qui démontre la conformité à toutes les normes de sécurité et de qualité requises par la FDA et l'USDA-FSIS. Ce dossier sert de lien critique entre la validation et la conformité réglementaire, offrant aux autorités une vue claire de la sécurité et des processus de production de votre milieu.
Éléments requis d'un dossier de soumission
Votre dossier doit inclure une répartition détaillée de la composition du milieu, répertoriant tous les acides aminés, vitamines, sels inorganiques et facteurs de croissance. Les directives de la FDA soulignent que le processus d'examen évalue non seulement le milieu lui-même, mais l'ensemble du flux de production. Cela inclut l'établissement de lignées et de banques cellulaires, la mise en œuvre de contrôles de fabrication et la vérification de tous les composants et intrants [11].
De plus, le dossier doit comporter une évaluation approfondie de la sécurité et de la toxicologie, prouvant la sécurité alimentaire du matériau cultivé et de tous ses intrants. Incluez les registres de contrôle de fabrication, les données de validation des processus et la documentation du programme de qualité pour démontrer que votre production est cohérente et exempte de contaminants.
Vous devez également fournir des registres de vérification des fournitures et des réactifs, montrant la validation de tous les matériaux utilisés dans le milieu, y compris ceux préparés en interne. Pour les produits réglementés par l'USDA-FSIS, incluez les plans HACCP et les protocoles de sanitation. La FDA conseille de conserver la plupart des registres CGMP pendant au moins 10 ans, tandis que les registres de nettoyage et de sanitation des installations doivent être conservés pendant au moins 3 ans [4]. Cela s'aligne avec les efforts de qualification des fournisseurs, garantissant que tous les intrants répondent aux exigences CGMP et réglementaires.
Documentation de la conformité des installations
Avant de produire, transformer ou stocker de la viande cultivée pour la consommation humaine, les installations doivent s'enregistrer auprès de la FDA [12]. Votre documentation doit inclure un plan de sécurité alimentaire complet qui aborde l'analyse des dangers (biologiques, chimiques et physiques), les contrôles préventifs (tels que l'assainissement, la gestion des allergènes et les mesures de la chaîne d'approvisionnement), et les procédures de surveillance [12].
Les simulations de remplissage de milieu sont également une exigence clé. Celles-ci impliquent une incubation de 14 jours et des tests de promotion de la croissance pour confirmer les pratiques aseptiques.Comme l'explique la FDA:
"Le remplissage de milieu doit évaluer l'assemblage aseptique et le fonctionnement de l'équipement critique (stérile), qualifier les opérateurs et évaluer leur technique, et démontrer que les contrôles environnementaux sont adéquats" [2].
Assurez-vous que vos dossiers incluent les données de qualification des fournisseurs, telles que les tests effectués sur les trois premiers lots de milieu d'un fournisseur pour confirmer qu'ils correspondent au certificat d'analyse. D'autres dossiers essentiels incluent les journaux de contrôle environnemental, les calendriers de calibration des équipements et les données de surveillance de la température. Pour les processus réglementés par l'USDA, préparez des plans HACCP, des procédures opérationnelles standard de sanitation écrites (SSOP) et des procédures de rappel [12][13].
sbb-itb-ffee270
Utilisation de Cellbase pour l'approvisionnement en milieux de culture conformes à la réglementation
Fournisseurs vérifiés pour la viande cultivée
Une fois que vous avez validé votre formulation de milieu de culture, l'étape suivante consiste à se procurer des composants qui répondent aux normes réglementaires. Ce n'est pas aussi simple que de commander auprès de fournisseurs génériques. Pour les produits cultivés en cellules, des réglementations strictes en matière d'hygiène s'appliquent, et chaque composant du milieu de culture doit être accompagné de documents spécifiques pour l'approbation réglementaire [3]. C'est là qu'intervient
Caractéristiques d'approvisionnement
La plateforme offre également une tarification transparente et une fonctionnalité de messagerie directe, permettant aux équipes de demander rapidement des devis, des certificats d'analyse et d'autres documents réglementaires.En consolidant ces fonctions d'approvisionnement critiques en un seul système adapté à la production de viande cultivée,
Conclusion
Valider les milieux de culture pour l'approbation réglementaire n'est pas seulement une case à cocher - c'est une exigence légale pour l'introduction de produits de viande cultivée sur le marché britannique. Cela implique des tests approfondis de composition et de pureté, la mise en œuvre d'un plan HACCP solide, et la tenue d'une documentation détaillée à chaque étape.
"Les aliments ne doivent pas être mis sur le marché s'ils sont dangereux. Cela signifie qu'ils ne doivent être ni nuisibles à la santé ni impropres à la consommation humaine." - Food Standards Agency [3]
The UK Food Standards Agency's £1.Le Regulatory Sandbox de 6 millions souligne son engagement à travailler avec les acteurs de l'industrie pour établir des directives techniques claires sur la composition des milieux de culture [1]. Les entreprises qui donnent la priorité à une validation appropriée seront dans une position plus forte lorsque ces lignes directrices seront pleinement définies.
Respecter les normes de conformité ne consiste pas seulement à cocher des cases réglementaires - il s'agit de gagner la confiance des consommateurs et d'assurer la sécurité des produits. Des tests de qualité rigoureux sont au cœur de l'approbation réglementaire et de l'acceptation du marché. Pour rationaliser le processus d'autorisation, concentrez-vous sur la construction de protocoles de validation solides, le maintien de dossiers précis et le partenariat avec des fournisseurs fiables. Ces étapes simplifieront non seulement l'approbation, mais ouvriront également la voie à une plus grande confiance des consommateurs.
FAQ
Quelles sont les principales étapes pour valider les milieux de culture pour l'approbation réglementaire ?
La validation des milieux de culture pour l'approbation réglementaire consiste à prouver que la formulation est sûre, fiable et adaptée à la production de viande cultivée. Voici à quoi ressemble généralement le processus :
- Évaluation des risques : Commencez par définir la lignée cellulaire que vous utiliserez, les objectifs du produit et ses attributs de qualité critiques (comme le pH ou la composition en nutriments). Identifiez les dangers potentiels, tels que la contamination microbienne, et établissez des mesures pour contrôler ces risques.
- Tests et spécifications : Définissez des critères d'acceptation clairs pour des facteurs tels que la stérilité, la pureté et la puissance. Utilisez des méthodes de test établies pour garantir que ces normes sont constamment respectées.
- Études de validation : Mener une validation de processus approfondie, y compris la qualification des équipements et le test de plusieurs lots, pour confirmer que les résultats sont reproductibles et cohérents.
- Tests de stabilité : Vérifier comment le milieu se maintient dans le temps en évaluant sa qualité tout au long de sa durée de conservation prévue dans des conditions de stockage appropriées (généralement 2–8 °C).
- Documentation : Rassembler le tout dans un dossier de validation complet. Cela devrait inclure tous les résultats de tests et analyses pour satisfaire aux exigences réglementaires.
En abordant soigneusement chacune de ces étapes, vous recueillerez les preuves nécessaires pour démontrer que le milieu répond aux normes de sécurité et de qualité requises pour la production de viande cultivée.
Quelles sont les principales différences entre les réglementations britanniques et américaines concernant les milieux de culture utilisés dans la viande cultivée ?
Au Royaume-Uni, la réglementation des milieux de culture pour la viande cultivée relève du Règlement sur les nouveaux aliments (Règlement UE 2015/2283), qui a été conservé dans la législation britannique. Tout milieu de culture utilisé dans des produits non couramment consommés avant le 15 mai 1997 doit faire l'objet d'une évaluation formelle des nouveaux aliments par la Food Standards Agency (FSA). Ce processus nécessite la soumission de documents détaillés, y compris des informations sur la composition, l'origine et la pureté du milieu. De plus, une évaluation des risques basée sur le HACCP est nécessaire pour démontrer comment les contaminants sont contrôlés pendant le processus de culture cellulaire.
Depuis décembre 2025, la FSA a mis en place un bac à sable pour les produits cultivés en cellules. Cette initiative offre des conseils et soutient une collecte de données plus rapide pour les demandes de nouveaux aliments.Pour obtenir l'autorisation finale, les entreprises doivent soumettre un dossier complet qui aborde la sécurité des médias, la cohérence et la validation de la fabrication. Ce n'est qu'après cette approbation que le produit peut être vendu en Grande-Bretagne.
En revanche, les États-Unis n'ont pas de cadre spécifique pour les nouveaux aliments adapté aux milieux de culture, ce qui rend les comparaisons réglementaires directes difficiles. Pour les entreprises basées au Royaume-Uni, se procurer des composants de médias qui respectent déjà ces normes strictes peut simplifier le processus d'approbation.
Comment le bac à sable réglementaire du Royaume-Uni soutient-il la validation des milieux de culture ?
Le bac à sable réglementaire du Royaume-Uni pour les produits cultivés offre un cadre bien organisé où les entreprises peuvent tester et affiner leurs formulations de milieux de culture. Supervisé par la Food Standards Agency (FSA) et Food Standards Scotland (FSS), ce programme se déroule par phases de six mois. Pendant cette période, les entreprises peuvent effectuer des tests de sécurité, réaliser des évaluations des risques et examiner la documentation tout en recevant des retours précieux de la part des régulateurs.
Cette approche pratique permet des essais concrets et des améliorations progressives, accélérant la collecte de données de sécurité et aidant les entreprises à se conformer aux exigences réglementaires. Pour ceux qui travaillent sur la viande cultivée, se procurer des milieux de culture pré-approuvés via











